To evaluate phenylalanine plasma profile in preterm newborns fed different human milk diets.
MethodsTwenty‐four very‐low weight preterm newborns were distributed randomly in three groups with different feeding types: Group I: banked human milk plus 5% commercial fortifier with bovine protein, Group II: banked human milk plus evaporated fortifier derived from modified human milk, Group III: banked human milk plus lyophilized fortifier derived from modified human milk. The newborns received the group diet when full diet was attained at 15 ± 2 days. Plasma amino acid analysis was performed on the first and last day of feeding. Comparison among groups was performed by statistical tests: one way ANOVA with Tukey's post‐test using SPSS software, version 20.0 (IBM Corp, NY, USA), considering a significance level of 5%.
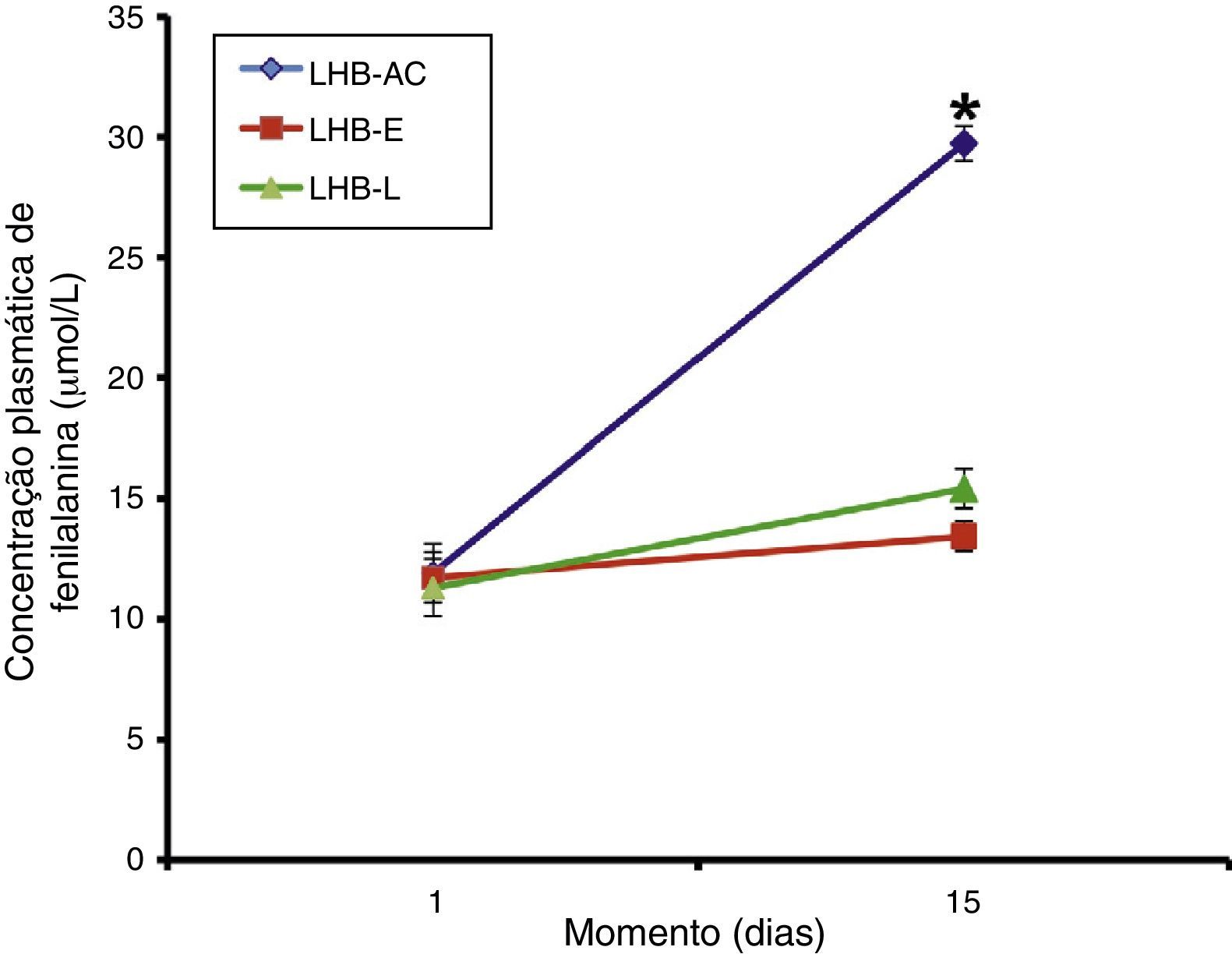
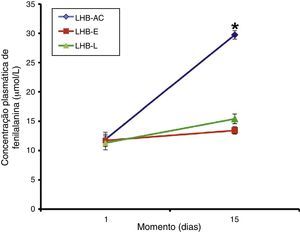
ResultsPhenylalanine levels in the first and second analysis were, respectively, in Group I: 11.9 ± 1.22 and 29.72 ± 0.73; in Group II: 11.72 ± 1.04 and 13.44 ± 0.61; and in Group III: 11.3 ± 1.18 and 15.42 ± 0.83μmol/L.
ConclusionThe observed results demonstrated that human milk with fortifiers derived from human milk acted as a good substratum for preterm infant feeding both in the evaporated or the lyophilized form, without significant increases in plasma phenylalanine levels in comparison to human milk with commercial fortifier.
Avaliar o perfil plasmático do aminoácido fenilalanina em recém‐nascidos pré‐termo alimentados com diferentes dietas de leite humano.
MétodosForam estudados 24 recém‐nascidos pré‐termo de muito baixo peso, distribuídos em três grupos com diferentes dietas: Grupo I: leite humano de banco com 5% de aditivo comercial para leite humano com proteína de origem bovina (LHB‐AC); Grupo II: leite humano de banco com aditivo de leite humano modificado evaporado (LHB‐E); e Grupo III: leite humano de banco com aditivo de leite humano modificado liofilizado (LHB‐L). Os recém‐nascidos receberam a dieta definida para o grupo quando alcançaram dieta plena por 15 ± 2 dias. A análise do aminoácido plasmático foi feita no primeiro e último dias da dieta. A comparação entre os grupos foi realizada por meio do teste ANOVA de uma via, seguido pelo pós‐teste de Tukey, utilizando‐se o software SPSS (IBM Corp, NY, EUA), versão 20.0, e considerando um nível de significância de 5%.
ResultadosAs concentrações plasmáticas do aminoácido fenilalanina na primeira e segunda análises foram, respectivamente, no Grupo I (LHB‐AC) 11,9±1,22 e 29,72±0,73; no Grupo II (LHB‐E) 11,72±1,04 e 13,44±0,61; e no Grupo III 11,3±1,18 e 15,42±0,83 umol/L.
ConclusãoOs resultados encontrados demonstram que o leite humano com aditivos do próprio leite humano comportou‐se como um bom substrato para alimentação do recém‐nascido pré‐termo, tanto na forma evaporada como liofilizada, sem levar a aumentos significativos na concentração plasmática de fenilalanina em comparação ao leite humano com aditivo comercial.
A superioridade do leite humano (LH) na alimentação de recém‐nascidos pré‐termo (RNPT) já está bem documentada. O LH tem impacto importante no crescimento cerebral e no desenvolvimento, mesmo quando não promove grande ganho de peso, reforçando o conceito de que o ótimo crescimento pós‐natal de RNPT ainda não é conhecido.1–5
Quanto ao aporte de proteínas, não só a quantidade, mas também a qualidade é importante para o crescimento adequado. A composição de aminoácidos das fórmulas e aditivos de leite humano com proteína bovina tem sua qualidade comprometida em relação à do LH, considerada padrão ouro.6–9
A fração proteica do leite de vaca tem predominância de caseína, que possui alto teor do aminoácido fenilalanina.10 Embora seja um aminoácido essencial, em crianças recebendo proteína de leite bovino, o nível plasmático desse aminoácido é elevado (próximo àqueles associados com defeitos do metabolismo).11–13
Com o aumento da ingestão e da concentração plasmática de fenilalanina ocorre a inibição da enzima tirosinase, e conversão, pela hidroxilação, da fenilalanina em tirosina, aumentando a disponibilidade de tirosina. Este aumento pode ocasionar um efeito deletério no desenvolvimento cerebral, levando a consequências como distúrbio do sono, déficit de memória, dificuldade de atenção e de concentração.14–17
Enquanto não se sabe o que é ótimo em nutrição de RNPT, os neonatologistas devem estar compromissados com o que parece ser ideal, que não cause alterações em curto prazo e que traga melhor desenvolvimento em longo prazo. Neste contexto, suplementar o LH com aditivo contendo proteína homóloga à do LH parece uma alternativa apropriada para o aporte proteico, mantendo uma concentração plasmática segura de fenilalanina.18–20
Considerando esta hipótese, pretendeu‐se analisar comparativamente a concentração plasmática de fenilalanina em RNPT alimentados com leite humano de banco (LHB) acrescido de aditivo comercial FM85® (Fortified Milk 85, Nestlé, São Paulo, Brasil), e em RNPT alimentados com LHB acrescido com um aditivo oriundo do próprio LH, com retirada de gordura e lactose nas formas evaporada ou liofilizada.
MétodosApós a aprovação do Comitê de Ética em Pesquisas (Res. 17/2006) da Universidade Federal do Mato Grosso do Sul (UFMS), foi realizado, no período de 2008 a 2010, um ensaio clínico randomizado, não cego, no setor de neonatologia do Núcleo do Hospital Universitário (NHU) da UFMS (Universidade Federal de Mato Grosso do Sul, Campo Grande, MS, Brasil).
Foram estudados 24 RNPT internados no setor de neonatologia, de ambos os sexos, divididos em três grupos. Cada grupo recebeu uma dieta diferente à base de leite humano. Os grupos foram comparados quanto à concentração plasmática de fenilalanina. Para atestar que os grupos tinham características semelhantes e que a diferença na concentração plasmática de fenilalanina estava relacionada à dieta recebida, eles foram comparados quanto às variáveis sexo, classificação peso/idade gestacional, SDR, idade gestacional, peso ao nascimento, início da alimentação, volume, calorias, início da nutrição enteral mínima e dias de ventilação mecânica.
As dietas oferecidas a cada grupo foram:
Grupo I: RNPT alimentados com leite humano de banco de leite, acrescido com 5% do aditivo FM85® (Nestlé, São Paulo, Brasil), determinado pela sigla: LHB‐AC;
Grupo II: RNPT alimentados com leite humano de banco de leite suplementado com leite humano modificado: 100ml de LH desnatado, evaporado a 20%, com extração de lactose, adicionado em 80ml de leite humano e pasteurizado, determinado pela sigla: LHB‐E;
Grupo III: RNPT alimentados com leite humano de banco de leite, suplementado com leite humano modificado: 70ml de LH desnatado, evaporado a 20%, com extração de lactose, liofilizado, reconstituído em 100ml de LHB e pasteurizado, determinado pela sigla: LHB‐L.
Os aditivos de originados de leite humano foram elaborados conforme a metodologia descrita por Thomaz et al.21
Dos 24 RNPT, dez pertenciam ao GI, cinco ao GII e nove ao GIII. Estes foram alimentados, nesta ordem, em diferentes momentos. Embora a seleção não tenha sido cega, foram selecionados todos os RNPT internados no NHU‐UFMS no período do estudo, e que se adequavam aos critérios de inclusão.
Foram incluídos os RNPT com idade gestacional inferior a 34 semanas, com peso de nascimento igual ou inferior a 1.500kg, adequados ou não para a idade gestacional, estáveis clinicamente e sem qualquer malformação congênita, cujos pais, após serem esclarecidos da natureza do estudo, assinaram o termo de consentimento informado, livre e esclarecido.
Foram excluídos RNPT com má formação congênita, distúrbios metabólicos, anemia, qualquer doença em atividade (distúrbios respiratórios, manifestações do sistema nervoso central e gastrointestinal), hemorragia periventricular, grau maior ou igual a 2 e aqueles cujas mães tinham leite suficiente para alimentar seus filhos.
Durante o estudo foram substituídos os RNPT que apresentaram condições clínicas desfavoráveis ao desenvolvimento da pesquisa. Estas condições estavam, em sua totalidade, relacionadas com piora do nível de infecção.
Os RNPT receberam a dieta específica do grupo a que iriam pertencer somente quando atingiram a dieta enteral plena (100ml/kg) e com boa tolerância; portanto, os prematuros fizeram parte dos grupos assim que iniciaram a alimentação plena por sonda gástrica.
Os RNPT foram acompanhados desde que iniciaram a alimentação dos leites modificados por 15±2 dias.
Foi feita a análise não cega do aminoácido fenilalanina plasmático. Para isso foi colhida uma amostra de sangue venoso pré‐prandial (2h30min à 3h após a última mamada) por punção percutânea com seringa contendo três gotas de heparina (efeito anticoagulante), acondicionada em tubo de microcentrífuga (Eppendorf do Brasil Ltda, São Paulo, Brasil), sendo o plasma devidamente separado por centrifugação (2.500 rotações por minuto durante 10min), identificado e congelado a ‐20°C para posterior análise de aminoácidos, por Cromatografia Líquida de Alta Eficiência. A coleta do sangue foi realizada em cada criança dos três grupos para a comparação do perfil do aminoácido no primeiro dia, antes de a criança iniciar a dieta específica do grupo e no último dia recebendo esta dieta.
A avaliação da associação entre as dietas ofertadas aos RNPT com as variáveis sexo, classificação peso/idade gestacional, SDR foi realizada por meio do teste do Qui‐quadrado. Já a associação entre as dietas ofertadas e as variáveis idade gestacional, peso ao nascimento, início da alimentação, volume, calorias, início da nutrição enteral mínima, dias de ventilação mecânica e concentração plasmática de fenilalanina foi realizada por meio do teste ANOVA de uma via, seguido pelo pós‐teste de Tukey. Os resultados das demais variáveis avaliadas neste estudo foram apresentados na forma de estatística descritiva ou na forma de tabela e gráfico. A análise estatística foi realizada utilizando‐se o software SPSS, versão 20.0 (IBM Corp, NY, USA), considerando um nível de significância de 5%.
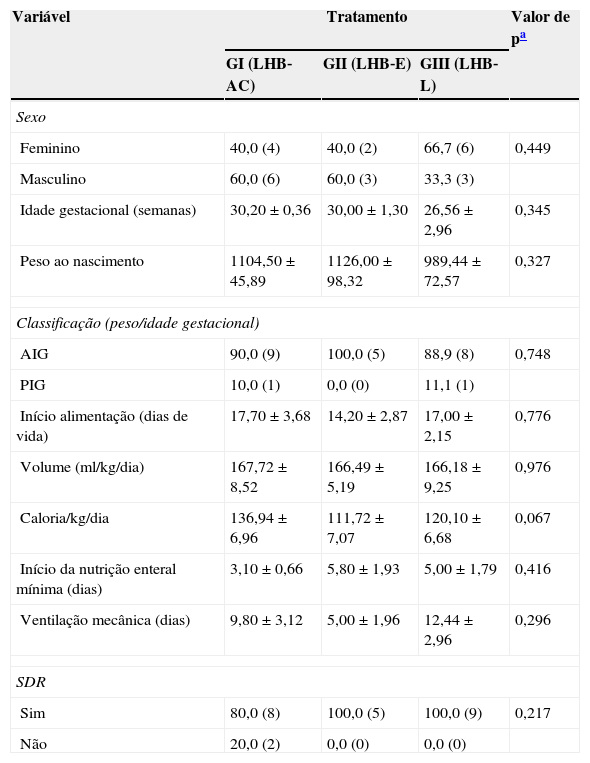
ResultadosAs características dos três grupos quanto ao sexo, idade gestacional, peso ao nascer, adequação do peso para a idade gestacional, início da alimentação enteral mínima, início da alimentação enteral plena, uso de ventilação mecânica, Síndrome do Desconforto Respiratório, volume e caloria média diária de dieta recebida estão expostas na tabela 1.
Resultados referentes às variáveis avaliadas neste estudo, de acordo com a alimentação ofertada aos recém‐nascidos pré‐termo
| Variável | Tratamento | Valor de pa | ||
|---|---|---|---|---|
| GI (LHB‐AC) | GII (LHB‐E) | GIII (LHB‐L) | ||
| Sexo | ||||
| Feminino | 40,0 (4) | 40,0 (2) | 66,7 (6) | 0,449 |
| Masculino | 60,0 (6) | 60,0 (3) | 33,3 (3) | |
| Idade gestacional (semanas) | 30,20±0,36 | 30,00±1,30 | 26,56±2,96 | 0,345 |
| Peso ao nascimento | 1104,50±45,89 | 1126,00±98,32 | 989,44±72,57 | 0,327 |
| Classificação (peso/idade gestacional) | ||||
| AIG | 90,0 (9) | 100,0 (5) | 88,9 (8) | 0,748 |
| PIG | 10,0 (1) | 0,0 (0) | 11,1 (1) | |
| Início alimentação (dias de vida) | 17,70±3,68 | 14,20±2,87 | 17,00±2,15 | 0,776 |
| Volume (ml/kg/dia) | 167,72±8,52 | 166,49±5,19 | 166,18±9,25 | 0,976 |
| Caloria/kg/dia | 136,94±6,96 | 111,72±7,07 | 120,10±6,68 | 0,067 |
| Início da nutrição enteral mínima (dias) | 3,10±0,66 | 5,80±1,93 | 5,00±1,79 | 0,416 |
| Ventilação mecânica (dias) | 9,80±3,12 | 5,00±1,96 | 12,44±2,96 | 0,296 |
| SDR | ||||
| Sim | 80,0 (8) | 100,0 (5) | 100,0 (9) | 0,217 |
| Não | 20,0 (2) | 0,0 (0) | 0,0 (0) | |
Os resultados estão apresentados em média±erro‐padrão da média ou em frequência relativa (frequência absoluta). SDR, síndrome do desconforto respiratório; AIG, Adequado para a idade gestacional; PIG, Pequeno para a idade gestacional.
Quanto a estas características, os grupos não apresentaram diferenças estatisticamente significantes (tabela 1).
Os níveis plasmáticos do aminoácido fenilalanina (média + EPM) na primeira e segunda análises foram, respectivamente, no grupo I (LHB‐AC) 11,9±1,22 e 29,72±0,73; no grupo II (LHB‐E) 11,72±1,04 e 13,44±0,61; e no grupo III 11,3±1,18 e 15,42±0,83 umol/L. Os resultados referentes à concentração do aminoácido essencial fenilalanina do grupo I, II e III estão ilustrados na figura 1.
Não houve diferença entre os tratamentos em relação à concentração plasmática de fenilalanina no primeiro dia da alimentação enteral plena (teste ANOVA de uma via, p = 0,931). Por outro lado, os tratamentos foram diferentes entre si no momento 15 dias após o início da alimentação (teste ANOVA de uma via, p < 0,001), sendo que a concentração plasmática de fenilalanina no grupo de RNPT LHB‐AC foi maior do que aquela para os grupos LHB‐E e LHB‐L (pós‐teste de Tukey, p < 0,05), porém, sem diferença significativa entre os dois últimos grupos (0 > 0,05).
DiscussãoEste estudo sugere que, para análise do perfil de aminoácidos, as amostras de sangue devem ser colhidas imediatamente antes da alimentação, pois assim é possível analisar o perfil de aminoácidos com menor interferência da dieta ofertada. Esta evidência justifica a escolha de fazer a coleta de sangue pré‐prandial para a análise de aminoácidos.22
Ao comparar a concentração do aminoácido fenilalanina entre os RNPT alimentados com as diferentes dietas, verificou‐se que aqueles alimentados com aditivo comercial tiveram índices plasmáticos maiores deste aminoácido, com diferença extremamente significativa em relação àqueles alimentados com os aditivos evaporado e liofilizado.
Considerando que os grupos eram semelhantes quanto às características expostas na tabela 1 e os índices plasmáticos de fenilalanina eram semelhantes nos três grupos no início do estudo, esta diferença na concentração de fenilalanina ao final do mesmo parece estar relacionada à qualidade da proteína do aditivo utilizado na alimentação de cada grupo e à menor capacidade de degradação deste aminoácido pelo RNPT, em relação ao recém‐nascido a termo. A diferença não deve estar relacionada à quantidade total de proteína consumida, porque o teor médio de proteína da dieta do grupo LHB‐AC (1,96±0,01g/dL) é intermediário aos das dietas dos grupos LHB‐E (1,81±0,01g/dL), LHB‐L (2,38±0,03g/dL).21
Embora o valor calórico do LHB‐AC 81,65±0,87kcal/dL seja maior que o do LHB‐E 67,78±2,01 e do LHB‐L 72,27±2,56kcal/dL, um estudo clínico ainda não publicado observou que o ganho de peso e de comprimento foi semelhante nos três grupos, com vantagem no aumento do perímetro cefálico no grupo LHB‐L em relação aos outros grupos.21 Estas características de crescimento evidenciam um bom aproveitamento das proteínas ofertadas pelos aditivos homólogos em comparação ao aditivo comercial comumente utilizado.
Estudos que avaliaram o perfil de aminoácidos sanguíneo de RNPT alimentados com LH acrescido com o aditivo comercial FM85® observaram que há necessidade de melhor adequação da proteína ofertada por este suplemento. O aditivo de origem heteróloga resultou em modificações dos macronutrientes bioquímicos podendo interferir no neurodesenvolvimento das crianças.23,24
Em análise de fenilalanina plasmática em grupos de recém‐nascidos a termo saudáveis aos seis meses de idade alimentados com leite materno, fórmula regular, dois tipos de fórmulas com caseína hidrolisada e fórmulas com proteínas do soro hidrolisadas, o grupo alimentado com leite materno apresentou a menor concentração do aminoácido,25 o que parece ocorrer, mesmo em recém‐nascidos a termo, devido ao maior teor de fenilalanina nas fórmulas à base de leite de vaca.
O mesmo resultado foi encontrado em RNPT alimentados com LH com três diferentes aditivos: proteína do LH, proteína do soro de leite de vaca e uma mistura de proteína do soro de leite de vaca, peptídeos e aminoácidos com uma composição de aminoácidos parecida com a do LH. A concentração de fenilalanina foi maior no grupo que recebeu o LH com aditivo de proteína do soro de leite de vaca. Entre os outros dois grupos não houve diferença.26
Também em RNPT agrupados de acordo com a idade gestacional e alimentados com LH ou quatro tipos de fórmulas com proteínas do leite de vaca com diferentes teores e proporção de proteínas do soro/ caseína, aqueles alimentados com leite humano tiveram a menor concentração plasmática de fenilalanina.27
Por outro lado, um estudo que ofereceu a RNPT leite humano de banco, leite humano de banco evaporado a 70% ou leite humano de banco com aditivo comercial FM85® não encontrou diferença significativa nos níveis de fenilalanina plasmática. Nesse caso, nem a quantidade, nem a qualidade da proteína oferecida interferiu nos níveis séricos desse aminoácido.23
Outro estudo que avaliou o fluxo dos aminoácidos glicina, leucina e fenilalanina em RNPT em alimentação parenteral e enteral observou que o fluxo do aminoácido glicina é mais afetado pela via de administração, o do aminoácido leucina é pouco afetado e o do aminoácido fenilalanina é mais afetado pelo aporte oferecido.28
Apesar do aumento significativo de fenilalanina plasmática, não foi observada qualquer repercussão metabólica importante nos bebês alimentados com proteína de origem bovina no decorrer deste estudo, mas em longo prazo pode ser um fator ruim no desenvolvimento cognitivo. Portanto, ainda são questionados os níveis plasmáticos ideais de fenilalanina a fim de evitar os efeitos no cognitivo em longo prazo.
As investigações realizadas demonstram que o LH com aditivos dele próprio comportou‐se como um bom substrato para alimentação do RNPT, seja na forma evaporada ou liofilizada, sem levar a aumentos significativos na concentração plasmática de fenilalanina em comparação ao leite humano com aditivo comercial.
FinanciamentoBolsa de pesquisa da Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado do Estado de Mato Grosso do Sul (FUNDECT).
Conflitos de interessesOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Thomaz DM, Serafin PO, Palhares DB, Tavares LV, Grance TR. Serum phenylalanine in preterm newborns fed different diets of human milk. J Pediatr (Rio J). 2014;90:518–22.
Estudo conduzido na Universidade Federal de Mato Grosso do Sul (UFMS), Campo Grande, MS, Brasil.