To assess the applicability of salivary C‐reactive protein, mean platelet volume, neutrophil–lymphocyte ratio, and platelet lymphocyte ratio in the diagnosis of neonatal sepsis.
MethodsProspective case‐control study of 70 full‐term neonates, 35 with sepsis (20 with proven sepsis and 15 with clinical sepsis) and 35 healthy controls. Serum and salivary CRP concentrations were measured by ELISA while MPV, NLR, and PLR were measured by automated blood cell counter.
ResultsThis study showed statistically significant difference of mean salivary CRP between septic neonates and controls (12.0±4.6ng/L vs. 2.8±1.2ng/L) respectively. At a cut‐off point of 3.48ng/L, salivary CRP showed 94.3% sensitivity and 80% specificity. Salivary CRP also showed good predictive accuracy for predicting elevated serum CRP values in septic neonates. MPV and NLR showed significant difference between septic neonates and controls (10.2±1.2fL vs. 8.0±0.5fL; 2.9±1.7 vs. 1.6±0.4, respectively). At a cut‐off point of 10.2fL, MPV presented 80% sensitivity and specificity. At a cut‐off point of 2.7, NLR presented 80% sensitivity and 57.1% specificity.
ConclusionThis study provides support for further studies on the usefulness of salivary CPR, MPV, and NLR as diagnostic markers for neonatal sepsis.
Avaliar a aplicabilidade da proteína C reativa salivar, do volume médio de plaquetas, a proporção de neutrófilos‐linfócitos e a proporção de plaquetas/linfócitos no diagnóstico de sepse neonatal.
MétodosEstudo caso‐controle prospectivo de 70 neonatos a termo, 35 com sepse (20 com sepse comprovada e 15 com sepse clínica) e 35 controles saudáveis. As concentrações de PCR no soro e salivar foram medidas por ensaio imunossorvente ligado a enzima (Elisa), ao passo que o VMP, PNL e PPL foram medidos por contador de células sanguíneas automatizado.
ResultadosEste estudo mostrou uma diferença estatisticamente significativa da média de PCR salivar entre os neonatos com sepse e os controles (12,0±4,6ng/L em comparação com 2,8±1,2ng/L), respectivamente. Um ponto de corte 3,48ng/L na PCR salivar mostrou sensibilidade de 94,3% e especificidade de 80%. A PCR salivar mostrou, ainda, boa precisão preditiva para prever altos valores de PCR no soro em neonatos com sepse. O VMP e a PNL mostraram diferença significativa entre os neonatos com sepse e os controles (10,2±1,2fL em comparação com 8,0±0,5fL), (2,9±1,7 em comparação com 1,6±0,4), respectivamente. O VMP no ponto de corte 10,2fL apresentou 80% de sensibilidade e especificidade. A PNL no ponto de corte 2,7fL apresentou 80% de sensibilidade e 57,1% de especificidade.
ConclusãoEste estudo fornece uma base para outros estudos na utilidade da PCR salivar, VMP e PNL como marcadores de diagnóstico de sepse neonatal.
A sepse é uma condição grave com risco de vida e uma das principais causas de morbidez e mortalidade em neonatos a termo e prematuros nos países em desenvolvimento. Ela é amplamente definida como uma resposta inflamatória sistêmica, que ocorre nos primeiros 28 dias de vida, como resultado de uma possível infecção ou infecção comprovada.1
Existe um apelo urgente no que diz respeito à detecção de biomarcadores confiáveis para diferenciar neonatos infectados e não infectados. A hemocultura foi considerada o padrão de base para diagnóstico, porém essa análise ainda é lenta e limitada por resultados falsos negativos.
A proteína C reativa (PCR), uma importante proteína de fase aguda, é um membro da família pentraxina e desempenha um papel central na imunidade inata e adaptativa.2 Apesar do desenvolvimento de novos biomarcadores, até o momento a PCR é um dos testes de laboratório mais estudados e mais usados para diagnóstico de sepse neonatal.3 A PCR leva de 10‐12 horas para surgir significativamente após o início da infecção.4 Como a PCR mostra um aumento em várias doenças, ela é preferencialmente usada em combinação com outros biomarcadores.3
Um problema relevante na abordagem clínica atual de neonatos doentes é a disponibilidade limitada de ferramentas simples, seguras e não invasivas com alta precisão de diagnóstico. A saliva dos neonatos supera os obstáculos associados à pesquisa neonatal e oferece ao investigador uma nova fonte de amostras não invasivas para exploração da biologia neonatal. A PCR foi detectável na saliva dos neonatos e pode prever limites anormais de PCR no soro.5
Recentemente, certos parâmetros de hemograma completo (HC) foram usados como marcadores de inflamação e infecções. O volume médio de plaquetas (VMP) tem sido usado no diagnóstico, no acompanhamento e na previsão de gravidade da sepse neonatal em neonatos a termo e prematuros.6–8 A proporção de neutrófilos‐linfócitos (PNL) é um simples biomarcador de inflamação.9 Além disso, a proporção de plaquetas/linfócitos (PPL) também é um marcador útil de inflamação sistêmica.9,10
O presente estudo visou a avaliar a aplicabilidade da PCR salivar, do VMP, da PNL e da PPL como marcadores de diagnóstico em neonatos a termo com sepse neonatal.
MétodosO presente estudo foi conduzido na unidade de terapia intensiva neonatal (UTIN) de Suez Canal University Hospital, Ismailia, Egito, entre janeiro de 2016 e junho de 2016. Durante esses seis meses, 320 neonatos foram internados na unidade. Foram inscritos 35 neonatos com sepse neonatal de início precoce ou tardio e 35 neonatos saudáveis de controle.
Critérios de inclusão: foram inscritos neste estudo os nascidos a termo de ambos os sexos, do nascimento a 28 dias, internados na UTIN de Suez Canal University com características clínicas de sepse neonatal de início precoce ou tardio. O diagnóstico de sepse clínica foi feito por histórico, achados clínicos, achados laboratoriais e hemocultura. Os achados clínicos incluem presença de três ou mais do que segue: (1) instabilidade de temperatura (hipotermia, hipertermia); (2) problemas respiratórios (grunhidos, retrações intercostais, apneia, taquipneia, cianose); (3) cardiovasculares (bradicardia, taquicardia, fraca perfusão, hipotensão); (4) neurológicos (hipotonia, letargia, convulsões) e (5) gastrointestinais (intolerância alimentar, distensão abdominal). O valor de PCR de>10mg/L foi considerado positivo.3,11
Critérios de exclusão: foram excluídos neonatos prematuros e neonatos com pneumonia confirmada ou outras condições inflamatórias, malformações do sistema nervoso central (SNC), disfunções metabólicas, anomalias cromossômicas, restrição do crescimento intrauterino, asfixia ao nascer.
Porém, os 35 neonatos saudáveis sem sintomas, sinais ou fatores de risco para infecções internados por icterícia fisiológica na unidade neonatal e todos os neonatos sem fatores de risco infecciosos internados em clínicas ambulatoriais do hospital foram inscritos de forma prospectiva como controles. O nível de PCR no soro dos neonatos nesse grupo foi negativo (PCR de menos de 10mg/L).
As amostras foram coletadas de neonatos com sepse entre 4‐12 horas após o diagnóstico clínico para a medição dos níveis de PCR no soro e antes do início do tratamento com antibióticos.
Para o HC, o sangue periférico foi coletado em um tubo EDTA a vácuo e analisado por um contador de células sanguíneas automatizado (Cell‐Dyn 3700, Abbott Laboratories, IL, EUA). A PNL e a PPL foram calculadas como proporção de neutrófilos/linfócitos e plaquetas/linfócitos, respectivamente. Os níveis deles foram obtidos das mesmas amostras de sangue. Para o cálculo preciso do VMP, as amostras foram analisadas até 60 minutos após a amostragem para evitar falso aumento do VMP.
Para determinação do nível de PCR no soro, foi usado o autoanalisador automatizado Cobas c501 (Roche Diagnostics, Manheim, Alemanha). Para a PCR salivar, as amostras foram coletadas aproximadamente uma hora antes da alimentação para evitar contaminação do leite. A saliva foi coletada ao inclinar a cabeça para frente para juntar saliva na parte do chão da boca. As amostras foram então obtidas com uma seringa de 1mL anexada em um aspirador para rede canalizada (LWS) (< 20mm Hg). Isso garante que a saliva continue na seringa e não entre no tubo ou no aspirador nasal. A saliva foi aspirada das línguas dos neonatos e de seus sulcos gengivais. A sucção foi mantida por aproximadamente 10‐15 segundos, coletaram‐se cerca de 0,5mL. A seringa foi então separada da sucção e o êmbolo foi novamente posicionado na seringa.
Após a coleta, as amostras foram colocadas em tubos de polipropileno para evitar contaminação e falhas analíticas de retenção. As amostras foram armazenadas a ‐20°C até o uso. A PCR salivar foi medida por Elisa. As hemoculturas foram feitas para o grupo com sepse.
Este estudo foi aprovado por nosso comitê de ética institucional local e foi obtido o consentimento informado dos pais de todos os neonatos durante todo o estudo.
Análises estatísticasForam feitas com o pacote estatístico SPSS para Windows, versão 20 (SPSS, Chicago, IL, EUA). Foram avaliadas as diferenças entre os grupos com relação aos dados quantitativos não paramétricos por meio do teste U de Mann‐Whitney. O teste de qui‐quadrado foi usado para testar as diferenças significativas das variáveis qualitativas. A sensibilidade, a especificidade e o ponto de corte ideal da PCR salivar foram determinados com a curva ROC. Para toda a análise estatística, o nível de relevância considerado foi<0,05.
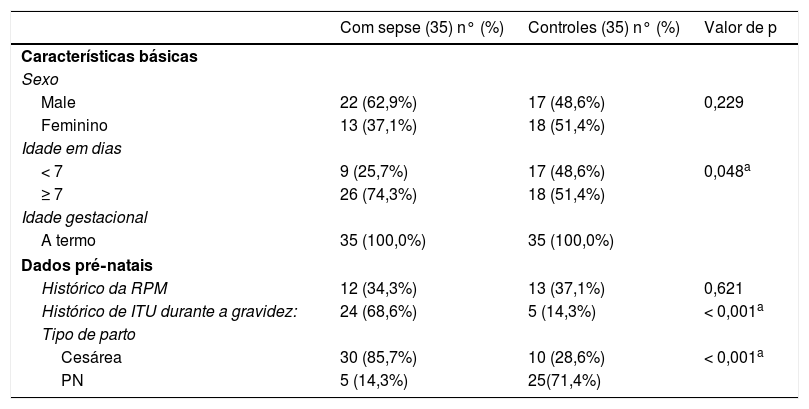
ResultadosDados demográficos e pré‐nataisHouve diferenças estatísticas entre os dois grupos com relação à idade, ao histórico de infecção do trato urinário (ITU) materna e ao tipo de parto. Sepse de início tardio (SIT) foi diagnosticada em 74,3% dos neonatos com sepse, ao passo que sepse de início precoce (SIP) foi diagnosticada em apenas 25,7% deles (tabela 1).
Dados demográficos e pré‐natais de cada grupo
| Com sepse (35) n° (%) | Controles (35) n° (%) | Valor de p | |
|---|---|---|---|
| Características básicas | |||
| Sexo | |||
| Male | 22 (62,9%) | 17 (48,6%) | 0,229 |
| Feminino | 13 (37,1%) | 18 (51,4%) | |
| Idade em dias | |||
| < 7 | 9 (25,7%) | 17 (48,6%) | 0,048a |
| ≥ 7 | 26 (74,3%) | 18 (51,4%) | |
| Idade gestacional | |||
| A termo | 35 (100,0%) | 35 (100,0%) | |
| Dados pré‐natais | |||
| Histórico da RPM | 12 (34,3%) | 13 (37,1%) | 0,621 |
| Histórico de ITU durante a gravidez: | 24 (68,6%) | 5 (14,3%) | < 0,001a |
| Tipo de parto | |||
| Cesárea | 30 (85,7%) | 10 (28,6%) | < 0,001a |
| PN | 5 (14,3%) | 25(71,4%) | |
ITU, infecção do trato urinário; PN, parto normal; RPM, ruptura prematura de membranas.
No momento da apresentação dos neonatos com sepse, 19 (54,3%) apresentaram baixa atividade e recusa de alimentação, ao passo que nove (25,7%) apresentaram febre e baixa atividade, sete (20%) apresentaram recusa de alimentação e insuficiência respiratória. Houve diferenças significativas entre os dois grupos nos níveis do HC. Dos neonatos com sepse 12 (34,3%) apresentaram anemia, ao passo que quatro (11,4%) dos controles apresentaram anemia. A contagem de glóbulos brancos mostrou diferença entre os neonatos com sepse e os controles, leucocitose em 11 (31,4%) dos neonatos com sepse em comparação com um (2,9%) dos controles. Trombocitopenia foi encontrada em nove (25,7%) do grupo com sepse e um (2,9%) dos controles.
No grupo com sepse, a hemocultura foi positiva em 25 (71,5%), estafilococos coagulase negativa foram os patógenos isolados mais frequentes, seguidos de E. coli, Klebsiella pneumonia e Serratia marcescens.
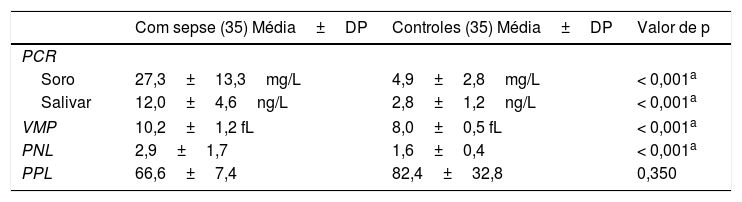
Valores de PCR no soro, PCR salivar, VMP, PNL e PPLHouve diferenças significativas entre os dois grupos na PCR no soro, PCR salivar, VMP e PNL. Os valores de PCR no soro mostraram diferença significativa entre os dois grupos (média=27,3±13,3mg/L em comparação com 4,9±2,8mg/L), respectivamente. A média de PCR no soro dos neonatos com SIP foi de 23,2±11,3, ao passo que a média em neonatos com SIT foi de 29,4±13. A PCR salivar mostrou diferença significativa entre os dois grupos (média=12,0±4,6ng/L em comparação com 2,8±1,2ng/L), respectivamente. O VMP mostrou diferença significativa entre os dois grupos (média=10,2±1,2 fL em comparação com 8,0±0,5 fL), respectivamente. A PNL mostrou diferença significativa entre os dois grupos (média=2,9±1,7 em comparação com 1,6±0,4), respectivamente. A diferença da PPL entre os dois grupos não foi significativa (tabela 2).
PCR no soro, PCR salivar, PNL, PPL e valores VMP
| Com sepse (35) Média±DP | Controles (35) Média±DP | Valor de p | |
|---|---|---|---|
| PCR | |||
| Soro | 27,3±13,3mg/L | 4,9±2,8mg/L | < 0,001a |
| Salivar | 12,0±4,6ng/L | 2,8±1,2ng/L | < 0,001a |
| VMP | 10,2±1,2 fL | 8,0±0,5 fL | < 0,001a |
| PNL | 2,9±1,7 | 1,6±0,4 | < 0,001a |
| PPL | 66,6±7,4 | 82,4±32,8 | 0,350 |
PCR, proteína C reativa; PNL, proporção de neutrófilos‐linfócitos; PPL, proporção de plaquetas/linfócitos; VMP, volume médio de plaquetas.
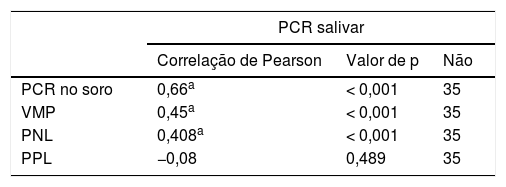
Houve correlações estatisticamente significativas entre PCR salivar e PCR no soro (0,66, p<0,001), VMP (r=0,45, p<0,001) e PNL (r=0,408, p<0,001). A correlação entre PCR salivar e PPL não foi estatisticamente significativa (tabela 3).
Correlação entre a PCR salivar e PCR no soro, VMP, PNL e PPL no grupo com sepse
| PCR salivar | |||
|---|---|---|---|
| Correlação de Pearson | Valor de p | Não | |
| PCR no soro | 0,66a | < 0,001 | 35 |
| VMP | 0,45a | < 0,001 | 35 |
| PNL | 0,408a | < 0,001 | 35 |
| PPL | −0,08 | 0,489 | 35 |
PCR, proteína C reativa; PNL, proporção de neutrófilos‐linfócitos; PPL, proporção de plaquetas/linfócitos; VMP, volume médio de plaquetas.
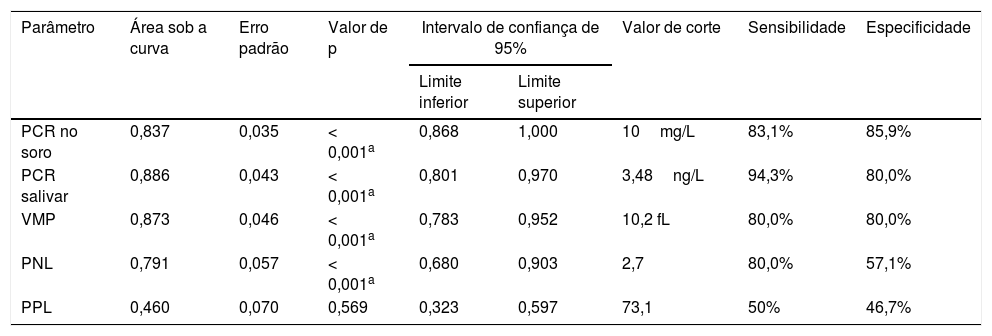
A análise das curvas ROC mostrou que a PCR no soro em um valor de corte de 10mg/L tem sensibilidade de 83,1% e especificidade de 85,9%. A PCR salivar em um valor de corte de 3,48ng/L tem sensibilidade de 94,3% e especificidade de 80%. O VMP mostrou sensibilidade de 80% e especificidade de 80% em um valor de corte de 10,2 fL. A PNL em um valor de corte de 2,7ng/L tem sensibilidade de 80% e especificidade de 57,1%. A PPL mostrou baixa sensibilidade e especificidade ao prever sepse neonatal (tabela 4).
Resultados das curvas de ROC para PCR no soro, PCR salivar, VMP, PNL e PPL
| Parâmetro | Área sob a curva | Erro padrão | Valor de p | Intervalo de confiança de 95% | Valor de corte | Sensibilidade | Especificidade | |
|---|---|---|---|---|---|---|---|---|
| Limite inferior | Limite superior | |||||||
| PCR no soro | 0,837 | 0,035 | < 0,001a | 0,868 | 1,000 | 10mg/L | 83,1% | 85,9% |
| PCR salivar | 0,886 | 0,043 | < 0,001a | 0,801 | 0,970 | 3,48ng/L | 94,3% | 80,0% |
| VMP | 0,873 | 0,046 | < 0,001a | 0,783 | 0,952 | 10,2 fL | 80,0% | 80,0% |
| PNL | 0,791 | 0,057 | < 0,001a | 0,680 | 0,903 | 2,7 | 80,0% | 57,1% |
| PPL | 0,460 | 0,070 | 0,569 | 0,323 | 0,597 | 73,1 | 50% | 46,7% |
PCR, proteína C reativa; PNL, proporção de neutrófilos‐linfócitos; PPL, proporção de plaquetas/linfócitos; ROC, característica de operação do receptor; VMP, volume médio de plaquetas.
A PCR salivar em um valor de corte de 3,4ng/L mostrou sensibilidade de 94% e especificidade de 91,3 na previsão de PCR no soro ≥ 10mg/L em neonatos com sepse.
DiscussãoA sepse neonatal é uma das principais causas de morbidade e mortalidade em unidades de terapia intensiva neonatais.12 Adicionalmente, tem morbidades de longo prazo.13,14 Por outro lado, manobras simples, como o uso de álcool em gel e treinamento sobre higienização das mãos, podem reduzir a SIT.15
Em todo o mundo, as infecções representam dois terços dos seis milhões de óbitos anuais em crianças com menos de cinco anos. O período neonatal representa o maior risco de vida de infecções graves, com uma estimativa de 400.000 óbitos de recém‐nascidos anualmente.16 No Egito, as taxas de sepse ultrapassam 50% em unidades de terapia intensiva neonatal.17
Recentemente, a análise da saliva para monitoramento clínico e detecção de biomarcadores em neonatos representa uma ótima promessa de melhoria nos cuidados de saúde dessa população frágil. A saliva representa um biofluido ideal e facilmente acessível para exames não invasivos de morbidades neonatais comuns, como prematuridade, infecções e insultos cerebrais.18–20
Até agora, a PCR é o reagente de fase aguda mais amplamente estudado e, apesar da detecção de novos marcadores de infecção, sua ampla disponibilidade e sua determinação rápida, simples e com bom custo‐benefício a tornam um dos índices preferenciais em muitas unidades de terapia intensiva neonatal.
Na literatura relatada, a PCR no soro mostrou diferente cinética e valores de corte que variam de 1,5 a 20mg/L, também com sensibilidades e especificidades de grande alcance que variam de 74 a 98% e de 71 a 94%, respectivamente, nas determinações de PCR serial ou uma única medição de pelo menos 12 horas após o início dos sintomas de sepse neonatal.3,11,21–23
Essas diferenças nos valores de corte podem ser explicadas por diferentes idades gestacionais, pesos no nascimento e cinética fisiológica da PCR após o nascimento nos neonatos estudados.3 Há um debate sobre o ponto de corte da PCR em casos de SIP e SIT, com certa concordância sobre o uso de 10mg/L como um corte confiável, principalmente na SIP.3,11 No presente estudo, a média da PCR no soro foi de 27,3±13,3mg/L em neonatos com sepse, com sensibilidade de 83,1% e especificidade de 85,9% em um valor de corte de 10mg/L.
As medições seriais do nível de PCR também podem ser úteis na identificação de neonatos com infecção bacteriana, no monitoramento da resposta ao tratamento em neonatos infectados e na determinação da duração da terapia antibiótica.21,24 Porém, o monitoramento da PCR no soro na população neonatal a coloca em riscos médicos de amostragem frequente.
A detecção da PCR salivar é um novo método de diagnóstico na população neonatal. Em 2014, Iyengar et al. publicaram o primeiro trabalho sobre detecção e utilidade da PCR salivar em neonatos, considerado o primeiro estudo para detectar, quantificar e demonstrar que a PCR salivar é um bom índice dos limites clinicamente relevantes de PCR no soro.5
Neste estudo, investigamos pela primeira vez até onde sabemos que a PCR salivar é um marcador de diagnóstico não invasivo em neonatos com sepse. A média da PCR salivar mostrou diferença estatisticamente significativa entre os neonatos com sepse e controles, com média de 12,0±4,6ng/L em neonatos com sepse, ao passo que a dos controles foi de 2,8±1,2ng/L. Um ponto de corte de 3,48ng/L na PCR salivar mostrou alta sensibilidade (94,3%) e especificidade (80,0%). Em nosso estudo, a PCR salivar mostrou boa precisão na previsão de altos níveis de PCR no soro. Foi observado que a PCR salivar no ponto de corte 3,4ng/L apresentou sensibilidade correspondente (94%) e especificidade (91,3%) na previsão de forma precisa de um nível de PCR no soro de ≥ 10mg/L.
Iyengar et al. mostraram que a concentração bruta de PCR salivar de 4,84ng/L apresentou uma sensibilidade e especificidade correspondentes de 64% e 94% na previsão de forma precisa de um nível de PCR no soro de 5mg/L e sensibilidade e especificidade correspondente de 54% e 95% na previsão de forma precisa de PCR no soro de 10mg/L.5 Essa discrepância pode retornar à natureza da doença investigada.
O HC é um dos tratamentos simples e rotineiros para determinar infecção em neonatos. A baixa contagem de leucócitos, a contagem absoluta de neutrófilos e a alta proporção de neutrófilos imaturos/total de neutrófilos foram os índices mais comumente usados na detecção de infecção em neonatos.25
Recentemente, outros índices de HC, como VMP, PNL e PPL, foram usados como marcadores de inflamação sistêmica em crianças e adultos. Em neonatos, estão disponíveis dados muito limitados sobre o uso de PNL e PPL no diagnóstico de infecção neonatal ou outras doenças inflamatórias.
Em nosso estudo, os valores VMP mostraram uma diferença significativa entre os neonatos com sepse e controles, com uma média de 9,5±1,2 fL e 8,0±0,5, respectivamente, e mostraram uma correlação significativa com PCR no soro e salivar. Oncel et al. relataram também um maior VMP em neonatos com sepse em comparação com os controles, com média de 8,82±0,8 fL e 8,44±0,5 fL, respectivamente.6
O VMP mostrou capacidade de prever neonatos doentes e demonstrou precisão diagnóstica com sensibilidade de 80% e especificidade no ponto de corte 10,2 fL. Aydın et al. relataram que o valor de corte do VMP para diagnóstico em neonatos com sepse foi de 10,4 fL, com sensibilidade e especificidade de 54% e 82%, respectivamente.26 Recentemente, Yao et al. constataram que o ponto de corte ideal do VMP para o diagnóstico de sepse foi 11,4 fL, com sensibilidade e especificidade de 40,5% e 88,4%, respectivamente.27
A PNL é simples e fácil de calcular com dados laboratoriais de rotina sem técnica ou custo adicionais, o que recentemente foi considerado um novo marcador de indicação de inflamação sistêmica.
Até onde sabemos, relatamos pela primeira vez uma diferença estatisticamente significativa na PNL entre os neonatos com sepse 2,9±1,7 e os controles, com média de 1,6±0,4, que também mostrou uma boa relevância estatística na previsão e diferenciação entre os neonatos com sepse e os controles, com sensibilidade de 80% e especificidade de 57% no ponto de corte 2,7. Com relação a infecções, a PNL foi relatada como uma variável preditora da gravidade e do resultado clínico em pacientes com pneumonia adquirida na comunidade28 e bacteremia29 e pode diferenciar entre meningite bacteriana e viral.30
A PPL é uma taxa sanguínea amplamente usada em doenças crônicas e malignidades em adultos. Em nosso estudo, a PPL não mostrou precisão significativa na previsão de neonatos com sepse com baixa sensibilidade (50%) e especificidade (46,7%) no ponto de corte 73,1.
As principais limitações de nosso estudo são número relativamente pequeno de neonatos com sepse, percentual pequeno de neonatos com SIP e uso do mesmo valor de corte para PCR no soro em neonatos com SIP e SIT.
Este estudo fornece uma comprovação inicial da utilidade da PCR salivar, do VMP e da PNL a serem combinados com outros marcadores no diagnóstico de sepse neonatal. Contudo, esses achados ainda precisam ser confirmados por outros estudos que visem a examinar grandes números de neonatos e diferentes categorias de infecções que usam métodos rigorosos para declarar o papel da PCR salivar e de outros marcadores testados no diagnóstico de sepse neonatal.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Omran A, Maaroof A, Mohammad MH, Abdelwahab A. Salivary C‐reactive protein, mean platelet volume and neutrophil lymphocyte ratio as diagnostic markers for neonatal sepsis. J Pediatr (Rio J). 2018;94:82–7.