To collect the most up‐to‐date information regarding pediatric osteoarticular infections, including the epidemiological and microbiological profiles, diagnosis, and treatment.
Source of dataA non‐systematic review was performed on the search engines PubMed, SciELO, Lilacs, and Google Scholar, using the keywords “bone and joint infection”, “children”, “pediatric”, “osteomyelitis”, “septic arthritis” and “spondylodiscitis” over the last ten years. The most relevant articles were selected by the authors to constitute the database.
Synthesis of dataOsteoarticular infections are still a major cause of morbidity in pediatrics. Their main etiology is Staphylococcus aureus, but there has been an increase in the detection of Kingella kingae, especially through molecular methods. Microbiological identification allows treatment direction, while evidence of inflammatory activity assists in treatment follow‐up. Imaging tests are especially useful in the initial diagnosis of infections. Empirical treatment should include coverage for the main microorganisms according to the age and clinical conditions of the patient, while considering the local resistance profile. Surgical procedures can be indicated for diagnosis, focus control, and function preservation. Acute complications include sepsis, deep venous thrombosis, and pulmonary embolism. Deaths are rare. Late complications are uncommon but may lead to deformities that compromise motor development.
ConclusionA correct and early diagnosis, prompt implementation of adequate antimicrobial therapy, and focus control, when indicated, are critical to a better prognosis.
Compilar as informações mais atuais referentes às infecções ostoarticulares em pediatria, inclusive perfil epidemiológico e microbiológico, diagnóstico e tratamento.
Fonte dos dadosFeita revisão não sistemática nos mecanismos de busca Pubmed, Scielo, Lilacs e Google Scholar, com as palavras‐chave bone and joint infection, children, pediatric, osteomyelitis, septic arthritis e espondylodiscitis nos últimos 10 anos. Os artigos mais relevantes foram selecionados pelos autores para compor a base de dados.
Síntese dos dadosAs infecções osteoarticulares ainda são causa importante de morbidade na pediatria. A sua principal etiologia é o Staphylococcus aureus, porém há um aumento na detecção de Kingella kingae, especialmente através de métodos moleculares. A identificação microbiológica possibilita direcionamento de tratamento, enquanto que as provas de atividade inflamatória auxiliam no acompanhamento do tratamento. Exames de imagem são especialmente úteis no diagnóstico inicial das infecções. O tratamento empírico deve incluir cobertura para os principais microrganismos, de acordo com a faixa etária e as condições clínicas do paciente, considerando o perfil de resistência local. Procedimentos cirúrgicos podem ser indicados para diagnóstico, controle do foco e preservação da função. As complicações agudas incluem sepse, trombose venosa profunda e embolia pulmonar. Óbitos são raros. As complicações tardias são incomuns, mas podem levar a deformidades que comprometem o desenvolvimento motor.
ConclusãoO diagnóstico correto e precoce, com pronta instituição de terapia antimicrobiana adequada e controle do foco, quando indicado, é fundamental para um melhor prognóstico.
As infecções osteoarticulares (IOA) em crianças e adolescentes ainda são causa de especial morbidade, podem ocasionar deformidades que comprometem o desenvolvimento motor.1 Por esse motivo, e considerando a dificuldade de fazer diagnósticos precoces e adequados, é tema de vital importância na prática clínica pediátrica.
O foco deste artigo são as IOA agudas de etiologia bacteriana e, por esse motivo, serão incluídas na revisão as seguintes infecções:
- •
Artrite séptica: processo infeccioso intra‐articular;
- •
Osteomielite: processo infeccioso ósseo;
- •
Espondilodiscite: engloba os processos infecciosos dos discos intervertebrais.
Vale ressaltar que as osteomielites podem se disseminar por contiguidade e atingir as articulações adjacentes, levar a quadros de osteomielite e artrite séptica associados.2
Um tipo específico de IOA que não será abordada neste artigo é a osteomielite vertebral, uma vez que tem características epidemiológicas e microbiológicas distintas das demais infecções. Sua etiologia mais comum é o Mycobacterium tuberculosis e seu tratamento é direcionado para esse agente.2
EpidemiologiaAs infecções osteoarticulares são mais comuns nas crianças abaixo de 5 anos e no sexo masculino.2–4 Em geral, elas acometem pacientes previamente hígidos, porém algumas condições podem predispor à sua ocorrência, como imunodepressão, prematuridade e anemia falciforme.5
Cerca de 20% dos pacientes tem algum histórico de trauma local inespecífico nas 2 semanas que antecedem o diagnóstico, como quedas, contusões e escoriações, porém, como traumas são muito comuns nessa faixa etária, é possível que os relatos dos pais e/ou responsáveis sejam subestimados.6
Estima‐se que, em países desenvolvidos, a incidência de osteomielite varie entre 2 e 13 casos a cada 100.000 habitantes. Em países em desenvolvimento, a incidência tende a ser maior, pode alcançar 200 casos a cada 100.000 habitantes.7
Artrites sépticas são menos comuns, com uma incidência que varia de 1 a 5 casos a cada 100.000 habitantes em países desenvolvidos8–10 a 20 casos a cada 100.000 habitantes em países em desenvolvimento.11
Não há dados específicos do Brasil sobre a incidência das infecções osteoarticulares.
EtiologiaA maior parte dessas infecções se dá por disseminação hematogênica durante episódios de bacteremia transitória em pacientes que podem, até então, encontrar‐se assintomáticos.2 No caso das osteomielites, a infecção se inicia, em geral, na região metafisária, que é altamente vascularizada, e pode se disseminar para outras regiões, incluindo articulações adjacentes.2
Uma menor porcentagem das infecções ainda pode ocorrer por contiguidade ou por inoculação direta, em situações pós‐trauma ou até mesmo após procedimentos cirúrgicos.5
A principal etiologia das infecções osteoarticulares é o Staphylococcus aureus, um coco Gram‐positivo que habitualmente coloniza as vias aéreas e a pele.2,5 O aumento da prevalência do Staphylococcus aureus resistente à meticilina adquirido na comunidade (CA‐MRSA) tem sido tema de importantes discussões na atualidade, leva à necessidade de reavaliar diversos protocolos de tratamento de infecções causadas por esse agente.12,13 Na América Latina, alguns países já evidenciaram uma maior taxa de incidência de IOA causada pelo CA‐MRSA, como o Uruguai, a Argentina e o Chile.14–16 Um estudo na Guiana Francesa entre 2010 e 2015, entretanto, não encontrou CA‐MRSA na população estudada.17 No Brasil, dois estudos feitos no Estado de São Paulo evidenciaram taxas de resistência à meticilina de 20 a 45% nas IOA em pediatria.18,19 Além disso, a detecção de cepas produtoras de toxinas, como a leucocidina de Panton‐Valentine, que podem levar a casos mais graves, com evolução para sepse, choque e até mesmo óbito, também são motivo de preocupação. Por esse motivo, o conhecimento do perfil de resistência local desse microrganismo é de extrema importância para a determinação do melhor esquema de antibioticoterapia empírica para as IOA.2,5
Outro microrganismo que tem sido identificado cada vez mais frequentemente, em especial na faixa abaixo dos 36 meses nos países desenvolvidos, é a Kingella kingae, um cocobacilo Gram‐negativo de difícil crescimento em meios de cultura habituais.2 Sua identificação tem se dado especialmente através de métodos de diagnóstico moleculares e estima‐se que esse microrganismo possa ser responsável por grande parte dos casos de IOA com culturas negativas.2 Um estudo feito entre 2004 e 2005 na França evidenciou que a Kingella kingae foi responsável por 45% dos casos de IOA em crianças, foi mais frequente do que o Staphylococcus aureus, responsável por apenas 29% dos casos.20 As infecções causadas pela Kingella kingae têm se mostrado mais leves, com menos alterações laboratoriais e menor comprometimento sistêmico.21,22 No Brasil, não há estudos sobre o papel desse microrganismo nas IOA em crianças. É um agente raramente identificado, uma vez que os testes moleculares não são comuns na prática clínica rotineira.
Outros agentes que podem causar infecções osteoarticulares em pediatria incluem:2,5
- •
Streptococcus do grupo A;
- •
Streptococcus pneumoniae;
- •
Streptococcus do grupo B, mais comum em neonatos;
- •
Enterobactérias, como E. coli, também mais comum em neonatos, e Salmonella spp., essa mais frequente em pacientes com anemia falciforme;
- •
Pseudomonas aeruginosa, em especial nos casos de osteomielite pós‐trauma perfurante plantar;
- •
Neisseria gonorrheae, nos casos de artrite séptica em população sexualmente ativa.
É importante lembrar que até 60% dos casos podem permanecer sem identificação microbiológica quando avaliado exclusivamente por meio de cultura.3,16,20
Quadro clínicoArtrites sépticasA apresentação mais comum das artrites sépticas inclui dor local, presente em cerca de 80% dos casos, e que pode estar acompanhada de edema, redução da mobilidade da articulação acometida e/ou febre.1,7
Em neonatos e lactentes jovens, os principais sintomas podem ser inespecíficos, como irritabilidade e inapetência, associados ou não a febre e/ou recusa em mobilizar a articulação envolvida.2
Em geral, os sintomas são agudos, com início entre 2 e 4 dias, e as articulações mais frequentemente acometidas são as do joelho e quadril, seguidas do tornozelo, cotovelo e ombro. O diagnóstico clínico das artrites de quadril é especialmente desafiador. O quadro típico inclui dor na face anterior do quadril e da coxa que por vezes se irradia para o joelho, claudicação e diminuição da mobilidade do quadril, que assume uma posição preferencial de rotação externa, flexão e abdução.2,4,23,24
OsteomielitesAs osteomielites podem ser divididas, com base no tempo de evolução, em agudas (< 2 semanas), subagudas (entre 2 semanas e 3 meses) e crônicas (> 3 meses).5
Sua apresentação inicial inclui alterações locais, como dor, edema e outros sinais flogísticos, bem como dificuldade de movimentar o membro acometido. Histórico de febre pode estar presente entre 60 e 80% dos casos.1,2
Em recém‐nascidos e lactentes jovens os sintomas podem ser inespecíficos, como nos casos de artrite séptica.
Os ossos mais frequentemente acometidos, em ordem decrescente, são o fêmur, a tíbia e o úmero.2,4 Menos frequente é o acometimento de ossos do pé, da mão, fíbula, rádio e clavícula.2,4
EspondilodisciteA apresentação da espondilodiscite costuma ser mais insidiosa e inespecífica. Seus principais sintomas incluem dor lombar, recusa em movimentar as costas, se sentar, ficar de pé ou andar.2,25 Pode haver ainda associação a dor abdominal e constipação.2,25 A febre pode estar ausente e sintomas sistêmicos são menos comuns.2,25
O tempo médio entre o início dos sintomas e o diagnóstico final é de cerca 27 dias, é maior do que 4 semanas em até 70% dos casos.25
A maior parte dos casos é de acometimento discal e vertebral concomitante, é raro o acometimento discal exclusivo.25 A região mais acometida é a lombar (75% dos casos), o espaço L4/L5 é o mais acometido.25
DiagnósticoO diagnóstico é baseado na suspeição clínica, considerando‐se o histórico e exame físico do paciente, e com auxílio de exames laboratoriais e de imagem.
Exames laboratoriaisOs principais exames laboratoriais recomendados, que podem auxiliar tanto no diagnóstico quanto no acompanhamento dos casos, são: o hemograma completo, a velocidade de hemossedimentação (VHS) e a proteína C‐reativa (PCR). Exames para identificação microbiológica também são fundamentais, como a hemocultura e cultura de demais sítios pertinentes (como líquido sinovial ou amostra de tecidos profundos).2
HemogramaNo hemograma pode ser observada leucocitose, porém essa alteração não é obrigatória, é menos comum em neonatos e lactentes jovens.1,2
Provas de atividade inflamatóriaAs provas de atividade inflamatória, VHS e PCR, são úteis tanto no diagnóstico quanto na avaliação da resposta ao tratamento.1,2 Ambos costumam estar elevados no início do quadro e a PCR tende a normalizar mais rapidamente com o tratamento adequado, indica uma boa evolução.1,2 Outro marcador que pode no futuro trazer benefícios no diagnóstico e acompanhamento dos casos é a procalcitonina, porém é um exame que ainda não está disponível rotineiramente na prática clínica e não se mostrou extensivamente superior à análise em conjunto da VHS e da PCR nesses casos.2 É importante reforçar, entretanto, que esses exames podem apresentar valores normais e, por esse motivo, não excluem o diagnóstico de IOA.1,2
CulturasRecomenda‐se a coleta de hemocultura sempre que houver suspeita de IOA, preferencialmente antes do início da antibioticoterapia empírica, porém sem atrasá‐la de forma significativa.1,2,26
Exames microbiológicos (cultura ou testes moleculares) de sítios normalmente estéreis, como tecido ósseo ou líquido sinovial, podem confirmar o diagnóstico das IOA, bem como fornecer informações importantes referentes ao perfil de resistência do microrganismo isolado.1,2,26 Recomenda‐se inoculação de ao menos uma amostra material em frasco de hemocultura, com objetivo de aumentar as chances de identificação da Kingella kingae.1,2 No caso de análise de material ósseo, recomenda‐se coleta de ao menos 3 amostras, com o objetivo de aumentar a chance de positividade.26
Para pacientes com osteomielite secundária a implantes ou pós‐osteossíntese, recomenda‐se o procedimento de sonicação do material retirado para aumentar as taxas de positividade.26
É importante reforçar que, no caso de amostras obtidas cirurgicamente, é recomendada a administração de antibioticoterapia profilática na indução anestésica, com objetivo de evitar bacteremia e sepse secundária à manipulação cirúrgica, e que não há evidência de redução das taxas de positividade por conta dessa profilaxia.26
Apesar de não serem rotina na prática clínica, os testes moleculares podem ser úteis especialmente na identificação de microrganismos que não costumam crescer com facilidade em meios de cultura habituais, como a Kingella kinga.18
Exames de imagemRadiografia simplesÉ recomendada a feitura de radiografia simples para todos os casos de suspeita de IOA, em especial para afastar outras hipóteses diagnósticas, como neoplasias ou fraturas, já que sua sensibilidade para diagnóstico definitivo dessas infecções é baixa.2
As alterações observadas nas osteomielites incluem rarefação óssea e elevação do periósteo e podem levar de 10 a 21 dias para surgir.2 Nas espondilodiscites, pode ser observada a diminuição do espaço intervertebral e erosão da vértebra adjacente, porém esse tipo de alteração pode levar de 2 a 3 semanas para aparecer.2 Já no caso das artrites sépticas, as principais alterações observadas incluem o aumento do espaço articular e edema de partes moles.2
UltrassomO ultrassom é exame de fácil execução, não invasivo, e habitualmente disponível na prática clínica pediátrica. É indicado para o diagnóstico das artrites sépticas, com alta sensibilidade para identificação de derrame articular.2 Em alguns casos, quando feito por operadores experientes, pode também visualizar abscessos ósseos e alterações periosteais, porém não é o exame mais indicado para diagnóstico de osteomielites.27
Tomografia computadorizadaA tomografia computadorizada tem menor sensibilidade do que a ressonância nuclear magnética, porém é exame mais disponível na prática clínica e de mais fácil execução na faixa etária pediátrica. Por esses motivos, muitas vezes é feito de forma preferencial. Além de auxiliar no diagnóstico das infecções, pode ser útil no planejamento de procedimentos cirúrgicos e ao guiar procedimentos de aspiração ou drenagem.2
Ressonância nuclear magnéticaA ressonância nuclear magnética é o exame mais indicado para o diagnóstico de IOA, principalmente no caso de osteomielites e espondilodiscites, por sua alta sensibilidade, é capaz de detectar alterações precocemente em casos de apenas 3 a 5 dias de evolução.2,26 Entretanto, é exame de difícil execução, que frequentemente demanda sedação na prática clínica pediátrica, além de ser pouco disponível, o que dificulta sua feitura de forma rotineira.
CintilografiaA cintilografia tem sua maior utilidade nas suspeitas de acometimento multifocal ou nos casos em que não é possível determinar o local exato da infecção por anamnese ou exame clínico.2 Tem alta sensibilidade, porém baixa especificidade, e ambas são menores no caso de recém‐nascidos e lactentes jovens.2 O grande problema desse tipo de exame são as altas doses de radiação empregadas na sua feitura.2
TratamentoA base do tratamento das IOA inclui terapia antimicrobiana e o controle do foco infeccioso.2 No geral, recomenda‐se a internação hospitalar para início de antibioticoterapia parenteral e acompanhamento rigoroso da evolução do caso.
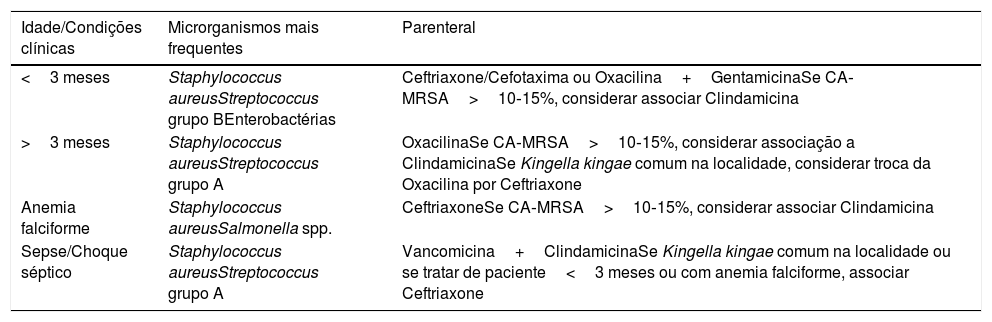
Terapia antimicrobianaA terapia antimicrobiana empírica deve ter cobertura para a principal etiologia de acordo com o tipo de lesão, condições clínicas e faixa etária do paciente27,28 (tabela 1).
Sugestões de esquema de tratamento empírico com base na faixa etária e condições clínicas dos pacientes
| Idade/Condições clínicas | Microrganismos mais frequentes | Parenteral |
|---|---|---|
| <3 meses | Staphylococcus aureusStreptococcus grupo BEnterobactérias | Ceftriaxone/Cefotaxima ou Oxacilina+GentamicinaSe CA‐MRSA>10‐15%, considerar associar Clindamicina |
| >3 meses | Staphylococcus aureusStreptococcus grupo A | OxacilinaSe CA‐MRSA>10‐15%, considerar associação a ClindamicinaSe Kingella kingae comum na localidade, considerar troca da Oxacilina por Ceftriaxone |
| Anemia falciforme | Staphylococcus aureusSalmonella spp. | CeftriaxoneSe CA‐MRSA>10‐15%, considerar associar Clindamicina |
| Sepse/Choque séptico | Staphylococcus aureusStreptococcus grupo A | Vancomicina+ClindamicinaSe Kingella kingae comum na localidade ou se tratar de paciente<3 meses ou com anemia falciforme, associar Ceftriaxone |
CA‐MRSA, Staphylococcus aureus resistente à meticilina adquirido na comunidade.
Obrigatoriamente deve incluir cobertura para Staphylococcus aureus e, nas localidades em que houver prevalência maior do que 10‐15% de CA‐MRSA, esse perfil de resistência também deve ser levado em consideração no momento da escolha do esquema preferencial.2
O esquema deve sempre ser direcionado, uma vez que haja identificação do microrganismo em cultura ou por métodos moleculares, com base nos resultados de perfil de resistência e sensibilidade. No caso de IOA com culturas negativas, a transição para esquema de antibioticoterapia oral deve seguir o perfil de cobertura do esquema parenteral inicial.
O tratamento deve ser administrado via parenteral até melhoria clínica e laboratorial do paciente.2 Anteriormente, preconizava‐se ao menos duas semanas de terapia endovenosa, porém estudos recentes mostram que ciclos mais curtos com transição para esquema de antimicrobiano oral precoce são igualmente efetivos.28–31 A transição pode ser feita precocemente, uma vez se trate de casos sem complicação, o paciente esteja afebril há ao menos 24 a 48 horas e com PCR em queda (30 a 50% do seu valor mais elevado).2
A duração do esquema antimicrobiano varia de 2 a 3 semanas nos casos de artrite séptica, 2 a 4 semanas nos casos de espondilodiscite (esse tempo é bastante variável devido à heterogeneidade dos casos) e de 4 a 6 semanas nos casos de osteomielite.2,32 Casos com complicação podem necessitar de tratamentos prolongados.2
Procedimentos cirúrgicosAs principais indicações para o procedimento cirúrgico incluem: diagnóstico microbiológico (através da aspiração de líquido sinovial ou biópsia óssea), controle do foco infeccioso e preservação máxima da função do membro acometido.4
Artrite sépticaRecomenda‐se a drenagem e irrigação da articulação o quanto antes, sempre que houver suspeita de processo infeccioso, pode ser feita por artrotomia, artroscopia ou artrocentese, a depender da experiência da equipe assistencial e das condições clínicas do paciente.2,4 Esse procedimento está indicado tanto para diagnóstico microbiológico quando para controle do foco infeccioso, é sempre indicada a coleta de material para cultura.2,4,5
Apesar de a artroscopia estar associada a menor tempo de internação, a artrotomia ainda é recomendada no caso de envolvimento das articulações do quadril e do ombro, em lactentes jovens<6 meses, no caso de infecção por microrganismos mais virulentos, como o Staphylococcus aureus produtor da leucocidina de Panton‐Valentine, e naqueles pacientes cujo tratamento foi iniciado tardiamente (após 5‐7 dias de evolução).2
OsteomieliteEstudos mostram que até 90% dos pacientes respondem bem com tratamento conservador, sem a necessidade de cirurgia, em especial se o diagnóstico for precoce.2 Por esse motivo não está indicada a feitura de procedimentos cirúrgicos de forma rotineira nesses casos.2,5 Esses procedimentos estão reservados para os casos em que não haja resposta adequada à terapia antimicrobiana dentro de 72‐96 horas, com persistência da febre e da elevação das provas de atividade inflamatória, e para aspiração ou drenagem de coleções purulentas e debridamento de áreas necróticas.2,4
Sempre que for feito procedimento cirúrgico, deve ser coletado material para cultura, independentemente do tempo de antibioticoterapia.
ComplicaçõesOs pacientes com infecções osteoarticulares podem apresentar complicações iniciais, secundárias à bacteremia, e complicações tardias, relacionadas às alterações ósseas decorrentes da infecção. As complicações estão associadas aos casos de infecção por microrganismos mais virulentos, como CA‐MRSA, S. aureus produtor de leucocidina de Panton‐Valentine ou Salmonella spp.2
Entre as complicações iniciais, destacam‐se a bacteremia persistente, em geral secundária a algum foco não controlado de infecção, como abscessos não drenados; a sepse ou choque séptico; a trombose venosa profunda (TVP), associada em especial às infecções causadas pelo CA‐MRSA e, consequentemente, a embolia pulmonar.33 Estudos evidenciaram entre 6 e 40% de ocorrência de TVP em pacientes com quadro de infecção osteoarticular por CA‐MRSA. Por esse motivo, alguns autores recomendam a feitura de ultrassonografia para pesquisa de TVP nesses pacientes e, à menor evidência de desconforto respiratório, avaliação urgente para possível quadro de embolia pulmonar.33 Não há indicação, entretanto, de profilaxia para TVP de forma rotineira.2 Nos casos em que houver essa complicação, recomenda‐se tratamento antimicrobiano prolongado, são sugeridas ao menos 6 semanas de terapia endovenosa, seguida de terapia oral até a resolução da trombose.2 O tratamento inicial da TVP deve ser feito com heparina de baixo peso molecular.2 Óbitos secundários a infecções osteoarticulares são muito raros na atualidade.2
Já as complicações tardias podem incluir comprometimento da placa de crescimento do osso acometido, com posterior diferença no tamanho dos membros; necrose avascular da cabeça do fêmur; fraturas patológicas; perda de função; infecções recorrentes e osteomielite crônica.5 Essas complicações, entretanto, são raras.3,4
ConclusãoAs IOA são causa importante de morbidade na faixa etária pediátrica, é importante considerar seu diagnóstico quando apropriado. Sua etiologia principal é o Staphylococcus aureus, porém podem também ser causadas por outros microrganismos, que variam com a faixa etária, localidade e condições clínicas do paciente. O diagnóstico e início de tratamento antimicrobiano precoces são fundamentais para a boa evolução dos pacientes, bem como o controle do foco infeccioso.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Alvares PA, Mimica MJ. Osteoarticular infections in pediatrics. J Pediatr (Rio J). 2020;96(S1):58–64.