To describe the characteristics of opportunistic infections in pediatrics regarding their clinical aspects, as well as the diagnostic strategy and treatment.
Source of dataNon‐systematic review of literature studies in the PubMed database.
Synthesis of dataOpportunistic infections caused by non‐tuberculous mycobacteria, fungi, Herpesvirae, and infections affecting individuals using immunobiological agents are analyzed. Because these are severe diseases with a rapid evolution, diagnostic suspicion should be early, associated with the patient's clinical assessment and history pointing to opportunistic infections. Whenever possible, samples of secretions, blood, and other fluids and tissues should be collected, with early therapy implementation.
ConclusionsDespite the improved diagnosis of opportunistic infections in recent years, they remain a challenge for pediatricians who are not used to these infections. They should raise the suspicion and start treating the case, but should also resort to specialists in the management of these infections to provide a better outcome for these patients, who still have high mortality.
Descrever as características das infecções oportunistas em pediatria em seus aspectos clínicos, bem como a estratégia diagnóstica e o tratamento.
Fonte dos dadosRevisão de trabalhos de literatura de forma não sistemática na base de dados Pubmed.
Síntese dos dadosSão apresentadas as infecções oportunistas causadas por micobactérias não tuberculosas, fungos, herpervírus e as infecções que acometem indivíduos em uso de imunobiológicos. Por se tratar de doenças graves e de evolução rápida, a suspeita diagnóstica deve ser precoce, associada à clínica do paciente e aos dados de história que apontam para infecções oportunistas. Sempre que possível, amostras de secreções, sangue e outros fluidos e de tecidos devem ser coletadas, com instituição precoce de terapia.
ConclusõesApesar da melhoria do diagnóstico de infecções oportunistas nos últimos anos, elas ainda são um desafio para o pediatra pouco habituado a essas infecções. Ele deve fazer a suspeita e iniciar a condução do caso, mas recorrer a especialistas com prática no manejo dessas infecções de modo a propiciar um melhor desfecho para esses pacientes que ainda apresentam alta mortalidade.
Infecções oportunistas são aquelas causadas por patógenos (bactérias, vírus, fungos ou protozoários) que se beneficiam de um hospedeiro com um sistema imune enfraquecido, com uma microbiota alterada ou com quebra de barreiras tegumentares.
Chama‐se eubiose à condição que se caracteriza por um equilíbrio entre as diversas espécies que compõem a microbiota. Perturbações na eubiose, conhecidas sob a denominação ampla de disbiose, podem desencadear doenças infecciosas e não infecciosas. As infecções oportunistas ocorrem em situações de disbiose, predispõem o indivíduo a infecções exógenas e endógenas. Elas ocorrem no contexto de autoimunidade ou apresentam reações de variada intensidade, tanto elevada (em reações alérgicas e em condições de inflamação crônica) quanto diminuída (nos casos de imunodeficiência e câncer).1
O modo de apresentação das infecções varia de acordo com a comorbidade do paciente, que por sua vez está associada aos aspectos do sistema imune que não estão em pleno funcionamento.
Comorbidades ou situações que predispõem a infecções oportunistas são cada vez mais presentes no dia a dia do pediatra. Infecção pelo vírus da imunodeficiência humana (HIV), erros inatos da imunidade (anteriormente chamados de imunodeficiências primárias), neoplasias, condições de autoimunidade e uso de quimioterapia, radioterapia ou de drogas imunomoduladoras do sistema imune são alguns exemplos dessas comorbidades.
Nesta revisão, apresentaremos as infecções oportunistas agrupadas segundo as diferentes classes de patógenos. Serão discutidos aspectos diagnósticos e terapêuticos de micobacterioses, infecções fúngicas, infecções por herpervírus e infecções que acometem indivíduos em uso de imunobiológicos.
Micobacterioses não tuberculosasAs micobactérias não tuberculosas estão amplamente difundidas no meio ambiente, podem causar doenças denominadas micobacterioses. As infecções disseminadas, em sua imensa maioria, estão associadas a alteração da imunidade celular, tais como pacientes com erros inatos da imunidade que afetam o eixo interferon‐gama(IFN)/interleucina(IL)‐12/IL‐23 [deficiência de IL‐12, deficiência de IFN‐gama, mutações do modulador de NF‐kappa‐B (NEMO) e defeitos dos receptores de IFN‐gama e de IL‐12], receptores de transplante de células‐tronco hematopoiéticas ou indivíduos em estágio avançado de infecção pelo HIV.2
Elas apresentam‐se como infecções respiratórias, em geral nos pacientes com patologias pulmonares prévias (fibrose cística, doença pulmonar obstrutiva crônica, bronquiectasias), infecções de pele e de partes moles, inclusive as linfadenites, infecções de feridas cirúrgicas associadas ou não a implantes de dispositivos. Podem também manifestar‐se como infecção disseminada em pacientes imunocomprometidos. São classificadas em dois grupos segundo suas características fenotípicas: micobactérias de crescimento lento e de crescimento rápido (tabela 1).
Distribuição das espécies do gênero Mycobacterium spp
| Complexo Mycobacterium tuberculosis | M. tuberculosis, M. bovis, M. africanum, M. microti, M. canetti, M. caprae, M. pinnipedii, M. suricattae, M. mungi |
| Micobactérias causadoras de hanseníase | M. leprae, M. lepromatosis |
| Micobactérias não tuberculosas de crescimento lento | Complexo M. avium ‐ M. intracellulare e M. aviumM. kansasii, M. xenopi, M. malmoense, M. szulgai, M. ulcerans |
| Micobactérias não tuberculosas de crescimento rápido | M. abscessus, M. chelonae, M. fortuitum, M. marinum, entre outras |
Fonte: Esteban e Navas, 2018 (modificado).3
Dentre as micobactérias de crescimento lento, o complexo Mycobacterium avium é a causa mais frequente de infecção pulmonar e também a principal causa de linfadenite em crianças menores de cinco anos. Acomete pacientes com HIV com linfócitos T CD4 abaixo de 50/mm3 ou aqueles com erros inatos da imunidade, causa quadros extrapulmonares e disseminados.3O M. kansasii, outra micobactéria não tuberculosa, produz infecção pulmonar com padrão fibrocavitário semelhante à tuberculose e, com menor frequência, infecções focais ou disseminadas em pacientes com HIV ou portadores de outras condições de imunodepressão.
As micobactérias de crescimento rápido também causam infecções respiratórias de caráter crônico em pessoas com lesões pulmonares pré‐existentes, infecções de pele e de partes moles, muitas delas associadas a procedimento estético, e infecções associadas a cateteres, próteses. Podem formar biofilmes, o que dificulta o tratamento, é necessário remover esses dispositivos para a cura do paciente. Desse grupo, o M. abscessus tem especial relevância, causa infecções respiratórias e apresenta grande dificuldade de manejo terapêutico.3
O diagnóstico definitivo de micobacterioses requer o isolamento do agente. À suspeita clínica de infecção por micobactérias não tuberculosas, o laboratório deve ser contactado de modo a garantir que as condições adequadas de manipulação e cultivo dos espécimes sejam usadas, permite o isolamento do patógeno. De maneira geral, em adultos, dois ou mais espécimes de escarro ou uma amostra de lavado broncoalveolar devem mostrar isolamento de micobactérias não tuberculosas para que o diagnóstico seja feito. Em crianças, esses critérios ainda não estão estabelecidos. Além disso, isolamento de micobactérias não tuberculosas de sítios estéreis são evidência de infecção. Vale lembrar que a prova tuberculínica em casos de micobacterioses costuma ser positiva pelo fato de diversos antígenos serem comuns a M. tuberculosis e as outras micobactérias. No caso de ensaios de liberação de interferon‐gama, pode ocorrer reação cruzada em infecções por M. kansasi, M. marinum e M. szulgai.
O diagnóstico e tratamento das micobacterioses estão descritos na tabela 2.
Diagnóstico e tratamento das principais infecções causadas por micobactérias não tuberculosas
| Patologia | Agente | Diagnóstico | Tratamentoa | Duração |
|---|---|---|---|---|
| Infecção pulmonar, nodular ou bronquiectasia | Complexo M. avium | Cultura de secreção respiratória | Claritromicina ou Azitromicina+Etambutol+Rifampicina ou RifabutinaNa forma fibrocavitária ou disseminada: associar Estreptomicina ou Amicacina | 18 a 24 meses, mantendo por mais 12 meses após cultura negativa |
| Infecção pulmonar | M. kansasii | Cultura de secreção respiratória | Rifampicina+Etambutol+Claritromicina+Levofloxacina ou MoxifloxacinoConsiderar Estreptomicina em enfermidade grave | Mínimo de 12 meses após cultura negativa |
| Infecção pulmonar | M. abscessus | Cultura de secreção respiratória | Imipenen ou CefoxetinaAmicacina, ClaritromicinaTigeciclina ou Doxiciclina (em maiores de 8 anos) | Escolher drogas segundo antibiogramaInfecção pulmonar: manter por mais 12 meses após cultura negativa |
Usar no mínimo 3 drogas e associar outras de acordo com a evolução clínica.
Fonte: Esteban e Navas, 2018 (modificado).3
As micoses oportunistas são infecções por fungos de baixa patogenicidade que infectam especificamente hospedeiros imunocomprometidos.4 São causadas por fungos onipresentes no ambiente, como fungos filamentosos (Aspergillus spp., Fusarium spp., Mucorales etc.), ou leveduras integrantes da microbiota fúngica endógena ou exógena, como a Candida spp.
As infecções por Candida spp. apresentam‐se como infecções da corrente sanguínea, do trato urinário, de parede cirúrgica, miocardite, meningite, infecções ósseas, pele e abscessos, esses últimos relacionados à inserção de cateter. O quadro clínico mais frequente é o aparecimento de febre não responsiva aos antibióticos em pacientes de risco.
Acredita‐se que a maioria dos casos de candidemia seja adquirida por via endógena, pela translocação do patógeno através do trato gastrintestinal, em que até 70% da população sadia imunocompetente apresenta colonização por Candida spp.
Fatores que aumentam a colonização intestinal por Candida (uso de antibióticos, corticosteroides, íleo paralítico, oclusão intestinal) ou determinam atrofia ou lesão de mucosa intestinal (jejum prolongado, nutrição parenteral total, hipotensão, procedimento cirúrgico, mucosite secundária a quimioterapia ou radioterapia) podem potencializar o fenômeno de translocação a partir do trato gastrintestinal. Menos frequentes são as infecções exógenas por procedimentos médicos, contaminação de soluções ou próteses ou de colonização de cateter venoso central.
Dentre as espécies de Candida spp, a C. albicans é a mais frequentemente encontrada na prática clínica. Entretanto, várias espécies não albicans como C. tropicalis, C. parapsilosis, C. glabrata, C. krusei estão envolvidas no aumento de incidência das infecções invasivas com altas taxas de falhas terapêuticas relacionadas à resistência aos azólicos e equinocandinas.5,6
A C. glabrata ocupa o segundo lugar em infecções profundas de partes moles nos Estados Unidos e na Europa, a frequência de multirresistência é acima de 10%. Sua incidência tem aumentado também em hospitais brasileiros.5
Em estudo retrospectivo de pacientes pediátricos oncológicos com candidemia, observou‐se que pacientes em que se isolava Candida tropicalis apresentavam mais frequentemente lesões de pele quando comparados aqueles com candidemia por outras espécies.7
Até há alguns anos, não se encontravam relatos de Candida multirresistente, porém o cenário atual é de infecções invasivas por Candida não albican multirresistente, a maioria delas por C. glabrata e C. auris.5
A Candida auris é uma espécie emergente. Descoberta em 2009, já foi descrita em mais de 30 países nos seis continentes.8 Tem uma alta taxa de resistência aos antifúngicos, com taxa de mortalidade estimada em 30% a 72%.9 O seu isolamento é difícil quando se empregam os métodos bioquímicos usuais, pode ser confundida com a C. haemulonii. O uso do Matrix assisted laser desorption/ionization time of flygth (MALDI‐TOF), espectrometria de massa, permite diferenciar a C. auris de outras espécies. Assim como em outras espécies de Candida spp, a presença da C. auris em sítios não estéreis pode representar apenas colonização, porém sua detecção é muito importante, pois além da colonização de difícil erradicação, há risco de transmissão horizontal. O reconhecimento precoce dos casos esporádicos, identificação de reservatórios e notificação são medidas importantes para prevenção de surtos.
O diagnóstico definitivo de candidíase invasiva requer isolamento do agente de um sítio habitualmente estéril ou a demonstração do microrganismo em uma amostra de tecido. Entretanto, resultados negativos não excluem o diagnóstico de infecção invasiva no hospedeiro imunocomprometido. A sensibilidade de uma hemocultura pode ser menor do que 50%.
O diagnóstico e tratamento da candidíase sistêmica estão descritos na tabela 3.
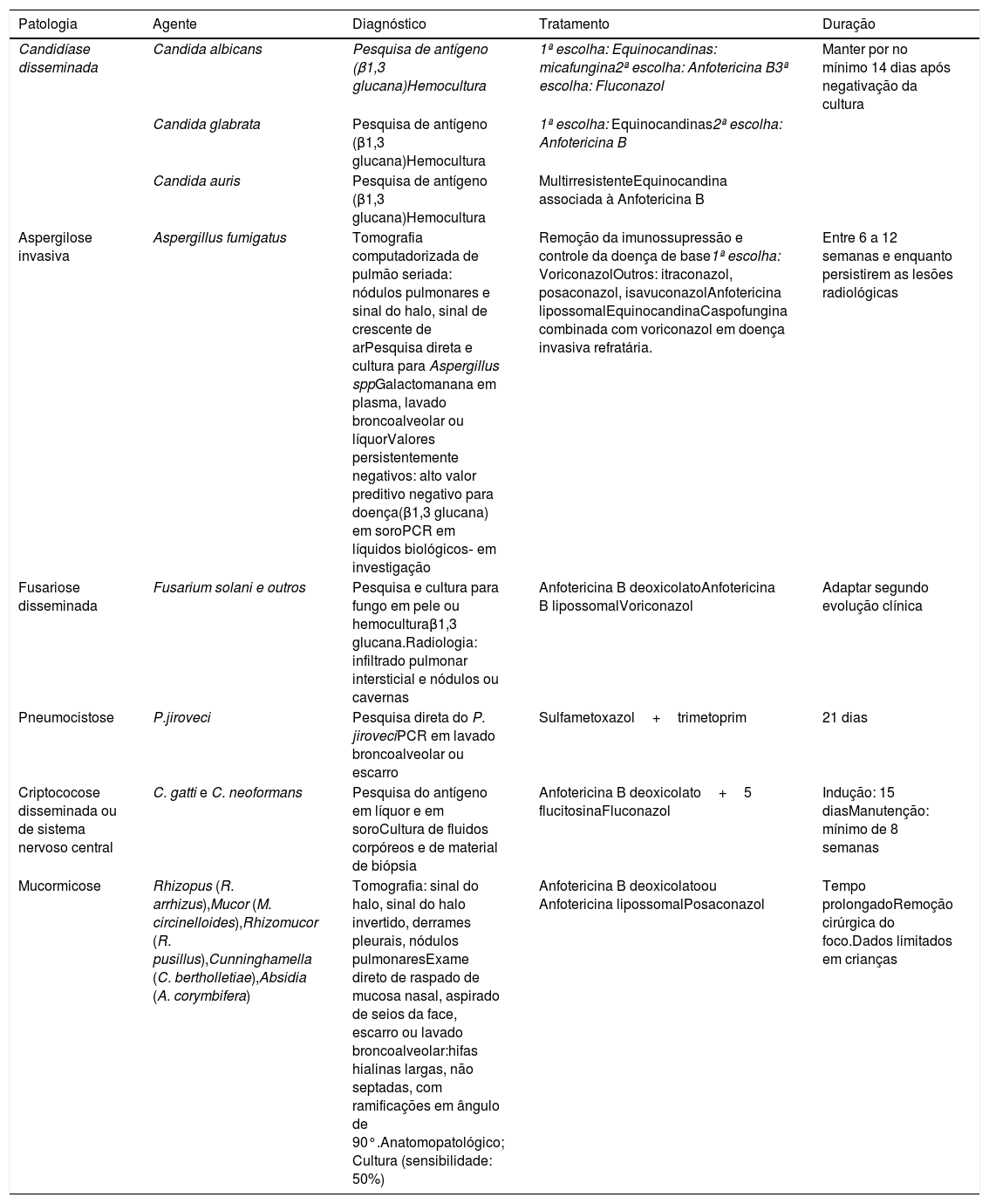
Diagnóstico e tratamento das principais infecções fúngicas oportunistas
| Patologia | Agente | Diagnóstico | Tratamento | Duração |
|---|---|---|---|---|
| Candidíase disseminada | Candida albicans | Pesquisa de antígeno (β1,3 glucana)Hemocultura | 1ª escolha: Equinocandinas: micafungina2ª escolha: Anfotericina B3ª escolha: Fluconazol | Manter por no mínimo 14 dias após negativação da cultura |
| Candida glabrata | Pesquisa de antígeno (β1,3 glucana)Hemocultura | 1ª escolha: Equinocandinas2ª escolha: Anfotericina B | ||
| Candida auris | Pesquisa de antígeno (β1,3 glucana)Hemocultura | MultirresistenteEquinocandina associada à Anfotericina B | ||
| Aspergilose invasiva | Aspergillus fumigatus | Tomografia computadorizada de pulmão seriada: nódulos pulmonares e sinal do halo, sinal de crescente de arPesquisa direta e cultura para Aspergillus sppGalactomanana em plasma, lavado broncoalveolar ou líquorValores persistentemente negativos: alto valor preditivo negativo para doença(β1,3 glucana) em soroPCR em líquidos biológicos‐ em investigação | Remoção da imunossupressão e controle da doença de base1ª escolha: VoriconazolOutros: itraconazol, posaconazol, isavuconazolAnfotericina lipossomalEquinocandinaCaspofungina combinada com voriconazol em doença invasiva refratária. | Entre 6 a 12 semanas e enquanto persistirem as lesões radiológicas |
| Fusariose disseminada | Fusarium solani e outros | Pesquisa e cultura para fungo em pele ou hemoculturaβ1,3 glucana.Radiologia: infiltrado pulmonar intersticial e nódulos ou cavernas | Anfotericina B deoxicolatoAnfotericina B lipossomalVoriconazol | Adaptar segundo evolução clínica |
| Pneumocistose | P.jiroveci | Pesquisa direta do P. jiroveciPCR em lavado broncoalveolar ou escarro | Sulfametoxazol+trimetoprim | 21 dias |
| Criptococose disseminada ou de sistema nervoso central | C. gatti e C. neoformans | Pesquisa do antígeno em líquor e em soroCultura de fluidos corpóreos e de material de biópsia | Anfotericina B deoxicolato+5 flucitosinaFluconazol | Indução: 15 diasManutenção: mínimo de 8 semanas |
| Mucormicose | Rhizopus (R. arrhizus),Mucor (M. circinelloides),Rhizomucor (R. pusillus),Cunninghamella (C. bertholletiae),Absidia (A. corymbifera) | Tomografia: sinal do halo, sinal do halo invertido, derrames pleurais, nódulos pulmonaresExame direto de raspado de mucosa nasal, aspirado de seios da face, escarro ou lavado broncoalveolar:hifas hialinas largas, não septadas, com ramificações em ângulo de 90°.Anatomopatológico; Cultura (sensibilidade: 50%) | Anfotericina B deoxicolatoou Anfotericina lipossomalPosaconazol | Tempo prolongadoRemoção cirúrgica do foco.Dados limitados em crianças |
As infecções por Aspergillus spp. incluem as doenças respiratórias por hipersensibilidade (sinusite alérgica e aspergilose broncopulmonar alérgica), infecções cutâneas e de epitélio, colonização intracavitária (bola fúngica pulmonar) e formas invasivas (aspergilose pulmonar invasiva e crônica necrosante, sinusite e formas disseminadas com invasão do sistema nervoso e formação de abscesso cerebral).
A aspergilose invasiva ocorre em pacientes imunocomprometidos com neutropenia grave e persistente devido a tratamento com corticosteroides ou quimioterapia, transplante de células‐tronco ou transplante de órgãos sólidos, principalmente pulmonares. Apresenta uma alta taxa de mortalidade, Aspergillus fumigatus, A. flavus, A. níger, A. terreus e A. versicolor são as espécies mais envolvidas. A. fumigatus é o principal agente da aspergilose pulmonar invasiva, seguido pelo A. flavus e A. terréus.10,11 Recentemente, foi demonstrado que A. fumigatus pode produzir aerossóis e tem o potencial de ser transmitido para outras pessoas.12
Na aspergilose invasiva, a manifestação mais precoce é a febre em paciente com neutropenia prolongada, com sintomas respiratórios como tosse e dispneia, e ausculta pulmonar pobre. Pacientes com forte imunossupressão podem evoluir para formas disseminadas com envolvimento do sistema nervoso central, que leva a abscesso cerebral e, raramente, a meningite.
O diagnóstico é feito através da suspeita clínica, exames de imagem, pesquisa de antígenos (galactomanana e B‐D glucana) e isolamento do fungo através de microscopia e cultura.
A tomografia de tórax é mais sensível do que a radiografia de tórax, principalmente no início da doença, e pode ter duas características radiológicas: sinal do halo e sinal de crescente aéreo, esse último raro em neutropênicos.13
A galactomanana é um polissacarideo da parede celular liberado pelo fungo durante seu crescimento nos tecidos, detectado no soro e em outros fluidos. Pode estar presente de 5 a 8 dias antes da manifestação clínica e deve ser solicitada como teste de triagem para pacientes com neutropenia prolongada e receptores de transplante alogênico de células‐tronco hematopoiéticas que não estejam com profilaxia com antifúngicos. A dosagem é feita por método imunoenzimático e apresenta sensibilidade e especificidade de 90% em pacientes neutropênicos. A maior precisão do teste é quando duas amostras consecutivas têm valor ≥ 0,5 e o melhor desempenho é quando é feito 2 a 3 vezes por semana para monitorar pacientes de risco, correlacionado com o exame de imagem e o quadro clínico.
A pesquisa da galactomanana em lavado bronco‐alveolar é também um bom teste para detector aspergilose invasiva e o cut‐off ótimo varia de 0,5 a 1,0. Resultados falso‐positivos podem ocorrer quando pacientes recebem piperacilina – tazobactam, transfusões de hemoderivados e em outras infecções fúngicas como histoplasmose, fusariose e talaromicose.10
A (1→3)‐β‐d‐glucana também é um polissacarídeo componente da parede celular do fungo que pode ser liberado nas infecções por diversos fungos: Aspergillus, Candida, Fusarium, Trichosporon,Saccharomyces, Acremonium e Pneumocystis jiroveci. Portanto, não é específico para Aspergillus.
O lavado bronco‐alveolar e/ou biópsia de pulmão são os espécimes de escolha para microscopia e cultura. Colorações específicas para fungos devem ser empregadas no exame histológico. A presença de hifas hialinas, dicotomizadas e septadas em materiais estéreis são prova de infecção por Aspergillus mesmo sem isolamento em cultura. Enquanto sua presença no trato respiratório de indivíduos imunocompetentes pode representar apenas colonização, no imunodeprimido pode indicar doença invasiva.
A cultura tem baixa sensibilidade e em lavado bronco‐alveolar tem uma positividade em 63% dos pacientes com infecção. Quando não é possível coletar o lavado, pode‐se tentar fazer a cultura em 3 amostras de escarro.10
O diagnóstico e o tratamento da aspergilose invasiva estão descritos na tabela 3.
As infecções por Fusarium spp., outro fungo oportunista, podem manifestar‐se clinicamente como febre persistente irresponsiva à antibioticoterapia de amplo espectro em pacientes neutropênicos, com imunodeficiência de células T ou em portadores de leucemia aguda. Imunodeprimidos podem apresentam lesões de pele caracterizadas por máculas ou pápulas eritematosas e dolorosas que evoluem para úlceras necróticas, o ectima gangrenoso, mais comuns nas extremidades, que rapidamente se disseminam. A porta de entrada principal do Fusarium spp é o trato respiratório, seguido pela pele lesada ou com queimaduras. Infecção de cateter pode levar a fungemia e a remoção desse, associada ao antifúngico, é crucial para o tratamento.14 O isolamento do fungo pode ser feito em biópsia de pele ou cultura do sangue. A mortalidade nas formas disseminadas é alta,15 mas parece ser menor quando se usam voriconazol e anfotericina liposomal, em comparação à anfotericina deoxicolato.16 O diagnóstico e o tratamento da fusariose disseminada estão descritos na tabela 3.
Pneumocystis jiroveci é conhecido como agente de pneumonia oportunista em pessoas infectadas pelo HIV. A incidência diminuiu nesse grupo devido à terapia antirretroviral combinada e o emprego da profilaxia para pneumocistose. Por outro lado, observa‐se atualmente um aumento da incidência da infecção naqueles que recebem imunossupressores por doença oncológica ou autoimune, em pacientes transplantados com células‐tronco hematopoiéticas ou transplantados de órgãos sólidos. Poucos são os dados sobre infecção por P. jiroveci em crianças. Estudo recente que avaliaram adultos e crianças mostra que nessas as doenças onco‐hematológicas, o período pós‐transplante e os erros inatos de imunidade foram as comorbidades mais comuns. A manifestação clínica principal foi a pneumonia com febre, tosse, dispneia e dessaturação, evoluiu para insuficiência respiratória em adultos e crianças. O exame radiológico apresentava consolidação bilateral ou infiltrado intersticial bilateral. A mortalidade foi de 25%.17
O diagnóstico de infecção por P. jiroveci baseia‐se na visualização do agente com coloração específica em tecido pulmonar ou espécimes de secreções respiratórias como lavado bronco‐alveolar, escarro induzido ou aspiração endotraqueal em pacientes intubados.
O tratamento de escolha é o sulfametoxazol‐trimetoprim (SMZ‐TMP) administrado por via intravenosa por 21 dias. A pentamidina por via intravenosa pode ser uma opção para aqueles que não toleram o SMT‐TMP ou que não mostraram resposta após 4 a 8 dias de terapia com SMZ‐TMP. Em pacientes com pressão parcial de O2 abaixo de 70mmHg em ar ambiente, recomenda‐se o uso de prednisona oral por 21 dias (tabela 3).
Faz parte do grupo das leveduras o criptococo, levedura encapsulada que causa a criptococose predominantemente em pacientes com neoplasias hematológicas, em uso de corticosteroides em altas doses, transplantados de órgãos sólidos e infectados pelo HIV que apresentam imunodepressão celular. Nessas crianças, a disseminação hematogênica pode ocorrer para sistema nervoso central, ossos e pele. A forma mais comum é a meningite criptocócica, que tem curso indolente, com febre, cefaleia e alterações comportamentais. A hipertensão intracraniana e a síndrome inflamatória da reconstituição imune são complicações comuns.18 O diagnóstico pode ser feito por pesquisa de antígeno em líquor ou soro, mas o diagnóstico definitivo depende do isolamento do agente em cultura de fluidos corpóreos ou material de biópsia. A distinção entre as duas espécies, C. neoformans e C. gatti, depende de uso de meios de cultura seletivos.19 O diagnóstico e o tratamento da criptococose estão descritos na tabela 3.
Outra micose profunda, a mucormicose, deve ser diagnóstico diferencial da Aspergilose invasiva. Ambas têm similaridades quanto aos pacientes acometidos (oncológicos e diabéticos, no caso da mucormicose), quanto aos fatores de risco (neutropenia prolongada), sinais clínicos e radiológicos. Estudo recente que comparou aspergilose invasiva com mucormicose em pacientes oncológicos mostrou que a mucormicose foi mais frequente em crianças e adolescentes que adultos e em pacientes com leucemias agudas e doença do enxerto versus hospedeiro, enquanto a aspergilose foi mais frequente em pacientes com linfoma. O envolvimento pulmonar foi menor, entretanto o acometimento de seios paranasais, de sistema nervoso central e infecção em mais de 2 sítios foi mais frequente na mucormicose.20 O diagnóstico e tratamento da mucormicose estão descritos na tabela 3.
Infecções por herpervírusHerpes simples 1 (HHV‐1) e 2 (HHV‐2) estão entre os 9 herpesvirus que infectam serem humanos. Com exceção do período neonatal, infecções por herpes simples tipo 1 e 2 são geralmente localizadas. Em pacientes imunocomprometidos, lesões intensas graves localizadas e, menos comumente, infecção disseminada por HHV‐1 e HHV‐2 podem ocorrer, com vesículas generalizadas em pele e/ou envolvimento visceral.
A reativação do HHV‐1 e HHV‐2 após a infecção primária ocorre mais frequentemente no indivíduo imunodeprimido e é mais prolongada. As reativações podem ser precedidas de uma sensação de queimação ou prurido no local da recorrência, sintoma esse que pode ser útil na instituição precoce da terapia antiviral.
A encefalite por HSV ocorre após a infecção primária ou recorrente. Caracteriza‐se por febre, alteração do estado de consciência, alteração de personalidade, convulsões e sinais neurológicos focais. Costuma ter início agudo, com evolução fulminante, evolui para coma e óbito se não for instituída a terapia precocemente. A ressonância magnética é o exame de imagem mais sensível e que apresenta tipicamente envolvimento de lobo temporal. Diferentes mutações têm sido associadas a predisposição ao desenvolvimento de encefalite.21
Pode ocorrer também meningite. O diagnóstico de HHV‐1 e HHV‐2 pode ser feito a partir de inoculação de secreção de vesículas ou de líquor em cultura de células, o efeito citopático é observado em um a 3 dias após a inoculação, pode ser confirmado por imunofluorescência direta do material de cultura. PCR pode ser feita a partir de LCR. Se ambos os exames (cultura e PCR) forem repetidamente negativos, exame histopatológico e cultura viral de biópsia de tecido cerebral são os testes mais confiáveis para confirmar o diagnóstico de encefalite por HHV‐1 e HHV‐2.
O tratamento em imunossuprimidos deve ser feito com aciclovir intravenoso para HSV mucocutâneo. Em casos de HSV resistente a aciclovir, recomenda‐se foscarnet parenteral. Para encefalite, recomenda‐se aciclovir parenteral por 21 dias.21
Infecções por vírus varicela zoster (Herpesvírus 3, HHV‐3) em imunossuprimidos podem apresentar erupção de lesões que aparecem sucessivamente, algumas vezes de aspecto hemorrágico, acompanhadas de febre alta. Pode ocorrer visceralização da infecção, com encefalite, hepatite e pneumonia. Casos graves de varicela foram observados em crianças que usavamm corticosteroides em doses imunossupressoras, bem como em indivíduos com erros inatos da imunidade com comprometimento de células T e naqueles infectados pelo HIV. Crianças e adolescentes com alterações pulmonares ou cutâneas de base também estão propensos a apresentar varicela grave.
A infecção pelo vírus varicela zoster também pode se manifestar na forma de herpes zoster, que acontece após reativação do vírus que estava latente na raiz dorsal da medula, de nervos cranianos ou de nervos autonômicos entéricos. No imunossuprimido, as lesões tendem a não se restringir a um ou dois dermátomos, podem se disseminar. O mais comum é que as lesões de zoster apareçam com manifestação cutânea, mas podem também se apresentar como meningite asséptica isolada, encefalite, infarto ou envolvimento do trato gastrointestinal.
Em estudo retrospectivo que comparou episódios de zoster em adolescentes infectados por HIV por transmissão vertical e adolescentes com lúpus eritematoso sistêmico juvenil, os infectados pelo HIV tinham maior tendência a apresentar zoster recorrente quando comparados àqueles com lúpus.22
O diagnóstico de escolha de infecções pelo vírus varicela zoster é a reação em cadeia de polimerase (PCR) de material de vesícula ou de crosta. A imunofluorescência direta para detecção de vírus e a cultura viral também podem detectar o vírus, mas são menos sensíveis do que a PCR e, diferentemente dessa, não distinguem vírus vacinal do selvagem. O diagnóstico sorológico de varicela não é recomendável quando se suspeita de imunodeficiência, devido à sua baixa sensibilidade. Casos de varicela em imunodeprimidos que apresentavam anticorpos para varicela também foram relatados.23
A terapia com aciclovir intravenoso é recomendada para indivíduos imunocomprometidos. O tratamento deve ser iniciado precocemente, de preferência nas primeiras 24 horas após o início do exantema. O valaciclovir tem sido recomendado por alguns no tratamento de crianças entre 2 e 17 anos para casos de pacientes imunocomprometidos com menor risco de desenvolver varicela grave, tais como em pacientes infectados pelo HIV com linfócitos T CD4 mais elevados e em algumas crianças com leucemia, sempre sob atenta supervisão médica. Nos raros casos de varicela resistente ao aciclovir pode‐se usar o foscarnet intravenoso.24
Indivíduos imunocomprometidos expostos a varicela devem receber profilaxia com imunoglobulina específica para VZV por via intramuscular ou imunoglobulina intravenosa o mais precocemente possível após a exposição.
A quimioprofilaxia pós‐exposição de imunocomprometidos ao VZV tem sido recomendada por alguns, embora haja pouca evidência que demonstre seu benefício na literatura. Usa‐se o aciclovir ou valaciclovir (inicia‐se 7 a 10 dias após a exposição e durante 7 dias).
Infecções pelo vírus Epstein‐Barr (Herpesvírus 4, HHV‐4) podem causar uma grande variedade de manifestações clínicas. Elas vão desde infecções assintomáticas no lactente, passam por mononucleose infecciosa, mais frequente em escolares e adolescentes, chegam a quadros graves quando acometem o imunodeprimido. Nesses casos, observam‐se distúrbios linfoproliferativos, como síndrome hemofagocítica, síndrome linfoproliferativa ligada ao X, distúrbios linfoproliferativos pós‐transplante, linfoma de Burkitt, carcinoma de nasofaringe e linfomas indiferenciados de células T e B. Especial atenção deve ser dada a pacientes transplantados e aos infectados pelo HIV.
Enquanto em indivíduos imunocompetentes o diagnóstico da infecção pelo vírus Epstein‐Barr pode ser feito através de sorologia, nos indivíduos imunossuprimidos o diagnóstico pode requerer o uso de técnica de PCR para detecção do vírus em soro, plasma e tecido e de rtPCR em células linfoides, tecidos e fluidos corpóreos.25
O uso de corticosteroides (prednisona na dose de 1mg/kg/dia por via oral, máximo de 20mg/dia) por 7 dias pode ser recomendado nas infecções por vírus Epstein‐Barr que cursem com hipertrofia tonsilar com risco de obstrução de vias aéreas, esplenomegalia importante, miocardite, anemia hemolítica e síndrome hemofagocítica. Nos casos de síndrome hemofagocítica, pode ser necessário usar outros agentes citotóxicos e imunomoduladores, como etoposide, ciclosporina. No caso de pacientes com EBV com desordens linfoproliferativas pós‐transplante, pode ser necessária a redução da terapia imunossupressora.
Infecções por citomegalovírus (Herpesvírus 5, HHV‐5), quando acometem imunossuprimidos, podem desencadear quadros de pneumonia, colite, retinite, meningoencefalite e mielite transversa. Além desses, uma síndrome caracterizada por febre, trombocitopenia, leucopenia e hepatite leve pode ocorrer.
O citomegalovírus (CMV) pode ser adquirido por transmissão vertical, de pessoa a pessoa por contato com secreções contaminadas (saliva, urina ou secreções genitais), via transfusão de hemocomponentes e também via transplante de órgãos sólidos ou de células‐tronco hematopoiéticas. Além disso, o vírus persiste no organismo sofre replicação e pode ser transmitido intermitentemente, particularmente em situações de imunossupressão.
Os indivíduos especialmente sob risco de apresentar essas manifestações são aqueles em tratamento de neoplasias, os infectados pelo HIV e aqueles que recebem terapia imunossupressora para transplante de células‐tronco hematopoiéticas e transplante de órgãos sólidos. Pacientes em uso de biológicos podem manifestar retinite e hepatite, embora mais raramente.
O isolamento do CMV do órgão‐alvo da infecção é a melhor evidência que a doença é causada por esse vírus. A cultura tradicional em linhagem de células pode levar até 28 dias; já a cultura rápida em shell‐vial com detecção viral através de imunofluorescência dá resultados em 24 a 72 horas. A antigenemia para CMV (detecção do antígeno pp65) é outra maneira de pesquisar o CMV, mas é mais difícil do ponto de vista técnico que a PCR. Além disso, os diversos fluidos corpóreos podem ser avaliados em relação à presença de CMV através de PCR.26
O ganciclovir intravenoso é aprovado para tratamento da retinite por CMV em adultos imunocomprometidos, inclusive os infectados pelo HIV, e para profilaxia e tratamento da doença por CMV em receptores de transplante. O valganciclovir também está aprovado para a prevenção da doença por CMV em crianças receptoras de transplante de rim com mais de 4 meses e de crianças receptoras de transplante de coração com mais de um mês.
A profilaxia secundária em crianças deve ser mantida em pacientes infectados pelo HIV com mais de 6 anos até atingirem contagem de CD4 acima de 100/mm3 por 6 meses consecutivos; para aqueles abaixo de 6 anos, devem manter CD4 acima de 15% por igual período antes de se descontinuar a profilaxia. Em crianças com erro inato da imunidade que tenham manifestado retinite, a retirada da profilaxia deve ser avaliada caso a caso, com monitoramento por oftalmologista no mínimo a cada 3 a 6 meses.
A reativação de infecção por herpesvírus 6B (HHV‐6B) está associada a doença em receptores de órgãos sólidos e de células‐tronco hematopoiéticas, com febre, exantema, hepatite, supressão medular, rejeição de enxerto, pneumonia e encefalite.27 Infecção pelos herpesvírus 6A (HHV‐6A) e herpesvírus 7 (HHV‐7) são muito mais raras em imunodeprimidos.
O diagnóstico de infecção pelo herpesvírus 6B é difícil, só disponível em laboratórios de referência. Mesmo com os testes desses laboratórios, pode ser difícil distinguir infecção de doença.
O uso de ganciclovir (e de valganciclovir) ou de foscarnet pode ser benéfico nos pacientes imunocomprometidos com encefalite por HHV‐6B.27
Infecções Herpesvírus 8 (HHV‐8) estão associadas a sarcoma de Kaposi, doença de Castleman multicêntrica e à síndrome de citocinas inflamatórias associadas ao herpesvírus do sarcoma de Kaposi. No Brasil, o HHV‐8 é associado a casos de sarcoma de Kaposi em indivíduos adultos infectados pelo HIV sem uso de medicação antirretroviral. São muito raros os casos em crianças brasileiras. Não há uma medicação antiviral aprovada para tratamento de HHV‐8. As neoplasias associadas ao HHV‐8 são habitualmente tratadas com radio e quimioterapia.28
O diagnóstico e tratamento das infecções por Herpesvírus29 estão resumidos na tabela 4.
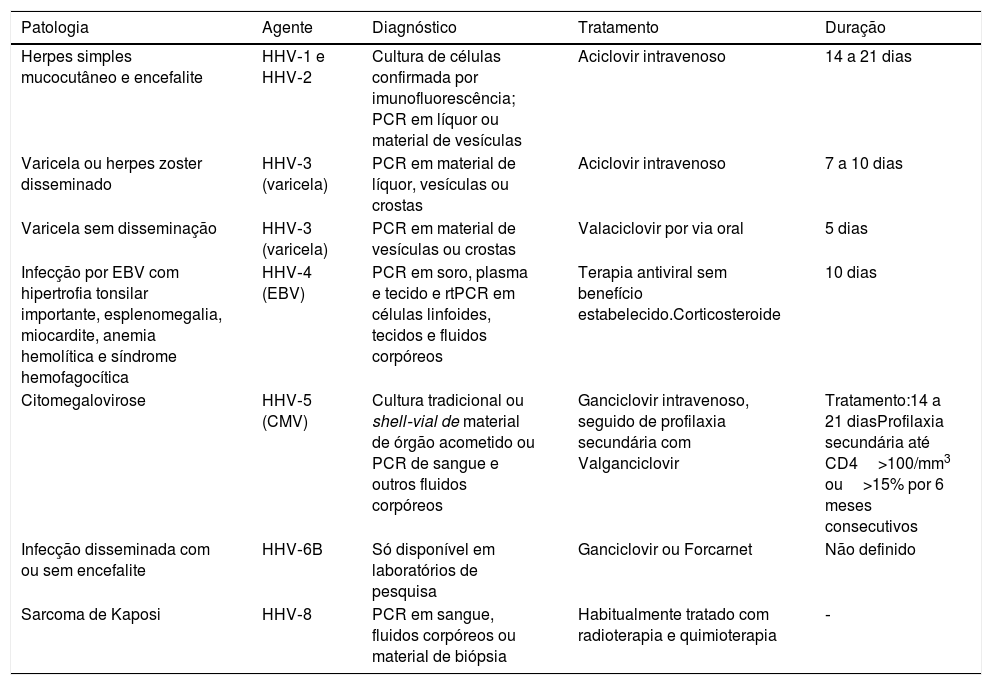
Diagnóstico e tratamento das infecções por herpesvírus em imunossuprimidos
| Patologia | Agente | Diagnóstico | Tratamento | Duração |
|---|---|---|---|---|
| Herpes simples mucocutâneo e encefalite | HHV‐1 e HHV‐2 | Cultura de células confirmada por imunofluorescência; PCR em líquor ou material de vesículas | Aciclovir intravenoso | 14 a 21 dias |
| Varicela ou herpes zoster disseminado | HHV‐3 (varicela) | PCR em material de líquor, vesículas ou crostas | Aciclovir intravenoso | 7 a 10 dias |
| Varicela sem disseminação | HHV‐3 (varicela) | PCR em material de vesículas ou crostas | Valaciclovir por via oral | 5 dias |
| Infecção por EBV com hipertrofia tonsilar importante, esplenomegalia, miocardite, anemia hemolítica e síndrome hemofagocítica | HHV‐4 (EBV) | PCR em soro, plasma e tecido e rtPCR em células linfoides, tecidos e fluidos corpóreos | Terapia antiviral sem benefício estabelecido.Corticosteroide | 10 dias |
| Citomegalovirose | HHV‐5 (CMV) | Cultura tradicional ou shell‐vial de material de órgão acometido ou PCR de sangue e outros fluidos corpóreos | Ganciclovir intravenoso, seguido de profilaxia secundária com Valganciclovir | Tratamento:14 a 21 diasProfilaxia secundária até CD4>100/mm3 ou>15% por 6 meses consecutivos |
| Infecção disseminada com ou sem encefalite | HHV‐6B | Só disponível em laboratórios de pesquisa | Ganciclovir ou Forcarnet | Não definido |
| Sarcoma de Kaposi | HHV‐8 | PCR em sangue, fluidos corpóreos ou material de biópsia | Habitualmente tratado com radioterapia e quimioterapia | ‐ |
Fonte: American Academy of Pediatrics (2018).29
Biológicos são parte de uma ampla gama de produtos, que incluem vacinas, componentes do sangue, alérgenos, células somáticas, terapia gênica, tecidos e proteínas. Nos últimos anos os biológicos têm sido usados em pediatria para tratar doenças reumatológicas, doenças inflamatórias intestinais e neoplasias (tabela 5). O objetivo do uso dessas drogas é interferir na alteração imunológica que leva à doença clínica, reduzir ou aumentar a resposta imune. Entretanto, alterações nas vias da resposta imune levam a deficiências seletivas que potencializam o risco de infecção.30
Biológicos e eventos infecciosos associados
| Alvo | Agente | Infecções associadas em Pediatria |
|---|---|---|
| TNF‐alfa | InfliximabeAdalimumabeEtanercept | Infecção de vias aéreas superiores, pneumonia, abscessos, varicela, histoplamose, meningite por Listeria monocytogenes, blastomicose cutânea, infecção por M. avium |
| IL‐1 | AnakinraCanakinumabe | Leishmaniose visceral, varicela, herpes tipo 1 e 2, infecção de vias aéreas superiores |
| IL‐2 | Basiliximabe | ‐ |
| IL‐6 | Tocilizumabe | Infecção de vias aéreas superiores, pneumonia, celulite, varicela |
| IL‐12/23 | Ustekinumabe | ‐ |
| Bloqueador de CD28 | Abatacept | ‐ |
| a‐4 integrina | Vedolizumabe | Infecção de vias aéreas superiores, celulite |
| JAK | Tofacitinibe | Infecções virais (BK, citomegalovírus, adenovírus), infecções bacterianas |
| CD20 | Rituximabe | Infecções virais (varicela, citomegalovírus, adenovírus), pneumonia, empiema, mastoidite, Salmonella enteritidis e candidíase |
Fonte: Danziger‐Isakov.30
Os inibidores de TNF‐alfa bloqueiam a resposta imune e reduzem a inflamação aguda em pacientes com artrite reumatoide, artrite idiopática juvenil, psoríase e doença inflamatória intestinal, como doença de Crohn e colite ulcerativa. Infliximabe, adalimumabe e etanercept têm indicação aprovada em pediatria. O uso de anti‐TNF‐alfa reduz a resposta imune a micobactérias e predispõe a reativação de tuberculose. Além disso, infecções bacterianas graves por Streptococcus pyogenes, meningite por listéria, infecções sistêmicas por complexo Mycobacterium avium (MAC) e infecções fúngicas endêmicas, como histoplasmose e blastomicose, foram relatadas em pacientes pediátricos. Reativação do vírus da varicela zoster (VZV) e de vírus Epstein Barr (EBV) também foram descritas. O que ainda não é claro na faixa etária pediátrica é o quanto o uso de anti‐TNF‐alfa efetivamente eleva o risco de determinadas infecções oportunistas comparado a crianças com patologias autoimunes em uso de outros imunossupressores como corticosteroides.30
Inibidores de interleucinasDiferentes inibidores de interleucinas (IL) têm sido usados com a função de interferir na cascata inflamatória de pacientes com doenças autoimunes. Essa terapêutica mostrou‐se associada ao desenvolvimento de infecções.
Inibidores de IL‐1. A IL‐1 medeia a ativação de macrófagos e de células T, desencadeiaa febre. Os inibidores de IL‐1 têm sido usados na doença inflamatória multissistêmica de instalação neonatal e nas síndromes periódicas associadas a criopirina, além do uso off label em artrite idiopática juvenil sistêmica.
Infecções na faixa etária pediátrica têm sido relatadas com o uso de Anakinra: leishmaniose visceral, varicela, herpes simples tipo 1 e infecções de vias aéreas superiores. Canakinumabe, usado no tratamento da artrite idiopática juvenil, não mostrou aumento no número de infecções.
Inibidores de IL‐6. A IL‐6 modula o crescimento e a diferenciação de linfócitos T e B, estimula a produção de proteínas da fase aguda. Tocilizumabe é um bloqueador de IL‐6 usado no tratamento da artrite idiopática juvenil sistêmica e poliarticular. Há pouca experiência com o uso desse medicamento na faixa etária pediátrica.
Inibidores de IL‐2. A IL‐2 promove a proliferação de células T, os bloqueadores de IL‐2 têm sido usados em transplantados de órgãos sólidos para interromper a proliferação de células T após o transplante. Basiliximabe parece não estar associado a aumento de infecções.
Inibidores de IL‐12, IL‐17 e IL‐23. A IL‐12 é produzida por macrófagos e células dendríticas e promove tanto a ativação de células NK quanto a diferenciação de células T. A IL‐23 estimula a proliferação de células Th17, e a IL‐17 produzida por essas células estimula a produção de citocinas pró‐inflamatórias, com efeito em endotélio, epitélio e fibroblastos. O uso desses biológicos ainda é restrito em pediatria. Poucas são as infecções relatadas com o seu uso.
Outros alvos diferentes de interleucinasO uso de drogas inibidoras de CD28 como Abatacept não está associado a infecções. Por outro lado, drogas anti‐CD20, que atuam sobre células B, levam a hipogamaglobulinemia, apresentam risco de diferentes infecções cujo mecanismo de defesa depende da resposta imune humoral. Um exemplo de anti‐CD20 é o Rituximabe, usado em casos de doença linfoproliferativa pós‐transplante, linfo‐histiocitose hemofagocítica relacionada ao vírus Epstein‐Barr, doenças glomerulares, doenças inflamatórias do sistema nervoso central e linfoma de Burkitt. As infecções associadas ao uso de Rituximabe são: sepse bacteriana, citomegalovirose, varicela, pielonefrite aguda, nefropatia por BK e enterite por salmonela. O risco de infecção varia de 1% a 10%.
ConclusãoApesar da melhoria do diagnóstico de infecções oportunistas nos últimos anos, elas ainda são um desafio para o pediatra pouco habituado a estas infecções. Ele deve fazer a suspeita e iniciar a condução do caso, mas recorrer a especialistas com prática no manejo dessas infecções de modo a propiciar um melhor desfecho para esses pacientes que ainda apresentam alta mortalidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: de Moraes‐Pinto MI, Ferrarini MA. Opportunistic infections in pediatrics: when to suspect and how to approach. J Pediatr (Rio J). 2020;96(S1):47–57.