To apply, in Brazil, the T‐cell receptor excision circles (TRECs) quantification technique using real‐time PCR in newborn screening for severe combined immunodeficiency (SCID) and assess the feasibility of implementing it on a large scale in Brazil.
Methods8715 newborn blood samples were collected on paper filter and, after DNA elution, TRECs were quantified by real‐time PCR. The cutoff value to determine whether a sample was abnormal was determined by ROC curve analysis, using SSPS.
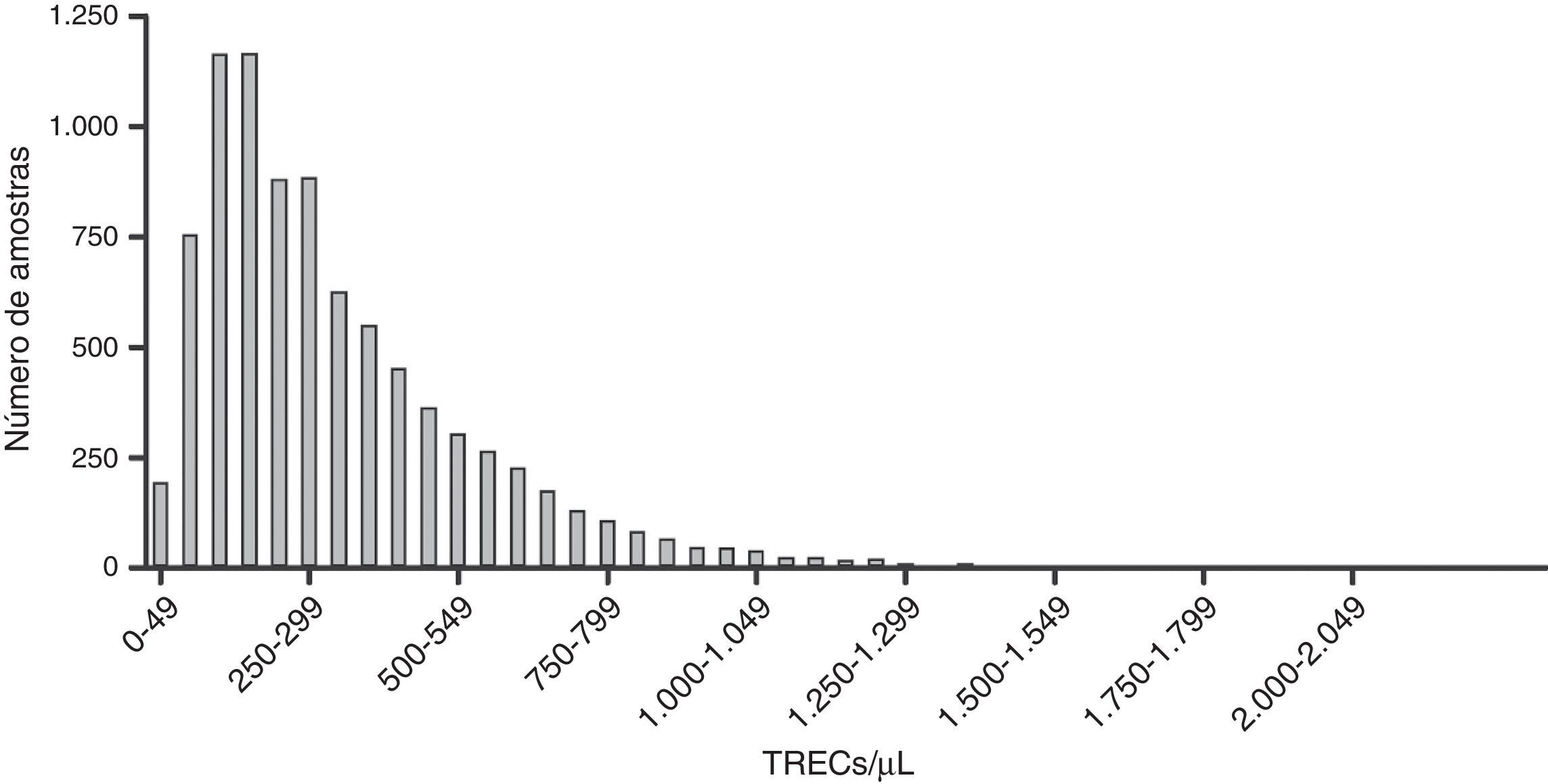
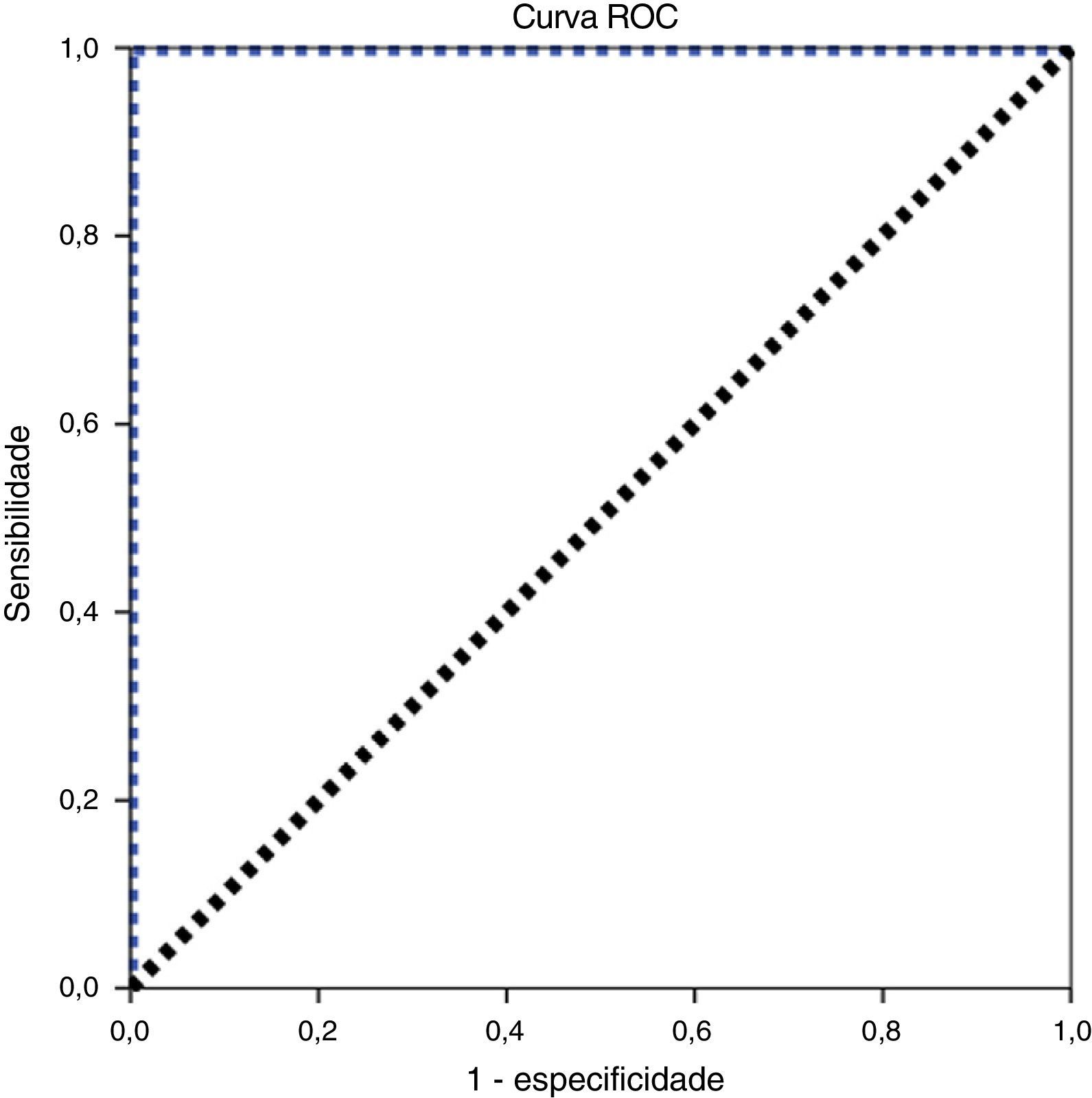
ResultsThe concentration of TRECs in 8682 samples ranged from 2 to 2181TRECs/μL of blood, with mean and median of 324 and 259TRECs/μL, respectively. Forty‐nine (0.56%) samples were below the cutoff (30TRECs/μL) and were reanalyzed. Four (0.05%) samples had abnormal results (between 16 and 29TRECs/μL). Samples from patients previously identified as having SCID or DiGeorge syndrome were used to validate the assay and all of them showed TRECs below the cutoff. Preterm infants had lower levels of TRECs than full‐term neonates. The ROC curve showed a cutoff of 26TRECs/μL, with 100% sensitivity for detecting SCID. Using this value, retest and referral rates were 0.43% (37 samples) and 0.03% (3 samples), respectively.
ConclusionThe technique is reliable and can be applied on a large scale after the training of technical teams throughout Brazil
Aplicar no Brasil a técnica de quantificação de T‐cell Receptor Excision Circles (TRECs) por PCR em tempo real para triagem neonatal de imunodeficiência combinada grave (SCID) e avaliar se é possível fazê‐la em grande escala em nosso país.
MétodosForam coletadas em papel filtro 8.715 amostras de sangue de recém‐nascidos e, após eluição do DNA, os TRECs foram quantificados por PCR em tempo real. O valor de corte para determinar se uma amostra é anormal foi determinado pela análise de curva ROC com o programa SSPS.
ResultadosA concentração de TRECs em 8.682 amostras analisadas variou entre 2 e 2.181 TRECs/μL de sangue, com média e mediana de 324 e 259 TRECs/μL, respectivamente. Das amostras, 49 (0,56%) ficaram abaixo do valor de corte (30 TRECs/μL) e foram requantificadas. Quatro (0,05%) mantiveram resultados anormais (entre 16 e 29 TRECs/μL). Amostras de pacientes com diagnóstico clínico prévio de SCID e síndrome de DiGeorge foram usadas para validar o ensaio e todas apresentaram concentração de TRECs abaixo do valor de corte. Recém‐nascidos prematuros apresentaram menores níveis de TRECs comparados com os nascidos a termo. Com o uso da curva ROC em nossos dados, chegamos ao valor de corte de 26 TRECs/μL, com sensibilidade de 100% para detecção de SCID. Com o uso desse valor, as taxas de repetição e encaminhamento ficaram em 0,43% (37 amostras) e 0,03% (3 amostras), respectivamente.
ConclusãoA técnica é factível e pode ser implantada em grande escala, após treinamento técnico das equipes envolvidas.
As imunodeficiências graves combinadas (SCID, do inglês Severe Combined Immunodeficiency) são um grupo de doenças heterogêneas caracterizadas por anomalias graves no desenvolvimento e na função de linfócitos T, B e NK. São reconhecidas como emergências pediátricas, pois levam a infecções graves e de repetição e são fatais nos dois primeiros anos de vida se não forem diagnosticadas e tratadas corretamente.1,2
Devido à gravidade da doença e à urgência no diagnóstico e tratamento, em 2005, pesquisadores americanos desenvolveram a triagem neonatal (TN) para SCID que consiste na quantificação de TRECs (do inglês–T‐Cell Receptor Excision Circles) por PCR em tempo real (qRT‐PCR).3,4 Os TRECs são pequenos pedaços circulares de DNA formados durante o processamento tímico normal, quando ocorre o rearranjo dos genes do receptor de célula T. Como não se reproduzem durante a divisão celular, funcionam como marcadores para o número de células T naïve recentemente emigradas do timo e que estão diminuídas em todas as formas de SCID.5
Na maioria dos casos, a TN é o único meio de se detectarem as SCID antes que as infecções se instalem, uma vez que mais de 80% dos casos não têm história familiar positiva para imunodeficiência primária.6
Um número importante alterado após o desenvolvimento da triagem neonatal foi o de incidência da doença. Como muitas crianças vão a óbito antes que o diagnóstico seja feito, estimava‐se a incidência da SCID em 0,10/10.000. Com a experiência americana, esse número hoje está próximo de 0,17/10.000 (1:58.000), ou seja, quase o dobro.6,7
No Brasil não existe um teste de triagem neonatal para imunodeficiências primárias aplicado à rotina médica, o diagnóstico dessas patologias está muito aquém do desejado.8–10 Por esse motivo, o objetivo deste trabalho foi aplicar no Brasil a técnica de quantificação de TRECs por qRT‐PCR para TN de imunodeficiências combinadas graves e avaliar se é possível aplicá‐la em grande escala em nosso país.
MétodosTodas as amostras foram coletadas de acordo com as normas éticas vigentes do Comitê de Ética em Pesquisa do ICB‐USP (Parecer 967/CEP), foi solicitada a assinatura do termo de consentimento livre e esclarecido pelos pais ou responsáveis pelo recém‐nascido (RN). A concentração de TRECs foi determinada após coleta de sangue a partir de punção no calcanhar de RN, dentro da rotina já existente para o teste do pezinho, em cartões de papel filtro 903. Foram analisadas amostras de crianças nascidas em três serviços de maternidades e Associação de Pais e Amigos dos Excepcionais em São Paulo (Apae‐SP), localizados na região metropolitana de São Paulo, e amostras coletadas na Clínica de Medicina Preventiva do Pará (Climep). Discos de 3,2mm de diâmetro foram picotados das amostras em papel filtro e foram adicionados a uma placa de polipropileno de 96 poços onde se fez o procedimento de eluição do DNA como já descrito anteriormente.3 Em todas as placas, além das amostras dos RNs, foram usados um controle positivo (sangue de adulto com baixos níveis de TRECs) e um controle sem alvo (um pedaço do papel filtro sem amostra). A reação de qRT‐PCR para TRECs e/ou beta‐actina foi feita conforme descrito.3,11 Todos os reagentes usados foram adquiridos da Life Technologies® (Life Technologies, EUA).
Inicialmente, usou‐se o valor arbitrário de corte de 30 TRECs/μL de sangue para determinar se uma amostra era normal, com base no valor estabelecido por Baker et al. de 25 TRECs/μL. Nos casos em que o resultado ficou abaixo desse valor, um novo picote da mesma amostra teve sua análise de TRECs repetida acompanhada da análise de beta‐actina, como controle da extração. Após a segunda análise, as amostras com valores abaixo de 30 TRECs/μL e beta‐actina acima de 8.000/μL foram consideradas anormais e os pacientes encaminhados para pediatra imunologista para consulta e testes confirmatórios (hemograma e determinação do número de linfócitos T, B e NK). Aquelas com TRECs abaixo de 30/μL e beta‐actina abaixo de 8.000/μL tiveram resultado classificado como inconclusivo e nova amostra deveria ser solicitada.
A análise dos dados foi feita com estatística descritiva. Com a aplicação do teste de Kolmogorov‐Smirnov os dados não apresentaram distribuição normal e foram então apresentados segundo mediana e valores interquartis. A comparação das concentrações de TREC entre recém‐nascidos a termo e pré‐termo foi estabelecida por meio do teste de Mann‐Whitney no programa GraphPadPrism 5.0 (GraphPadPrism, EUA). O valor de corte para determinar se uma amostra é anormal foi determinado por análise de curva ROC (área sob a curva) com o programa SSPS (IBM Corp. Released 2013. IBM SPSS Statistics para Windows, versão 22.0, NY, EUA).
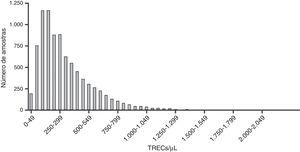
ResultadosForam coletadas amostras de 8.715 RN, 3.353 (38%) provenientes da Climep e o restante, dos hospitais localizados na região metropolitana de São Paulo. Desse total, 33 foram consideradas inadequadas devido à falha na coleta. Assim, 8.682 amostras foram analisadas quanto à concentração de TRECs e os valores obtidos na primeira quantificação variaram de 2 a 2.181 TRECs/μL de sangue, com média e mediana de 324 e 259 TRECs/μL, respectivamente. De acordo com se o protocolo estabelecido, as amostras com valores abaixo do corte (30 TRECs/μL) foram reanalisadas. Assim, 49 (0,56%) amostras foram requantificadas e apenas quatro (0,05%) tiveram resultados anormais, com TRECs entre 16 e 29/μL. Dentre essas quatro amostras, uma foi proveniente de um RN de 27 semanas (24 TRECs/μL), sexo masculino, que não pôde ser localizado para que o protocolo fosse completado. Os três RN restantes foram examinados e submetidos à avaliação do número de linfócitos, cujos resultados foram normais em todos os casos. Na figura 1 pode‐se observar a distribuição das amostras de acordo com a concentração de TRECs obtida na primeira análise.
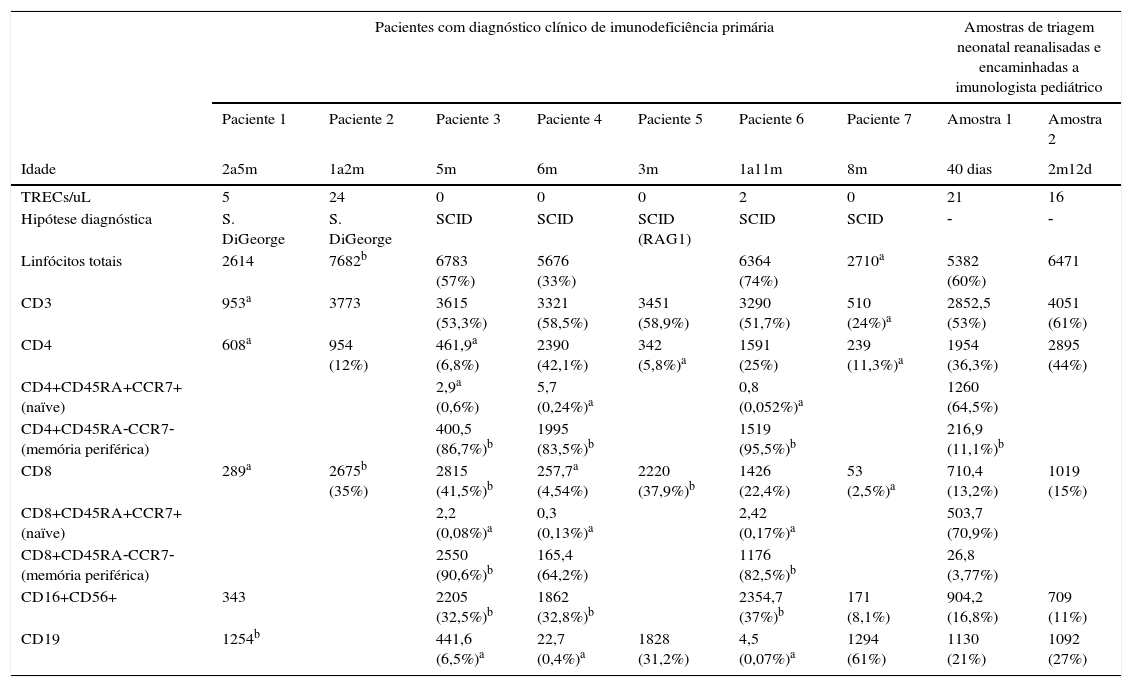
Para verificar a eficácia do ensaio, foram analisadas e usadas como controles amostras de pacientes com diagnóstico clínico prévio de SCID (n=5) e síndrome de DiGeorge (n=2). Todas as amostras de SCID apresentaram valores de TRECs abaixo de 3TRECs/μL e as amostras de DiGeorge tiveram resultados de 5 e 24 TRECs/μL (tabela 1).
Imunofenotipagem de linfócitos para pacientes com diagnóstico clínico de imunodeficiências primárias e amostras encaminhadas a imunologista pediátrico para avaliação após triagem neonatal alterada
| Pacientes com diagnóstico clínico de imunodeficiência primária | Amostras de triagem neonatal reanalisadas e encaminhadas a imunologista pediátrico | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| Paciente 1 | Paciente 2 | Paciente 3 | Paciente 4 | Paciente 5 | Paciente 6 | Paciente 7 | Amostra 1 | Amostra 2 | |
| Idade | 2a5m | 1a2m | 5m | 6m | 3m | 1a11m | 8m | 40 dias | 2m12d |
| TRECs/uL | 5 | 24 | 0 | 0 | 0 | 2 | 0 | 21 | 16 |
| Hipótese diagnóstica | S. DiGeorge | S. DiGeorge | SCID | SCID | SCID (RAG1) | SCID | SCID | ‐ | ‐ |
| Linfócitos totais | 2614 | 7682b | 6783 (57%) | 5676 (33%) | 6364 (74%) | 2710a | 5382 (60%) | 6471 | |
| CD3 | 953a | 3773 | 3615 (53,3%) | 3321 (58,5%) | 3451 (58,9%) | 3290 (51,7%) | 510 (24%)a | 2852,5 (53%) | 4051 (61%) |
| CD4 | 608a | 954 (12%) | 461,9a (6,8%) | 2390 (42,1%) | 342 (5,8%)a | 1591 (25%) | 239 (11,3%)a | 1954 (36,3%) | 2895 (44%) |
| CD4+CD45RA+CCR7+(naïve) | 2,9a (0,6%) | 5,7 (0,24%)a | 0,8 (0,052%)a | 1260 (64,5%) | |||||
| CD4+CD45RA‐CCR7‐ (memória periférica) | 400,5 (86,7%)b | 1995 (83,5%)b | 1519 (95,5%)b | 216,9 (11,1%)b | |||||
| CD8 | 289a | 2675b (35%) | 2815 (41,5%)b | 257,7a (4,54%) | 2220 (37,9%)b | 1426 (22,4%) | 53 (2,5%)a | 710,4 (13,2%) | 1019 (15%) |
| CD8+CD45RA+CCR7+ (naïve) | 2,2 (0,08%)a | 0,3 (0,13%)a | 2,42 (0,17%)a | 503,7 (70,9%) | |||||
| CD8+CD45RA‐CCR7‐ (memória periférica) | 2550 (90,6%)b | 165,4 (64,2%) | 1176 (82,5%)b | 26,8 (3,77%) | |||||
| CD16+CD56+ | 343 | 2205 (32,5%)b | 1862 (32,8%)b | 2354,7 (37%)b | 171 (8,1%) | 904,2 (16,8%) | 709 (11%) | ||
| CD19 | 1254b | 441,6 (6,5%)a | 22,7 (0,4%)a | 1828 (31,2%) | 4,5 (0,07%)a | 1294 (61%) | 1130 (21%) | 1092 (27%) | |
TRECs, T cell receptor excision circles; S. DiGeorge, síndrome de DiGeorge; SCID, severe combined immunodeficiency; RAG1, recombination activation gene 1; CD, cluster of differentiation; CCR7, chemokine (C‐C motif) receptor 7.
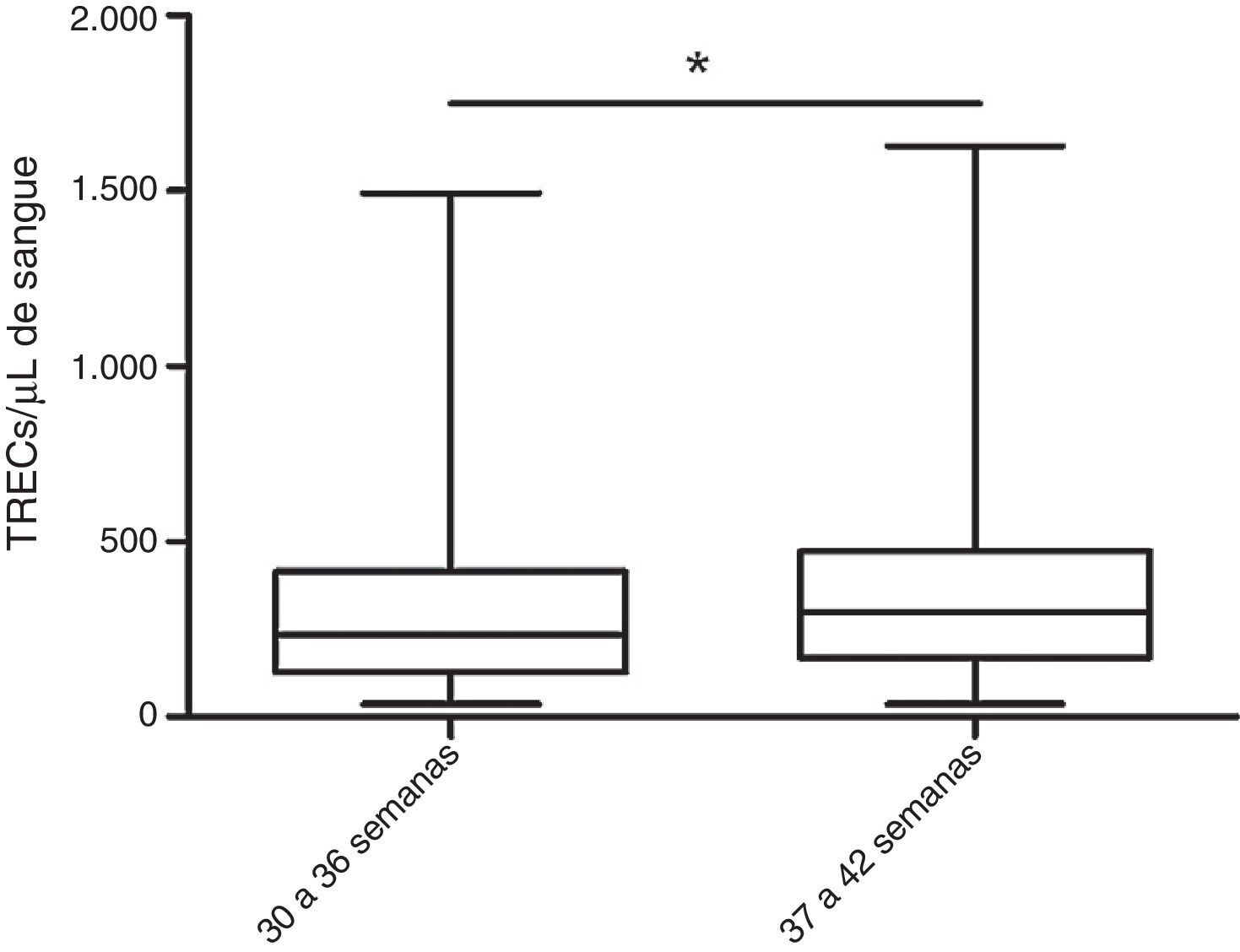
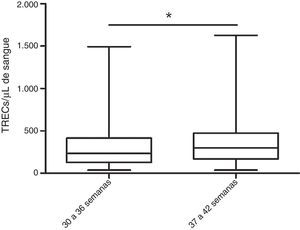
Parte das amostras provenientes da Climep (2.416) continham dados sobre a idade gestacional: 9,9% (239) dos neonatos eram prematuros (30‐36 semanas de idade gestacional). Isso permitiu que se comparasse a concentração de TRECs entre os dois grupos e chegou‐se à conclusão de que os prematuros têm níveis de TRECs menores do que os nascidos a termo (fig. 2).
Concentração de TRECs/μL para RN prematuros e a termo. TRECs foram quantificados por qRT‐PCR em amostras de sangue de 239 recém‐nascidos prematuros (30‐36 semanas) e em 2.177 recém‐nascidos a termo (37 a 42 semanas). Recém‐nascidos prematuros apresentaram concentrações de TRECs mais baixas do que os nascidos a termo (237 TRECs/μL vs. 300 TRECs/μL, respectivamente; *p<0,05, teste de Mann‐Whitney). A concentração de TRECs está representada em boxplot e mostra mediana, 25° e 75° percentis e mínimo e máximo.
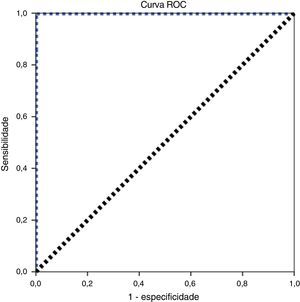
Com o uso, arbitrariamente, de 30 TRECs/μL como valor de corte inicial, tivemos uma taxa de repetições de 0,56% (49 amostras). Após a segunda quantificação, apenas quatro amostras mantiveram valores anormais, o que resultou em uma taxa de encaminhamento para serviço pediátrico especializado de 0,05%. Ao analisar a curva ROC para nossas condições (fig. 3), chegamos ao valor de corte de 26 TRECs/μL, com área sob a curva de 1,00 e sensibilidade de 100% para detecção de SCID. Com o uso desse valor, recalculamos as taxas de repetição e encaminhamento, que resultaram em 0,43% (37 amostras) e 0,03% (3 amostras), respectivamente.
DiscussãoAs SCID resultam de uma gama de defeitos moleculares e os defeitos tanto na imunidade celular como na humoral levam a apresentações clínicas similares. Na maioria dos casos, os sintomas se iniciam entre o segundo e terceiro mês de vida e as complicações infecciosas são a característica predominante da doença, com preponderância de infecções oportunistas (por exemplo, por P. jirovecii). Os sinais clínicos são inespecíficos e incluem infecções do trato respiratório, candidíase mucocutânea resistente à terapia tópica, dermatite eczematosa e infecções bacterianas locais e sistêmicas (otite, mastoidite, rinite purulenta e conjuntivite, doença séptica, meningite, artrite e abscessos locais). Muitas vezes, o primeiro sinal é a reação à vacina de BCG, que pode se apresentar como uma reação localizada ou disseminada.12 As infecções graves e de repetição levam ao crescimento inadequado. Além disso, parasitas intracelulares (Listeria, Legionella), assim como vírus (Epstein‐Barr e citomegalovírus), podem causar complicações fatais.13
No Brasil, um estudo multicêntrico comprovou o grave problema do subdiagnóstico das SCID em nosso meio. Em 15 anos (1996 a 2010), apenas 70 casos foram diagnosticados em 23 centros contatados no país. Considerando a provável incidência de 0,17 caso de SCID para 10.000 nascidos vivos (1:58.000) e a média de 2.900.000 nascidos vivos/ano de 1996 a 2010, esperávamos 750 casos de SCID nesse período. Como somente 70 foram documentados, mais de 90% dos casos passaram sem o diagnóstico adequado.6,10 Esses números mostram claramente a dificuldade encontrada no Brasil de se fazer o diagnóstico de SCID. Como comentado anteriormente, os sinais e sintomas são inespecíficos, podem variar de infecções comuns na fase neonatal à dificuldade de crescimento. As crianças nascidas em famílias com casos prévios de SCID podem ser beneficiadas pela história positiva e têm a possibilidade de ter o diagnóstico precoce feito. No entanto, 80% dos casos não têm história prévia6 e o diagnóstico muitas vezes ocorre somente quando as infecções de repetição já deixaram sequelas.
Devido à urgência no diagnóstico e tratamento, este trabalho teve como objetivo validar a técnica de quantificação de TRECs por qRT‐PCR para TN das SCID e aplicar a técnica no Brasil.
Os resultados mostram que após se analisarem amostras de 8.682 neonatos, chegou‐se a um valor de corte de 26 TRECs/μL, o que implicou a reanálise de 0,43% das amostras. A acurácia da técnica foi validada por meio da quantificação de TRECs em cinco casos de SCID com diagnóstico clínico prévio, cujos resultados variaram de 0 a 2 TRECs/μL (tabela 1). O índice de reteste de 0,43% está dentro dos valores relatados na literatura (0,20 a 3,26%) e pode ser considerado um valor adequado, importante para a implantação de um teste em alta escala, o que evita a elevação dos custos e expectativas e estresse desnecessários nos parentes.14 A porcentagem de amostras a serem repetidas está diretamente relacionada ao valor de corte usado, que varia entre 7 e 252 TRECs/μL nos diferentes estudos feitos até o momento. Isso se deve às diferentes metodologias usadas tanto para extração de DNA quanto para a reação de PCR.14 O valor de corte encontrado para as amostras (26 TRECs/μL) está muito próximo do valor usado por Baker et al. (25 TRECs/μL), trabalho no qual este estudo se baseou para validar a técnica em nosso laboratório.3 É importante ressaltar que esse valor de corte teve sensibilidade de 100% para detecção de SCID, mas trabalhos recentes descreveram que vários outros tipos de linfopenias T também puderam ser detectados por meio dessa metodologia: síndrome de DiGeorge, trissomia do 21, ataxia‐telangiectasia, trissomia do 18, síndrome CHARGE, anomalias cardíacas, entre outras.6
O menor valor na concentração de TRECs/μL encontrado em prematuros já foi relatado em outros trabalhos que também mostram que o resultado tende a normalizar quando a criança atinge a idade gestacional ajustada de 37 semanas.7,15 Assim, esses resultados são compatíveis com a literatura internacional e foram validados por controles positivos da doença.
A técnica de quantificação de TRECs por PCR em tempo real foi aplicada em pequena escala e, neste estudo, teve um custo estimado de US$4 por amostra. Esse valor, apesar de considerar somente custos em reagentes, pode ser comparado ao custo da TN para hiperplasia adrenal congênita (HAC), calculado de acordo com o estudo piloto feito no Estado de Goiás, de US$7.16 Considerando‐se o número de nascidos vivos no Brasil em 2.013 de quase 3 milhões de crianças,17 o custo total seria de aproximadamente US$12 milhões, menor do que da TN para HAC, patologia recentemente incluída no Programa Nacional de Triagem Neonatal.18 Vale ressaltar que é necessário acrescentar custos adicionais (busca ativa e exames confirmatórios) a esse valor e que, em grande escala, esse valor tende a diminuir.
Dentre as linfopenias T com possibilidade de ser diagnosticadas por meio da quantificação de TRECs, as SCID são, sem dúvida, as mais graves. A maior parte das crianças com SCID não é diagnosticada até que várias infecções graves se manifestem ou que a criança apresente déficit de crescimento e a menos que haja história familiar de SCID, o diagnóstico é muitas vezes retardado e as chances de cura diminuídas. Ademais, o argumento irrefutável para a inclusão das SCID na triagem neonatal é o fato de que as SCID são as únicas patologias passíveis de triagem neonatal que podem ser curadas pelo tratamento quando o diagnóstico é feito de maneira precoce.19
O transplante de células tronco hematopoéticas (TCTH) é curativo e está disponível no Brasil.5 Quando instituído antes de 3,5 meses de vida, resulta em um índice de sobrevida de 95%; após essa idade, a sobrevida em longo prazo cai para 60‐70% e a incidência de complicações infecciosas e sequelas aumenta dramaticamente.20 Consequências ainda piores ocorrem quando o TCTH é feito com infecções ativas durante o procedimento: a sobrevida cai para 50%, mostra mais uma vez que o diagnóstico precoce melhora, substancialmente, o desfecho.14,20
Ainda com relação aos aspectos econômicos, é necessário considerar os custos do TCTH e complicações decorrentes das várias infecções a que os portadores de SCID estão sujeitos. Vários estudos compararam o custo do TCTH precoce com o tardio: o tratamento precoce completo, feito até os três meses e meio (antes que as infecções se instalem), custa até quatro vezes menos do que quando feito após essa idade (US$ 365.785 vs. US$ 1,43 milhão).21 Quando considerado somente o custo do transplante, a diferença foi de US$ 120.000 contra US$ 360.000 quando o TCTH foi feito antes e após três meses e meio, respectivamente.22 Esses valores, calculados para os EUA, mostram o grande benefício da triagem neonatal para SCID em detrimento dos elevados custos decorrentes do diagnóstico tardio e das complicações que esse atraso pode acarretar.21
Quando analisamos os valores do TCTH antes e depois dos três meses e meio temos uma margem de US$ 240.000 de economia, quando o transplante é feito precocemente. Considerando o custo obtido para este estudo de US$ 4, seria possível triar cerca de 60 mil crianças. Assim, a introdução deste teste em alta escala praticamente se pagaria, pois a economia gerada com o diagnóstico de uma criança com SCID encaminhada para TCTH precoce possibilitaria cobrir os custos dos testes necessários para diagnosticar outra criança (quando considerada a incidência de 0,17/10.000).
Salienta‐se que os dados econômicos apresentados refletem os custos nos EUA e é necessário que estudos de custo‐benefício sejam feitos no Brasil e considerem o sistema de saúde aqui existente.
A implantação do teste de triagem neonatal para SCID é crescente no mundo todo. Vários países estão incluindo a SCID em suas rotinas de triagem neonatal ou têm estudos pilotos em andamento (EUA, Canadá, Irã, Taiwan, Israel, Espanha, França, Suécia e Inglaterra).19,23 A implantação como rotina em nosso país poderia melhorar significativamente esse trágico panorama apresentado anteriormente sem que uma nova plataforma seja requerida.
A aplicação da quantificação de TRECs na triagem neonatal de 8.682 recém‐nascidos resultou num valor de corte de 26 TRECs/μL com índice de reteste semelhante ao de estudos internacionais. Este estudo mostrou que a técnica usada é factível e pode ser implantada em grande escala, após treinamento técnico das equipes envolvidas.
FinanciamentoFapesp, CNPq, Baxter Bioscience.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosAos voluntários, pacientes e suas famílias que aceitaram participar do estudo. Ao Dr. John Routes e à Dra. Mei Baker pelo treinamento, ao Dr. Daniel Douek pelos plasmídeos doados, aos funcionários dos hospitais e das clínicas participantes e aos funcionários da APAE‐SP por nos ajudarem com os dados necessários.
Como citar este artigo: Kanegae MP, Barreiros LA, Mazzucchelli JT, Hadachi SM, Guilhoto LM, Acquesta AL, et al. Neonatal screening for severe combined immunodeficiency in Brazil. J Pediatr (Rio J). 2016;92:374–80.
Este trabalho está vinculado ao Departamento de Imunologia, Instituto de Ciências Biomédicas, Universidade de São Paulo (USP), São Paulo, SP, Brasil.