To evaluate musculoskeletal involvement and autoantibodies in pediatric leprosy patients.
Methods50 leprosy patients and 47 healthy children and adolescents were assessed according to musculoskeletal manifestations (arthralgia, arthritis, and myalgia), musculoskeletal pain syndromes (juvenile fibromyalgia, benign joint hypermobility syndrome, myofascial syndrome, and tendinitis), and a panel of autoantibodies and cryoglobulins. Health assessment scores and treatment were performed in leprosy patients.
ResultsAt least one musculoskeletal manifestation was observed in 14% of leprosy patients and in none of the controls. Five leprosy patients had asymmetric polyarthritis of small hands joints. Nerve function impairment was observed in 22% of leprosy patients, type 1 leprosy reaction in 18%, and silent neuropathy in 16%. None of the patients and controls presented musculoskeletal pain syndromes, and the frequencies of all antibodies and cyoglobulins were similar in both groups (p > 0.05). Further analysis of leprosy patients demonstrated that the frequencies of nerve function impairment, type 1 leprosy reaction, and silent neuropathy were significantly observed in patients with versus without musculoskeletal manifestations (p = 0.0036, p = 0.0001, and p = 0.309, respectively), as well as multibacillary subtypes in leprosy (86% vs. 42%, p = 0.045). The median of physicians’ visual analog scale (VAS), patients’ VAS, pain VAS, and Childhood Health Assessment Questionnaire (CHAQ) were significantly higher in leprosy patients with musculoskeletal manifestations (p = 0.0001, p = 0.002, p = 0002, and p = 0.001, respectively).
ConclusionsThis was the first study to identify musculoskeletal manifestations associated with nerve dysfunction in pediatric leprosy patients. Hansen's disease should be included in the differential diagnosis of asymmetric arthritis, especially in endemic regions.
Avaliar o envolvimento musculoesquelético e os autoanticorpos em pacientes pediátricos com hanseníase.
MétodosForam avaliados 50 pacientes com hanseníase e 47 crianças e adolescentes saudáveis de acordo com manifestações musculoesqueléticas (artralgia, artrite e mialgia), síndromes dolorosas musculoesqueléticas (fibromialgia juvenil, síndrome de hipermobilidade articular benigna, síndrome miofascial e tendinite) e painel de autoanticorpos e crioglobulinas. Escores de avaliação de saúde e tratamento foram realizados nos pacientes com hanseníase.
ResultadosPelo menos uma manifestação musculoesquelética foi observada em 14% dos pacientes com hanseníase e em nenhum controle. Dentre os pacientes com hanseníase, cinco tinham poliartrite assimétrica das pequenas articulações das mãos. Comprometimento da função do nervo foi observado em 22% dos pacientes com hanseníase, reação tipo I hansênica em 18% e neuropatia silenciosa em 16%. Nenhum dos pacientes e controles apresentou síndromes de dor musculoesquelética e as frequências dos anticorpos e crioglobulinas foram semelhantes nos dois grupos (p > 0,05). Comprometimentos da função nervosa, reação hansênica tipo I e neuropatia silenciosa foram observados em pacientes com vs sem manifestações musculoesqueléticas (p = 0,0036, p = 0,0001 e p = 0,309, respectivamente), bem como subtipos de hanseníase multibacilar (86% vs 42%, p = 0,045). A escala visual analógica (EVA) do médico, dos pacientes, e da dor e o Questionário de Avaliação de Saúde Infantil foram maiores em pacientes com manifestações musculoesqueléticas (p = 0,0001, p = 0,002, p = 0002 e p = 0,001, respectivamente).
ConclusãoEste foi o primeiro estudo a identificar manifestações musculoesqueléticas associadas com disfunção de nervos periféricos em pacientes pediátricos. A hanseníase deve ser incluída no diagnóstico diferencial de artrite assimétrica, principalmente em regiões endêmicas.
A hanseníase é uma doença infecciosa crônica causada pela Mycobacterium leprae. É considerada um dos maiores problemas de saúde pública em países em desenvolvimento e raramente foi descrita na população pediátrica, com 6% a 14% de casos da doença,1,2 com uma média de 7% no Brasil.3
Seus sinais clínicos importantes são lesões cutâneas localizadas hipopigmentadas ou avermelhadas com perda de sensibilidade e envolvimento dos nervos periféricos.4,5 Manifestações musculoesqueléticas foram descritas em pacientes adultos6–12 com hanseníase, principalmente artrite aguda e crônica e artralgia,8 e esses envolvimentos raramente foram descritos na população pediátrica com hanseníase.13,14
Autoanticorpos também foram estudados em pacientes adultos com hanseníase, principalmente anticorpo antinuclear (ANA)9 e antifosfolípide.15 Porém, não há um estudo que tenha avaliado simultaneamente envolvimento musculoesquelético e autoanticorpos em pacientes pediátricos com hanseníase.
Portanto, este foi um estudo transversal que investigou o envolvimento musculoesquelético e autoanticorpos em pacientes pediátricos com hanseníase e controles saudáveis. Além disso, foram avaliadas as possíveis associações de manifestações musculoesqueléticas em crianças e adolescentes com hanseníase com dados demográficos, manifestações da hanseníase, escores de avaliação de saúde, autoanticorpos e tratamento.
Pacientes e métodosDe janeiro de 2010 a outubro de 2012, 56 pacientes com hanseníase foram acompanhados no Serviço de Dermatologia do Hospital Universitário Júlio Muller, Universidade Federal do Mato Grosso, Cuiabá, Brasil. Deles, 50 pacientes com hanseníase concordaram em participar do estudo. Todos os pacientes foram diagnosticados com a doença de acordo com as orientações do Programa Nacional de Hanseníase5 com os critérios de classificação de Ridley e Jopling,16 como dimorfa‐dimorfa (DD), dimorfa‐virchowiana (DV), virchowian‐virchowiana (VV), dimorfa‐tuberculoide (DT), tuberculoide‐tuberculoide (TT) ou hanseníase indeterminada (HI). O grupo de controle incluiu 47 crianças e adolescente saudáveis da Escola Estadual de 1° e 2° graus Bela Vista, Cuiabá, Mato Grosso, Brasil. O Comitê de Ética Local do Hospital Universitário Júlio Muller e Hospital das Clínicas da Universidade de São Paulo aprovaram este estudo, e foi obtido o consentimento informado de todos os participantes e responsáveis legais.
Dados demográficos e classes socioeconômicasOs dados demográficos incluíram idade atual e sexo. As classes socioeconômicas brasileiras foram classificadas de acordo com a Associação Brasileira dos Institutos de Pesquisa de Mercados.17
Manifestações musculoesqueléticasAs manifestações musculoesqueléticas foram definidas de acordo com: artralgia (dor difusa nas articulações ou sensibilidade sem evidência de inflamação); artrite (edema em uma articulação ou limitação na amplitude de movimento articular com dor nas articulações ou sensibilidade);18 e mialgia (dor ou sensibilidade muscular em um ou mais membros sem evidência de inflamação). A artrite foi classificada de acordo com o número de articulações [oligoarticular (menos de 4) e poliarticular (superior a 5)] e duração [aguda (inferior a 6 semanas) e crônica (superior ou igual a 6 semanas].18
Síndromes dolorosas musculoesqueléticasAs seguintes síndromes dolorosas foram diagnosticadas durante o exame musculoesquelético: fibromialgia juvenil,19 síndrome miofascial e tendinite.20–22 A fibromialgia juvenil foi diagnosticada de acordo com os critérios de Yunus e Masi.19 A síndrome miofascial foi diagnosticada de acordo com os pontos‐gatilho ativos, que são definidos como pontos dolorosos em bandas tensas de fibras musculares. Caso pressionados, esses pontos induzem à dor relatada, que é reprodutível e que afeta locais específicos de cada músculo.20–22
Outros achados no exame físico musculoesqueléticoA hipermobilidade articular (HA) foi diagnosticada de acordo com os critérios propostos por Beighton. A síndrome de hipermobilidade articular benigna foi definida como HA mais dor musculoesquelética e cinco dos nove critérios.23
Avaliação clínica da hanseníaseA avaliação clínica da doença foi feita de acordo com as orientações do Programa Nacional da Hanseníase.5 Comprometimento da função nervosa é uma perda clinicamente detectável da função motora, sensorial ou autonômica dos nervos periféricos. Reação hansênica tipo I (reversa) é definida como inflamação dos nervos com perda de funções sensoriais e motoras e/ou eritema e edema na lesão cutânea pré‐existente e em novas lesões. Neuropatia silenciosa é definida como comprometimento da função nervosa sem qualquer dor nos nervos ou sensibilidade. Reação hansênica tipo II (eritema nodoso hansênico) é definida como um surgimento repentino de máculas superficiais ou profundas em novos nódulos subcutâneos sensíveis.5
Escores de avaliação de saúde e tratamento de pacientes com hanseníaseTodos os pacientes com hanseníase foram avaliados com relação ao parecer global do médico, do paciente e dor, de acordo com a escala visual analógica (EVA)24 de 10cm e o Questionário de Avaliação de Saúde Infantil (Childhood Health Assessment Questionnaire [CHAQ]).25
Os dados com relação ao tratamento da hanseníase incluíram: prednisona, terapia multibacilar (rifampicina, dapsona ou clofazimina) e terapia paucibacilar (rifampicina e dapsona).5
Autoanticorpos e crioglobulinasOs exames laboratoriais foram feitos sem conhecimento dos resultados para hanseníase e manifestações musculoesqueléticas. Os seguintes autoanticorpos séricos foram medidos na inclusão no estudo: ANA (anticorpo antinuclear) por imunofluorescência indireta em células de epitelioma humano [HEp‐2 (linhagem de células tumorais derivadas de carcinoma laríngeo humano)] (GMK, USA) e corante reativo em diluição sérica ≥ a 1:80 definido como positivo; anti‐DNA dupla hélice (anti‐ds DNA) pela técnica interna de imunofluorescência indireta utilizando Crithidia luciliae como substrato (GMK, EUA), com valor de corte de 1:10; anti‐SSA e anti‐SSB por fluorimetria (Phadia, Suécia), com corte < 10,1; isotipo IgG (imunoglobulina G) e IgM (imunoglobulina M) anticardiolipina (aCL) por ensaio imunossorvente ligado à enzima (ELISA) (Phadia, Suécia) e valor de corte de 20 GPL e/ou MPL). Anticoagulante lúpico (LAC) pelo teste do veneno de víbora de Russel diluído com corte < 1,15 e testes de confirmação com corte < 1,21 (Siemens, Alemanha). A crioglobulina foi realizada pela técnica interna de imunoeletroforese em gel (Arup Laboratories, EUA). As detecções do HLA B27 e fator reumatoide (FR) foram feitas pela técnica interna de reação em cadeia da polimerase em tempo real (Arup Laboratories, EUA) e por ensaios imunoturbidimétricos com corte < 20UI/ml (Wiener, Argentina) em pacientes e controles com artralgia e/ou artrite.
Análise estatísticaOs resultados foram apresentados como média±desvio‐padrão ou mediana (faixa) para contínuo e número (%) para variáveis categóricas. Os dados foram comparados pelos testes t de Student ou Mann‐Whitney para variáveis contínuas. As diferenças das variáveis categóricas foram avaliadas pelo teste exato de Fisher. Em todos os testes estatísticos, foi estabelecido o nível de relevância a 5% (p < 0,05).
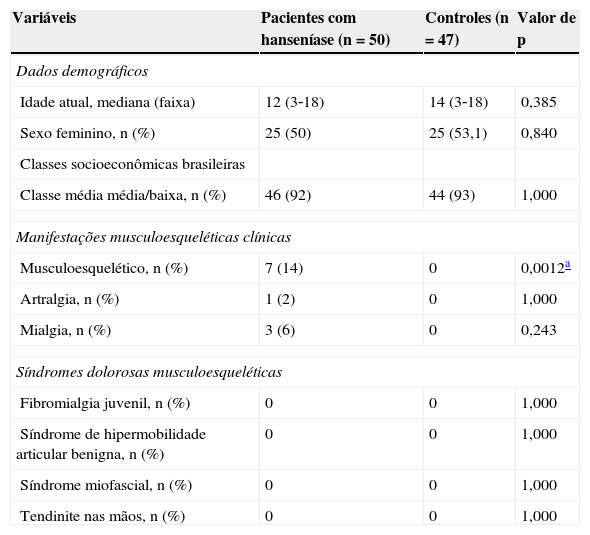
ResultadosPacientes com hanseníase e controles saudáveisManifestações musculoesqueléticas e da hanseníase e síndromes dolorosas musculoesqueléticasPelo menos uma manifestação musculoesquelética (artralgia, artrite e/ou mialgia) foi observada em 14% dos pacientes com hanseníase e nenhuma nos controles saudáveis. Apresentaram poliartrite assimétrica de pequenas articulações das mãos (articulações metacarpofalangeanas e interfalangianas proximais) cinco pacientes com hanseníase, com duração média de 12 meses (variação de 15 dias a 36 meses). Dentre os pacientes com hanseníase dimorfa, quatro apresentaram poliartrite crônica e rigidez matinal.
As manifestações de hanseníase mais frequentes foram lesões cutâneas localizadas hipopigmentadas ou avermelhadas com perda de sensibilidade, principalmente de toque e temperatura, observadas em 94% de todos os pacientes com hanseníase. Foi observado comprometimento da função nervosa em 22% dos pacientes, bem como reação hansênica tipo I em 18% e neuropatia silenciosa em 16%. Nenhum dos pacientes apresentou vasculite cutânea e reação hansênica tipo II (eritema nodoso hansênico).
Nenhum dos pacientes e controles apresentou fibromialgia juvenil, síndrome de hipermobilidade articular benigna, síndrome miofascial e tendinite nas mãos (tabela 1).
Dados demográficos, manifestações musculoesqueléticas clínicas e síndromes dolorosas musculoesqueléticas em pacientes com hanseníase e controles saudáveis
| Variáveis | Pacientes com hanseníase (n = 50) | Controles (n = 47) | Valor de p |
|---|---|---|---|
| Dados demográficos | |||
| Idade atual, mediana (faixa) | 12 (3‐18) | 14 (3‐18) | 0,385 |
| Sexo feminino, n (%) | 25 (50) | 25 (53,1) | 0,840 |
| Classes socioeconômicas brasileiras | |||
| Classe média média/baixa, n (%) | 46 (92) | 44 (93) | 1,000 |
| Manifestações musculoesqueléticas clínicas | |||
| Musculoesquelético, n (%) | 7 (14) | 0 | 0,0012a |
| Artralgia, n (%) | 1 (2) | 0 | 1,000 |
| Mialgia, n (%) | 3 (6) | 0 | 0,243 |
| Síndromes dolorosas musculoesqueléticas | |||
| Fibromialgia juvenil, n (%) | 0 | 0 | 1,000 |
| Síndrome de hipermobilidade articular benigna, n (%) | 0 | 0 | 1,000 |
| Síndrome miofascial, n (%) | 0 | 0 | 1,000 |
| Tendinite nas mãos, n (%) | 0 | 0 | 1,000 |
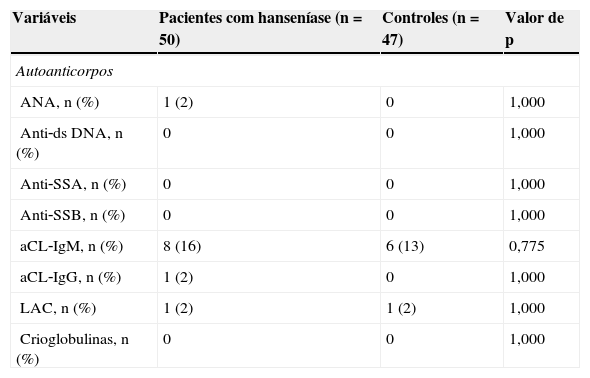
As frequências de todos os anticorpos (ANA,) e crioglobulinas foram semelhantes em pacientes com hanseníase e controles (tabela 2). O teste HLA B27 apresentou resultados negativos em todos os pacientes com artralgia e/ou artrite. O FR foi positivo em dois de cinco pacientes com artralgia e/ou artrite.
Autoanticorpos e crioglobulinas em pacientes com hanseníase e controles saudáveis
| Variáveis | Pacientes com hanseníase (n = 50) | Controles (n = 47) | Valor de p |
|---|---|---|---|
| Autoanticorpos | |||
| ANA, n (%) | 1 (2) | 0 | 1,000 |
| Anti‐ds DNA, n (%) | 0 | 0 | 1,000 |
| Anti‐SSA, n (%) | 0 | 0 | 1,000 |
| Anti‐SSB, n (%) | 0 | 0 | 1,000 |
| aCL‐IgM, n (%) | 8 (16) | 6 (13) | 0,775 |
| aCL‐IgG, n (%) | 1 (2) | 0 | 1,000 |
| LAC, n (%) | 1 (2) | 1 (2) | 1,000 |
| Crioglobulinas, n (%) | 0 | 0 | 1,000 |
ANA, anticorpo antinuclear; anti‐ds DNA, anti‐DNA dupla hélice; anti‐SSA, anticorpo anti‐SSA; anti‐SSB, anticorpo anti‐SSB; aCL, anticorpo anticardiolipina; IgM, imunoglobulina M; IgG, imunoglobulina G, LAC, anticoagulante lúpico.
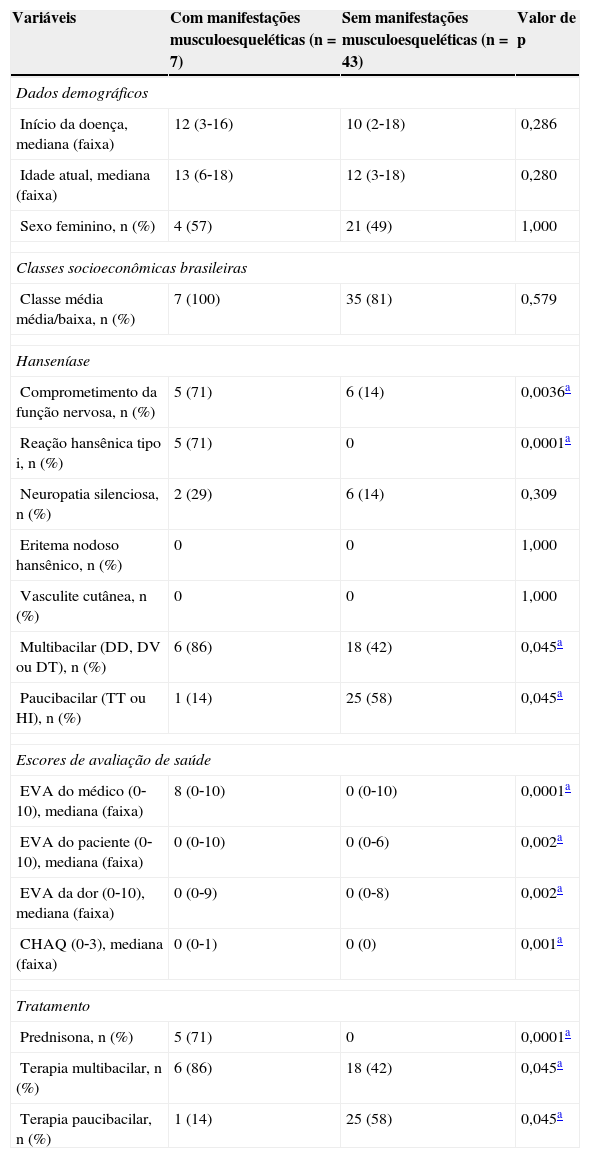
As frequências de comprometimento da função nervosa, reação hansênica tipo I e neuropatia silenciosa foram significativamente observadas em pacientes com hanseníase com manifestações musculoesqueléticas em comparação a, pacientes sem manifestações musculoesqueléticas (71% em comparação a 14%, p = 0,0036; 71% em comparação a 0%, p = 0,0001; 29% em comparação a 14%, p = 0,309, respectivamente), bem como subtipos multibacilares em pacientes com hanseníase com manifestações musculoesqueléticas (86% em comparação a 42%, p = 0,045 (tabela 3).
Dados demográficos, manifestações clínicas da hanseníase, escores de avaliação de saúde e tratamento em pacientes com hanseníase com e sem manifestações musculoesqueléticas
| Variáveis | Com manifestações musculoesqueléticas (n = 7) | Sem manifestações musculoesqueléticas (n = 43) | Valor de p |
|---|---|---|---|
| Dados demográficos | |||
| Início da doença, mediana (faixa) | 12 (3‐16) | 10 (2‐18) | 0,286 |
| Idade atual, mediana (faixa) | 13 (6‐18) | 12 (3‐18) | 0,280 |
| Sexo feminino, n (%) | 4 (57) | 21 (49) | 1,000 |
| Classes socioeconômicas brasileiras | |||
| Classe média média/baixa, n (%) | 7 (100) | 35 (81) | 0,579 |
| Hanseníase | |||
| Comprometimento da função nervosa, n (%) | 5 (71) | 6 (14) | 0,0036a |
| Reação hansênica tipo i, n (%) | 5 (71) | 0 | 0,0001a |
| Neuropatia silenciosa, n (%) | 2 (29) | 6 (14) | 0,309 |
| Eritema nodoso hansênico, n (%) | 0 | 0 | 1,000 |
| Vasculite cutânea, n (%) | 0 | 0 | 1,000 |
| Multibacilar (DD, DV ou DT), n (%) | 6 (86) | 18 (42) | 0,045a |
| Paucibacilar (TT ou HI), n (%) | 1 (14) | 25 (58) | 0,045a |
| Escores de avaliação de saúde | |||
| EVA do médico (0‐10), mediana (faixa) | 8 (0‐10) | 0 (0‐10) | 0,0001a |
| EVA do paciente (0‐10), mediana (faixa) | 0 (0‐10) | 0 (0‐6) | 0,002a |
| EVA da dor (0‐10), mediana (faixa) | 0 (0‐9) | 0 (0‐8) | 0,002a |
| CHAQ (0‐3), mediana (faixa) | 0 (0‐1) | 0 (0) | 0,001a |
| Tratamento | |||
| Prednisona, n (%) | 5 (71) | 0 | 0,0001a |
| Terapia multibacilar, n (%) | 6 (86) | 18 (42) | 0,045a |
| Terapia paucibacilar, n (%) | 1 (14) | 25 (58) | 0,045a |
DD, dimorfa‐dimorfa; DV, dimorfa‐virchowiana; DT, dimorda‐tuberculoide; TT, tuberculoide‐tuberculoide; HI, hanseníase indeterminada; EVA, escala visual analógica; CHAQ, Questionário de Avaliação de Saúde Infantil.
A mediana da EVA do médico, do paciente, da dor e CHAQ foi significativamente maior em pacientes com hanseníase com manifestações musculoesqueléticas em comparação a essas alterações (p = 0,0001; p = 0,002; p = 002; p = 0,001, respectivamente). Pacientes com hanseníase com manifestações musculoesqueléticas foram significativamente tratados com prednisona e terapias multibacilares em comparação a pacientes com essas manifestações (71% em comparação a 0%, p = 0,0001; 86% em comparação a 42%, p = 0,045) (tabela 3).
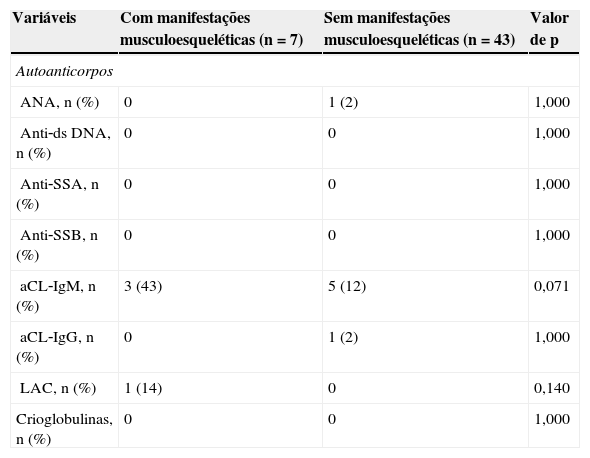
As frequências de todos os anticorpos (ANA,) e crioglobulinas foram semelhantes em pacientes com hanseníase com e sem manifestações musculoesqueléticas (tabela 4).
Autoanticorpos e crioglobulinas em pacientes com hanseníase com e sem manifestações musculoesqueléticas
| Variáveis | Com manifestações musculoesqueléticas (n = 7) | Sem manifestações musculoesqueléticas (n = 43) | Valor de p |
|---|---|---|---|
| Autoanticorpos | |||
| ANA, n (%) | 0 | 1 (2) | 1,000 |
| Anti‐ds DNA, n (%) | 0 | 0 | 1,000 |
| Anti‐SSA, n (%) | 0 | 0 | 1,000 |
| Anti‐SSB, n (%) | 0 | 0 | 1,000 |
| aCL‐IgM, n (%) | 3 (43) | 5 (12) | 0,071 |
| aCL‐IgG, n (%) | 0 | 1 (2) | 1,000 |
| LAC, n (%) | 1 (14) | 0 | 0,140 |
| Crioglobulinas, n (%) | 0 | 0 | 1,000 |
ANA, anticorpo antinuclear; anti‐ds DNA, anti‐DNA dupla hélice; anti‐SSA, anticorpo anti‐SSA; anti‐SSB, anticorpo anti‐SSB; aCL, anticorpo anticardiolipina; IgM, imunoglobulina M; IgG, imunoglobulina G; LAC, anticoagulante lúpico.
Até onde sabemos, este foi o primeiro estudo que mostrou claramente manifestações musculoesqueléticas, principalmente poliartrite assimétrica, na população pediátrica com hanseníase associadas à doença grave e comprometimento da função nervosa, sem produção de autoanticorpos.
A maior vantagem deste projeto de estudo foi a avaliação sistemática da hanseníase e das manifestações musculoesqueléticas, das síndromes dolorosas e de um painel de autoanticorpos em pacientes portadores da doença, incluindo definições padronizadas18–23 e excluindo dor periarticular,20–22 em uma população com hanseníase de um estado no Centro‐Oeste do Brasil. Além disso, incluímos um grupo de controle saudável com a mesma idade, sexo e classe socioeconômica utilizando o mesmo protocolo.
É importante ressaltar que envolvimento musculoesquelético é a terceira manifestação mais frequente em pacientes adultos com hanseníase.10 Artrite foi descrita de 4% a 79%8,10 dos adultos com hanseníase e poderá ser dividida em quatro subtipos: articulações de Charcot, artrite séptica e artrite aguda e crônica.10 A poliartrite assimétrica normalmente envolve articulações metacarpofalangeanas e articulações interfalângicas proximais e distais, como observado em nossos cinco pacientes pediátricos com hanseníase. Adicionalmente, também foi relatada poliartrite crônica das mãos mimetizando artrite reumatoide em um homem de meia‐idade com reação hansênica tipo I.10
Esse envolvimento articular geralmente é ignorado em crianças e adolescentes com hanseníase, e a poliartrite crônica poderá mimetizar doenças autoimunes pediátricas, principalmente artrite idiopática juvenil,7,13 leucemia aguda26 e lúpus eritematoso sistêmico infantil.27 Deve‐se ressaltar que essas manifestações musculoesqueléticas foram raramente relatadas nos dois casos de hanseníase que envolveram articulações periféricas e das mãos,13 e também em um caso anteriormente comprovado por nosso grupo associado a eritema nodoso.14
Síndromes dolorosas musculoesqueléticas não foram observadas em nossa população de pacientes com hanseníase e controles, assim como em nossos adolescentes saudáveis e obesos, com uma prevalência variando de 0% a 10%. Além disso, nenhum deles apresentou tendinite nas mãos associada a envolvimento articular.
Curiosamente, nenhum de nossos pacientes apresentou hipermobilidade articular, e essa anormalidade foi relatada em até 20% da população pediátrica.20,21 Essa alteração é mais frequente em crianças em idade escolar, reduzindo a prevalência em adolescentes e adultos. De fato, nossos pacientes com hanseníase e controles saudáveis eram principalmente adolescentes, e isso pode contribuir para a inexistência de hipermobilidade articular, como também observado em outro estudo de nosso grupo.22
Autoanticorpos foram raramente observados em nossos pacientes pediátricos com hanseníase. A anticardiolipina IgM foi o autoanticorpo mais frequente, tendo sido observado em 13% de nossos pacientes com hanseníase sem trombose autoimune, como também em pacientes adultos com hanseníase. Esse fato difere de nosso lúpus eritematoso sistêmico infantil, dermatomiosite juvenil28 e RASopatias,29 que apresentaram até 93%, 59% e 52% de uma variedade de autoanticorpos órgão‐específicos e não órgão‐específicos, respectivamente.
A hanseníase é uma infecção crônica granulomatosa que ocorre principalmente com manifestações cutâneas e neurológicas,4,5 como observado em nossos pacientes com e sem envolvimento musculoesquelético. É uma doença que pode afetar atividades da vida diária e a qualidade de vida relacionada à saúde em pacientes adultos,30 como observado neste trabalho.
Notavelmente, a reação hansênica tipo I com comprometimento da função nervosa está relacionada à doença grave,5 e, neste trabalho, essas anormalidades também foram associadas a manifestações musculoesqueléticas, indicando um envolvimento simultâneo dos nervos e articulações que necessitaram tratamento imunossupressor e multibacilar. Ademais, esses pacientes podem apresentar lesões articulares permanentes com deformidades de pescoço de cisne, dedo martelo e/ou desvio ulnar,10 exigindo acompanhamento rigoroso e prolongado.
Concluindo, este foi o primeiro estudo para identificar uma frequência elevada de manifestações musculoesqueléticas associadas à disfunção nervosa em pacientes pediátricos com hanseníase. A hanseníase deve ser incluída no diagnóstico diferencial de artrite assimétrica, principalmente em regiões endêmicas.
FinanciamentoEste estudo recebeu o apoio do “Doutorado Interinstitucional” (DINTER) do Departamento Pediátrico – UFMT‐FMUSP, do Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq (bolsa #302724/2011‐7 para CAS), da Bolsa Fundação Federico ao CAS e do Núcleo de Apoio à Pesquisa “Saúde da Criança e do Adolescente” da USP (NAP‐CriAd‐SP).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Agradecemos todos os colegas do Hospital Universitário de Cuiabá, Brasil, e o Dr. Ulysses Dória Filho, pela ajuda na análise estatística.
Como citar este artigo: Neder L, Rondon DA, Cury SS, Silva CA. Musculoskeletal manifestations and autoantibodies in children and adolescents with leprosy. J Pediatr (Rio J). 2014;90:457–63.