This narrative review aimed to provide practitioners a synthesis of the current knowledge on the role of a low Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols diet in reducing symptoms associated with functional abdominal pain disorders in children. This review is focused on the pathophysiology, efficacy and criticism of low Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols diet in children.
SourcesCochrane Database, Pubmed and Embase were searched using specific terms for Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols diet interventions and functional abdominal pain disorders.
Summary of the findingsIn children, only one Randomized Control Trial and one open‐label study reported positive results of low Fermentable Oligosaccharides Disaccharides Monosaccha‐rides and Polyols diet; one Randomized Control Trial showed exacerbation of symptoms with fructans in children with Irritable Bowel Syndrome; no effect was found for the lactose‐free diet whilst fructose‐restricted diets were effective in 5/6 studies.
ConclusionsIn children there are few trials evaluating low Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols in functional abdominal pain disorders, with encour‐aging data on the therapeutic efficacy particularly of fructose‐restricted diet. Additional effort sare still needed to fill this research gap and clarify the most efficient way for tailoring dietary restrictions based on the patient's tolerance and/or identification of potential biomarkers of low Fermentable Oligosaccharides Disaccharides Monosaccharides and Polyols efficacy, to maintain nutritional adequacy and to simplify the adherence to diet by labeling FermentableOligosaccharides Disaccharides Monosaccharides and Polyols content in commercial products.
Nos últimos anos, foram feitos esforços consideráveis para esclarecer o papel da dieta com baixo teor de oligossacarídeos fermentáveis, dissacarídeos, monossacarídeos e polióis (FODMAPs) para o tratamento de distúrbios gastrintestinais funcionais (DGIFs). Esta revisão narrativa teve como objetivo fornecer aos profissionais uma síntese do conhecimento atual sobre o papel de uma dieta com baixo teor de FODMAPs (BFM) na redução dos sintomas associados a distúrbios funcionais de dor abdominal (DFDA) em crianças. Esta revisão está focada na fisiopatologia, eficácia e crítica da dieta BFM em crianças.
FontesO banco de dados Cochrane, Pubmed e Embase foram pesquisados com o uso dos termos específicos para intervenções na dieta FODMAP e DFDA.
Resumo dos achadosEm crianças, apenas um estudo controlado randomizado e um estudo aberto relataram resultados positivos da dieta BFM; um estudo controlado randomizado mostrou exacerbação dos sintomas com frutanos em crianças com síndrome do intestino irritável; nenhum efeito foi encontrado para a dieta livre de lactose, enquanto dietas com restrição de frutose foram eficazes em 5/6 estudos.
ConclusõesExistem poucos estudos que avaliam BFM em DFDA em crianças, com dados encorajadores sobre a eficácia terapêutica, particularmente de dietas com restrição de frutose. Esforços adicionais ainda são necessários para preencher essa lacuna de pesquisa e esclarecer a maneira mais eficiente de adaptar as restrições dietéticas com base na tolerância do paciente e/ou identificação de biomarcadores potenciais de eficácia da BFM, para manter a adequação nutricional e simplificar a adesão à dieta, ao incluir informações sobre conteúdo de FODMAPs em rótulos de produtos comerciais.
O papel da dieta aparece cada vez mais em diferentes doenças gastrointestinais, como distúrbios gastrointestinais (GI) funcionais (DGIFs), síndrome do intestino irritável (SII), constipação, doença diverticular e doença inflamatória intestinal.1 DGIFs são distúrbios comuns caracterizados por sintomas GI crônicos ou recorrentes, que não são explicados por anormalidades bioquímicas ou estruturais.2 A patogênese dos DGIFs permanece pouco compreendida, embora recentemente uma interação alterada complexa entre intestino e cérebro tenha sido defendida.3 Na ausência de biomarcadores específicos, os DGIFs são classificados clinicamente de acordo com os critérios diagnósticos de Roma IV, baseados principalmente no histórico detalhado do paciente.4,5 Em crianças, os DGIFs podem ser classificados em três categorias principais: distúrbios de náusea e vômito, distúrbios de evacuação ou baseados em dor (como distúrbios funcionais da dor abdominal – DFDA). Os DFDA compreendem quatro distúrbios distintos: SII, dispepsia funcional, enxaqueca abdominal e dor abdominal funcional (DAF) – sem outra especificação (DAF‐SOE). Isso significa que a DAF não se ajusta ao padrão diagnóstico específico de um dos três primeiros distúrbios.6 A dispepsia funcional e a SII frequentemente ocorrem tanto em crianças como em adultos. A prevalência de SII varia de 10 a 25% dos adultos7 e 0 a 45% das crianças, respectivamente.8,9 A SII prejudica fortemente a qualidade de vida, a função social, a frequência escolar, a produtividade do trabalho e aumenta substancialmente os custos com saúde. Na patogênese dos DGIFs, diferentes mecanismos têm sido propostos e incluem: aumento da sensibilidade à dor ou hipersensibilidade visceral,10,11 motilidade intestinal anormal,12 supercrescimento bacteriano no intestino delgado,13 inflamação intestinal de baixo grau,14 infecções,15–17 fatores psicossociais,18 eventos da primeira infância,19,20 alergia à proteína do leite de vaca21,22 e eixo intestino‐cérebro desregulado.23,24 A agregação familiar de DGIFS é comumente encontrada e pode ser secundária ao aprendizado social e fatores genéticos.25 Foi descoberto recentemente que variantes gênicas que codificam dissacaridases com atividade enzimática defeituosa ou reduzida predispõem à SII em um subgrupo de pacientes adultos.26 O microbioma intestinal é também reconhecido como um ator fundamental nos DGIFs e a disbiose intestinal tem sido relatada em pacientes com SII em comparação com indivíduos saudáveis.27 A diversidade microbiana pode levar ao aumento da permeabilidade intestinal, ativação imunológica da mucosa, motilidade intestinal alterada e hipersensibilidade visceral.27 O conceito de uma relação estrita entre microbiota e imunidade, motilidade, sistema nervoso, estresse e comportamento resultou no termo conjunto “eixo microbioma‐intestino‐cérebro”. Esse eixo emergiu como o responsável pelo controle e regulação das diferentes funções GI e neurológicas.28 Nesse contexto, a importância dos eventos adversos precoces e da dieta é reconhecida há muito tempo. O período perinatal, com sua influência crucial na maturação do intestino e do cérebro, é um período crítico no qual diferentes determinantes podem predispor ao desenvolvimento de DGIFs.27
A maioria dos pacientes com DGIFs relata que seus sintomas GI estão genericamente ou especificamente relacionados à alimentação, embora evidências dessa relação sejam frequentemente difíceis de provar, particularmente em crianças.29–31 Múltiplos mecanismos de interação e confusão podem estar envolvidos na percepção da “intolerância alimentar”. Em pacientes com SII, os sintomas pós‐prandiais podem ser desencadeados por superalimentação, resposta gastrocólica hiperativa, sensibilidade visceral,32,33 disbiose, sinalização intestino‐cérebro desordenada,34 antecipação, alergias e má absorção. Na ausência de testes confiáveis de fácil acesso, fáceis de administrar, baseados em consultório, restrições dietéticas empíricas são frequentemente indicadas na ausência de intolerância comprovada, má absorção ou diagnóstico confirmado de alergias alimentares.35
Isso é relevante, pois mudanças na dieta podem interferir no metabolismo do indivíduo, na motilidade intestinal, nas secreções, na sensibilidade, na função de barreira, na microbiota intestinal36 e na nutrição adequada. Como esperado, dada a heterogeneidade dos DGIFs, o paciente individual e os fatores subjacentes, nenhum tratamento isolado mostrou‐se eficaz em todos os pacientes. Restrições dietéticas desnecessárias são uma preocupação especial em crianças em crescimento. Portanto, é de grande importância ter uma compreensão profunda das evidências por trás de cada recomendação alimentar dada às crianças, a fim de projetar planos de tratamento personalizados.
Nos últimos anos, tem havido grande interesse nos teores de oligossacarídeos fermentáveis, dissacarídeos, monossacarídeos e polióis (FODMAPs, do inglês fermentable oligosaccharides, disaccharides, monosaccharides, and polyols) na dieta para o tratamento de DGIFs em adultos e crianças. A dieta com baixo teor de FODMAPs (BFM) restringe a ingestão de vários carboidratos fermentáveis, inclusive alimentos com frutanos (trigo e cebola), galacto‐oligossacarídeos (leguminosas, repolho), lactose (produtos lácteos), frutose em excesso de glicose (peras e maçãs) e polióis de açúcar, como sorbitol e manitol (frutas com caroço e adoçantes artificiais).18 Um efeito promissor da dieta com baixo teor de FODMAP na redução de sintomas GI funcionais em pacientes adultos tem sido demonstrado,37 mas há evidências limitadas em crianças.38
Esta revisão narrativa explora a literatura disponível sobre dietas com BFM e objetiva fornecer aos profissionais uma síntese crítica da fisiopatologia, mecanismo de ação, eficácia e limites para ajudar a identificar uma intervenção feita sob medida de dieta para DFDA em crianças.
MétodosFoi feita uma pesquisa bibliográfica nas bases de dados Medline (via Pubmed), Embase e Cochrane Library, do início até agosto de 2018, com foco na dieta BFM em relação aos DFDA. Os seguintes termos foram usados: FODMAP, FODMAPs, fermentable oligosaccharides, disaccharides and monosaccharides and polyols, fermentable, poorly absorbed, short‐chain carbohydrates, lactose‐free diet, fructose, fructans, sorbitol AND functional gastrointestinal disorders, OR functional abdominal pain, recurrent abdominal pain, irritable bowel syndrome, IBS. Restringimos a pesquisa ao idioma inglês e a crianças (até 18 anos). Como o objetivo desta revisão não foi duplicar uma revisão sistemática recente sobre FODMAPs, mas rever criticamente a literatura disponível e fornecer aos médicos um resumo prático da DBF em crianças, expandimos nossa pesquisa e incluímos estudos prospectivos e retrospectivos, ensaios clínicos randomizados (ECRs), revisões e editoriais.
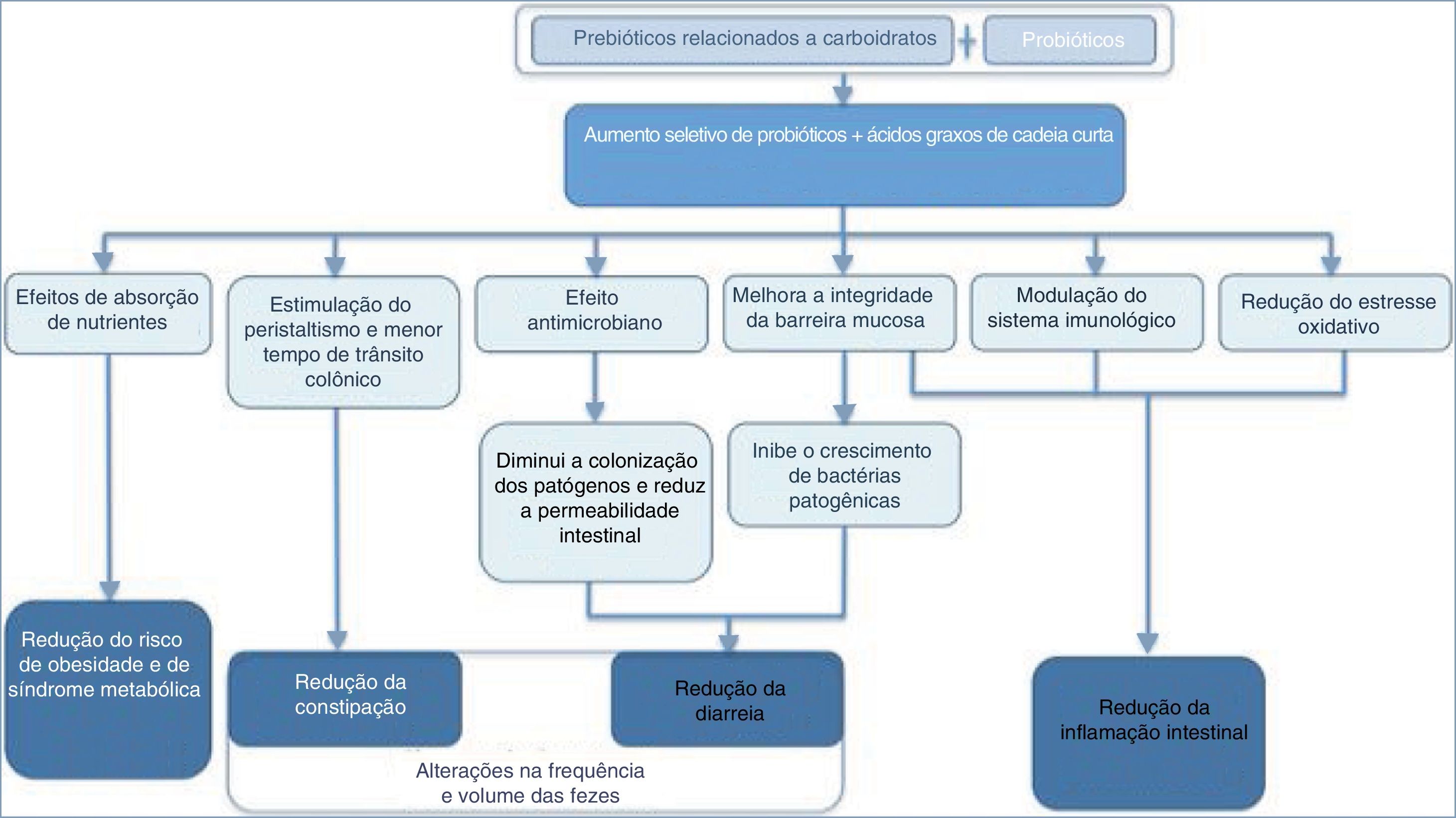
FODMAPsDurante os anos 1980 e 1990, os estudos clínicos focalizaram principalmente no papel da ingestão de lactose, frutose e sorbitol como fatores desencadeantes dos sintomas gastrintestinais, inclusive dor abdominal, desconforto, distensão abdominal e diarreia. Nos últimos anos, o foco mudou para a ingestão de fruto‐oligossacarídeos (frutanos) (FOS) e galacto‐oligossacarídeos (GOS) como possíveis culpados da SII.39 Agrupar todos esses carboidratos de cadeia curta fermentáveis e álcoois de açúcar levou à sigla FODMAPs. Absorção deficiente, atividade osmótica e fermentação rápida pelo microbioma luminal40 podem resultar em produção excessiva de gás,41 distensão luminal, fezes amolecidas e hipersensibilidade visceral, características consistentes com a SII. Além disso, o supercrescimento bacteriano do intestino delgado que pode ocorrer em alguns pacientes com SII pode aumentar o metabolismo desses carboidratos e a consequente produção de gás.39 Os sintomas relacionados aos FODMAPs também podem derivar de alterações na microbiota e metabolismo do intestino, nas células endócrinas, na função imunológica e na barreira intestinal.42–45 É interessante o fato de que uma dieta FODMAP não restritiva pode estar associada tanto com fezes amolecidas e atraso no trânsito intestinal, como com constipação, como acontece em indivíduos com microbiota produtora de metano.46,47 Além disso, a ingestão dietética de prebióticos relacionados a carboidratos (fibras) que interagem com probióticos intestinais pode ter efeitos benéficos sobre a saúde humana48,49 (fig. 1).
A dieta BFM foi desenvolvida pela primeira vez em 1999 pelo Dr. Gibson e pelo Dr. Shepard na Monash University em Melbourne. Em 2005, os mesmos autores propuseram que uma dieta rica em FODMAPs poderia perpetuar sintomas gastrointestinais (funcionais) em pacientes com doença de Crohn.50 Esse conceito logo foi extrapolado para pacientes com SII. Estudos iniciais mostraram os efeitos positivos da restrição da frutose e de frutanos de cadeia curta em adultos com má absorção de frutose. Além disso, a coingestão de frutose e glicose neutraliza o efeito prejudicial do excesso de frutose livre no intestino delgado de pacientes com SII com má absorção de frutose devido ao transporte combinado facilitado.51 Desde então, vários estudos foram conduzidos e a dieta BFM é atualmente considerada uma abordagem dietética eficaz em adultos com SII,39 particularmente quando os sintomas persistem apesar das mudanças de estilo de vida e outros aconselhamentos dietéticos.52 Os FODMAPs estão presentes em alimentos com trigo, centeio, cevada, leguminosas, lentilhas, grão de bico, couve de Bruxelas, aspargos, alcachofras, beterraba, brócolis, repolho, erva‐doce, cebola, alho, alho‐poró, quiabo, ervilha, cebolinha, maçã, pêssego, caqui, melancia e pistache.53 Uma lista de alimentos com baixo teor de FODMAPs é mostrado na tabela 1.54–59
Lista de alimentos com baixo teor de FODMAPs
| Nutrientes | Baixo teor de FODMAPs |
|---|---|
| Cereais | Produtos sem glútena, arroz, massa feita de milho, tortilla chips, quinoa, aveia, farinha de milho, pão sovado, macarrão |
| Produtos lácteosQueijo | Produtos sem lactose, leite de arroz, leite de soja, sorvetes à base de águaQueijos duros, cheddar, parmesão, muçarela, suíço, tofu firme, tempeh, brie, camembert |
| Frutas | Bananas, melão cantalupo, carambola, durião, melão, kiwi, laranja, maracujá, mamão, todos os frutos silvestres (framboesas, mirtilos, amoras, morangos) exceto amoras, tangelo, uva, toranja, todas as castanhas (exceto castanha de caju e pistache e menos de 10), amêndoas (mas menos de 10), macadâmia, azeitonas, sementes de abóbora, sementes de linho e de chia, coco, limão siciliano, limão Taiti, mamão papaia, ruibarbo |
| Vegetais | Brotos de bambu, bok choy, pimenta, aipo, cebolinha, choko, choy sum, milho, berinjela, feijão verde, brotos de feijão, alface, nabo, abóbora, acelga, tomate, batatas, cebolinha (parte verde apenas), óleo com infusão de alho, pimentão, acelga suíça, cenoura, espinafre, abobrinha, beterraba (não mais de quatro fatias), brócolis (não mais que 1/2 xícara) |
| Leguminosas | Abóbora enlatada, grão‐de‐bico enlatado, lentilhas enlatadas |
| Adoçantes | Néctar, xarope de milho dourado, xarope de bordo, glicose, sacarose (açúcar de mesa), aspartame, estévia, melaço, quaisquer edulcorantes que não contenham frutose e que não terminem em “‐ol” |
| Referências | Khan et al., 201554; Barrett, 201755; Varney et al., 201756; Monash University Low FODMAP Diet app., 201657; Canadian Digestive Health Foundation, 201958; Magge & Lembo, 201259 |
Observação: A composição dos FODMAPs é afetada por técnicas de processamento de alimentos. Processos que envolvem aquecimento e água podem reduzir o teor de FODMAPs solúveis em água (como os frutanos e GOS) e infiltrando o líquido circundante (leguminosas enlatadas têm teor mais baixo de FODMAPs, GOS, do que leguminosas cozidas). As porções também devem ser consideradas, porque uma ingestão excessiva pode aumentar o conteúdo de FODMAPs da dieta (ou seja, amêndoas e outras nozes, se em menor quantidade do que 10 unidades, são pobres em FODMAPs; bananas grandes têm maior teor de FODMAPs). Os produtos sem glúten têm baixo teor de FODMAPs, exceto se contiverem mel ou adoçantes à base de frutose ou polióis.
Um estudo em pacientes íleo‐ostomizados esclareceu que a carga fermentável e o volume de líquido fornecido ao intestino grosso aumentam com FODMAPs.40 A microbiota intestinal fermenta rapidamente os carboidratos, resulta em distensão luminal e dor abdominal em adultos com hipersensibilidade visceral. Um estudo cintilográfico demonstrou que a ingestão de frutose‐sorbitol reduziu o tempo de trânsito orocecal em aproximadamente três horas em indivíduos saudáveis.60 Outros estudos mostraram que os FODMAPs podem alterar a composição da microbiota, diminuir a histamina urinária61 e aumentar a citocinas pró‐inflamatórias62 e a nocicepção visceral.63 Uma dieta rica em FODMAPs (RFM) aumentou as bactérias Gram‐negativas fecais de ratos, elevou os lipopolissacarídeos, induziu a disfunção da barreira intestinal e a hipersensibilidade visceral.63 Uma dieta BFM de quatro semanas foi capaz de reverter essas manifestações, melhorar os sintomas da SII e reduzir os níveis de lipopolissacarídeos fecais. A administração intracolônica de sobrenadante fecal de pacientes com SII em ratos causou hipersensibilidade visceral nos animais, não transferida se os pacientes estivessem em dieta BFM.63
A dieta BFM: passos práticosA dieta BFM pode ser implantada com duas abordagens diferentes: bottom‐up, ou de baixo para cima e top‐down, ou de cima para baixo.64 A abordagem bottom‐up é uma eliminação gradual progressiva de produtos individuais (ou grupos de produtos) da dieta até o alívio dos sintomas e permite especificar o limite de tolerância do paciente aos FODMAPs. Esse método é preferido em pacientes: (1) que ainda não foram diagnosticados com SII, mas apresentam sintomas sugestivos que afetam sua qualidade de vida; (2) quem já seguem outra dieta de eliminação; ou (3) que têm dificuldade de seguir uma dieta BFM completa.65 A segunda abordagem, a top‐down, mais comumente usada em estudos experimentais, requer redução ou eliminação transitória de todos os alimentos ricos em FODMAPs da dieta, é portanto muito mais restritiva. Subsequentemente, os produtos contendo FODMAPs são gradualmente reintroduzidos na dieta.65,66
Há três fases distintas na dieta BFM: eliminação, determinação das sensibilidades e personalização.36,67,68 A maioria dos estudos conduzidos sobre a dieta BFM se concentra na fase de eliminação, geralmente prescrita por duas a seis semanas, seguida pela avaliação da melhoria dos sintomas. Após completar a primeira fase da restrição de FODMAPs, se uma resposta terapêutica for alcançada, os pacientes devem passar por uma fase de reintrodução estruturada (idealmente com a ajuda de um nutricionista) para determinar o tipo e quantidade de FODMAPs que podem ser tolerados antes de sentir sintomas, cria‐se assim uma dieta BFM personalizada.67 Com essa abordagem, baseada em restrições dietéticas personalizadas demonstradas pela tolerância do paciente, é mais provável que a adequação nutricional seja mantida e as alterações da microbiota luminal podem ser parcialmente compensadas.69
Orientações sobre o conteúdo de FODMAPs está disponível em publicações científicas e leigas para muitos tipos de alimentos70 e a maioria das informações e análises origina‐se na Austrália.71 A discordância do conteúdo de FODMAPs nas listas de alimentos de outros países pode estar parcialmente relacionada à falta de orientação clara do conteúdo de FODMAPs em diferentes áreas geográficas.72 Chumpitazi et al.70 encontraram um conteúdo excessivo de FODMAPs em vários alimentos processados, antes considerados alimentos BFM, tais como produtos assados sem glúten e bebidas processadas. Além disso, no pão sem glúten fabricado na Austrália, o teor de frutose é, por vezes, mais elevado do que nos seus equivalentes sem glúten.73 A avaliação adequada de FODMAPs e frutose e/ou frutanos pode ser útil para pacientes com tolerância diferente a diferentes carboidratos.74 O desenvolvimento de tecnologias que permitam a redução de FODMAPs em alimentos processados também é recomendado.64
Críticas à dieta com baixo teor de FODMAPsApesar da eficácia demonstrada da dieta BFM em um subgrupo de pacientes com SII, múltiplas preocupações têm sido levantadas.64,75 Essas incluem: (1) a falta de ensaios randomizados, controlados por placebo e de alta qualidade em crianças76–78; (2) a complexidade e dificuldade de ensinar a dieta; (3) a falta de pontos de corte específicos para o conteúdo de FODMAPs; (4) a escassez de dados sobre segurança e eficácia em longo prazo e (5) seu efeito sobre a microbiota intestinal.79
Além do impacto na ingestão de nutrientes, a dieta BFM pode ter impactos psicossociais. Os pacientes relataram achar a dieta “muito difícil de seguir”80 e um estudo com questionário relatou dificuldade de comer fora e viajar naqueles que seguem uma dieta com baixo teor de FODMAPs em longo prazo.81
Por outro lado, foram demonstrados os efeitos benéficos da dieta BFM sobre a qualidade de vida.82,83 Apesar da complexidade percebida ao seguir uma dieta tão restritiva,83 57% dos pacientes relataram alívio adequado dos sintomas. De 90 pacientes incluídos em um estudo observacional prospectivo, 60% afirmaram que a dieta BFM era fácil de seguir.84
Em termos de segurança, as principais preocupações consideram possíveis deficiências nutricionais, particularmente durante a fase inicial de eliminação de alimentos ricos em FODMAPs.79 A ingestão reduzida de grãos, frutas, vegetais e produtos lácteos pode restringir as escolhas dietéticas e pode resultar, especialmente em crianças em crescimento, em perda de peso, déficit de crescimento, risco de deficiência de fibras e micronutrientes (principalmente ferro, cálcio, retinol, tiamina e riboflavina)83,85–87 e distúrbios alimentares, como maus hábitos alimentares e aversões alimentares. No maior ECR sobre dietas BFM,79 a ingestão de energia não foi diferente daqueles que seguiam uma dieta normal, a mudança no peso corporal foi mínima (média < 0,5kg) e não foi diferente entre os dois grupos.83,85 Por outro lado, dois outros ECRs de quatro semanas relataram redução na ingestão de energia no grupo BFM.44,86,87 Além disso, alguns vegetais ricos em FODMAPs (por exemplo, couve‐flor, cebola, alho) contêm antioxidantes naturais, tais como flavonoides, carotenoides e vitamina C; algumas frutas e amoras contêm ácido fenólico e antocianinas e o trigo é uma fonte importante de ácidos fenólicos.88,89 No entanto, um recente estudo de acompanhamento não demonstrou inadequação nutricional após o período de reintrodução em pacientes com SII seguindo uma dieta “FODMAP adaptada”.69 Além disso, os dois únicos estudos de longo prazo em pacientes com SII que seguiam uma dieta FODMAPs personalizada com reintrodução de FODMAPs de acordo com a tolerância dos pacientes descobriram que o cálcio,81,82 o ferro e outros micronutrientes81 não foram comprometidos em um período de 6‐18 meses.
Dois ensaios clínicos randomizados em adultos com SII29,86 e um pequeno estudo não controlado em pacientes com sintomas gastrointestinais induzidos por radiação80 relataram reduções na ingestão de fibras durante a dieta BFM em comparação com a linha basal. A substituição inadequada de grãos, frutas e vegetais ricos em FODMAPs por substitutos adequados de BFM/alto teor de fibras poderia explicar esses achados. Além disso, outro grande ECR não encontrou diferença na ingestão de fibras ou macronutrientes após uma dieta BFM de quatro semanas em SII.85 O impacto nutricional pode variar principalmente devido à oferta de opções alimentares e à integralidade das orientações nutricionais fornecidas.
Sobre a influência da dieta no microbioma intestinal, espécies consideradas benéficas para a saúde do hospedeiro, como as bifidobactérias e Faecalibacterium prausnitzii, estavam reduzidas em pacientes com SII que receberam uma dieta BFM, provavelmente como consequência da redução da ingestão de prebióticos.34 A abundância de várias bactérias (Faecalibacterium prausnitzii, Actinobacteria e Bifidobacterium) reapareceu após 10 dias de suplementação com FOS62 e a diversidade de cepas não diminuiu com a restrição de FODMAPs em quatro estudos.61,87,90,91 Além disso, Staudacher et al.83 descobriram que a redução de Bifidobacterium induzida por uma dieta BFM foi neutralizada através de um preparado probiótico específico com bifidobactérias.
Evidências para o uso de dietas BFM para o manejo de sintomas gastrointestinais em adultosUma recente revisão sistemática38 descobriu que, em 12 dos 13 estudos em adultos, uma dieta com restrição de FODMAPs foi uma intervenção dietética eficaz para reduzir os sintomas da SII. No entanto, um ECR recente mostrou que embora a dieta BFM tenha reduzido os sintomas da SII, ela não foi melhor do que o aconselhamento dietético tradicional.44 Outro estudo descobriu que a proporção de indivíduos que relataram alívio adequado dos sintomas da SII‐D em ≥50%) durante as semanas 3 e 4 não diferiram significativamente daqueles que não receberam a dieta BFM.87
Em atletas com histórico autorrelatado de estresse gastrointestinal associado a exercício persistente, uma dieta BFM de curto prazo resulta em menos sintomas GI diários, em comparação com uma dieta com alto teor de FODMAPs.92
Evidências para o uso de dietas BFM para gerenciar os DFDA em criançasA busca na literatura pediátrica recuperou 156 registros e, de acordo com os critérios de inclusão selecionados, 24 registros foram incluídos nesta revisão (fig. S1).
Evidências de dieta BFM abrangente em crianças com DFDAO resumo dos estudos em crianças é mostrado na tabela 2.
Características dos estudos pediátricos sobre FODMAPs incluídos na revisão
| Estudo | Metodologia | Participantes | Intervenção | Duraçãoda dieta | Medidas de desfecho e instrumentos | Resultados‐chave |
|---|---|---|---|---|---|---|
| Chumpitazi et al., 201493 | Estudo prospectivo aberto | Crianças de 7 a 17 anos(n = 8) com SII | Dieta com baixo teor de FODMAPs | 7 dias | Frequência de episódios de dor; Instrumentos: diários de evacuações e de dor | Redução significativa (p < 0,05) da frequência da dor, da intensidade da dor e da interferência relacionada à dor nas atividades. Redução de >50% na frequência de dor abdominal foi obtida com a BFD em quatro crianças (50%) identificadas como respondedoras |
| Chumpitazi et al., 201590 | Estudo randomizado, duplo‐cego, cruzado, com período de wash‐out | Crianças de 7 a 17 anos(n = 33) com SII | Baixo teor de FODMAPsvs. dieta DTIA | 2 dias | Frequência de episódios de dor em crianças; Instrumentos: diário de evacuações e dor | 16 crianças foram inicialmente tratadas com a dieta com baixo teor de FODMAPs, enquanto 17 começaram com a DTIA; crianças com baixo teor de FODMAPs relataram uma diminuição nos episódios diários de dor abdominal vs. crianças seguindo a DTIA [1,1 ± 0,2 (EPM) vs. 1,7 ± 0,4 episódios de dor por dia, respectivamente;p < 0,05]. |
| Chumpitazi et al., 2018108 | Estudo duplo‐cego, cruzado, controlado por placebo (maltodextrina) com wash‐out | Crianças com média de idade de 12,4 +2,2 y(n = 23) e SII | Frutanos ou maltodextrina (0,5 g/kg; máximo, 19 g) | 3 dias | Frequência de episódios de dor em crianças; Instrumentos: diários de dor e evacuações e diário alimentar | A dieta contendo frutanos foi associada com inchaço e flatulência significativamente mais graves e mais episódios médios de dor abdominal / dia (3,4 ‐ 2,6) em comparação com a dieta com maltodextrina (2,4 ‐ 1,7) (p < 0,01).Dor abdominal mais frequente na dieta contendo frutanos foi relatada por 18 crianças (78,2%) e 12 (52,2%) qualificadas como sensíveis a frutanos (definida como um aumento de ≥30% da frequência de dor abdominal após a ingestão de frutanos); |
| Däbritz et al., 2014124Dearlove et al., 1983109 | Estudo retrospectivoEstudo prospectivo | Crianças de 3 a 18 anoscom DAR(n = 206)Crianças com idade > 3 anos com DAR (n = 39) | Dieta com restrição de lactose, frutose e/ou sorbitolDieta com restrição de lactose | Mais de 12 meses em 55 pacientes [47%]2 semanas | Melhoria dos sintomas;Instrumentos: questionário de acompanhamentoMelhoria dos sintomas;Instrumentos: não especificados | A má absorção de sorbitol foi diagnosticada em 109/146 (75%) crianças; 27/31 (87%) apresentaram melhoria com uma dieta com restrição ao sorbitol.55/142 (39%) crianças apresentaram má absorção de frutose. O número de crianças que responderam especificamente a uma dieta com restrição de frutose é incerto, devido a vários pacientes nessa coorte terem sido submetidos a múltiplos testes positivos de carboidratos.Um terço das crianças relatou benefício da dieta isenta de lactose, mas nenhuma correlação foi encontrada com os resultados do teste de tolerância à lactose, estimativa do hidrogênio respiratório ou resposta aos testes de tolerância à lactose. |
| Escobar et al., 2014131 | Estudo retrospectivo | Crianças de 2 a 19 anos com DAR(n = 222) | Dieta com baixo teor de frutose | 2 meses (não claramente especificado) | Melhoria dos sintomas; Instrumentos: escore na escala de dor | 93/121 pacientes (76,9%) com positividade no BHT relataram resolução dos sintomas com uma dieta de baixo teor de frutose (p < 0,0001) em comparação com 55/101 pacientes (54,4%) com BHT negativo para frutose (p = 0,37) |
| Gijsbers et al., 2012122 | Estudo prospectivo com teste de tolerância DCCP | Crianças de 4 a 16 anos com DAR (n = 220) | Dieta com baixo teor de lactose e/ou frutose | 3 dias de teste de tolerância | Resolução de dor abdominal com eliminação, recorrência com teste de tolerância e desaparecimento com re‐eliminação; Instrumentos: não especificados | A dor foi resolvida após a eliminação em 24 / 38 pacientes com má absorção de lactose e em 32 / 49 com má absorção de frutose. Um resultado positivo no teste de tolerância aberto com lactose e frutose foi relatado em 7 / 23 e 13 / 31 pacientesTeste de tolerância DCCP feito em 6 / 7 e 8 / 13 pacientes, foi negativo em todos, mas algumas crianças continuaram a relatar sintomas abdominais após a ingestão de leite ou frutose |
| Gomara et al., 2008128 | Estudo prospectivo | Crianças de 7 a 17 anos(n = 32) DGIFs | Dieta com baixo teor de frutose e sorbitol | 2 semanas | Melhora nos sintomas GI; Instrumentos: não especificados | 9 de 11 pacientes (81%) com resultados positivos no teste de frutose exalada relataram melhoria quase imediata nos sintomas GI, mas houve uma redução significativa apenas para dor e inchaço abdominal (p < 0,05) |
| Gremse et al., 2003111 | Estudo randomizado, duplo‐cego, cruzado | Crianças de 3 a 17 anos com DAR(n = 30) | Leite contendo lactose hidrolisada ou lactose | 14 dias | Melhora nos sintomas GI; Instrumentos: registros diários | Um aumento significativo na dor abdominal foi experimentado pelos participantes do estudo durante o período de ingestão de lactose, quando comparado com o período sem lactose (escores totais 7,5 + 2,7 vs. 4,1 + 1,4, p = 0,021) |
| Hammer et al., 2018130 | Estudo prospectivo | Crianças com DAR, com histórico sugestivo de possível associação dos sintomas com ingestão de frutose (n = 82) | Teste de ar exalado com frutose com o uso de 1g / kg de peso corporal até o máximo de 25 g | ‐ | Gravidade dos sintomas clínicos. Instrumentos: questionário de sintomas | Um total de 33 crianças (40%) apresentava má absorção; a ingestão de frutose induziu sintomas em 31 (38%), mas somente 15 (46%) com má absorção foram sintomáticos; a má absorção de frutose não se correlacionou significativamente com os sintomas induzidos pela frutose; sintomas clínicos se correlacionaram apenas com sintomas experimentados durante o teste de ar exalado (p < 0,001, r2 = 0,21), mas não com má absorção (NS) |
| Iacovou et al., 201898 | Estudo intervencionista, cego e aberto | Mães com amamentação exclusiva e seus bebês entre 2 e 17 semanas que preencheram os critérios de Wessel para cólica infantil (n = 18) | Dieta materna com baixo teor de FODMAPs | 7 dias | Duração do choro do bebê (minutos),Instrumentos:diário do dia‐a‐dia dos bebês | Durações de choro e agitação do bebê caíram 73 [301–223] min (n = 13; p = 0,007), bem como episódios de choro (p = 0,01) e durações de agitação (p = 0,011). Bebês “muito mais satisfeitos” foram relatados no fim do estudo por suas mães |
| Lebenthal et al., 1981110 | Estudo prospectivo | Crianças de 6 a 14 anos(n = 69) DAR | Dieta com baixo teor de lactose | 12 meses | Melhora na DAR;Instrumentos: diário de sintomas | Os sintomas de RAP foram resolvidos em 40% de não‐absorvedores de lactose, em 38,4% de absorvedores de lactose após 12 meses de dieta de eliminação e em 41,7% de absorvedores de lactose seguindo uma dieta regular |
| Wintermeyer et al., 2012129 | Estudo prospectivo | Crianças de 3 a 14 anos(n = 75) com DAR | Dieta com baixo teor de frutose e sorbitol | 4 semanas | Melhoria da frequência e intensidade da dor abdominal; Instrumentos: questionário não padronizado | Foi relatada uma redução mediana da frequência semanal de dor, de uma média de 3,64 + 1,6 antes da dieta para uma média de 1,46 + 1,4 (p < 0,001) sob restrição de frutoseA intensidade mediana da dor diminuiu de 6 (média de 5,83 + 2,0) antes da intervenção para 3 (média de 3,4 + 2,5; p < 0,001) com a dieta. Uma melhoria significativa da frequência diária de evacuações, náuseas, problemas de sono, dias escolares perdidos também foram relatados com a dieta |
| Wirth et al., 201497 | Ensaio intervencionista prospectivo, cego e randomizado | 103 crianças com DAR:51 com dieta restrita (grupo A), 52 com dieta padrão (grupo B) | Dieta com restrição de frutose vs. dieta padrão | 2 semanas | 1. Intensidade da dor (medida pelo questionário)2. Frequência de dor (como acima)3. “escore de sintomas secundários” (SSS) criado a partir de 8 parâmetros (náuseas, vômitos, fadiga, distúrbios do sono, dor de cabeça, tontura, anorexia e uso de analgésicos). | Houve uma diminuição significativa no escore de dor (de uma média de 5,5 a 4) no grupo A e não houve alterações significativas no grupo B (5,3 a 5) duas semanas após a intervenção. A frequência de dor abdominal diminuiu em ambos os grupos, mas sem diferença significativa, enquanto o SSS melhorou apenas no grupo A, da mediana de 6 a 3,5 |
BHT, teste respiratório de hidrogênio expirado; DAR, dor abdominal recorrente; DBF, dieta com baixo teor de FODMAPs; DCCP, estudo duplo‐cego controlado por placebo; DTIA, dieta típica da infância americana; SII, síndrome do intestino irritável.
Em um estudo aberto,93 feito em uma pequena amostra de oito crianças com SII, a gravidade da dor abdominal, a intensidade e a interferência com as atividades da vida diária foram significativamente reduzidas após uma semana de dieta BFM. Quatro das oito crianças tiveram uma redução de ≥ 50% na frequência de dor abdominal em comparação com a linha basal.93 Em um estudo randomizado duplo‐cego cruzado,90 33 crianças com SII foram randomizadas para receber uma dieta BFM (0,15g/kg/dia, máximo de 9g/dia de FODMAPs) ou uma dieta típica da infância americana (DTIA) com 0,7g/kg/dia (máximo 50g/dia) de FODMAPs por 48 horas. Após o período de washout de cinco dias, as crianças foram “cruzadas” para a outra dieta por mais 48 horas. Crianças que receberam uma dieta BFM relataram número significativamente menor de episódios diários de dor abdominal em comparação com crianças após DTIA. As crianças que apresentaram uma melhoria significativa na dieta BFM tinham um perfil distinto de microbiota, mostraram uma maior capacidade metabólica sacarolítica (por exemplo, Bacteroides, Ruminococcaceae, Faecalibacterium prausnitzii). Nenhuma diferença na diversidade α (número de unidades taxonômicas operacionais, isto é, número de espécies) foi encontrada após uma dieta BFM de uma semana. Em um editorial subsequente,94 os autores levantam a hipótese de que um tamanho de efeito maior poderia ter sido encontrado com um estudo mais longo que comparasse a BFM e a dieta típica da infância americana.
Um estudo recente em adultos com SII confirmou que os níveis pré‐tratamento de marcadores de DNA microbiano intestinais selecionados (níveis mais elevados de Bacteroides fragilis, Acinetobacter, Ruminiclostridium, Streptococcus e Eubacterium) foram associados a maior probabilidade de responder à restrição de FODMAPs.95
Duas revisões recentes38,96 destacaram os dados limitados disponíveis em crianças90,97 e a necessidade de futuros estudos maiores e de alta qualidade para testar a eficácia da dieta BFM.
Um recente estudo cego pediátrico de prova de conceito, intervencionista e aberto98 avaliou a eficácia de uma abordagem alternativa e inovadora. Neste estudo, 18 bebês nascidos a termo em amamentação exclusiva, entre 2‐17 semanas, que preencheram critérios para cólica infantil e suas mães, foram recrutados para um estudo de intervenção dietética. As mães dos bebês receberam uma dieta BFM de sete dias e completaram o Baby Day Diary (Diário do Dia a Dia dos Bebês) nos dias 5‐7 para avaliar os resultados do estudo clínico e usaram um cronômetro para medir a duração do sono, alimentação, choro, agitação e tempo acordado e satisfeito.
O conteúdo de FODMAPs no leite materno e amostras fecais infantis para pH foram analisados no início e no fim da intervenção dietética. A duração do choro diminuiu em 52 minutos em comparação com os valores basais [142 minutos] no fim do estudo dietético. Uma redução significativa na duração da agitação e no número de episódios de choro também foi relatada. A análise do teor de lactose do leite materno mostrou‐se estável durante toda a intervenção. O pH das fezes dos bebês permaneceu inalterado em relação aos valores basais. Apesar da falta de evidências, muitas mães que amamentam tendem a praticar uma mudança na dieta como uma estratégia comum para aliviar os sintomas da cólica de seus filhos,99–102 em alguns casos evitam alimentos produtores de gás (por exemplo, cebola, alho, repolho ou leguminosas).101,102
Dietas restritas, como a dieta LFM, tanto em mães que amamentam quanto em crianças em crescimento, precisam ser conduzidas e supervisionadas adequadamente, e após consulta com um nutricionista especializado, pois pode levar não apenas ao comprometimento da adequação nutricional, mas também ao desenvolvimento de maus comportamentos alimentares e fobias alimentares.
Estudos relacionados a frutanos em crianças com DFDAOs frutanos são FODMAPs comumente presentes na dieta habitual de adultos e crianças.103 Os frutanos são ricos em ligações frutosil‐frutose que chegam intactas ao intestino, uma vez que não podem ser hidrolisadas por enzimas humanas.103–105 Esses oligossacarídeos sofrem fermentação colônica, aumentam a produção de gás e a distensão luminal subsequente que podem exacerbar os sintomas em indivíduos com SII.42,106 No entanto, limitar os frutanos pode reduzir a ingestão de alimentos saudáveis (i.e. fibras) e bifidobactérias.104,107
Em um recente estudo cruzado duplo‐cego, randomizado, controlado por placebo,108 23 crianças com SII completaram diários basais de dor abdominal e de evacuações por uma semana e diários alimentares de três dias. Escores de depressão, ansiedade e somatização foram medidos através de questionários validados. As crianças foram aleatoriamente designadas para receber refeições com ou frutanos ou maltodextrina (0,5g/kg; máximo de 19g) por 72 horas, seguido por um período de washout de pelo menos 10 dias.
A produção de hidrogênio e metano na respiração foi testada no início e durante cada período do estudo. Indivíduos sensíveis e não sensíveis a frutanos foram semelhantes nos sintomas basais e dieta, avaliação psicossocial, subtipo de SII e produção de gás. Houve um número significativamente maior de episódios diários de dor abdominal, inchaço mais grave e flatulência durante a dieta com frutanos em comparação com a dieta com maltodextrina. A produção de hidrogênio (mas não de metano) foi significativamente maior durante o período de frutanos).
Estudos relacionados à lactose em crianças com DFDATrês ECRs sobre uma dieta com restrição de lactose foram concluídos109–111 em crianças com DFDA,112 bem como um maior número de ensaios observacionais ou não controlados.113–124 A maioria dos estudos mais antigos foi feita com a terminologia antiga de dor abdominal recorrente (DAR). Dois dos três ECRs sobre dieta isenta de lactose feitos em crianças com DAR109,110 foram avaliados através de uma Revisão Cochrane125 e incluídos em uma revisão sistemática por Rutten et al.126
Lebenthal et al.110 estudaram o efeito da intolerância à lactose em DAR através de um tratamento não controlado e um teste de tolerância controlado randomizado. Das 69 crianças com intolerância à lactose 38 receberam fórmula infantil com lactose ou sem lactose por seis semanas. A ingestão de lactose aumentou os sintomas em 48% das crianças com má absorção de lactose e 24% dos absorvedores de lactose. Das 69 crianças, 40 continuaram com dieta livre de lactose por 12 meses. Após 12 meses, a melhoria da dor abdominal foi semelhante nos dois grupos, independentemente de serem absorvedores ou portadores de má absorção de lactose (40% vs. 38%).
Em outro estudo duplo‐cego com desenho cruzado, feito em 39 crianças com DAR,109 as crianças foram orientadas a continuar com a dieta habitual nas duas primeiras semanas, enquanto na terceira e quarta semanas elas receberam uma dieta livre de lactose e durante a quinta e sexta semanas receberam aleatoriamente ou lactose (2g/kg) ou um placebo com sabor similar. Relatou‐se que um terço das crianças foi beneficiado pela dieta sem lactose, mas não houve correlação entre a melhoria e os resultados do teste sanguíneo de tolerância à lactose, teste do hidrogênio no ar expirado ou resposta clínica ao teste de tolerância à lactose.
Em 2003, Gremse et al.111 fizeram um estudo randomizado, duplo‐cego, cruzado. Trinta crianças, entre três e 17 anos, com DAR e má digestão de lactose definida por um aumento > 10ppm no teste respiratório de hidrogênio expirado, receberam leite com lactose‐hidrolisada ou leite com lactose por duas semanas. Os escores de dor abdominal, inchaço, flatulência e diarreia foram semelhantes nos indivíduos que apresentaram aumento >10ppm ou >20ppm no teste respiratório de hidrogênio expirado após a ingestão de lactose. Devido aos resultados conflitantes dos estudos acima, outros ECRs prospectivos são necessários para esclarecer a eficácia de uma dieta com restrição de lactose em crianças com DGIFs‐DA que apresentam má absorção de lactose,93 ao passo que, de acordo com uma recente revisão sistemática,38 as evidências atuais da literatura não encorajam o uso de dieta com restrição de lactose em todas as crianças com SII. Dados em estudos com adultos também são inconclusivos e ainda não está claro se a má absorção de lactose é parte dos sintomas da SII ou se as duas condições podem simplesmente coexistir em alguns pacientes.38
Estudos relacionados à frutose em crianças com DFDAA frutose é um monossacarídeo, do qual as crianças americanas consomem uma média de 54,7g/dia (representa aproximadamente 10% de sua ingestão calórica diária).127 A frutose é dependente do transportador de glicose 5 (GLUT5) e do transportador de glicose 2 (GLUT2) para absorção passiva.112 Um estudo prospectivo sobre o efeito da dieta com baixo teor de lactose e/ou frutose,116 quatro estudos prospectivos sobre o efeito de uma dieta com baixo teor de frutose97,128,129 ou ingestão de frutose130 e dois estudos retrospectivos124,131 sobre o efeito de uma dieta de baixo teor de frutose foram feitos em crianças (tabela 2).
Em um estudo prospectivo controlado,97 103 crianças com DGIFs‐DA foram randomizadas para uma dieta com restrição de frutose (n = 51) ou grupo sem intervenção dietética (n = 52) por duas semanas. Menor intensidade de dor abdominal, mas não menor frequência, foi relatada pelas crianças que recebiam a dieta com restrição de frutose (independentemente do resultado do teste respiratório para frutose). Em um estudo observacional prospectivo,129 75 crianças com DGIFs‐DA e teste respiratório positivo para frutose em uma dieta com restrição de frutose mostraram uma redução geral na frequência de dor abdominal e na gravidade da dor.129 Gomara et al.128 fizeram o teste respiratório para frutose com várias doses de frutose, inclusive 1g, 15g e 45g em 32 crianças com DGIFs‐DA. Eles descobriram que 11 (34%) das 32 crianças estudadas apresentavam má absorção de frutose com as doses de 15 ou 45g. Após uma dieta com restrição de frutose de duas semanas, recomendada por nutricionista, nove das 11 crianças (82%) apresentaram uma melhoria significativa.128
Recentemente, um estudo de 82 crianças com distúrbios funcionais da dor abdominal cujo histórico era sugestivo de uma possível correlação com a ingestão de frutose revelou que apenas 40% delas apresentavam má absorção definida pelo aumento do hidrogênio exalado e apenas metade delas com má absorção eram sintomáticas. Os autores sugeriram que a hipersensibilidade visceral, em vez da má absorção em si, pode se correlacionar com os sintomas em alguns pacientes.130 Escobar et al.131 fizeram o teste respiratório para frutose com 1g/kg (até 25g) em 222 crianças com DGIFs‐DA e descobriram que 121 de 222 crianças (55%) apresentavam má absorção de frutose e 93 (77%) delas melhoraram com uma dieta com baixo teor de frutose recomendada pela nutricionista.
Em um estudo retrospectivo,124 55/142 (39%) crianças apresentaram má absorção de frutose, identificada pelo teste respiratório para frutose, mas várias delas também apresentaram múltiplos testes positivos de carboidratos, o que tornou pouco clara a resposta à dieta. Em outro estudo122 que envolveu 220 crianças com DAR, algumas crianças ainda se queixaram de sintomas abdominais quando ingeriam leite ou alimentos com frutose, apesar de um teste negativo de tolerância duplo‐cego placebo‐controlado, com lactose ou frutose (25% com leite e 48% com frutose respectivamente).
De maneira semelhante à lactose,38,132 uma melhoria nos sintomas abdominais foi relatada na dieta com restrição de frutose, independentemente da presença ou ausência de má absorção de frutose.91,133,134
Estudos relacionados ao sorbitol em crianças com DFDANenhum estudo prospectivo com restrição apenas de sorbitol foi concluído em crianças com DGIFs‐DA,110 enquanto dois estudos prospectivos128,129 avaliaram uma combinação de dieta com baixos teores de frutose e sorbitol (tabela 2).
Um relato de caso135 descreveu uma menina de 15 anos com dor abdominal crônica, provavelmente devido à ingestão de sorbitol contido em goma de mascar sem açúcar, que melhorou com a eliminação da fonte de sorbitol. Em um estudo retrospectivo, Däbritz et al.124 descobriram que 109/146 (75%) crianças com DAR submetidas a teste respiratório de hidrogênio exalado tinham má absorção de sorbitol e 27/31 (87%) que iniciaram uma dieta com restrição de sorbitol relataram melhoria dos sintomas.
DiscussãoUm efeito benéfico significativo de uma dieta BFM sobre os sintomas clínicos tem sido relatado por vários estudos em adultos com SII37,97 enquanto em crianças há atualmente dados muito limitados e apenas um pequeno estudo duplo‐cego randomizado. As evidências para apoiar uma mudança na dieta materna para o tratamento da cólica infantil também é fraca. Assim, mais pesquisas são necessárias antes que recomendações possam ser feitas para crianças.
Devido à complexidade de criar dietas BFM e os potenciais desequilíbrios nutricionais, a orientação de profissionais com experiência em manejo dietético é importante, particularmente em crianças, para garantir a adequação nutricional e o potencial de crescimento. Atualmente, é difícil prever quais pacientes se beneficiariam de uma dieta BFM devido à falta de um biomarcador específico e de uma relação entre os testes respiratórios e a melhoria dos sintomas. Quando os médicos consideram a dieta BFM, eles devem estar cientes das limitações de curto e longo prazo, inclusive o impacto na qualidade de vida determinado por múltiplas restrições, as possíveis alterações na microbiota intestinal e a falta de conhecimento da eficácia relativa em crianças.
Atualmente, a reintrodução gradual do FODMAPs na dieta após a fase de eliminação é recomendada.82 Essa abordagem permite uma dieta personalizada baseada na tolerância individual e evita a super‐restrição com potenciais desequilíbrios nutricionais. A suplementação com probióticos específicos também pode restaurar a microbiota intestinal alterada pela dieta BFM.83
Aumentar o conhecimento sobre o teor de FODMAPs e melhorar a rotulagem e a análise dos alimentos são importantes70 para os clínicos e nutricionistas elaborarem uma dieta BFM sob medida e facilitar a adesão à dieta.
Mais pesquisas são necessárias para identificar a melhor maneira de reintroduzir alimentos com FODMAPs e quais alimentos são responsáveis pelos sintomas de cada paciente.34 Além disso, mais dados sobre adesão, eficácia e segurança em longo prazo também são necessários.
As evidências atuais não apoiam o uso de uma dieta com restrição de lactose em todas as crianças com SII. Mais trabalhos são necessários para elucidar o papel das dietas com restrição de frutanos e frutose exclusivamente para o tratamento de DFDA na população pediátrica.
Concluindo, uma dieta com baixo teor de FODMAPs é uma intervenção terapêutica dietética promissora em adultos com SII, mas a eficácia dessa abordagem em crianças com SII e DFDA ainda não está clara. Esforços adicionais ainda são necessários para esclarecer quais pacientes e com que tipo de restrição de FODMAPs seriam beneficiados para garantir a adequação nutricional, para facilitar o reconhecimento do teor de FODMAPs e para simplificar a adesão à dieta.
Disponibilidade de dados e materialO compartilhamento de dados não se aplica a este artigo, já que nenhum conjunto de dados foi gerado ou analisado durante o estudo.
Conflitos de interesseS. Salvatore participou como consultor e/ou palestrante para Deca, IMS‐Health, Danone, Nestlé, Menarini; Nikhil Thapar participou como membro do conselho consultivo e/ou palestrante da Nutricia, Danone. Yvan Vandenplas participou como investigador clínico e/ou membro do conselho consultivo e/ou consultor e/ou palestrante para Abbott Nutrition, Aspen, Biocodex, Danone, Nestlé Health Science, Nestle Nutrition Institute, Nutricia, Mead Johnson Nutrition, Merck, Phacobel, Rontis, United Pharmaceuticals, Wyeth e Yakult. Annamaria Staiano participou como investigadora clínica e/ou membro do conselho consultivo e/ou consultora e/ou palestrante para DMG, Valeas, Angelini, Miltè, Danone, Nestlé, Sucampo, Menarini. Miguel Saps atuou como consultor científico para Forest, Quintiles, Ardelyx, IM HealthScience, QOL Medical e Sucampo. Mas nenhum dos fabricantes ou empresas acima mencionados teve qualquer participação ou envolvimento neste estudo.
Como citar este artigo: Pensabene L, Salvatore S, Turco R, Tarsitano F, Concolino D, Baldassarre ME, et al. Low FODMAPs diet for functional abdominal pain disorders in children: critical review of current knowledge. J Pediatr (Rio J). 2019;95:642–56.
Estudo vinculado a University Magna Graecia of Catanzaro, Department of Medical and Surgical Sciences, Catanzaro, Itália.