The objective of this study is to evaluate the hypothesis that use of heliox would result in improvement of gas exchange when used with high flow nasal cannula in infants with RSV acute bronchiolitis.
MethodsAll patients that met the inclusion criteria were randomized to either heliox (70:30) or air–oxygen mixture 30% via high flow nasal cannula at 8L/min for a continuous 24h. Measurements were taken at baseline, after 2h, and at the end of the 24h.
ResultsThis prospective study included 48 patients. After 2h of treatment with heliox, the oxygen saturation and PaO2 significantly improved when compared with the air–oxygen group, 98.3% vs. 92.9%, 62.0mmHg vs. 43.6mmHg (p=0.04 and 0.01), respectively. Furthermore, PaO2/FiO2 ratio was significantly higher in the heliox group when compared with the air–oxygen group, 206.7 vs. 145.3. Nevertheless, CO2 showed better elimination when heliox was used, without significance. MWCA score dropped significantly in the heliox group, 2.2 points vs. 4.0 points in air–oxygen (p=0.04), 2h after starting the therapy.
ConclusionTransient improvement of oxygenation in infants with RSV acute bronchiolitis during the initial phase of the therapy is associated with heliox when provided with HFNC, may provide a precious time for other therapeutic agents to work or for the disease to resolve naturally, avoiding other aggressive interventions.
Avaliar a hipótese de que o uso da mistura heliox resultaria em melhoria da troca gasosa quando usado com cânula nasal de alto fluxo em crianças com bronquiolite aguda por VSR.
MétodosTodos os pacientes que atenderam aos critérios de inclusão foram randomizados para receber a mistura heliox (70:30) ou a mistura ar/oxigênio a 30% por meio da cânula nasal de alto fluxo a 8 L/min por 24 horas contínuas. As medições foram feitas no início, depois de duas horas e ao fim de 24 horas.
ResultadosFizemos um estudo prospectivo em que foram incluídos 48 pacientes. Após duas horas de tratamento com a mistura heliox, a saturação de oxigênio e a PaO2 apresentaram melhoria significativa em comparação com o grupo da mistura ar/oxigênio: 98,3% em comparação com 92,9%, 62,0mmHg em comparação com 43,6mmHg (p=0,04 e 0,01), respectivamente. Além disso, a relação PaO2/FiO2 era significativamente mais alta no grupo da mistura heliox do que no grupo da mistura ar/oxigênio, 2.067 em comparação com 1.453. Contudo, o CO2 apresentou melhor eliminação quando a mistura heliox foi usada, sem relevância. O Escore MWCA caiu significativamente no grupo da mistura heliox, 2,2 pontos em comparação com 4,0 pontos da mistura ar/oxigênio (p=0,04) duas horas após o início da terapia.
ConclusãoA breve melhoria da oxigenação em crianças com bronquiolite aguda por VSR na fase inicial da terapia está associada à mistura heliox quando administrada pela CNAF e poderá fornecer um tempo precioso para outros agentes terapêuticos funcionarem ou para a própria doença se curar naturalmente e evitar outras intervenções agressivas.
O hélio é um gás inerte e sua densidade constitui quase 15% da densidade do ar. O dióxido de carbono (CO2) tem a capacidade de difundir‐se no hélio mais facilmente do que no ar.1 A inalação do hélio resulta na manutenção de maior fluxo laminar e diminui o fluxo turbulento por meio de vias aéreas estreitadas que posteriormente diminuem a resistência ao fluxo de gás.2 Portanto, respirar a mistura de oxigênio e hélio (heliox) levará a uma diminuição da resistência ao fluxo dessa mistura nas vias aéreas, que, por sua vez, diminui o esforço respiratório, principalmente em disfunções que apresentam um aumento da resistência nas vias aéreas.3 Esse efeito faz com que seja benéfico o uso da mistura heliox em pacientes que sofrem de obstrução das vias aéreas superiores,4 bronquiolite e doenças pulmonares obstrutivas das vias aéreas inferiores.5,6 A mistura heliox pode ser administrada de maneira não invasiva em pacientes com respiração espontânea ou invasiva por meio das configurações de ventilação mecânica.4
O vírus sincicial respiratório (VSR) é um vírus de RNA envelopado não segmentado que pertence à família Paramyxoviridae. Seu período de incubação é de até oito dias. O vírus reproduz‐se inicialmente no revestimento da nasofaringe e depois se espalha para o revestimento epitelial dos bronquíolos, o que desencadeia uma infecção do trato respiratório inferior. O principal alvo do VSR são as células epiteliais ciliadas respiratórias, porém outras células, como os macrófagos e as dendríticas, também podem ser infectadas. A reprodução do genoma do vírus sincicial respiratório cria intermediários do RNA que induzem uma resposta antiviral mediada pelo interferon e outras citocinas.7 Como a infecção ocorre no trato respiratório inferior, ocorre uma cadeia de eventos nas células epiteliais, inclusive edema, produção de muco em excesso, seguida de necrose celular e regeneração. Posteriormente, ocorre obstrução das pequenas vias aéreas, que leva a aprisionamento de ar, aumento da resistência das vias aéreas inferiores e hipoxemia.8
Com base em suas propriedades, a mistura heliox foi considerada uma terapia adjuvante para melhorar a oxigenação em pacientes com infecção do trato respiratório inferior por VSR enquanto são submetidos a ventilação mecânica; contudo, seu uso nesses pacientes foi inconclusivo.3
O objetivo de nosso estudo é avaliar se o uso da mistura heliox resultaria em uma melhoria da troca gasosa quando administrada por meio de uma cânula nasal de alto fluxo (CNAF) continuamente em crianças diagnosticadas com bronquiolite aguda causada por VSR.
MétodoParticipantesOs participantes elegíveis eram crianças com de um mês a dois anos. Elas foram internadas na unidade de alta dependência pediátrica de setembro de 2013 a maio de 2015 com bronquiolite aguda por VSR diagnosticada clinicamente e confirmada por laboratório. A bronquiolite foi diagnosticada com base em critérios que incluíram tosse, aumento da frequência respiratória, retração torácica, tempo expiratório prolongado, roncos sibilantes e pulmões hiperinsuflados no raios X de tórax. A confirmação da infecção por VSR foi feita pelo teste de detecção direta de antígeno da secreção nasofaríngea. Os pacientes se qualificavam para inclusão em nosso estudo quando não conseguiam manter sua saturação de oxigênio ≥ 93% em ar ambiente e precisavam de oxigênio complementar na internação. Depois de obter um consentimento por escrito de no mínimo um dos pais, os pacientes elegíveis foram randomizados para receber terapia com a mistura heliox (70:30) ou uma mistura ar/oxigênio a 8 L/min por meio de uma CNAF por 24 horas contínuas.
Excluímos as crianças que precisavam de ventilação mecânica ou apresentavam defeito cardíaco congênito hemodinamicamente significativo (shunt intracardíaco esquerdo‐direito significativo com ou sem a presença de hipertensão arterial pulmonar ou shunt direito‐esquerdo) ou quando não se obteve o consentimento informado. Pacientes com doença pulmonar crônica, inclusive displasia broncopulmonar, e diagnosticados anteriormente com doenças das vias aéreas hiperreativas também foram excluídos.
Modelo do estudoFizemos um estudo unicêntrico intervencional e prospectivo. Todos os participantes que atenderam aos critérios de inclusão foram randomizados por meio de randomização em blocos após obter um consentimento por escrito e submetidos a mistura heliox (70:30) ou ar/oxigênio, começando com uma fração de 30% de oxigênio, por meio de CNAF a 8 L/min por 24 horas contínuas. Se a saturação de oxigênio fosse mantida em ≤ 93% apesar da fração de oxigênio inspirado de 30%, era feito um aumento de 5% para manter a saturação em>93%.
O Escore Clínico Modificado da Asma de Wood9 é um sistema usado para avaliar alterações na insuficiência respiratória em um período de tempo, com o escore máximo de 11. As medições dos sinais vitais foram feitas no início e, então, de hora em hora durante todo o estudo, ao passo que a PaO2, a PaCO2 e o Escore Clínico Modificado da Asma de Wood foram mensurados e relatados no início, duas horas após o início do tratamento, 12 horas após o início do tratamento e ao fim de 24 horas.
Detecção do VSRA detecção de VSR em amostras nasofaríngeas foi feita por meio do teste TRU RSV (Meridian Bioscience, Inc., EUA). O teste TRU RSV é um imunoensaio de captura qualitativo rápido para a detecção do antígeno do VSR em amostras humanas. O teste usa anticorpos monoclonais ligados ao ouro em proteínas de fusão e nucleoproteínas do VSR (anticorpos de detecção). Foram usados cotonetes com hastes de plástico para coletar amostras nasofaríngeas dos participantes do estudo. Os cotonetes foram transportados em um meio de transporte (solução fisiológica a 0,85%) para o Laboratório de Microbiologia para serem processados. O teste foi feito de acordo com o método apresentado pelo fabricante.
Logística do suprimento de gásAdministramos a mistura heliox (Advanced Technology Company, Kuwait) por meio da CNAF com o sistema RT329, conectado à entrada de gás da câmara do umidificador (sistema de umidificação MR850, Fisher & Paykel Healthcare, Madri, Espanha). A fonte de gás da CNAF era a mistura heliox (30% de oxigênio e 70% de hélio) e, por meio do lado seco da câmara do umidificador, foi acrescentada uma fonte secundária de gás oxigênio. A mistura ar/oxigênio foi mantida em 30% de fração de oxigênio inspirado (FIO2), suprida por meio da CNAF com o sistema RT329.
MediçõesFoi obtida uma radiografia do tórax de cada participante antes da implantação do protocolo do estudo para avaliar a presença de hiperinsuflação, demarcada no raios X de tórax como um nível diafragmático abaixo da sexta costela torácica anteriormente. O sangue arterial foi coletado para medir a pressão parcial do oxigênio no sangue arterial (PaO2) e a pressão parcial do dióxido de carbono no sangue arterial (PaCO2) antes de iniciar o tratamento e duas e 24 horas após o início do tratamento. Todos os pacientes foram tratados de acordo com um protocolo de manejo unificado.10
Com o oxímetro de pulso Masimo SET (Masimo Corporation, Irvine, EUA), a saturação de oxigênio foi continuamente monitorada. Outros sinais vitais também foram monitorados de hora em hora por 24 horas, até a interrupção da terapia com a mistura heliox. Os dados coletados foram analisados.
Medidas dos resultadosO ponto final foi a melhoria da PaO2 arterial e a extensão das variações na insuficiência respiratória mensuradas pelo Escore Clínico Modificado da Asma de Wood duas e 24 horas após o início do tratamento.
O protocolo do estudo foi aprovado pelo comitê de ética da Faculdade de Medicina da Universidade de Almançora. Registro do ensaio clínico: ISRCTN99072045.
Análise estatísticaFoi feita pelo teste t para amostras independentes. Os dados foram apresentados como média±desvio padrão. Quando o valor de p era inferior a 0,05, era atingida relevância estatística. Toda a análise estatística foi feita pelo SPSS versão 15.0 (Chicago, IL, EUA).
ResultadosAo longo de nosso estudo, 86 crianças foram diagnosticadas com bronquiolite aguda e internadas na unidade de alta dependência pediátrica. Desses, 48 crianças (22 meninos e 26 meninas) atenderam aos critérios de inclusão no estudo e foram randomizadas em dois grupos; 24 foram alocados para o grupo da mistura heliox (70:30) ou para o grupo da mistura ar/oxigênio 30% por meio da CNAF. A idade média dos pacientes era de 6,4 meses (± 1,2 mês). Foram excluídos dois que apresentavam doença cardíaca de base (conhecida por apresentar um grande defeito do septo ventricular), oito que eram bebês prematuros e apresentavam doença pulmonar crônica, dois que sofriam de bronquiolite recorrente e 26 que não apresentaram infecção por VSR nos esfregaços nasofaríngeos pelo ensaio de detecção direta de antígeno.
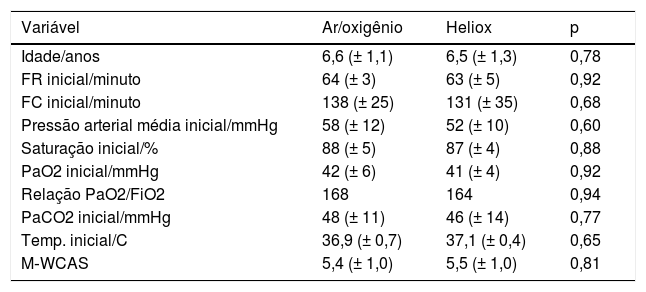
Todas as medições iniciais dos indivíduos do estudo em ambos os grupos eram semelhantes (tabela 1). Tivemos de aumentar a FIO2 para 35% em dois pacientes no grupo da mistura ar/oxigênio por apenas três horas para manter a saturação>93% e então voltamos para 30%. Nenhum paciente no grupo da mistura heliox precisou de FIO2 acima de 30%.
Características iniciais do estudo em ambos os grupos
| Variável | Ar/oxigênio | Heliox | p |
|---|---|---|---|
| Idade/anos | 6,6 (± 1,1) | 6,5 (± 1,3) | 0,78 |
| FR inicial/minuto | 64 (± 3) | 63 (± 5) | 0,92 |
| FC inicial/minuto | 138 (± 25) | 131 (± 35) | 0,68 |
| Pressão arterial média inicial/mmHg | 58 (± 12) | 52 (± 10) | 0,60 |
| Saturação inicial/% | 88 (± 5) | 87 (± 4) | 0,88 |
| PaO2 inicial/mmHg | 42 (± 6) | 41 (± 4) | 0,92 |
| Relação PaO2/FiO2 | 168 | 164 | 0,94 |
| PaCO2 inicial/mmHg | 48 (± 11) | 46 (± 14) | 0,77 |
| Temp. inicial/C | 36,9 (± 0,7) | 37,1 (± 0,4) | 0,65 |
| M‐WCAS | 5,4 (± 1,0) | 5,5 (± 1,0) | 0,81 |
FC, frequência cardíaca; FIO2, fração de oxigênio inspirado; FR, frequência respiratória; M‐WCAS, Escore Clínico Modificado da Asma de Wood; PaCO2, dióxido de carbono arterial parcial; PaO2, oxigênio arterial parcial.
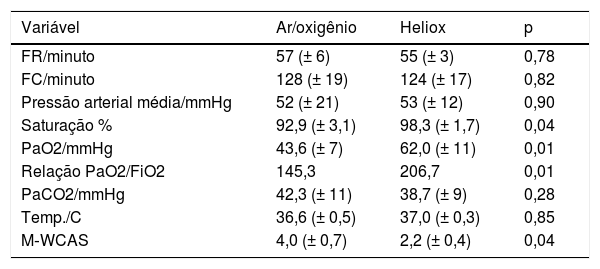
Após as primeiras duas horas de tratamento, foi observada uma melhoria de todos os valores medidos desde o início em ambos os grupos de estudo. A saturação de oxigênio e a PaO2 melhoraram significativamente no grupo da mistura heliox em relação ao grupo da mistura ar/oxigênio: 98,3% (± 1,7%) em comparação com 92,9% (± 3,1%), 62,0mmHg (± 11mmHg) em comparação com 43,6mmHg (± 7mmHg), respectivamente (p=0,04 e 0,01, respectivamente). Além disso, a relação PaO2/FiO2 era significativamente mais alta no grupo da mistura heliox do que no grupo da mistura ar/oxigênio, 206,7 em comparação com 145,3. Contudo, a melhoria na PaCO2 não apresentou a mesma relevância entre os grupos estudados: 38,7 (± 9) mmHg em comparação com 42,3 (± 11) mmHg (p=0,28) (tabela 2).
Diferenças entre os grupos de estudo duas horas após o início da intervenção
| Variável | Ar/oxigênio | Heliox | p |
|---|---|---|---|
| FR/minuto | 57 (± 6) | 55 (± 3) | 0,78 |
| FC/minuto | 128 (± 19) | 124 (± 17) | 0,82 |
| Pressão arterial média/mmHg | 52 (± 21) | 53 (± 12) | 0,90 |
| Saturação % | 92,9 (± 3,1) | 98,3 (± 1,7) | 0,04 |
| PaO2/mmHg | 43,6 (± 7) | 62,0 (± 11) | 0,01 |
| Relação PaO2/FiO2 | 145,3 | 206,7 | 0,01 |
| PaCO2/mmHg | 42,3 (± 11) | 38,7 (± 9) | 0,28 |
| Temp./C | 36,6 (± 0,5) | 37,0 (± 0,3) | 0,85 |
| M‐WCAS | 4,0 (± 0,7) | 2,2 (± 0,4) | 0,04 |
FC, frequência cardíaca; FIO2, fração de oxigênio inspirado; FR, frequência respiratória; M‐WCAS, Escore Clínico Modificado da Asma de Wood; PaCO2, dióxido de carbono arterial parcial; PaO2, oxigênio arterial parcial.
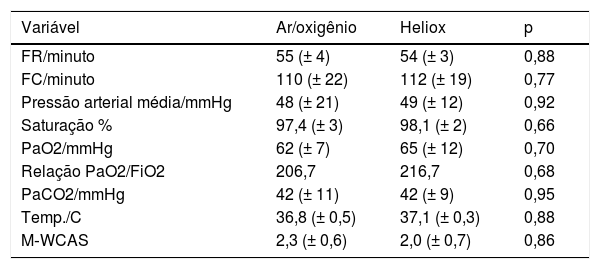
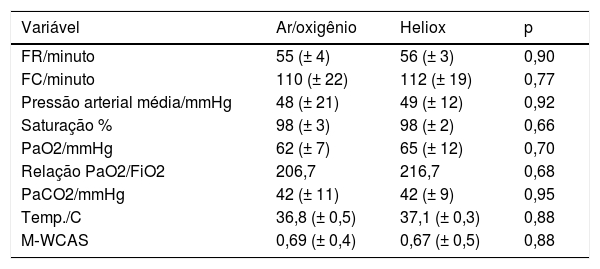
A melhoria na saturação de oxigênio, PaO2, relação PaO2/FiO2 e PaCO2 também foi melhor no grupo da mistura heliox após 12 horas de tratamento, porém a diferença não atingiu relevância estatística [98,1% (± 2,0%) em comparação com 97,4% (± 3,0%), 65,0mmHg (± 12mmHg) em comparação com 62,0mmHg (± 7mmHg), 216,7 em comparação com 206,7 e 42,0mmHg (± 9mmHg) em comparação com 42,0mmHg (± 11mmHg) (p=0,66, 0,70 e 0,95)], respectivamente (tabela 3). Ao fim de 24 horas após o início do tratamento, todos os parâmetros medidos em ambos os grupos, inclusive PaO2, saturação de oxigênio e PaCO2, apresentaram melhoria em relação ao início, porém a diferença não atingiu relevância estatística: p=0,95, 0,7 e 0,88, respectivamente (tabela 4).
Diferenças entre os grupos de estudo 12 horas após o início da intervenção
| Variável | Ar/oxigênio | Heliox | p |
|---|---|---|---|
| FR/minuto | 55 (± 4) | 54 (± 3) | 0,88 |
| FC/minuto | 110 (± 22) | 112 (± 19) | 0,77 |
| Pressão arterial média/mmHg | 48 (± 21) | 49 (± 12) | 0,92 |
| Saturação % | 97,4 (± 3) | 98,1 (± 2) | 0,66 |
| PaO2/mmHg | 62 (± 7) | 65 (± 12) | 0,70 |
| Relação PaO2/FiO2 | 206,7 | 216,7 | 0,68 |
| PaCO2/mmHg | 42 (± 11) | 42 (± 9) | 0,95 |
| Temp./C | 36,8 (± 0,5) | 37,1 (± 0,3) | 0,88 |
| M‐WCAS | 2,3 (± 0,6) | 2,0 (± 0,7) | 0,86 |
FC, frequência cardíaca; FIO2, fração de oxigênio inspirado; FR, frequência respiratória; M‐WCAS, Escore Clínico Modificado da Asma de Wood; PaCO2, dióxido de carbono arterial parcial; PaO2, oxigênio arterial parcial.
Diferenças entre os grupos de estudo 24 horas após o início da intervenção
| Variável | Ar/oxigênio | Heliox | p |
|---|---|---|---|
| FR/minuto | 55 (± 4) | 56 (± 3) | 0,90 |
| FC/minuto | 110 (± 22) | 112 (± 19) | 0,77 |
| Pressão arterial média/mmHg | 48 (± 21) | 49 (± 12) | 0,92 |
| Saturação % | 98 (± 3) | 98 (± 2) | 0,66 |
| PaO2/mmHg | 62 (± 7) | 65 (± 12) | 0,70 |
| Relação PaO2/FiO2 | 206,7 | 216,7 | 0,68 |
| PaCO2/mmHg | 42 (± 11) | 42 (± 9) | 0,95 |
| Temp./C | 36,8 (± 0,5) | 37,1 (± 0,3) | 0,88 |
| M‐WCAS | 0,69 (± 0,4) | 0,67 (± 0,5) | 0,88 |
FC, frequência cardíaca; FIO2, fração de oxigênio inspirado; FR, frequência respiratória; M‐WCAS, Escore Clínico Modificado da Asma de Wood; PaCO2, dióxido de carbono arterial parcial; PaO2, oxigênio arterial parcial.
O Escore Clínico Modificado da Asma de Wood não apresentou diferença significativa entre ambos os grupos antes do início do tratamento, porém caiu significativamente após duas horas de tratamento, passou de 5,5 pontos (± 1,0 ponto) no grupo da mistura heliox em comparação com 5,4 pontos (± 0,9 ponto) no grupo da mistura ar/oxigênio para 2,2 pontos (± 0,4 ponto) em comparação com 4,0 pontos (± 0,7 ponto), respectivamente (p=0,04). Ao fim de 24 horas após o tratamento, o Escore Clínico Modificado da Asma de Wood caiu em ambos os grupos, porém não foi significativo (p=0,88).
Não foi observado evento adverso relacionado ao tratamento durante o período do estudo. Todos os participantes incluídos concluíram o estudo. Nenhum dos participantes incluídos precisou de ventilação mecânica. Além disso, todos os pacientes se recuperaram completamente, sem complicação.
DiscussãoO hélio é um gás com peso molecular baixo que, quando misturado com o oxigênio, gera uma mistura menos densa do que o ar.11 Portanto, essa mistura pode ser usada quando houver obstrução das vias aéreas por meio da redução da resistência ao fluxo e, consequentemente, redução no esforço respiratório.12–14 Além disso, foi comprovado que a mistura de hélio e O2 aprimora a ventilação alveolar por meio de seu alto coeficiente de difusão e eliminação do CO2.11,14,15
Na literatura, existem referências recentes ao uso da mistura heliox de forma não invasiva para o manejo da bronquiolite aguda em neonatos.16 Nosso trabalho mostrou que a mistura heliox, quando combinada com a CNAF, aumentará sua eficácia a respeito de troca gasosa e reduziu significativamente o escore clínico de avaliação da insuficiência respiratória durante a fase inicial do tratamento em pacientes com bronquiolite aguda por VSR. A resposta observada com a mistura heliox sobre o aumento da oxigenação aumentou rapidamente nas primeiras duas horas da intervenção do estudo e foi mantida em toda a terapia, de forma coerente com seu modo de ação. O grau de melhoria clínica e na troca gasosa observado em nosso estudo, quando a mistura heliox foi usada com a CNAF, é semelhante aos achados anteriores, em que a mistura heliox foi usada com ventilação por Pressão Positiva Contínua nas Vias Aéreas (CPAP) nasal.17,18 Contudo, a melhoria na oxigenação foi associada mais provavelmente à ventilação por CPAP nasal do que ao efeito da mistura heliox.17 Além disso, Moraa et al. apresentaram, em uma revisão Cochrane recente, evidências do benefício de curto prazo da inalação da mistura de hélio e oxigênio como terapia adjuvante com dexametasona oral ou intramuscular em crianças com crupe moderada a grave.4 Chowdhury et al. descobriram, em um ensaio multicêntrico, que a terapia com a mistura heliox não diminuía a duração do tratamento quando administrada por meio da cânula nasal. Contudo, eles declararam que o efeito da mistura heliox era maior com uma máscara facial, ou CPAP.19
A falta de melhoria na liberação de CO2 em nosso trabalho foi compatível com o relato anterior de Gross et al.3 Eles não conseguiram demonstrar efeito benéfico de diversas misturas heliox sobre o CO2 arterial em neonatos com ventilação mecânica devido a doença do trato respiratório inferior por VSR moderada a grave. Além disso, Kneyber et al. relataram os mesmos resultados, embora seus participantes provavelmente apresentassem doenças mais graves do que em nosso estudo, com maior PaCO2.20 Anteriormente, eles observaram um efeito favorável da mistura heliox sobre as vias aéreas obstruídas entre neonatos.
Nenhum de nossos pacientes apresentou qualquer efeito adverso, independentemente da terapia administrada. As técnicas de administração de gás com a CNAF usadas e a natureza inerte do hélio foram bem toleradas em todos os pacientes. Entretanto, é necessário mencionar algumas limitações observadas em nosso estudo. A randomização não foi cega devido à discrepância entre ambos os sistemas de administração de gás. A distinção entre os fenótipos clínicos com base em radiologia torácica foi prejudicada pelo tamanho reduzido da amostra do estudo, porém outras pesquisas sobre esse assunto são incentivadas.
Nossos dados mostraram o efeito benéfico momentâneo da mistura heliox quando administrada com a CNAF em termos de quadro clínico e troca de gases no sangue em crianças com bronquiolite aguda por VSR durante a fase inicial da terapia feita de maneira não invasiva. Ademais, essa melhoria momentânea pode proporcionar um intervalo de tempo precioso para que outras terapêuticas sejam efetivas ou para a cura natural da doença durante a fase inicial da terapia. Além disso, poderão ser evitadas outras intervenções, como intubação e ventilação mecânica. Claramente são necessários mais trabalhos para avaliar outros aspectos, como o momento inicial ideal para a intervenção, a proporção adequada da mistura heliox, a duração da terapia e a identificação dos não respondedores. Enquanto isso, a mistura de hélio e oxigênio administrada com a CNAF poderá ser benéfica para o manejo da bronquiolite aguda por VSR entre crianças.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Seliem W, Sultan AM. Heliox delivered by high flow nasal cannula improves oxygenation in infants with respiratory syncytial virus acute bronchiolitis. J Pediatr (Rio J). 2018;94:56–61.