To describe the current indicators of environmental enteric dysfunction and its association with linear growth deficit and the height‐for‐age anthropometric indicator.
Data sourcesNarrative review with articles identified in PubMed and Scopus databases using combinations of the following words: environmental, enteric, dysfunction, enteropathy, and growth, as well as the authors’ personal records.
Data synthesisIn the last 15 years, new non‐invasive markers have been investigated to characterize environmental enteric dysfunction; however, the best tests to be used have not yet been identified. There is evidence that, in environmental enteric dysfunction, a systemic inflammatory process may also occur as a consequence of increased intestinal permeability, in addition to intestinal mucosa abnormalities. Bacterial overgrowth in the small intestine and changes in fecal microbiota profile have also been identified. There is evidence indicating that environmental enteric dysfunction can impair not only full growth but also the neuropsychomotor development and response to orally administered vaccines. It is important to emphasize that the environmental enteric dysfunction is not a justification for not carrying out vaccination, which must follow the regular schedule. Another aspect to emphasize is the greater risk for those children who had height impairment in early childhood, possibly associated with environmental enteric dysfunction, to present overweight and obesity in adulthood when exposed to a high calorie diet, which has been called “triple burden.”
ConclusionsAccording to the analyzed evidence, the control of environmental enteric dysfunction is very important for the full expression of growth, development, and vaccine response in the pediatric age group.
Descrever os indicadores atuais da disfunção entérica ambiental e sua relação com déficit de crescimento linear e com o indicador antropométrico estatura‐idade.
Fontes dos dadosRevisão narrativa com artigos identificados no PubMed e Scopus com o uso de combinações das seguintes palavras: environmental, enteric, dysfunction, enteropathy e growth e dos arquivos pessoais dos autores.
Síntese dos dadosNos últimos 15 anos, vem sendo pesquisados novos marcadores não invasivos para caracterizar disfunção entérica ambiental. No entanto, ainda não foram identificados os melhores testes a serem usados. Existem evidências de que na disfunção entérica ambiental, além das anormalidades da mucosa intestinal, pode ocorrer também processo inflamatório sistêmico em consequência da maior permeabilidade intestinal. Sobrecrescimento bacteriano no intestino delgado e mudança no perfil da microbiota fecal também estão sendo identificados. Evidências indicam que a disfunção entérica ambiental pode comprometer não somente o pleno crescimento como também comprometer o desenvolvimento neuropsicomotor e a resposta de vacinas administradas por via oral. É importante destacar que a disfunção entérica ambiental não é justificativa para não fazer a vacinação, que deve seguir o calendário normal. Um outro aspecto a ser ressaltado é o risco maior dessas crianças que tiveram comprometimento da estatura na infância precoce, possivelmente associado à disfunção entérica ambiental, apresentarem na idade adulta excesso de peso e obesidade quando expostas a uma dieta rica em calorias, o que tem sido chamado “triple burden”.
ConclusõesDe acordo com as evidências analisadas, o controle da disfunção entérica ambiental é muito importante para plena expressão do crescimento, desenvolvimento e resposta vacinal na faixa etária pediátrica.
Na primeira metade da década de 1960 observou‐se, na Tailândia, que indivíduos adultos sem sintomatologia gastrintestinal apresentavam redução na absorção intestinal da D‐xilose e anormalidades na mucosa do intestino delgado (redução na altura das vilosidades e aumento do infiltrado de linfócitos na lâmina própria) em relação aos indivíduos que viviam nos países desenvolvidos.1 Em outros países tropicais as mesmas anormalidades morfológicas e funcionais foram descritas e o quadro passou a ser denominado enteropatia tropical.2 As evidências mostraram que essas anormalidades eram adquiridas, ou seja, não estavam presentes no recém‐nascido e apareciam depois do primeiro semestre de vida.3–5 Considerando que a distribuição geográfica da enteropatia tropical não se restringia somente às regiões tropicais, na década de 1980 autores da América do Sul propuseram a denominação enteropatia ambiental.6,7 Nesse contexto, vale destacar que em determinados países desenvolvidos situados na região tropical, como o Qatar e Singapura, não foram identificados esses tipos de anormalidades no intestino delgado.8
Outro aspecto fundamental, conhecido desde a década de 1970, é a reversibilidade espontânea da enteropatia ambiental. Em paquistaneses e indianos que se mudaram para Nova York, sem que qualquer intervenção terapêutica fosse usada, constatou‐se melhoria dos indicadores de função intestinal.9 Fenômeno inverso, ou seja, aparecimento de alterações funcionais no intestino delgado, foi observado alguns meses após a mudança de americanos para o Paquistão.10 Há décadas observou‐se, também, que a intensidade da enteropatia ambiental oscilava ao longo do tempo.
Na década de 1980 sugeriu‐se definir enteropatia ambiental como um conjunto de alterações inespecíficas do intestino delgado, morfológicas e funcionais, com ou sem exteriorização clínica, que apresentam, potencialmente, reversão espontânea com a mudança para ambiente com boas condições de salubridade.3 Nesse contexto, enteropatia ambiental foi considerada uma doença da sociedade que compromete a saúde e qualidade de vida de crianças e adultos que vivem em condições ambientais aquém da dignidade merecida por todos os componentes de uma sociedade civilizada.11
Nessa época, de acordo com os conhecimentos existentes, era muito difícil vincular as anormalidades da morfologia e função intestinal especificamente com a enteropatia ambiental, uma vez que, frequentemente, ocorria a coexistência com outros problemas comuns das populações que vivem em condições desfavoráveis, como dieta inapropriada quanto a macro e micronutrientes, desnutrição energético‐proteica, parasitoses intestinais e surtos repetidos de diarreia aguda e persistente. Apesar de suspeitado, no século XX nunca ficou claro o efeito negativo da má absorção intestinal da enteropatia ambiental no comprometimento do crescimento linear.12
Na década de 1990, consolidava‐se a ideia de que a exposição repetida a agentes microbianos do ambiente, em geral de natureza bacteriana, tinha potencial de comprometer a saúde intestinal e constituía o fator mais importante na geração da enteropatia ambiental.2,3,5,8 Poderiam ocorrer, associadamente, modificações na microbiota do intestino proximal, que levariam ao sobrecrescimento bacteriano no intestino delgado. Considerando que, a exemplo da obtenção de biópsia de intestino delgado, a coleta de fluido enteral para análise microbiológica é um procedimento invasivo, passou a ser empregado o teste respiratório do hidrogênio no ar expirado como uma opção não invasiva para a caracterização de sobrecrescimento bacteriano.13–16
A partir da década de 1990, até o presente momento, têm sido pesquisados outros indicadores para a caracterização da enteropatia ambiental, destaca‐se o teste da permeabilidade intestinal da lactulose e manitol. O teste de absorção da D‐xilose, apesar de exequível, foi praticamente abandonado.4,5,8
Em 2013, foi proposta a denominação disfunção entérica ambiental como sinônimo do termo enteropatia ambiental.17 Ampliou‐se, também, o interesse na disfunção entérica ambiental em função de sua associação com o déficit de crescimento linear (stunting) observado com frequência em crianças que vivem em condições socioambientais desfavoráveis. Passou‐se a valorizar o potencial da disfunção entérica ambiental no comprometimento do pleno crescimento, que ocorre com maior celeridade nos primeiros anos de vida. No entanto, deve ser destacado que a disfunção entérica ambiental pode ocorrer em qualquer faixa etária.18–20
O objetivo desta revisão é descrever os indicadores atuais da disfunção entérica ambiental e sua relação com déficit de crescimento linear e com o indicador antropométrico estatura‐idade.
MétodosPara esta revisão narrativa foram identificados artigos na base de dados no PubMed e Scopus com o uso das combinações das seguintes palavras: environmental, enteric, dysfunction, enteropathy e growth. Foram considerados não somente artigos originais como também artigos de revisão. Foram usadas, também, referências dos artigos selecionados e dos arquivos dos próprios autores.
ResultadosDisfunção entérica ambiental e outras enteropatiasDefine‐se, atualmente, disfunção entérica ambiental como uma doença subclínica adquirida, reversível, associada com atrofia parcial das vilosidades intestinais, aumento da profundidade das criptas e infiltrado de linfócitos T na lâmina própria e no epitélio do intestino delgado consequente à exposição repetida do intestino a patógenos exógenos.17,20,21 Associa‐se, também, com aumento da permeabilidade intestinal e influxo de elementos inflamatórios através do epitélio intestinal.22
Por sua vez, sprue tropical caracteriza‐se por acometimento mais extenso do intestino delgado, inclusive da porção terminal. As descrições mais frequentes são procedentes do Caribe e do Sudeste da Ásia. No passado, era confundido com a enteropatia tropical (ambiental). mas, posteriormente, ficou claro que se tratava de doenças diferentes. Ao contrário da disfunção entérica ambiental, o sprue tropical manifesta‐se por diarreia grave associada a emagrecimento abrupto. No passado, era valorizada a presença de esteatorreia e má absorção de vitamina B12. Não existe um indicador laboratorial específico para seu diagnóstico como os marcadores sorológicos da doença celíaca.3,5
No presente, a forma mais comum de desnutrição energético‐proteica crônica é o déficit de crescimento linear com escore‐z de estatura‐idade inferior a ‐2,0 desvios‐padrão (stunting). Considera‐se que a disfunção entérica ambiental seja um dos fatores determinantes do stunting. Por outro lado, a desnutrição energético‐proteica aguda com expressivo déficit ponderal pode acarretar processo diarreico secundário à atrofia das vilosidades intestinais e inflamação sistêmica. Essas lesões são encontradas, também, no kwashiorkor. Nessas crianças, é difícil a reversão da desnutrição e o risco de morte é elevado.5 Além da enteropatia da desnutrição energético‐proteica e do sprue tropical, outras enteropatias devem ser diferenciadas da disfunção entérica ambiental, como doença celíaca, enteropatia autoimune, enteropatia induzida por anti‐inflamatórios não hormonais, entre outras.5
Papel dos biomarcadores na disfunção entérica ambientalAté o momento os critérios para o diagnóstico da disfunção entérica ambiental ainda não estão estabelecidos. O fato de os sinais e sintomas serem compartilhados por diversas doenças torna a busca por biomarcadores de patogenicidade um desafio. As mesmas alterações observadas na disfunção entérica ambiental (aumento de permeabilidade intestinal, lesão dos enterócitos, inflamação da mucosa) estão presentes, também, em doenças relativamente comuns na mesma faixa etária: doença inflamatória intestinal, doença celíaca, alergia alimentar e até em alguns casos da síndrome do intestino irritável, na qual predomina a inflamação da mucosa.23,24
Para facilitar o entendimento e orientar a interpretação dos biomarcadores associados à disfunção entérica ambiental têm sido propostas diferentes abordagens com o objetivo de avaliar: a) dano e reparo da mucosa intestinal; b) permeabilidade intestinal; c) absorção; d) translocação bacteriana; e) inflamação da mucosa intestinal e sistêmica.
Um biomarcador ideal seria o que tivesse especificidade alta, o que permitiria o refinamento diagnóstico. Devido à complexidade da interação de fatores envolvidos, esse biomarcador ainda não está disponível. No entanto, se for possível identificar a alteração fisiopatológica que está na base do processo, é possível identificar a disfunção intestinal na sua fase inicial, subclínica, e em um momento no qual as intervenções possam ser iniciadas com maior chance de serem efetivas. Do ponto de vista teórico, o estudo histopatológico seria o padrão‐ouro. No entanto, a feitura de um procedimento invasivo (biopsia intestinal) é um fator limitante.23,24
Considerando que as alterações teciduais se correlacionam com o aumento da permeabilidade intestinal, a feitura de um teste diagnóstico capaz de aferi‐la é útil na clínica. Nesse contexto, o teste lactulose/manitol tem bom desempenho, embora apresente algumas dificuldades de interpretação, principalmente em crianças e quando existe associação com sobrecrescimento bacteriano no intestino delgado e/oudisbiose. A falta de padronização e de estudos de validação em relação à técnica e a ausência de padrão de referência são dificuldades que ainda precisam ser sanadas.25,26 As dificuldades incluem necessidade de jejum, coleta completa de urina por período prolongado e a dosagem da lactulose e manitol, que requer a disponibilidade de procedimentos laboratoriais complexos.8
Em condições normais, o manitol é absorvido no intestino delgado, enquanto que lactulose é minimamente absorvida pelos humanose. Portanto, permanece na luz intestinal, onde sofre fermentação bacteriana. Logo, se há comprometimento de área intestinal há redução na absorção do monossacarídeo e consequentemente redução na sua excreção urinária. Por outro lado, se há aumento da permeabilidade intestinal, a lactulose também pode chegar à corrente sanguínea e também ser excretada pelo rim.23,24
Revisão sistemática a partir de estudos originários de diversas regiões mostrou que quando é alta a probabilidade de ocorrência da disfunção entérica ambiental, o teste da lactulose/manitol alterado apresenta boa associação com a presença de stunting. Dessa forma, tem sido usado não somente como um marcador da doença, mas como parâmetro para avaliar efetividade das intervenções.26 Na tabela 1 são apresentados os principais biomarcadores que têm sido pesquisados na disfunção entérica ambiental.20,23,24,27
Métodos propostos para a avaliação da disfunção entérica ambiental
| Método | |
|---|---|
| Biópsia do intestino delgado | Avaliação por microscopia óptica (padrão de referência). Anormalidades observadas também com microscopia eletrônica e endomicroscopia confocal |
| Biomarcador de lesão e reparo da mucosa intestinal | |
| Citrulina | Aminoácido não essencial produzido por enterócitos jovens. Diminui quando ocorrem atrofia das vilosidades intestinais e diminuição da superfície absortiva |
| GLP‐2 (glucagon‐like peptide 2) | Produzido por células endócrinas do íleo. Tem efeito trófico no intestino e fortalece a barreira intestinal |
| REG (regenerating family proteins): | Essas proteínas aumentam nas fezes quando ocorre lesão intestinal |
| Absorção e permeabilidade intestinal | |
| D‐xilose | Absorção diminui quando há atrofia das vilosidades intestinais e diminuição da superfície absortiva. Pode ser metabolizada por bactérias que se encontrem em excesso no intestino delgado. |
| Lactulose:manitol ou lactulose:ramnose | A relação entre o dissacarídeo e o monossacarídeo aumenta quando ocorre lesão associada a aumento da permeabilidade e atrofia das vilosidades intestinais e diminuição da superfície absortiva. |
| Zonulina | Regulação da junção entre enterócitos. Aumenta quando existe lesão na junção entre enterócitos, indica aumento da permeabilidade intestinal. |
| Claudulina 2, 4 e 15 | Regulação da junção entre enterócitos. Aumento de claudulina 2 e 15 indica diminuição da absorção intestinal. Aumento da claudulina 4 indica aumento da função de barreira da mucosa intestinal. |
| Translocação bacteriana | |
| Lipopolissacarídeo (LPS) e anti‐LPS | Ambas as substâncias fazem parte da estrutura das bactérias presentes na luz intestinal. Passagem através da mucosa indica aumento da permeabilidade e translocação bacteriana. Gera resposta imunológica com formação de anticorpos. |
| Flagelina e antiflagelina | |
| EndoCAb (endotoxin core antibody) | Aumento quando há endotoxemia secundária à inflamação desencadeada pela translocação bacteriana |
| Inflamação da mucosa | |
| Mieloperoxidasa (MPO) | Produzida por neutrófilos para destruição bacteriana. Aumenta nas fezes quando há inflamação. |
| Neopterina | Produzida por macrófagos e células dendríticas. Aumenta nas fezes quando há inflamação. |
| Calprotectina | Produzida por neutrófilos. Aumenta nas fezes quando há inflamação. |
| Alfa‐1‐antitripsina | Proteção das células da ação de enzimas produzidas pelos neutrófilos. Aumenta nas fezes quando há inflamação. |
| Inflamação sistêmica | |
| Proteína C reativa (PCR) | Aumenta em processos inflamatórios sistêmicos |
| Ferritina | |
| Interferon gama | |
| Fator de necrose tumoral | |
| Interleucina 6 e 10 | |
| Alfa‐1 glicoproteína ácida | |
| Sobrecrescimento bacteriano no intestino delgado | |
| Cultura de fluido enteral | Idealmente cultura de aeróbios e anaeróbios. |
| Teste respiratório do hidrogênio e metano no ar expirado | Fermentação excessiva de lactulose ou glicose administrada em jejum aumenta a concentração de hidrogênio e/ou metano no ar expirado |
| Microbiota/microbioma fecal | Análise com técnicas de biologia molecular. |
Com base nas referências 15, 20, 23, 24, 27.
A alfa‐1‐antitripsina (AAT) tem a função de proteger as células dos efeitos deletérios de enzimas proteolíticas liberadas por neutrófilos estimulados. Essa proteína não é sintetizada no intestino e sua presença nas fezes reflete aumento da permeabilidade intestinal e perda proteica secundária à inflamação da mucosa. A calprotectina fecal, uma proteína presente no citoplasma dos neutrófilos, é detectada nas fezes quando existe processo inflamatório ativo. Presença de altas concentrações de zonulina nas fezes também sugere aumento da permeabilidade intestinal, uma vez que sua função é modular as junções entre os enterócitos.23,24,27
A citrulina é um aminoácido produzido pelos enterócitos e seus níveis são baixos quando há achatamento das vilosidades e consequente redução de área intestinal. GLP‐2 (Glucagon‐likepeptide 2) é um fator trófico importante na reparação das células intestinais, estimula o crescimento das vilosidades intestinais, a integridade da barreira mucosa e as funções absortivas e tem papel anti‐inflamatório, reduz a inflamação da mucosa intestinal.23,24,27
Como biomarcadores de translocação bacterina têm sido estudados dois componentes estruturais bacterianos, o lipo‐olissacarídeo (LPS) e a flagelina. Como uma das explicações para a presença da inflamação é a exposição sistêmica ao LPS, o Endocab mede essa exposição e está aumentado quando há aumento da permeabilidade intestinal e endotoxemia secundária à inflamação. Outros marcadores da inflamação que têm despertado interesse são a mieloperoxidase (MPO) – uma enzima presente no citoplasma dos neutrófilos – e a neopterina (NEO), que é produzida por macrófagos e células dendríticas.23,24,27
O projeto BEED (Bangladesh Environmental EntericDysfunction)24 tem o objetivo de comparar o desempenho de diferentes biomarcadores frequentemente usados na pesquisa de disfunção entérica ambiental em relação ao exame histopatológico da mucosa do intestino delgado, considerado o padrão‐ouro. O projeto ainda está em andamento e recrutou 400 crianças com stunting e 400 crianças em risco de apresentar retardo de crescimento linear. Uma das expectativas é a criação de um escore que permita refinar o diagnóstico. Uma das dificuldades é que ainda não foi identificado um padrão típico de alterações histológicas da biopsia do intestino delgado que permita definir o padrão‐ouro para diagnóstico da disfunção entérica ambiental.24
Em outro estudo feito na mesma região geográfica com alto risco de disfunção entérica ambiental, que envolveu cerca de 180 lactentes no segundo ano de vida, foi avaliada a concordância entre o teste da lactulose:manitol com um conjunto de biomarcadores indicativos de comprometimento da estrutura da mucosa intestinal e inflamação sistêmica. Os resultados foram desanimadores e concluiu‐se que a existência de outros fatores que podem comprometer a permeabilidade intestinal pode explicar a dificuldade para a interpretação dos testes. Diante da complexidade dos mecanismos patogênicos envolvidos na gênese da disfunção entérica ambiental, ressalta‐se a necessidade de se buscar marcadores com maior especificidade.28
Portanto, ainda não se encontrou um biomarcador ou conjunto de biomarcadores que tenha se mostrado preciso para refinar a probabilidade diagnóstica em um paciente com suspeita clínica de disfunção entérica ambiental. Como os mecanismos fisiopatogênicos e a fisiopatologia são comuns a várias outras doenças, pode‐se especular que esse problema não terá solução em curto prazo.
Disfunção entérica ambiental e crescimentoA estatura final dos seres humanos depende basicamente do genótipo e dos fatores ambientais que influenciam o crescimento.18,19 Mesmo após a redução na sua prevalência, stunting continua a ser um importante problema de saúde pública, presente, praticamente, em todas as regiões do mundo.29 No Brasil, constatou‐se expressiva redução na prevalência do stunting, que diminuiu de 37% em 1974 para 7% em 2007 nas crianças menores de cinco anos.30 Entretanto, no mundo, estima‐se que aproximadamente 25% das crianças nos primeiros cinco anos de vida apresentam déficit de estatura (stunting), caracterizado por escore‐z inferior a ‐2,0 desvios‐padrão em relação à curva de crescimento da Organização Mundial da Saúde, principalmente na África e no Sudeste da Ásia.18,19
O mecanismo de desenvolvimento do déficit de estatura é complexo e não está plenamente esclarecido. Considera‐se que déficits de nutrientes na vida intrauterina e pós‐natal possam contribuir para o seu desenvolvimento. Nos últimos anos, tem sido valorizado, também, o papel da disfunção entérica ambiental no aparecimento do déficit de crescimento linear.18,19
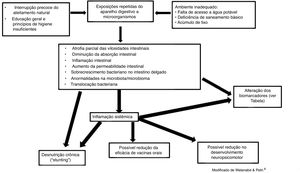
No passado, suspeitava‐se que a má absorção intestinal subclínica observada na disfunção entérica ambiental era o mecanismo mais importante para o comprometimento do estado nutricional e do crescimento. Mais recentemente, tem sido valorizado não somente o acometimento do intestino delgado como também a ocorrência de inflamação sistêmica. A inflamação sistêmica pode ser secundária ao aumento da permeabilidade intestinal, que permite translocação bacteriana e/ou passagem de substância com potencial de gerar resposta inflamatória. Outro aspecto são as mudanças na microbiota intestinal. Assim, recentemente, foram apresentados os seguintes mecanismos para explicar a interferência da disfunção entérica ambiental no crescimento: 1. aumento da permeabilidade intestinal, 2. translocação bacteriana; 3. inflamação intestinal; 4. inflamação sistêmica; 5. disbiose, 6. má absorção de nutrientes.18
Recente revisão sistemática da literatura analisou as publicações entre 2010 e 2018 que relacionaram os indicadores de disfunção entérica ambiental com déficit de crescimento ou estatura.20 Dos cinco artigos publicados que analisaram os indicadores de lesão e ou reparação do intestino delgado (citrulina, proteína ligadora de ácidos graxos intestinais [intestinal fatty acid binding protein], proteínas regeneradoras [regenerating family proteins, REG] e GLP‐2 [glucagon‐likepeptide 2]), apenas dois identificaram relação positiva entre disfunção entérica ambiental e déficit de crescimento.20 Com relação à análise dos dez artigos que avaliaram a permeabilidade intestinal (relação lactulose/manitol ou ramnose; percentagem de absorção de lactulose, zonulina, claudulina‐4 e 15), constatou‐se associação entre aumento da permeabilidade intestinal com déficit de crescimento em metade das publicações.20 Por sua vez, dos 11 estudos que avaliaram indicadores de translocação bacteriana (anticorpo antilipolissacarídeo [LPS] e anticorpo antiflagelina), apenas quatro mostraram associação com comprometimento do crescimento linear. Resultados semelhantes foram encontrados em relação aos indicadores de inflamação no intestino (mieloperoxidade, neopterina e alfa‐1‐antitripsina), ou seja, ausência de relação entre o crescimento linear e inflamação em quatro das cinco publicações.20 Em relação aos indicadores de inflamação sistêmica (citocinas, proteína C reativa, ferritina, entre outros), também foram encontradas informações conflitantes. A tentativa de relacionar os diferentes indicadores de disfunção entérica ambiental não mostrou associação relevante.20 Portanto, até o presente momento, não é possível escolher um marcador não invasivo que permita o estabelecimento do diagnóstico da disfunção entérica ambiental com precisão e definir sua relação com a ocorrência de déficit do crescimento linear.20
No que se refere às mudanças na microbiota intestinal na disfunção entérica ambiental, a maior parte dos estudos avalia o sobrecrescimento bacteriano no intestino delgado e a composição da microbiota fecal. Atualmente, o estudo microbiológico da secreção duodenal é o método mais preciso para avaliar sobrecrescimento bacteriano do intestino delgado. No entanto, considerando a complexidade da coleta e do processamento das amostras, o teste respiratório no ar expirado tem sido usado na pesquisa de sobrecrescimento bacteriano no intestino delgado por não ser invasivo e ter menor custo.14,15 Estudo feito no sul da Ásia avaliou 430 crianças com idade inferior a cinco anos e revelou sobrecrescimento bacteriano no intestino delgado em 12,5% das crianças no primeiro ano de vida e cerca de 30% nos anos subsequentes. A distribuição do sobrecrescimento bacteriano em relação à idade foi semelhante à observada no número de episódios de diarreia aguda.13
No Brasil, foi usado o teste respiratório para pesquisa de sobrecrescimento bacteriano em crianças em idade escolar que viviam em condições ambientais desfavoráveis. Em 2007, foi publicado um estudo feito com 50 crianças entre cinco e 11 anos estudadas em uma favela no interior do Estado de São Paulo.31 Os resultados foram comparados com os obtidos no grupo controle constituído em uma escola particular da mesma cidade. Foram usados o teste respiratório com dois substratos: glicose e lactulose. A glicose não revelou produção expressiva de hidrogênio nas crianças que viviam na favela em relação aos controles. Por sua vez, sobrecrescimento bacteriano no intestino delgado foi mais prevalente nas crianças da favela (37,5%) dos que nos controles (2,1%, p <0,001).31 A média do escore z de estatura‐idade das crianças controles (+ 0,19±0,84) foi maior (p <0,05) do que nas crianças da favela com (‐0,63±0,91) ou sem (‐0,81±1,19) sobrecrescimento bacteriano no intestino delgado. Na favela, o sobrecrescimento bacteriano no intestino delgado não se associou com maior comprometimento da estatura. Outros dois estudos foram feitos em momentos diferentes em favela da região metropolitana da cidade de São Paulo.32,33 Os dados foram comparados com os de crianças de bom nível socioeconômico recrutadas em escola particular da mesma região. No primeiro, constatou‐se maior prevalência de sobrecrescimento bacteriano no intestino delgado das crianças moradoras na favela (30,9%) do que na escola particular (2,4%; p=0,0007). Nas crianças moradoras na favela, os indicadores antropométricos foram semelhantes nas crianças com e sem sobrecrescimento bacteriano. Por outro lado, foram inferiores aos da criança da escola particular, inclusive a estatura.32 Na segunda pesquisa constatou‐se sobrecrescimento bacteriano no intestino delgado em 61,0% das 100 crianças avaliadas em uma favela.33 Foi verificada menor média do escore‐z do índice estatura para idade (‐0,48±0,90 vs. ‐0,11±0,97) e de hemoglobina capilar (12,6±1,0 vs. 13,4±1,2 g/dL) no grupo de crianças com sobrecrescimento bacteriano no intestino delgado, quando comparadas com aquelas que não apresentavam sobrecrescimento bacteriano no intestino delgado (p <0,05).33 Infelizmente, neste estudo, não foram avaliados os indicadores de inflamação sistêmica.
O desenvolvimento de sobrecrescimento bacteriano no intestino delgado em moradores de áreas com condições ambientais insatisfatórias foi atribuído à inibição do complexo inibidor migratório secundário à exposição repetida do tubo digestivo a lipopolissacarídeos (LPS) através da ingestão de água ou do solo contaminado com bactérias.14 Diminuição do peristaltismo aumenta o tempo de trânsito e facilita a proliferação microbiana. Essa hipótese apoia‐se em modelos animais nos quais se mostrou diminuição da frequência e vigor das contrações peristálticas no intestino delgado induzida pelo LPS produzido pela Escherichia coli. Adicionalmente, em camundongos livres de micro‐organismos (germ‐freemice), o Lactobacillus acidophilus e o Bifidobactrium bifidus provocam aumento no complexo inibidor migratório, enquanto o Micrococcusluteus e a Escherichia coli diminuem. São poucas as evidências de efetivo comprometimento do estado nutricional vinculado ao sobrecrescimento bacteriano do intestino delgado. No Brasil, constatou‐se que, em crianças moradoras em uma favela entre cinco e 11 anos, as que apresentavam sobrecrescimento bacteriano apresentavam menores valores do escore z de estatura‐idade.33 Esses dados podem ser explicados pela má absorção intestinal, conforme caracterizado na década de 1990, em uma comunidade de Burma/Myanmar.34,35 Constatou‐se, com o teste do hidrogênio no ar expirado, menor absorção de uma refeição‐teste com arroz nas crianças com sobrecrescimento bacteriano do intestino delgado. Constataram, longitudinalmente, que a velocidade de crescimento em estatura das crianças com má absorção de arroz foi menor.34,35 Esse é o único estudo longitudinal que mostra que o sobrecrescimento bacteriano pode comprometer o crescimento.
Outro possível mecanismo para explicar o efeito do sobrecrescimento bacteriano no intestino delgado é o aumento da permeabilidade intestinal.14 Assim, pode ocorrer comprometimento funcional da junção firme entre enterócitos com consequente endotoxemia e inflamação sistêmica. Deve ser lembrado o papel da microbiota intestinal no estado de homeostaseintestinal. É bem conhecido que a microbiota regula não somente a barreira intestinal, como também a função imunológica intestinal, interage de maneira complexa, resulta na manutenção de um nível basal mínimo de inflamação e controla a ocorrência de resposta inflamatória plena.14
Do ponto de vista microbiológico, a microbiota fecal de crianças e adultos de Bangladesh que vivem em favelas onde a enteropatia ambiental é prevalente apresenta marcantes diferenças em relação moradores nos Estados Unidos da América.5 Amostras de um pequeno número (quatro a seis) de crianças e adultos foram avaliadas mensalmente por cerca de seis meses. Observou‐se que a microbiota dos indivíduos de Bangladesh apresentava maior diversidade e menor estabilidade do que a observada nos americanos. Em relação aos americanos, as fezes da casuística de Bangladesh eram mais ricas em Prevotella, Butyrivibrio e Oscillospira e apresentavam maior abundância de Bacterioides.36 As diferenças da microbiota podem estar relacionadas com o tipo de dieta das comunidades que apresentam elevada prevalência de disfunção entérica ambiental, que, em geral, são ricas em amido e fibras alimentares e pobres em proteína e gordura de origem animal.5 Um exemplo é o estudo que comparou a microbiota de 11 crianças africanas de comunidades rurais de Burkina Faso, 13 em áreas urbanas do mesmo país e 13 de crianças italianas de Florença.37,38 Observou‐se que quando alimentos de origem animal e carboidratos simples são incluídos na dieta em áreas urbanas do país africano, a microbiota passa apresentar maior abundância de bactérias com maior capacidade para metabolizar esses alimentos, a exemplo do observado em crianças europeias. Esse processo se associa com redução na produção de ácidos graxos de cadeia curta pela microbiota intestinal. Crianças que vivem nas comunidades rurais permanecem com microbiota com maior riqueza de Prevotella, Treponema e Succinivibrio, que apresentam maior especificidade para alimentos de dieta rica em fibra alimentar e outros carboidratos complexos presentes em vegetais.37,38
Projeto feito na Região Metropolitana de São Paulo comparou a microbiota de 100 crianças em idade escolar moradoras em uma favela com a de 30 crianças que viviam em boas condições ambientais recrutadas em escola particular. Foi usada a técnica do PCR em tempo real para a quantificação dos filos, gêneros e espécies selecionadas. As crianças que viviam em condições desfavoráveis apresentam maior número de bactérias, organismos dos filos Firmicutes e Bacteroidetes, dos gêneros Escherichia e Lactobacillus e menores contagens de Salmonella. Observou‐se também menor prevalência e contagens de Clostridium difficile. Comparativamente, especulou‐se que a maior participação de Salmonella e Clostridium difficile possa representar aspectos negativos na microbiota das crianças que vivem em boas condições ambientais.39 É interessante mencionar que se constatou, também, maior quantidade da archea Methanobrevibacter smithii nas crianças moradoras na favela acompanhada de maior produção de metano caracterizada no ar expirado, o que indica diferente padrão de metabolismo bacteriano.40 Nas crianças das favelas com sobrecrescimento bacteriano no intestino delgado, segundo o teste respiratório com lactulose, constatou‐se que a microbiota fecal apresentava menor contagem de bactérias e Firmicutes e maior contagem de bactérias do gênero Salmonella.
Entretanto, ainda existem muitas questões sobre o papel da microbiota no desenvolvimento da disfunção entérica ambiental, como a estabilidade do perfil da microbiota das crianças em risco de stunting, se existem particularidades na microbiota das crianças que vivem em países não industrializados que não apresentam stunting e se são possíveis intervenções para corrigir os eventuais desvios da microbiota intestinal.41 Outra questão é sobre a validade de considerar a microbiota fecal como um indicador das anormalidades que ocorrem no intestino delgado, inclusive o sobrecrescimento bacteriano. Estudos com técnicas de biologia molecular poderão contribuir para o melhor entendimento da microbiota no intestino delgado proximal. Lembra‐se, no entanto, a dificuldade e o caráter invasivo da coleta de amostras dessa porção do intestino, a exemplo da obtenção de fragmentos de tecido para os estudos histológicos.
Disfunção entérica ambiental e resposta à imunização oralExistem evidências de que o estado inflamatório local e sistêmico descrito na disfunção entérica ambiental, além de ser a principal causa do stunting, pode também diminuir a resposta das vacinas orais.42,43
Nesse contexto, diminuição da resposta à vacina do rotavírus, vacina oral contra poliomielite e vacina atenuada da cólera observada principalmente na África e na Ásia tem sido associada com a disfunção entérica ambiental. Várias hipóteses têm sido levantadas para explicar o fenômeno, desde a heterogeneidade de cepas, o que dificultaria o desenvolvimento de uma vacina que tivesse o mesmo desempenho universalmente, até fatores associados ao hospedeiro e ao ambiente.42,43 Em editorial recente,44 foi discutida a hipótese de que as características da microbiota intestinal, as alterações na mucosa intestinal decorrentes do processo inflamatório que afeta principalmente a resposta imunológica inata e o estado pró‐inflamatório sistêmico poderiam estar envolvidos na resposta comprometida às vacinas orais documentada em crianças que vivem em regiões com más condições de higiene ambiental.
Estudos do tipo caso‐controle aninhados em ensaios clínicos feitos em Gana e na Índia mostraram que a microbiota intestinal analisada antes de as crianças receberem a vacina do rotavírus era qualitativamente diferente entre as crianças que responderam e as que não responderam ao estímulo vacinal.45,46 Esses estudos também compararam a microbiota intestinal das crianças de Gana e da Índia respondedoras ao estímulo vacinal com um grupo de crianças alemãs e constataram que o perfil da microbiota dos dois grupos era semelhante. Por outro lado, a microbiota das crianças não respondedoras apresentava diferenças em relação às crianças alemãs.45,46 Esses achados não podem ser extrapolados para toda a população infantil que vive em ambientes contaminados, uma vez que essa hipótese não foi corroborada em outros contextos, nos quais a prevalência da disfunção entérica ambiental é elevada.47
Artigo recente de revisão48 analisou os oito estudos feitos na África, Ásia e América do Sul com o objetivo de avaliar a resposta a vacinas orais em regiões onde é alta a frequência de disfunção entérica ambiental. Foram encontradas várias dificuldades para a interpretação integrada desses estudos, entre as quais: critérios diagnósticos diferentes para disfunção entérica ambiental, uso de biomarcadores que podem ser alterados por outras doenças e outras limitações na metodologia desses artigos. Assim, não foi possível chegar a conclusões substanciais. Dos oito artigos, quatro mostraram evidência de que a resposta vacinal foi menor em crianças com alta probabilidade de disfunção entérica ambiental, dois encontraram um resultado inverso, ou seja, maior imunogenicidade vacinal, e dois não encontraram relação estatisticamente significante. Concluem que embora seja plausível do ponto de vista biológico, ainda não há dados empíricos suficientes que permitam um posicionamento definitivo sobre a possibilidade de a disfunção entérica ambiental reduzir a responsividade das vacinas orais em regiões subdesenvolvidas.
No entanto, é importante registrar que esses resultados não devem desencorajar o uso dessas vacinas em populações de risco para disfunção entérica ambiental, porque mesmo que tenham menor efetividade, a imunização é capaz de proteger um número significativo de crianças e contribuir para redução de hospitalizações e mortes.42 Ou seja, esses dados devem ser considerados uma indicação da necessidade urgente de controle da disfunção entérica ambiental.
Disfunção entérica ambiental e desenvolvimento neurocognitivoEstudos experimentais têm mostrado que o estado inflamatório pode induzir alterações neurocognitivas. Teoriza‐se que, além do estado inflamatório, metabólitos associados à disbiose intestinal estimulam a produção de neurotransmissores que interferem no processo do desenvolvimento do cérebro. Em humanos, é mais difícil avaliar esse processo porque os processos inflamatórios podem estar associados a outros fatores, como déficit de micronutrientes (ferro), falta de estímulos ambientais, situação de pobreza e disbiose intestinal.8
Um estudo multicêntrico intitulado MAL‐ED (The Etiology, Risk Factors and Interactions of Enteric Infections and Malnutrition and the Consequences for Child Health and Development) acompanha uma coorte de 1.600 crianças recrutadas ao nascimento em oito países (África do Sul, Bangladesh, Brasil, Índia, Nepal, Paquistão, Peru e Tanzânia). Dados sobre exposições ambientais, inflamação intestinal, avaliação da permeabilidade intestinal, exposição a enteropatógenos, medidas periódicas da ingestão alimentar, inclusive micronutrientes, resposta às vacinas orais, desenvolvimento cognitivo e acompanhamento do crescimento, estão sendo analisados. Esse projeto permite estudar as consequências da disfunção entérica ambiental em diferentes contextos geográficos e epidemiológicos.27 A figura 1 esquematiza a etiologia e consequências da disfunção entérica ambiental.
Considerações finaisAté o presente momento não existe medida preventiva ou terapêutica plenamente efetiva para a disfunção entérica ambiental. Desde a década de 1970 existem evidências de que as anormalidades da disfunção entérica ambiental podem regredir com a melhoria das condições ambientais.9 Considerando que as exposições repetidas do intestino a agentes infecciosos constituem um dos mecanismos mais valorizados na gênese da disfunção entérica ambiental,21 as medidas de prevenção e o tratamento da diarreia aguda podem ter um impacto importante na redução do problema.21,49,50
Nesse contexto, valoriza‐se não somente a distribuição de água tratada e saneamento, como também o aprimoramento da terapia de reidratação oral, suplementação com zinco e vitamina A.21,49,50
O uso de antimicrobianos não absorvíveis não se acompanhou de normalização da permeabilidade intestinal aferida pelo teste da lactulose/manitol.21 Por outro lado, constatou‐se normalização do teste do hidrogênio no ar expirado com lactulose após a administração de antimicrobianos durante duas semanas para escolares com sobrecrescimento bacteriano no intestino delgado que moravam em uma favela localizada em região metropolitana do Brasil.51 Tratamento do sobrecrescimento bacteriano do intestino delgado deve ser considerado, principalmente quando o paciente apresenta manifestações clínicas gastrintestinais.
Para finalizar, deve ser enfatizado que alterações do trato gastrointestinal tradicionalmente descritas como associadas à desnutrição primária grave têm sido descritas em crianças com quadros mais leves de desnutrição e estão incluídas no diagnóstico de disfunção entérica ambiental. Essa constatação é interessante porque ajuda a entender por que intervenções focadas apenas na oferta de alimentos não conseguem impactar na recuperação nutricional em muitos casos, principalmente na retomada do crescimento linear. A sobreposição das duas desordens torna mais difícil a recuperação do estado nutricional das crianças.49
Um outro aspecto a ser ressaltado é o risco maior de essas crianças que tiveram comprometimento da estatura na infância precoce apresentarem na idade adulta excesso de peso e obesidade quando expostas a uma dieta rica em energia, o que tem sido chamado triple burden. Ou seja, no início da vida crianças que vivem em um ambiente com grau elevado de contaminação ambiental têm maior exposição às infecções intestinais e à desnutrição (double burden) e na vida adulta acrescentam‐se o excesso de peso/obesidade e as comorbidades associadas (triple burden).49
Do que se conhece até o momento, estudos epidemiológicos substanciais mostram que o stunting é mais observado em regiões pobres, com alta contaminação ambiental, onde é mais frequentemente relatada alta prevalência de disfunção entérica ambiental. No entanto, a sobreposição com outros fatores que podem comprometer o crescimento linear dificulta a se chegar a uma conclusão definitiva. Vários estudos de coorte estão em andamento e no futuro é possível que tenhamos dados mais confiáveis que permitam fazer uma inferência causal com segurança.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Morais MB, Silva GA. Environmental enteric dysfunction and growth. J Pediatr (Rio J). 2019;95:S85–S94.