To compare bacterial growth in pure colostrum versus colostrum with human milk fortifier (HMF) containing iron.
MethodsThe growth of Escherichia coli, Staphylococcus aureus, and Pseudomonas aeruginosa in 78 samples of pure colostrum or colostrum with added iron-containing HMF was compared. For qualitative analysis, filter paper discs were immersed in samples from each group and incubated for 48hours with 101 colony forming units (CFUs)/mL of each strain. For quantitative assessment, 1mL of each strain containing 107 CFUs/mL was homogenized with 1mL of either colostrum or colostrum with human milk fortifier, seeded into a Petri dish, and incubated at 37°C. Twenty-four hours later, the number of CFUs was counted.
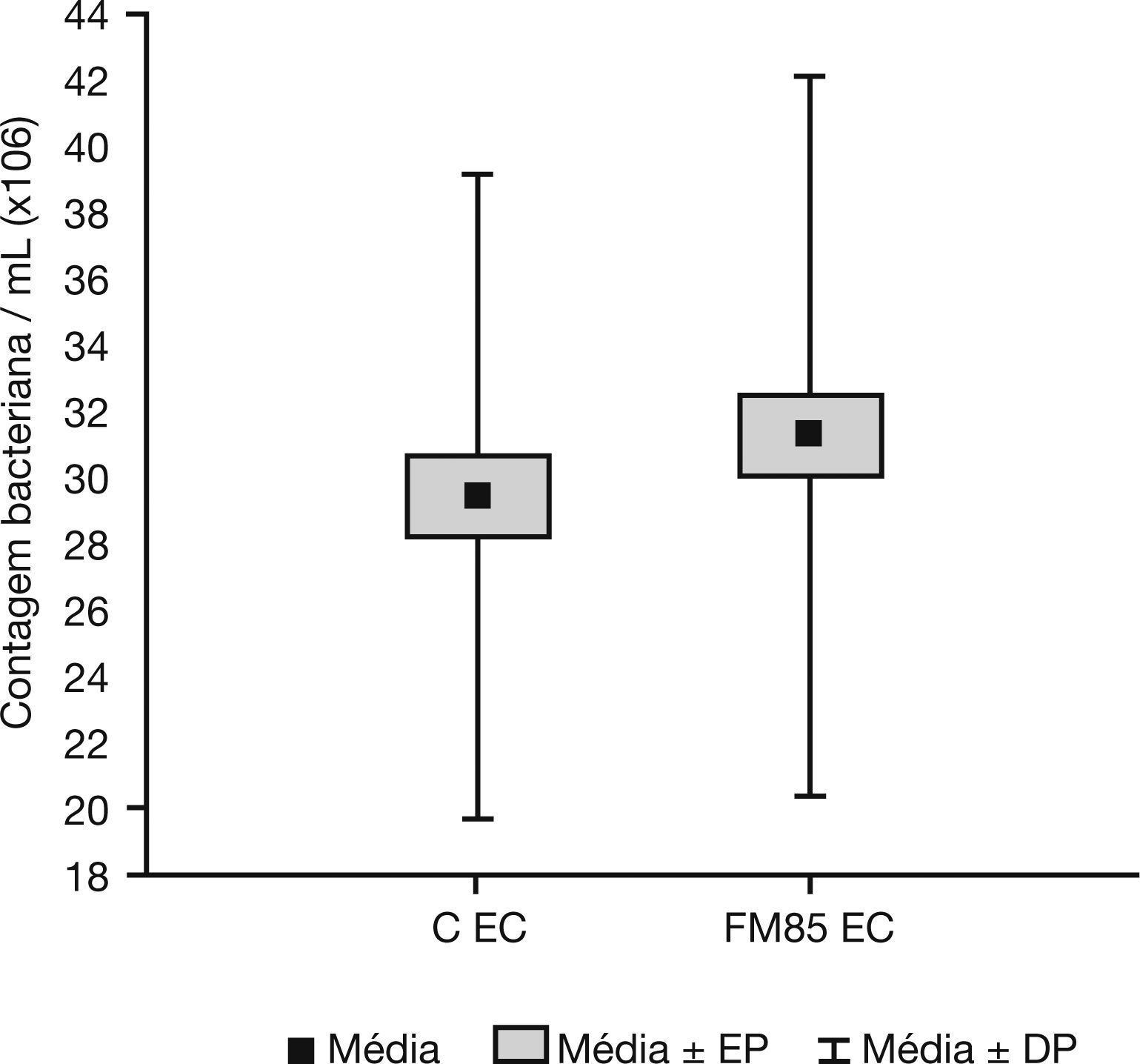
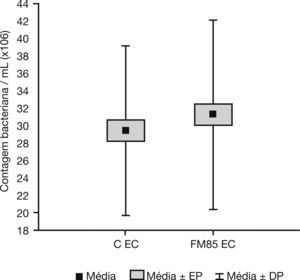
ResultsThe qualitative analysis showed no difference in bacterial growth. In the quantitative evaluation, E. coli growth in the control group was 29.4±9.7×106 CFU/mL, while in the HMF group it was 31.2±10.8×106 CFU/mL. The difference between the average growth was 1.9±4.9×106 CFU/mL (p=0.001). There were no differences in S. aureus and P. aeruginosa growth.
ConclusionAddition of iron at this concentration reduces breast milk bacteriostatic action against E. coli.
Comparar o crescimento bacteriano em colostro puro e colostro com aditivo do leite materno contendo ferro.
MétodosForam comparadas 78 amostras de colostro puro ou colostro com adição de aditivo do leite materno contendo ferro para avaliar o crescimento de Escherichia coli, Staphylococcus aureus e Pseudomonas aeruginosa. Para a análise qualitativa, discos de papel-filtro foram imersos em amostras de cada grupo e incubados por 48 horas com 101 Unidades Formadoras de Colônias/mL de cada cepa. Para a avaliação quantitativa, 1mL de cada cepa contendo 107 Unidades Formadoras de Colônias/mL foi homogeneizado com 1mL, tanto de colostro puro quanto de colostro com aditivo do leite materno, espalhado em placa de Petri e incubado a 37°C. O número de Unidades Formadoras de Colônias foi contado 24 horas depois.
ResultadosA análise qualitativa não mostrou nenhuma diferença no crescimento bacteriano. Na avaliação quantitativa, o crescimento de Escherichia coli (EC) no grupo C foi de 29,4±9,7×106 CFU/mL, enquanto no grupo FM85 foi de 31,2±10,8×106 CFU/mL. A diferença entre o crescimento médio foi de 1,9±4,9×106 CFU/mL (p=0,001). Não houve diferenças no crescimento de Staphylococcus aureus e Pseudomonas aeruginosa.
Conclusão: A adição de ferro a essa concentração reduz a ação bacteriostática do leite materno contra Escherichia coli.
O leite materno é o alimento ideal para ser ofertado ao recém-nascido devido aos seus benefícios no crescimento e desenvolvimento e de seus fatores imunológicos.1,2 O leite materno também é considerado o alimento ideal para o recém-nascido pré-termo.2,4 Entretanto, devido à necessidade nutricional aumentada deste grupo, o leite materno como fonte exclusiva de nutrição muitas vezes é insuficiente para atender às necessidades nutricionais, principalmente em recém-nascidos pré-termo com peso inferior a 1.500g. O aditivo de leite materno pode ser utilizado, com o objetivo de manter as vantagens do aleitamento materno e aumentar o aporte de nutrientes.4,6–10 O único aditivo de leite materno disponível no Brasil no momento do presente estudo foi reformulado com acréscimo de ferro (0,28mg por grama de aditivo).
O leite materno (LM) promove benefícios imunológicos, entre os quais se destaca a capacidade bacteriostática da lactoferrina.11 A lactoferrina é uma proteína vinculada ao ferro que demonstrou agir contra bactérias, vírus e fungos,11,12 estimular o sistema imunológico e a função imunitária das mucosas,11 e apresentou efeitos antioxidantes e anticancerígenos.11–13 A suplementação de lactoferrina bovina demonstrou prevenir a sepse em neonatos com peso muito baixo ao nascer, reduzir a doença do trato respiratório e causar o aumento de hematócritos em neonatos saudáveis amamentados por mamadeira.14,15 No leite materno humano, a lactoferrina age na mucosa dos recém-nascidos, protegendo-os de infeções vinculadas ao ferro e resguardando o leite materno de bactérias patológicas que precisam do ferro para proliferar.7–11 Para manter essa capacidade bacteriostática, a lactoferrina precisa estar em um ambiente com baixa concentração de ferro. Se o ferro exógeno for adicionado ao leite materno, os benefícios da lactoferrina poderão ser prejudicados, o que, por sua vez, pode aumentar o risco de infecção em recém-nascidos.7–10
O objetivo deste estudo foi comparar o crescimento de bactérias patogênicas no colostro em relação àquele complementado com aditivo e enriquecido com ferro.
2Materiais e métodosAs amostras de colostro foram coletadas de lactantes a termo durante o período de 2010 e 2011. Foram coletados 10mL de leite materno de cada mãe. Os critérios de inclusão foram lactantes brancas saudáveis a termo; os de exclusão foram mães que tiveram partos cesáreos, que receberam tratamento com antibiótico, com suspeita de infecção ou mães com histórico de fumo.
As mães foram abordadas pelo pesquisador após o parto, sempre acompanhadas por médicos residentes de obstetrícia e ginecologia.
As participantes foram questionadas sobre seu peso e idade antes da gravidez. Elas foram instruídas sobre como coletar o leite materno de forma asséptica. A coleta de amostras podia ser feita manualmente ou com uma bomba de sucção manual, de acordo com a preferência da mãe. Aquelas que escolheram utilizar a bomba de sucção manual receberam material esterilizado por óxido de etileno, contendo um frasco, um tubo de polipropileno e um êmbolo de borracha, e foram orientadas sobre como utilizá-lo (de acordo com as instruções do fabricante).
As amostras foram coletadas em vidros esterilizados e fechados com tampas de borracha, igualmente esterilizadas. Para as mães que utilizaram bomba de sucção manual o LM foi armazenado no frasco acoplado à bomba, fechado com tampa de polipropileno. No laboratório o leite foi transferido para o frasco padrão para ser armazenado. Os frascos foram identificados com etiqueta contendo número da amostra, data e horário de coleta.
As amostras foram mantidas em um refrigerador a uma temperatura de 4 a 6°C e analisadas em 72 horas. Cada amostra foi dividida em duas outras de 5mL, uma para ser analisada como controle (leite humano puro), e outra para adicionar o aditivo. O aditivo foi adicionado pouco antes das análises, na proporção de 5%, que resultou em 0,25g de aditivo para cada 5mL de leite materno (instruções do fabricante). O aditivo foi pesado em uma balança analítica.
A prova de esterilidade foi aplicada a todas as amostras segundo o método de Almeida e Novak.16 As amostras foram espalhadas em caldo de tioglicolato e de soja tripticaseína. Foi espalhado 0,4mL de leite materno em 10mL de cada um dos caldos, utilizando uma pipeta automatizada esterilizada. As amostras foram então incubadas a 36,4°C por 48 horas. As análises de leitura foram feitas após 24 e 48 horas.
A avaliação qualitativa da capacidade bactericida foi avaliada segundo a metodologia proposta pela Sociedade Americana de Microbiologia17 e Chan.8 As seguintes bactérias foram obtidas de cepas clínicas isoladas: Escherichia coli, Staphylococcus aureus e Pseudomonas aeruginosa, sob cultivo de 18 a 24 horas em ágar infusão cérebro-coração (BHI).
Cada cepa de cultura de bactérias foi preparada em caldo infusão cérebro-coração (BHI) em placa de ágar a 37°C. Para cada amostra, uma colônia foi ressuspensa em salina e diluída até a concentração desejada (101 Unidades Formadoras de Colônias – UFC/mL) em comparação ao tubo padrão da escala de Mac-Farland. Duas placas de Petri contendo ágar BHI foram preparadas para cada cepa de bactérias e receberam, individualmente, 101 UFC/mL de cada cepa, tendo sido identificadas com a cepa e o número da amostra.
Os discos de papel-filtro esterilizados foram imersos em amostras de leite materno puro, sendo denominante o grupo de controle (C), ou em leite materno acrescido de Aditivo do Leite Materno, sendo denominantre o grupo FM85. Os discos foram colocados nas placas de Petri e incubados por 48 horas. Os halos de inibição foram então mensurados. Quatro discos foram colocados em cada placa de Petri. Um modelo padrão, mantendo as mesmas distâncias entre os discos, determinou as localizações dos discos.
Para avaliação quantitativa de amostras de leite materno, as amostras foram avaliadas segundo a metodologia proposta por Hernandez et al.18 Foram utilizadas as mesmas amostras de colostro puro e colostro com aditivo, bem como as mesmas cepas de bactérias da avaliação qualitativa. Entretanto, a concentração de bactérias foi de 107 unidades de formação de colônias (UFC)/mL. Foi homogeneizado em um agitador magnético 1mL da suspensão de bactérias com 1mL de leite materno puro, ou 1mL de leite materno acrescido de aditivo. Dessa mistura, 1mL foi espalhado em placas de Petri com ágar BHI. As placas foram então incubadas a 37°C por 24 horas. A quantidade de UFC foi contada após o período de incubação.
O tamanho da amostra foi determinado pelo SIGMA, aceitando uma margem de erro de 5% e variação do crescimento bacteriano de 10%. Esse cálculo sugeriu, no mínimo, 40 amostras.
3Análise estatísticaOs resultados obtidos no estudo foram expressos como médias e desvios-padrão. Para comparar o crescimento bacteriano entre o colostro e os colostros + aditivo, foi utilizado o teste t- Student para amostras pareadas. O coeficiente de correlação de Pearson foi calculado para avaliar a correspondência entre os dois tipos de leite. Essa mesma análise estatística foi utilizada para avaliar a correlação entre a quantidade de bactérias e a idade da mãe, bem como o peso antes da gravidez. Valores de p<0,05 foi considerado estatisticamente significativo. Os dados foram analisados com o software de computador (StatSoft Inc., EUA).
O protocolo de pesquisa foi aprovado pelo Comitê de Ética e Pesquisa do Hospital Angelina Caron e pelo Comitê de Ética e Pesquisa do Hospital das Clínicas – Faculdade de Medicina da Universidade de São Paulo. Todos os procedimentos seguiram as normas éticas do comitê responsável sobre experimentos com humanos dos comitês de ambas as instituições. Os procedimentos também estavam de acordo com a Declaração de Helsinki de 1975. Todos os participantes receberam uma explicação detalhada do protocolo e assinaram um consentimento informado que delineou sua participação neste estudo.
4ResultadosForam coletadas 78 amostras de leite materno. Apenas três mães se recusaram a doar suas amostras de leite, duas devido à dor e uma por motivos pessoais.
A idade média das participantes foi de 25,2±6,6 anos, e a média de peso corporal antes da gravidez foi de 60,6±10,1kg.
A prova de esterilidade confirmou que todas as amostras se encontravam estéreis.
A análise qualitativa mostrou que em todas as amostras, tanto com LM puro como com LM+FM85® houve crescimento bacteriano semelhante. Não foi possível observar halo de inibição de crescimento bacteriano próximo aos confetes contendo as amostras de LM puro ou aditivado em nenhum caso. A avaliação quantitativa mostrou que a média de crescimento da Escherichia coli no grupo C foi de 29,4±9,7×106 CFU/mL, enquanto no grupo FM85 foi de 31,2±10,8×106 CFU/mL. A diferença entre o crescimento médio nos grupos C e FM85 foi de 1,9±4,9 × 106 CFU/mL (p=0,001) (fig. 1).
Crescimento bacteriano de Escherichia coli no grupo de controle e no grupo aditivo do leite materno. CEC, crescimento bacteriano de Escherichia coli no grupo C (leite materno puro); DP, desvio-padrão; EP, erro padrão; FM85 EC, crescimento bacteriano de Escherichia coli no grupo HMF (leite materno + FM85).
A média de crescimento da Staphylococcus aureus foi de 43±11,6 × 106 CFU/mL no grupo C, e 43,2±12,6×106 CFU/mL no grupo FM85. A diferença média entre os dois grupos foi de 0,3±4,5×106 CFU/mL (p=0,614). A média de crescimento da Pseudomonas aeruginosa foi de 51,1±12,0×106 CFU/mL no grupo C, e 51,5± 2,0×106 CFU/mL no grupo FM85. A diferença média entre os dois grupos foi de 0,4±3,0×106 CFU/mL (p=0,285).
As variáveis peso corporal e idade antes da gravidez não estavam correlacionadas ao crescimento bacteriano (o coeficiente de correlação para todas as cepas foi p>0,05).
Para cada cepa de bactéria, foi estimado o coeficiente de correlação entre a quantidade de bactérias no grupo C e no grupo FM85. O coeficiente de correlação entre o grupo C Escherichia coli e o grupo FM85 Escherichia coli foi de 0,89 (p<0,001); entre o grupo C Staphylococcus aureus e o grupo FM85 Staphylococcus aureus foi de 0,94 (p<0,001); e entre o grupo C Pseudomonas aeruginosa e o grupo FM85 Pseudomonas aeruginosa foi de 0,97 (p<0,001).
5DiscussãoTodas as amostras foram coletadas em até dois dias após o parto. Não houve crescimento de bactérias ou fungos nas amostras, conforme determinado pela prova de esterilidade, nem contaminação durante a coleta e armazenagem, o que valida a metodologia aplicada.
As variáveis idade e peso corporal pré-gestacional não mostraram qualquer correlação com o crescimento bacteriano. O peso pré-gestacional foi o único parâmetro nutricional avaliado neste estudo. Collado et al.19 associaram a função imunomodulatória do leite humano com o sobrepeso e o ganho de peso durante a gravidez. Nesse estudo, as mães com excesso de peso tiveram menores níveis de TGF-β2 e CD14 em comparação com aquelas de peso normal. O peso materno e o ganho de peso durante a gravidez também pareceram afetar a composição microbiana fecal dos neonatos, pois os nascido de mães de peso normal e ganho de peso normal durante a gravidez apresentaram níveis mais altos de Staphyloccocus sp. e menores níveis de Bifidobacterium sp.19,20 Estudos anteriores não constataram relação entre a hemoglobina e os níveis de ferro da mãe e o teor de ferro e lactoferrina em seu leite materno.21,22 Em contrapartida, outros estudos demonstraram que o estado nutricional materno afeta a composição do leite humano.23,24
A idade das mães (25,2±6,6 anos) mostrou que a população do estudo foi composta por mães adultas, o que possivelmente fez com este parâmetro não fosse correlacionado com o crescimento bacteriano. O LM de mães adolescentes pode apresentar deficiência de nutrientes, devido ao período de rápido crescimento das mães durante esta fase da vida.25,26
Decidimos coletar o colostro, assim como em outros estudos, devido à sua concentração mais elevada de lactoferrina,22 e também porque poderíamos uniformizar a concentração da mesma nas amostras. A coleta também foi mais fácil porque coletamos amostras logo após o parto, enquanto as mães ainda estavam no hospital.
A análise qualitativa feita neste estudo não conseguiu confirmar um efeito bacteriostático no leite, já que não houve formação de uma zona de inibição do crescimento bacteriano; portanto, não foi possível medir os halos, ao contrário dos resultados obtidos por Chan et al.7,8 Nesses estudos, houve inibição do crescimento bacteriano no leite materno puro e no leite materno com aditivo sem adição de ferro (0,2mg/100mL de leite materno), porém não se constatou inibição do crescimento bacteriano quando o leite materno foi complementado com aditivo contendo ferro adicional (1,5mg de ferro em 100mL de leite materno).
Santiago et al.10 compararam o crescimento de bactérias gram-positivas e gram-negativas em amostras de leite materno complementado com o mesmo aditivo utilizado por Chan et al.7,8 Os autores realizaram contagens totais de bactérias em amostras congeladas no instante 0, após 24 e 72 horas, com e sem adição de aditivo. Eles não encontraram diferenças na redução do crescimento bacteriano em ambos os grupos e também concluíram que as propriedades antibacterianas do leite humano, com ou sem aditivo, podem durar 72 horas. Esses resultados também validam a metodologia de refrigeração aplicada. Da mesma forma, Yuen et al.27 analisaram 25 colostros e 11 amostras maduras de leite após serem armazenadas a 4°C e -20°C, e concluíram que todos os fatores nutricionais e imunológicos foram adequadamente preservados após três dias de refrigeração.
Ovali et al.9 compararam a capacidade bacteriostática do leite materno puro, do leite materno com aditivo sem adição de ferro e do leite materno com sulfato ferroso (0,38mg em 30mL de leite materno), utilizando a mesma metodologia proposta por Chan, e com as mesmas cepas de bactérias utilizadas neste estudo. Ao contrário dos resultados deste estudo, os autores concluíram que a adição de sulfato ferroso a 0,38mg em 30mL de leite materno inibiu a capacidade bacteriostática em todas as cepas.
Todos os estudos citados analisaram amostras de leite de mães de recém-nascidos pré-termo enquanto o nosso estudo incluiu mães que deram à luz no tempo certo. A incidência de partos de RN pré-termo no Hospital Maternidade onde o estudo foi realizado é pequena, por isso optou-se por utilizar amostras de LM de mães de RN de termo. É importante perceber que este pode ser um motivo para os resultados terem sido diferentes.
Relatos anteriores sobre os níveis de lactoferrina no leite pré-termo apresentaram tanto valores significativamente maiores em relação ao leite a termo28 quanto nenhuma diferença entre eles.29 Ronayne de Ferrer et al.30 não constataram em seu estudo qualquer diferença entre os valores de lactoferrina de mães pré-termo e de mães a termo, apesar da tendência observada em amostras de colostro, nas quais o leite a termo tendia a apresentar níveis mais elevados do que o leite pré-termo. O mesmo estudo,30 da mesma forma que outros,22 mostrou que os valores da concentração lactoferrina diminuem, principalmente no leite a termo. Também é importante perceber que os níveis de lactoferrina variam em populações diferentes, como alguns estudos também mostraram.31
Analisamos o colostro a termo em vez do colostro pré-termo, e essa pode ser uma limitação para o nosso estudo, apesar de os níveis de lactoferrina do colostro pré-termo e a termo não parecerem claros. Ao estendermos nossos resultados para a área clínica, é importante ressaltar que, apesar de o aditivo ser de fato utilizado para neonatos pré-termo, temos, no Brasil, uma grande quantidade de neonatos pré-termo que recebem aditivo adicionado ao leite materno de Bancos de Leite e, nesse caso, normalmente recebem leite a termo.
Nenhum dos estudos anteriores avaliou o crescimento bacteriano com adição do aditivo utilizado neste estudo, que é o único aditivo disponível no Brasil (0,28mg de ferro em 1g de aditivo). Também é importante considerar que, nos estudos de Chan, diferentes cepas de bactérias foram analisadas: Escherichia coli, Staphylococcus, Enterobacter sakazakii e Streptococcus Grupo B. Em nosso estudo, o crescimento de Escherichia coli foi maior nas amostras com aditivo, como nos estudos de Chan et al.7,8
As cepas de bactérias selecionadas para este estudo são as mais frequentemente relatadas pela Comissão de Controle de Infecções Hospitalares da unidade em que o estudo foi realizado.
Os coeficientes de correlação entre as amostras do grupo C e as amostras do grupo FM85 foram significativos em todas as cepas de bactérias, o que mostra que o crescimento bacteriano foi semelhante em todas as amostras quando os dois grupos foram comparados, comprovando que ele seguiu o mesmo padrão de crescimento em ambos os grupos, independentemente da adição de aditivo.
O mecanismo pelo qual a lactoferrina inibe o crescimento bacteriano ainda não está claro. A capacidade bacteriostática da lactoferrina normalmente é atribuída à sua capacidade de quelar o ferro, restringindo este nutriente essencial para a proliferação de bactérias patogênicas. Contudo, é importante ressaltar que estudos também mostraram que a atividade bactericida não depende do grau de saturação da lactoferrina com ferro. Como a lactoferrina demonstrou afetar o sistema imunológico e a função imunológica da mucosa, a adição de ferro, provavelmente, também poderia afetar essas ações. Entretanto, como nosso estudo foi feito in vitro, não conseguimos analisar essas funções.7,11–13,32,33
Devemos ser cautelosos ao estendermos nossos resultados para a prática clínica. As análises in vitro indicam que o aditivo atualmente disponível no Brasil poderá aumentar o risco de proliferação de Escherichia coli (EC). Contudo, estudos in vivo são necessários para testar a relevância clínica desses resultados.
Resultados contraditórios encontrados nos estudos citados podem ser interpretados pela diferença na composição do LM, que varia na dependência da etnia, raça, idade gestacional do RN no momento do parto, maturidade do LM, horário da coleta e momento da ordenha em que o leite foi coletado. Os estudos divergem ainda na quantidade de ferro adicionada às amostras e nas cepas de bactérias. analisadas.
ConclusãoO acréscimo de aditivo de LM suplementado com ferro na proporção de 0,28mg por grama de aditivo reduziu in vitro a ação bacteriostática contra Escherichia coli, entretanto este efeito não foi encontrado para cepas de Pseudomonas aeruginosa e Staphyiloccocus aureus em amostras de leite materno coletadas até o sétimo dia pós-parto. Mais estudos são necessários para saber como extrapolar estes resultados para prática clínica.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Gostaríamos de agradecer todas as mães que participaram desta pesquisa e que, generosamente, doaram seu leite, e ao doutor Frederick Schwenk, por sua leitura crítica do manuscrito.
Como citar este artigo: Campos LF, Repka JC, Falcão MC. Effects of human milk fortifier with iron on the bacteriostatic properties of breast milk. J Pediatr (Rio J). 2013;89:394-9.