To assess the prevalence of congenital hypothyroidism and the ability of various neonatal thyroid‐stimulating hormone (TSHneo) cutoff values to detect this disease.
MethodsThis cohort study was based on the retrospective collection of information available from the Reference Service for Newborn Screening database for all live births from January 1, 2010, to December 31, 2012, assessed using the Newborn Screening Program of a Brazilian state. The infants were divided into two groups: I–Control: infants with normal newborn screening tests and II–Study: infants with congenital hypothyroidism. Analysis included comparing the TSHneo levels from both groups. A receiver operating characteristic (ROC) curve was constructed to assess the TSHneo cutoff values.
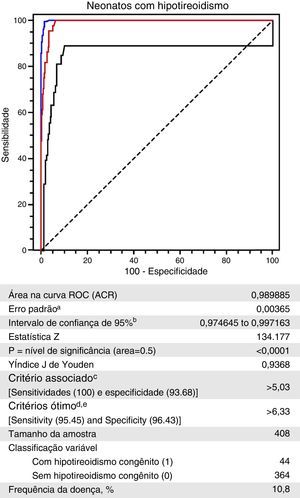
ResultsUsing a TSHneo cutoff value of 5.0μIU/mL, 50 out of 111,705 screened infants had diagnosis of congenital hypothyroidism (prevalence 1:2234 live births). The ROC curve showed that TSHneo value of 5.03μIU/mL had 100% sensitivity and the greatest associated specificity (93.7%). The area under the curve was 0.9898 (p<0.0001).
ConclusionsThe ROC curve confirmed that the TSHneo cutoff value of 5.0μIU/mL adopted by the Newborn Screening Program of a Brazilian state was the most appropriate for detecting congenital hypothyroidism and most likely explains the high prevalence that was found.
Avaliar a prevalência do hipotireoidismo congênito e a capacidade de vários valores de corte do hormônio estimulante da tireoide de neonatos (TSHneo) para detectar essa doença.
MétodosEste estudo de coorte teve como base a coleta retrospectiva de informações disponíveis no banco de dados do Serviço de Referência em Triagem Neonatal de todos os nascidos vivos de 1∘ de janeiro de 2010 a 31 de dezembro de 2012, avaliados no Programa de Triagem Neonatal de um estado brasileiro. Os neonatos foram divididos em dois grupos: I – Controle: neonatos com testes de triagem neonatal normais e II – Estudo: neonatos com hipotireoidismo congênito. A análise incluiu a comparação entre os níveis de TSHneo dos dois grupos. Uma curva do poder discriminante do teste (ROC) foi criada para avaliar os diferentes valores de corte de TSHneo.
ResultadosUtilizando um valor de corte de TSHneo de 5,0IU/mL, 50 dos 111.705 neonatos examinados foram diagnosticados com hipotireoidismo congênito (prevalência de 1:2.234 nascidos vivos). A curva ROC mostrou que o valor do TSHneo de 5,03IU/mL possuía sensibilidade de 100% e a maior especificidade relacionada (93,7%). A área abaixo da curva foi 0,9898 (p<0,0001).
ConclusõesA curva ROC confirmou que o valor de corte de TSHneo de 5,0IU/mL adotado pelo Programa de Triagem Neonatal de um estado brasileiro foi o mais adequado na detecção do hipotireoidismo congênito e provavelmente explica a alta prevalência constatada.
O hipotireoidismo congênito (HC) é um distúrbio endócrino pediátrico comum1,2 que pode causar retardo mental.3,4 A importância do diagnóstico e tratamento precoces para evitar dano cerebral irreparável4,5 e atraso no crescimento3,6 justificou o estabelecimento de programas de triagem neonatal (PTOs) para detecção de HC.4,7 Esses PTOs mostraram‐se ter um bom custo‐benefício para toda a sociedade.8,9
A medição da concentração do hormônio estimulante da tireoide (TSH) é considerada a melhor estratégia de teste de triagem na detecção do HC primário,4 pois ele mostra alta sensibilidade4,10 e precisão.11 Contudo, a detecção do HC depende diretamente do valor de corte de TSH (TSHneo),4,12 que varia entre os diferentes PTOs13,14 e pode ter uma influência sobre a taxa de reconvocação.13 De acordo com a comprovação disponível, muitos casos de HC não seriam detectados caso o valor de corte de TSHneo fosse aumentado.9,15 Por outro lado, a redução do valor de corte exige uma avaliação criteriosa prévia da qualidade do trabalho laboratorial15 e dos custos do programa de triagem.4,9 Os critérios usados na escolha do valor de corte de TSHneo para detectar HC devem ser adaptados à definição da doença‐alvo.4
Alguns programas em todo o mundo diminuíram o valor de corte dos testes de triagem5,7 para aumentar a sensibilidade do ensaio.16 De acordo com isso, os valores de corte próximos de 10,0μIU/mL2,8 ou abaixo de 5,0μIU/mL3,17 ou 4,5μIU/mL18 são usados em vários PTOs em todo o mundo para melhorar a detecção de crianças em risco.
A prevalência do HC no Brasil é aproximadamente um caso por 2.500 nascidos vivos; foi observada uma variação regional e, de acordo com as recomendações do Ministério da Saúde do Brasil de 2010, um valor do TSH acima de 15,0μIU/mL por ensaio imunométrico deve ser considerado positivo.19
Como a eficiência de qualquer PTO depende de sua capacidade de abranger a maior população possível e detectar o maior número de casos, é necessária a obtenção confiável dos valores do TSH para maximizar a detecção dos casos de HC. Contudo, a falta de concordância sobre os valores de corte de TSH na literatura torna essa tarefa difícil. Desde novembro de 2009, o valor do TSHneo de 5.0μIU/mL é o ponto de corte adotado pelo PTO no Mato Grosso (MT), Brasil. Consequentemente, este estudo visou a avaliar a capacidade de detecção do HC de vários valores de corte de TSHneo e seus efeitos sobre o programa de triagem atual.
MétodosModelo e população do estudoEstudo transversal incorporado a um estudo de coorte com base nas informações retrospectivas coletadas do banco de dados do Serviço de Referência em Triagem Neonatal (SRTN) no MT de todos os nascidos vivos, 2010‐2012, que foram avaliados pelo PTO‐MT. Os dados também foram coletados dos prontuários clínicos de todos os indivíduos com todas as formas de HC.
Os neonatos incluídos no estudo foram divididos em dois grupos: Grupo I – grupo de controle (n=220), neonatos com triagem neonatal normal (TNN) e Grupo II – grupo de estudo (n=44), neonatos com HC confirmado, ou seja, TSH sérico superior a 10,0μIU/mL e níveis de tiroxina livre normais ou baixos (T4), de acordo com os valores de referência laboratoriais. Para cada criança incluída no grupo de estudo, havia cinco neonatos com TNNs normais incluídos no grupo de controle.
As crianças no Grupo I foram aceitas no programa imediatamente antes do caso e corresponderam ao Grupo II, eles nasceram no mesmo mês e, ao nascer, pesavam ≥ 2.500 gramas. Foram coletadas amostras na TNN desses neonatos quando eles tinham dois a seis anos. Possíveis participantes foram excluídos do Grupo I quando a amostra na TNN continuou no local de coleta por mais de 30 dias ou os dados do teste estavam incompletos.
Os neonatos com HC confirmado e peso ao nascer ≥ 2.500 gramas foram incluídos no Grupo II independentemente da data de coleta da triagem neonatal. A idade na época da coleta da TNN não foi pareada entre os dois grupos. Foram excluídos os neonatos cujas amostras da TNN foram coletadas 24 horas após o nascimento ou que apresentaram comorbidades e/ou uso de medicações que provavelmente interferiram nos resultados laboratoriais.
De acordo com as orientações do PTO, recomenda‐se que a coleta de amostras de sangue seja feita por punção do calcanhar quando o neonato está com três a cinco dias; uma gota de sangue é coletada em papel‐filtro (Schleicher & Schuell, 903) e enviada para o laboratório no SRTN do MT para medição da concentração de TSH na mancha de sangue.
O valor de corte de TSHneo foi estabelecido em 5,0μIU/mL. Os valores iguais ou inferiores a 5,0μIU/mL foram considerados normais, os valores entre 5,0 e 15,0μIU/mL foram reavaliados por meio de uma nova amostra de coleta e os pacientes com valores superiores a 15,0μIU/mL foram encaminhados para confirmação do diagnóstico. Aqueles com concentrações de TSHneo acima de 5,0μIU/mL na nova amostragem também foram encaminhados para o SRTN para avaliação adicional.
A prevalência do HC foi calculada como a proporção de nascidos vivos com um diagnóstico confirmado por ano com relação ao número de nascidos vivos submetidos a uma TNN no mesmo ano. O número de testes feitos durante o período do estudo foi obtido do SRTN e o número de nascidos vivos no período correspondente foi obtido da Secretaria da Saúde do Estado do Mato Grosso e o do Departamento do Sistema Único de Saúde (DATASUS), Brasil.
Não houve exigências para o consentimento livre informado, pois não houve mudança no procedimento médico, nenhuma amostra de sangue adicional foi obtida e os participantes não foram identificados e pelo fato de que este foi um estudo de revisão de prontuários e a autorização dessa consulta aos prontuários médicos foi fornecida pelo diretor clínico do hospital. O estudo foi aprovado pelos Comitês de Ética em Pesquisa Humana de nossa instituição Hospital Universitário Júlio Müller, Universidade Federal do Mato Grosso, em 13 de outubro de 2010 sob o n° 940/CEP‐HUJM/2010, pela Comissão para Análise de Projetos de Pesquisa (CAPPesq), pelo diretor clínico do Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, em 19 de julho de 2011 sob o n° 307/11.
Métodos bioquímicosA concentração de TSH na mancha de sangue foi medida com um ensaio imunofluorométrico de tempo resolvido com AutoDELFIA® (Perkin Elmer®, Turku, Finlândia). Para casos com valores acima do valor de corte estabelecido de 5,0μIU/mL, foi feito um segundo ensaio e os resultados relatados correspondem à média de ambas as medições. De acordo com a sensibilidade do método, a maior concentração detectável foi 250,00μIU/mL; valores mais elevados foram relatados em >250,00μIU/mL e, para análise, considerados 251,00μIU/mL.
Para garantir a uniformidade e equivalência dos resultados, as miliunidades internacionais por mililitro (μIU/L) foram expressas como microunidades internacionais por litro (μIU/mL). Foi usado um ensaio quimioluminescente (ADVIA Centaur® XP Immunoassay System, Siemens, Alemanha) para medição das concentrações séricas de TSH (μIU/mL) e os resultados foram interpretados de acordo com os valores de referência por idade, ou seja, até 25.000μIU/mL na primeira semana de vida e de 0,800 a 6.000μIU/mLda segunda semana até 11 meses de vida. A concentração sérica de T4 livre (ng/dL) foi medida com o método de quimioluminescência (ADVIA Centaur® XP Immunoassay System, Siemens, Alemanha), e o valor de referência variou de 0,70 a 1,80ng/dL, para adultos e crianças, de acordo com os valores de referência fornecidos pelo laboratório de apoio.
Análise estatísticaCom base nos dados de prevalência da doença fornecidos pelo PTO‐MT, α=0,05 e β=0,20 (potência de 80%); se considerarmos uma área na curva ROC de 90% e um intervalo de confiança (IC) de 70 a 100%, o tamanho da amostra foi inicialmente calculado em 45 casos confirmados de HC. Esse número foi atingido no período escolhido para o estudo e, após a aplicação dos critérios de exclusão, 44 crianças foram analisadas com diagnóstico confirmado de HC (grupo de estudo). Foram incluídos 220 neonatos com TNN normal no grupo de controle.
Além dos neonatos incluídos no Grupo 1 e Grupo II, para criar a curva ROC, os neonatos com resultados falos‐positivo também foram incluídos (n=24), bem como cinco neonatos com TNN normal para cada resultado falso‐positivo (n=120).
A sensibilidade, especificidade, o valor preditivo positivo e negativo e o índice de probabilidade correspondente a vários valores de TSHneo foram então calculados com o Microsoft® Excel (Microsoft®, versão 2007, EUA) e o software Stata® (StataCorp. 2011. Stata Statistical Software: versão 12, EUA). Dados contínuos são apresentados como medidas de tendência central (média e mediana) e dispersão (desvio padrão [DP], mínimo e máximo). Para analisar a relação entre as concentrações de TSH e TSHneo séricos, foi usado o teste de correlação de Spearman. O teste binomial Z foi usado para comparar proporções múltiplas. Para comparar o TSHneo entre os grupos, foi usado o teste de Mann‐Whitney não paramétrico. O nível de significância foi estabelecido como p<0,05.
ResultadosNasceram 151.245 neonatos no MT no período do estudo e 111.705 (73,9%) foram submetidos à TNN; 50 foram diagnosticados com HC e 44 deles foram incluídos no presente estudo. A prevalência do HC foi calculada em 1:2.234.
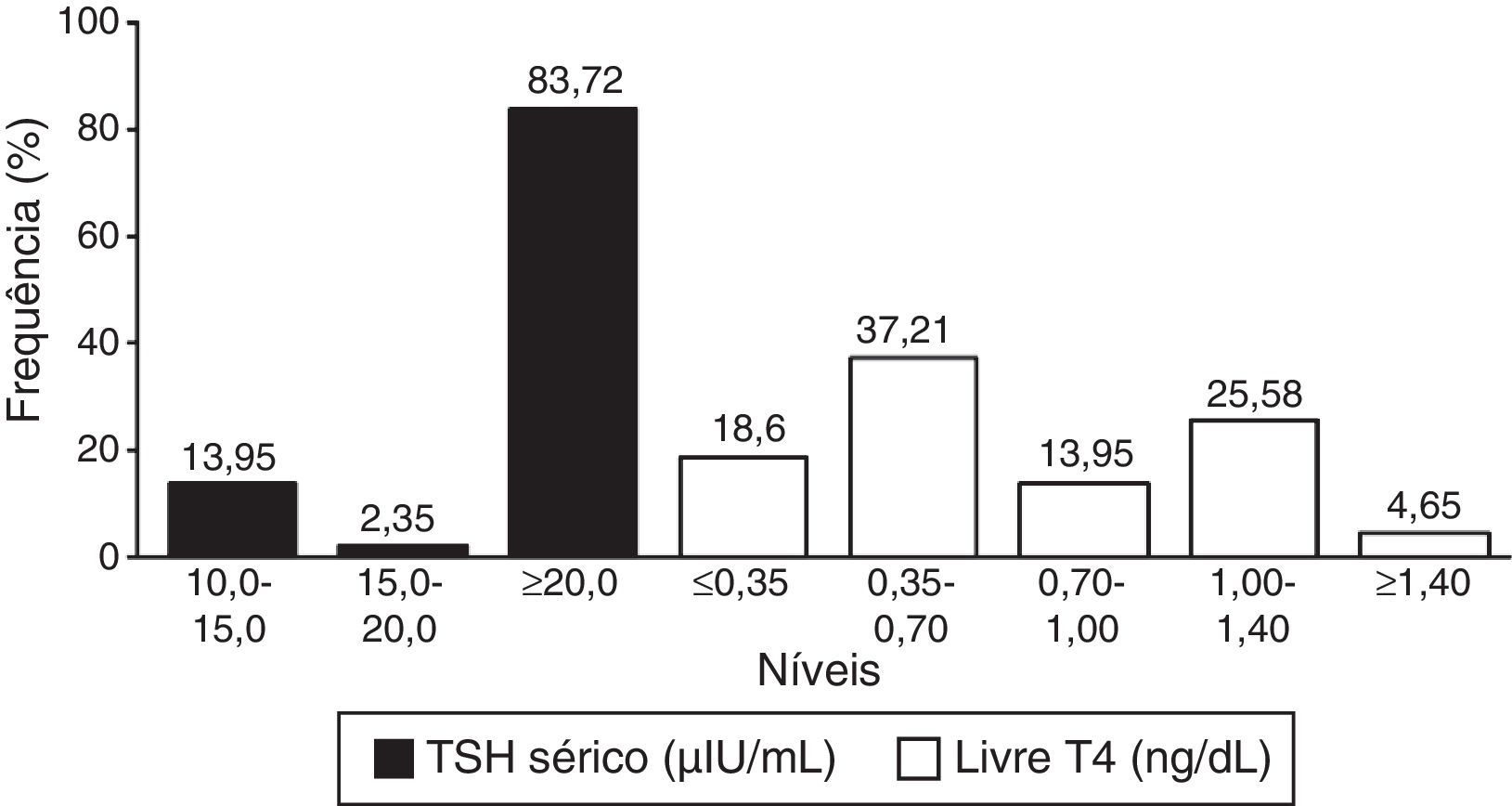
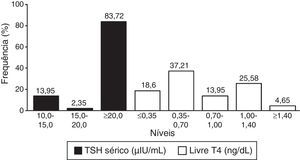
Entre os neonatos com HC, o valor médio de TSHneo foi de 93,97μIU/mL (DP=98,15; mínimo de 5,10 e máximo de>250,00μIU/mL). O valor sérico mediano de TSH foi, por sua vez, de 101,00μIU/mL, com uma média de 86,72μIU/mL (DP=52,34), e variou de 10,07 a>150,00μIU/mL. A média (DP) e mediana do valor de T4 livre sérico foram 0,70ng/dL (DP=0,39) e 0,62ng/dL, respectivamente, variaram de 0,11 a 1,44ng/dL.
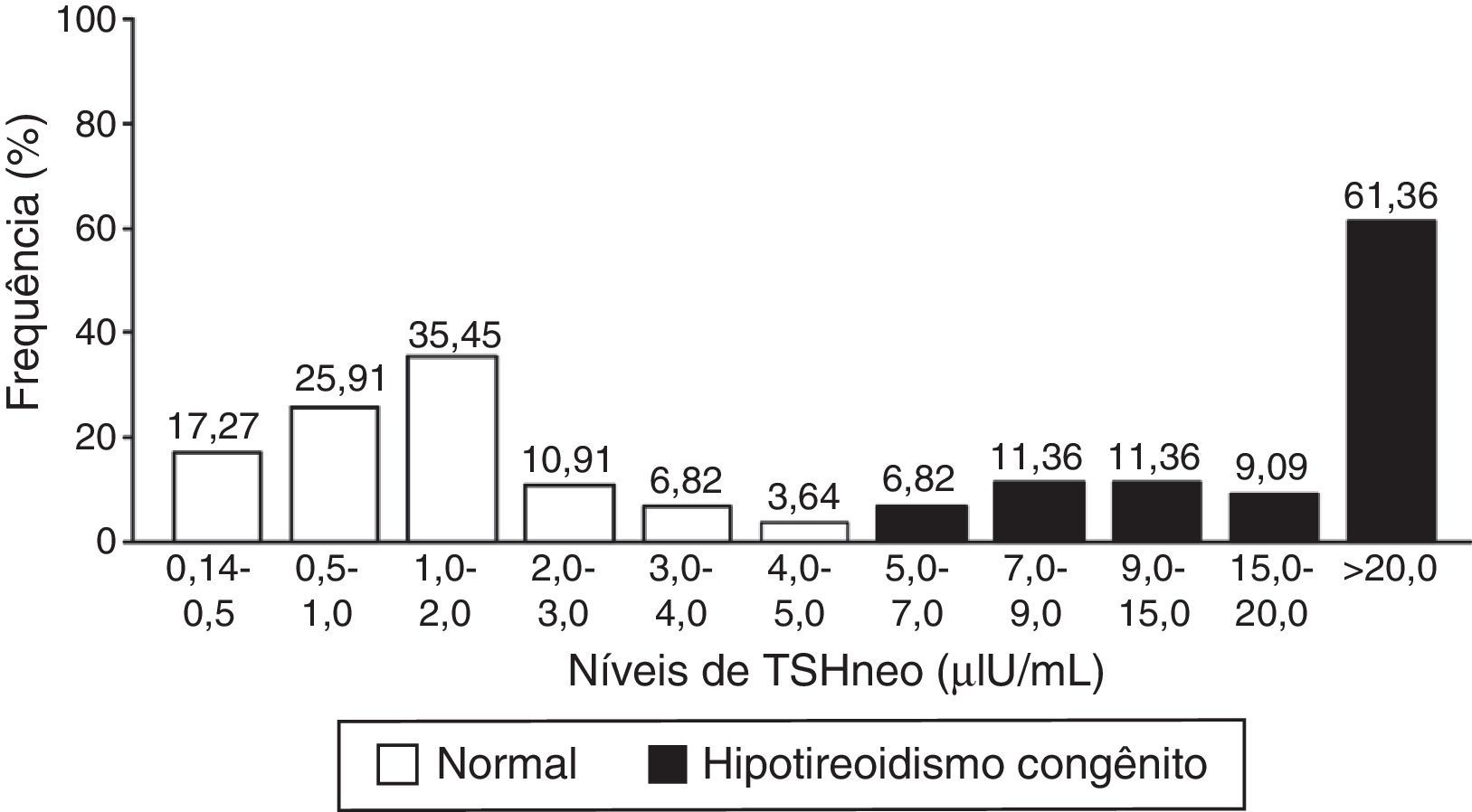
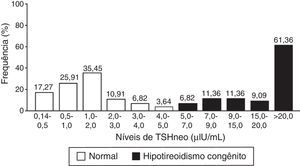
A figura 1 mostra a distribuição dos valores de TSHneo nos Grupos I e II. Os resultados mostram que os valores de TSHneo de 78,63% dos neonatos com TNN normal variou de 0,14 a 2,0μIU/mL, ao passo que os valores dos 21,37% restantes variou de 2,0 a 5,0μIU/mL. Entre os neonatos com HC, os valores de TSHneo iniciais foram maiores do que 9,0μIU/mL em 81,81% dos casos; a grande maioria dos neonatos apresentou valores acima de 20,0μIU/mL. A proporção de casos falso‐positivo detectada com valor de corte de TSHneo de 5,0μIU/mL correspondeu a uma proporção de 0,02%.
O valor médio de TSHneo dos neonatos com TNN normal foi de 1,40μIU/mL (DP=1,2; variou de 0,14 a 4,70μIU/mL). Os valores medianos de TSHneo diferiram significativamente entre os grupos I (1,15μIU/mL) e II (26,55μIU/mL) (p<0,001).
A figura 2 mostra os resultados dos testes confirmatórios (TSH sérico e T4 livre).
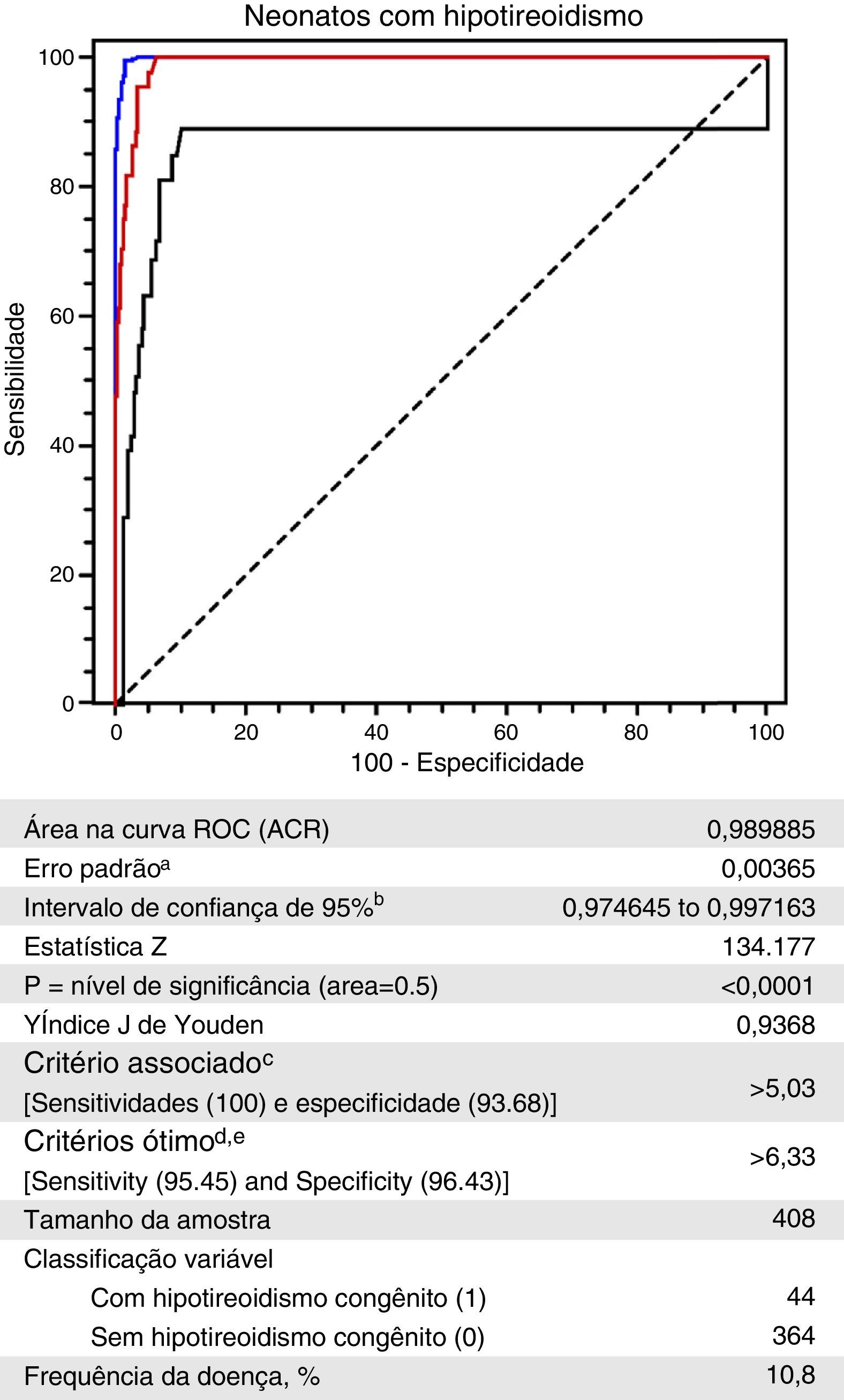
A curva ROC criada com os valores de TSHneo dos Grupos I e II é mostrada na figura 3.20 Um valor de TSHneo de 5,03μIU/mL mostrou a maior especificidade (96,68%; IC de 95%=90,7 a 96,0) para uma sensibilidade de 100% (IC de 95%=92,0 a 100,0). Um valor de corte de 6,33μIU/mL mostrou a melhor combinação de sensibilidade (95,45%; IC de 95%=84,5 a 99,4) e especificidade (96,45%; IC de 95%=94,0 a 98,1) figura 3.
Curva ROC dos níveis de TSHneo de neonatos sem e com diagnóstico confirmado de hipotireoidismo congênito, Programa de Triagem Neonatal, Estado do Mato Grosso, 2010 a 2012.
a Hanley & McNeil20, 1982.
bBinomial exact=Binomial exato
cGreater specificity for a sensitivity of 100%=Maior especificidade para sensibilidade de 100%
dHigher sensitivity and specificity associated and above 95%=Maior sensitividade e especificidade associadas e acima de 95%
eTaking into account disease prevalence and estimated costs: cost False Positive: 1; cost False Negative: 1; cost True Positive: 0; cost True Negative: 0=Considerando a prevalência da doença e os custos estimados: custo Falso‐positivo: 1; custo Falso‐negativo: 1; custo Verdadeiro‐positivo: 0; custo Verdadeiro‐negativo: 0.
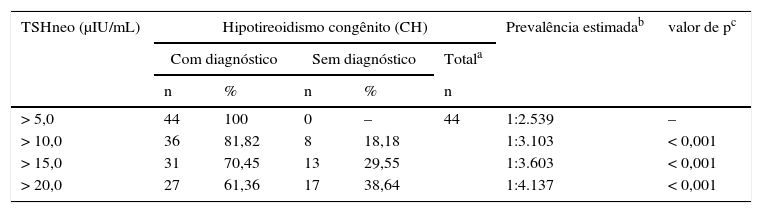
A tabela 1 descreve a prevalência do HC de acordo com diferentes valores de corte de TSHneo. A prevalência descrita de forma consistente com o valor de corte de TSHneo aumentou (p<0,001).
Percentual de distribuição de acordo com o valor de corte de TSH neonatal e a prevalência estimada de HC dos 44 neonatos no Grupo II, Programa de Triagem Neonatal, Estado do Mato Grosso, 2010‐2012
O presente estudo avaliou a capacidade de vários valores de corte de TSHneo detectarem casos de HC e avaliou os efeitos desses níveis sobre a triagem neonatal do HC em uma população avaliada com o PTO‐MT. Os resultados mostraram que a prevalência do HC aumentou com o passar do tempo conforme o valor de corte de TSHneo adotado caiu. O valor de corte de TSHneo de 5,0μIU/mL se mostrou mais efetivo na detecção do HC na população investigada.
Foram detectados 50 casos de HC durante o período do estudo. A prevalência correspondente (1:2.234) foi quatro vezes maior do que a prevalência constatada por Stranieri & Takano21 no mesmo PTO em 2003‐2004, que foi de 1:9.448 nascidos vivos com o valor de corte de TSHneo de 15,0μIU/mL por meio do ensaio enzimático‐colorimétrico. A diferença na prevalência do HC entre os serviços de triagem neonatal que usaram diferentes métodos laboratoriais de detecção consta na literatura.22 Com um método laboratorial semelhante, Mengreli et al.8 constataram um aumento na prevalência do HC permanente (1:1.749 em comparação com 1:3.384) quando usados diferentes valores de corte de TSHneo.
Estudos conduzidos nos Estados Unidos mostraram que mudanças no valor de corte de TSHneo13 podem resultar em um aumento na prevalência do HC. Portanto, os dados relatados aqui indicam veementemente que a mudança no valor de corte de TSHneo provavelmente é o principal fator que causou o aumento na prevalência do HC no PTO em MT.
A média da concentração de TSHneo em neonatos brasileiros do Estado de Sergipe entre dois e seis dias de vida foi de 1,33±1,08μIU/mL23,23 ou seja, semelhante à concentração de TSHneo no presente estudo (1,40±1,02μIU/mL). Apesar da alta temperatura média no estado de MT, as variações sazonais e os efeitos associados ao armazenamento das amostras no local de coleta parecem não ter influenciado os valores de TSH no presente estudo, pois as amostras armazenadas por mais de 30 dias não foram incluídas na análise.
O valor de TSHneo foi superior a 20,0μIU/mL em 61,36% dos neonatos com HC no presente estudo, com uma média de 93,97±98,15μIU/mL.
Esses achados estão de acordo com os relatos de Ramalho et al.,23 que constataram valores acima de 19,70μIU/mL em 62,5% dos neonatos com HC.
A eficiência de qualquer PTO depende da escolha dos valores de corte, que devem ter alta sensibilidade ao mesmo tempo em que mantêm a especificidade. Aumentar o valor de corte aumenta sua sensibilidade, porém também haverá um aumento nos resultados falso‐positivos.24
No presente estudo, o valor de corte de TSHneo de 5,0μIU/mL detectou 50 casos de HC, dos quais muitos não teriam sido detectados com os altos valores de corte de TSH. A melhor capacidade de detectar casos de HC pode indicar o poder diagnóstico de menores níveis de corte de TSH e refletir a estruturação do PTO local. Botler et al.25 analisaram os valores de corte de TSH na detecção do HC e contataram 42 casos com um valor de corte de ≥ 20,0μIU/mL em 2005, porém 165 casos foram constatados em 2007, quando o valor de corte foi reduzido para ≥ 10,0μIU/mL. Korada et al.6 constataram 120 neonatos com um valor de corte de TSHneo de 6,0μIU/mL, ao contrário do estudo de Ramalho et al.,23 no qual foram detectados oito casos de HC com valor de corte de 5,2μIU/mL.
No presente estudo, o valor de corte de TSHneo de 10,2μIU/mL, com sensibilidade de 81,82% (IC de 95%: 67,3 a 91,8) e especificidade de 98,08% (IC de 95%: 96,1 a 99,2), não teria conseguido detectar aproximadamente 18% dos neonatos examinados que necessitaram investigação diagnóstica adicional. No estudo de Tu et al.,26 a sensibilidade do ponto de corte de TSHneo de 10,0μIU/mL, com o método DELFIA (sistema de imunoensaio para programas de rastreio e diagnósticos de rotina), foi melhor (98,93%) do que a sensibilidade constatada no presente estudo; a especificidade (99,48%) foi semelhante em ambos os estudos. Aqui, com um valor de corte de TSH de 15,5μIU/mL, quase 30,0% dos casos de HC não seriam diagnosticados devido à baixa sensibilidade do texto (68,18%; IC de 95%: 52,4 a 81,4). Contudo, os neonatos saudáveis com valores abaixo de 10,2μIU/mL ou 15,5μIU/mL seriam corretamente identificados em 98,0% dos casos.
As chances de encontrar neonatos saudáveis com valores de TSHneo de 30,8μIU/mL foram zero devido à alta especificidade (100%; IC de 95%: 99,0 a 100) e à sensibilidade muito baixa (47,73%, IC de 95%: 32,5 a 63,3) desse valor de corte, que não teria conseguido detectar mais de 50% dos neonatos com risco real da doença.
Não obstante essa lacuna, devido a seu valor preditivo positivo de 100%, os valores de TSHneo acima de 30,8μIU/mL indicaram de forma confiável a necessidade de tratamento antes da divulgação dos resultados dos testes confirmatórios, pois a doença foi confirmada em todos os neonatos que apresentaram valores acima desse nível. Segundo Léger et al.,4 quando os valores de TSHneo estão acima de ≥ 40,0, recomenda‐se iniciar tratamento após a coleta de uma boa amostra venosa, sem esperar o resultado dos testes confirmatórios.
No presente estudo, os valores de corte de TSHneo de 15,0 e 20,0μIU/mL não teriam conseguido detectar 30% e 40%, respectivamente, dos neonatos examinados que necessitaram confirmação da doença. Barone et al. 18 constaram que, em 24,4% dos neonatos com HC e valores de TSHneo na extremidade inferior da abrangência, seus valores variaram entre 4,5 e 5,4μIU/mL. No presente estudo, 6,82% dos neonatos com HC mostraram valores de TSHneo de 5,0 a 7,0μIU/mL.
Essa análise teve como base um valor de corte de TSH de 5,0μIU/mL, cuja precisão é mostrada pela curva ROC (área abaixo da curva=98,98% e um p<0,0001). Além disso, esse valor de corte mostrou sensibilidade de 100% e especificidade associada de 93,68%. Considerando o resultado equivalente dessas duas medidas, o índice de Youden de 0,9368 indicou que a escolha do valor de corte de TSHneo provavelmente está correto, pois ele foi associado à melhor proporção de classificação errada.
Uma das limitações do estudo é a não inclusão das crianças submetidas a triagem por meio do sistema de saúde privado e contratado e até mesmo uma pequena proporção que não fez o exame. Contudo, devemos enfatizar que foram incluídos todos os nascidos vivos no sistema público de saúde submetido à TNN. A outra limitação está relacionada ao fato de que alguns neonatos ainda não foram reavaliados para identificar uma forma transitória de HC, pois eles ainda têm menos de três anos.
Os resultados obtidos sugerem que, na população de neonatos examinados para HC com o PTO‐MT, o baixo valor de corte de TSHneo adotado pode ter contribuído para a alta prevalência da doença constatada. Este estudo mostra que o limite atual de TSHneo no PTO‐MT em termos de custo‐benefício é o ponto de corte mais adequado para detectar HC e conseguiu detectar todos os casos de HC, inclusive aquelas formas mais leves da doença. Porém, por outro lado, esse protocolo aumentou a ocorrência de testes falso‐positivos associada ao aumento dos efeitos psicológicos sobre a ansiedade dos pais. Essa proporção de falso‐positivo pode ser uma limitação ao valor de corte de TSHneo de 5,0μIU/mL, porém, correspondendo a essa pequena proporção (0,02%), não contribuiu para o aumento dos custos do programa. A possibilidade de detectar o maior número possível de casos da doença justificou a adoção desse valor de corte.
Infelizmente, independentemente de os casos leves adicionais de HC detectados dessa forma associados a uma redução no desempenho cognitivo serem conhecidos e, portanto, necessitar de avaliação e garantia de aumento significativo nos custos de reconvocação, ele é controverso no presente estudo. Segundo Léger et al.,4 o objetivo de uma triagem neonatal deve ser detectar todas as formas de HC primário, principalmente os mais graves. Além disso, são necessários estudos adicionais para avaliar o custo‐benefício de adotar valores de corte mais baixos de TSHneo para o programa estadual.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Silvestrin SM, Leone C, Leone CR. Detecting congenital hypothyroidism with newborn screening: the relevance of thyroid‐stimulating hormone cutoff values. J Pediatr (Rio J). 2017;93:274–80.