The objective of this study was to evaluate the health‐related quality of life in children and adolescents with autoimmune hepatitis.
MethodsA cross‐sectional assessment with the Pediatric Quality of Life Inventory 4.0 (PedsQL 4.0) was completed for 80 patients with autoimmune hepatitis and 45 healthy controls. Demographic data, prednisone dose, disease remission state, disease severity, and abdominal pain were also evaluated.
ResultsBased on the child self‐reports, physical, emotional, school, and total scores were significantly lower in autoimmune hepatitis patients when compared with controls (p<0.05). Based on the parental reports, only the physical and total scores were significantly lower in autoimmune hepatitis patients versus controls (p<0.05). Further analysis in autoimmune hepatitis patients with abdominal pain in the last month revealed significantly lower physical, social, and total median scores (p<0.05). No differences were observed based on disease remission state or disease severity (p>0.05). Autoimmune hepatitis patients who received a prednisone dose below 0.16mg/kg/day at the time of the interview showed significantly higher physical scores than those who received a dose similar to or above 0.16mg/kg/day (87.5 [50–100] vs. 75 [15.63–100], p=0.006).
ConclusionsReduced scores in the physical, emotional, and school domains were observed in pediatric autoimmune hepatitis patients compared to control patients. Abdominal pain and corticosteroid dose negatively influenced the health‐related quality of life in children and adolescents with autoimmune hepatitis.
Avaliar a qualidade de vida relacionada à saúde em crianças e adolescentes com hepatite autoimune (HAI).
MétodosFoi concluída uma avaliação transversal com o Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0) para 80 pacientes com hepatite autoimune e 45 controles saudáveis. Os dados demográficos, a dose de prednisona, o estado de remissão da doença, a gravidade da doença e dor abdominal também foram avaliados.
ResultadosCom base nos autorrelatos das crianças, os escores físico, emocional, escolar e total foram significativamente menores em pacientes com hepatite autoimune em comparação com os controles (p < 0,05). Com base nos relatos dos pais, apenas os escores físico e total foram significativamente menores em pacientes com hepatite autoimune em comparação com os controles (p < 0,05). Uma análise adicional em pacientes com hepatite autoimune com dor abdominal no mês passado revelou escores médios físico, social e total significativamente menores (p < 0,05). Nenhuma diferença foi observada com base no estado de remissão da doença ou na gravidade da doença (p > 0,05). Os pacientes com hepatite autoimune que receberam uma dose de prednisona abaixo de 0,16mg/kg/dia no momento da entrevista mostraram escores físicos significativamente maiores que os que receberam uma dose semelhante ou acima de 0,16mg/kg/dia [87,5 (50‐100) em comparação com 75 (15,63‐100), p = 0,006].
ConclusõesEscores reduzidos nos domínios físico, emocional e escolar foram observados em pacientes pediátricos com hepatite autoimune em comparação com pacientes do grupo de controle. Dor abdominal e dose de corticosteroide influenciaram negativamente a qualidade de vida relacionada à saúde em crianças e adolescentes com hepatite autoimune.
Hepatite autoimune (HAI) é uma doença hepática inflamatória crônica e progressiva. A HAI é imunomediada, caracterizada por altos níveis séricos de aminotransferases e imunoglobulina G (IgG) e detectável por autoanticorpos e comprovação histológica de hepatite interface na ausência de uma etiologia conhecida. A HAI é uma condição rara com incidência relatada de 0,4 a 3 por 100.000 crianças. A HAI pode ocorrer juntamente com outras doenças autoimunes, como diabetes Tipo I, hipotireoidismo e lúpus eritematoso sistêmico.1,2 A prevalência da HAI/síndrome da sobreposição com colangite esclerosante é de 48%.3
O quadro clínico de HAI é altamente variável em crianças, varia de hepatite aguda a início insidioso com fadiga progressiva, icterícia intermitente, anorexia e perda de peso.4 O principal objetivo dos tratamentos imunossupressores é melhorar as manifestações clínicas e os achados laboratoriais.1,4 Um tratamento comum é a prednisona, que pode levar a efeitos colaterais como hipertricose, ganho de peso e restrição do crescimento linear; esses efeitos podem afetar a autoimagem e influenciar negativamente a saúde emocional, comprometer, assim, a qualidade de vida relacionada à saúde (QVRS) em crianças e adolescentes com HAI.4
A doença hepática crônica é uma principal causa de óbito em todo o mundo e é responsável por incapacitar um grande segmento da população economicamente ativa.5 Nesse contexto, a QVRS dos pacientes com doença hepática crônica desde a infância ou adolescência é um importante determinante de saúde.
A expectativa de vida de pacientes pediátricos com doença hepática crônica melhorou significativamente na última década e a qualidade de vida relacionada à saúde (QVRS) percebida pelo paciente assumiu um maior papel na determinação da qualidade da sobrevida aprimorada desses pacientes pediátricos.6 Portanto, foram desenvolvimentos instrumentos de medição da QVRS de crianças, adolescentes e seus pais.
Os instrumentos gerais de QVRS são multidimensionais e têm o objetivo de avaliar o impacto de uma doença em uma função da dor, saúde geral, vitalidade, aspectos sociais e emocionais e saúde mental. Os instrumentos são bem projetados para avaliar a eficácia das políticas e programas de saúde ou comparar duas doenças distintas. Instrumentos específicos focam nos sintomas, deficiências e limitações associados a uma doença específica; contudo, não há questionário específico para HAI na literatura.7
Escolhemos a versão genérica do questionário PedsQL 4.0 para este estudo devido à sua facilidade de uso e suas avaliações globais, inclusive aspectos físicos, emocionais, sociais e escolares, e ela também possibilita a avaliação da percepção dos pais da QVRS de seu filho.8
A QVRS foi raramente estudada na população adulta e pediátrica com HAI com o uso de instrumentos genéricos.9,10 Aspectos emocionais negativos foram observados em pacientes adultos com HAI em comparação com a população geral, independentemente do estado de remissão da doença.9 No Brasil, atualmente, não há estudos que abordem especificamente a QVRS de crianças e adolescentes com HAI.
Até onde sabemos, há apenas um relato que avaliou a QVRS em pacientes com HAI com uma amostra de 22 crianças e adolescentes com HAI, inclusive as submetidas a transplante de fígado, que mostrou redução na QVRS desses pacientes.10 Contudo, não foi concluída uma análise dos domínios de QVRS em pacientes pediátricos sem transplante de fígado, inclusive as comparações do estado de remissão da doença, gravidade da doença e dose de corticosteroide.
Os objetivos deste estudo foram avaliar a QVRS em pacientes com HAI e controles saudáveis com o instrumento genérico PedsQL 4.0 para crianças/adolescentes e seus responsáveis legais e avaliar a possível influência do estado de remissão da doença, da gravidade da doença e da dose de prednisona sobre a QVRS.
Pacientes e métodosDe março a dezembro de 2016, foi feito um estudo transversal com 80 pacientes com HAI em duas unidades de hepatologia infantil de hospitais terciários (Instituto da Criança da Faculdade de Medicina da Universidade de São Paulo e Hospital Infantil Municipal Menino Jesus) em São Paulo, Brasil. Todos os pacientes foram avaliados sistematicamente e o diagnóstico de HAI foi confirmado de acordo com os critérios do Grupo Internacional de Hepatite Autoimune.11,12 Este estudo foi aprovado pelos Comitês de Ética dos hospitais. Os pacientes, controles e seus responsáveis legais assinaram formulários de consentimento informado.
AmostraOs pacientes foram selecionados com um método de amostragem de conveniência. Os pacientes com HAI eram de diferentes regiões do Brasil, e, apesar de terem sido monitorados em duas unidades de hepatologia infantil localizadas em São Paulo, não eram exclusivamente dessa cidade. Os critérios de inclusão foram os que seguem: (i) entre cinco e 18 anos; e (ii) diagnóstico confirmado de hepatite autoimune. Os critérios de exclusão foram os que seguem: (i) pacientes submetidos a transplante de fígado; (ii) pacientes que se recusaram participar do estudo; (iii) pacientes com hepatite fulminante; e (iv) pacientes que não receberam tratamento anterior.
Grupo de controleO grupo de controle consistiu em 45 crianças e adolescentes saudáveis com perfil de idade semelhante dos pacientes [13 (5‐18) em comparação com 14 (3‐18), p = 0,804] de uma escola pública local em Cuiabá, Brasil.
Avaliações da QVRSA QVRS foi determinada com o Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0), validado no idioma e na cultura portugueses (Brasil). Três versões foram usadas com base na idade do paciente: 5‐7, 8‐12 ou 13‐18 anos.7,8
Dois instrumentos foram usados neste estudo: o autorrelato das crianças PedsQL 4.0 e o relato dos pais PedsQL 4.0. O questionário PedsQL 4.0 inclui perguntas relacionadas aos seguintes quatro domínios multidimensionais: capacidade física, aspectos emocionais, aspectos sociais e atividades acadêmicas durante o mês anterior. Há 23 itens pontuados com uma escala de cinco pontos no grupo de 8‐12 anos, no grupo de 13‐18 anos e nos grupos dos pais (0 – nunca = 100 pontos, 1 – quase nunca = 75 pontos, 2 – às vezes = 50 pontos, 3 – frequentemente = 25 pontos e 4 – quase sempre = 0 pontos) e uma escala de três pontos para o grupo 5‐7 anos (0 – nunca = 100 pontos, 2 – às vezes = 50 pontos e 4 – frequentemente = 0 pontos). Os escores medianos variaram de 0 a 100 e um maior escore indica uma melhor QVRS.13,14
Avaliações demográficas, clínicas, laboratoriais e terapêuticasOs prontuários médicos dos pacientes foram revisados meticulosamente de acordo com um amplo protocolo padronizado para avaliar os dados demográficos, as características clínicas, os achados laboratoriais e os dados terapêuticos.
Os dados demográficos incluíram idade atual, sexo e duração da doença (tempo entre o diagnóstico e a entrevista). A HAI foi classificada como HAI tipo 1 [presença de anticorpos antinucleares (ANA) e/ou anticorpo antimúsculo liso (SMA)] ou HAI tipo 2 [presença de anticorpo microssomal de fígado‐rim anti‐tipo I (anti‐LKM‐1) e/ou anticorpo anticitosol hepático (anti‐LC1)].15,16 A síndrome da sobreposição foi definida como HAI associada a colangite esclerosante autoimune com base em características clínicas/bioquímicas da colestase e achados histológicos ou colangiográficos.17 Outras doenças autoimunes também foram avaliadas, inclusive diabetes mellitus tipo 1 – DMT1 (com base em poliúria, polidipsia, perda de peso inexplicada e aumento na glicose plasmática ≥ 200mg/dL a qualquer momento do dia ou glicemia de jejum ≥ 126mg/dL)18 e lúpus eritematoso sistêmico de início na infância (cSLE), de acordo com os critérios de classificação do Colégio Americano de Reumatologia.19 Os dados relacionados a prednisona, azatioprina e outros medicamentos imunossupressores também foram coletados, bem como os achados laboratoriais no início do estudo.
Remissão incompleta ou não remissão foi definida como níveis de aminotransferase duas vezes maiores do que o limite superior normal, bem como alta concentração de IgG ou globulina de soro.20
Remissão foi caracterizada como níveis de aminotransferases (AST/ALT) e IgG abaixo do limite superior normal.20
A gravidade da doença foi definida como histórico anterior de complicações, como hipertensão portal, sangramento gastrointestinal superior, ascite e/ou peritonite bacteriana espontânea.21 Nenhum paciente apresentou essas complicações no momento da entrevista.
Dose de prednisonaOs pacientes foram divididos de forma aleatória nos dois seguintes grupos de acordo com a dose média de prednisona no momento da entrevista: grupo A (< 0,16mg/kg/dia) e grupo B (≥ 0,16mg/kg/dia).
Análises estatísticasForam feitas com o programa estatístico SPSS (IBM SPSS Estatística para Windows, versão 22.0. NY, EUA). Os testes de Mann‐Whitney ou t foram usados para comparar as variáveis contínuas, apresentadas como mediana (intervalo) ou média ± desvio‐padrão (DP), respectivamente. As diferenças nas frequências das variáveis categóricas foram avaliadas pelo teste exato de Fisher. Os valores de p foram estabelecidos em 5% (p < 0,05) para todos os testes estatísticos.
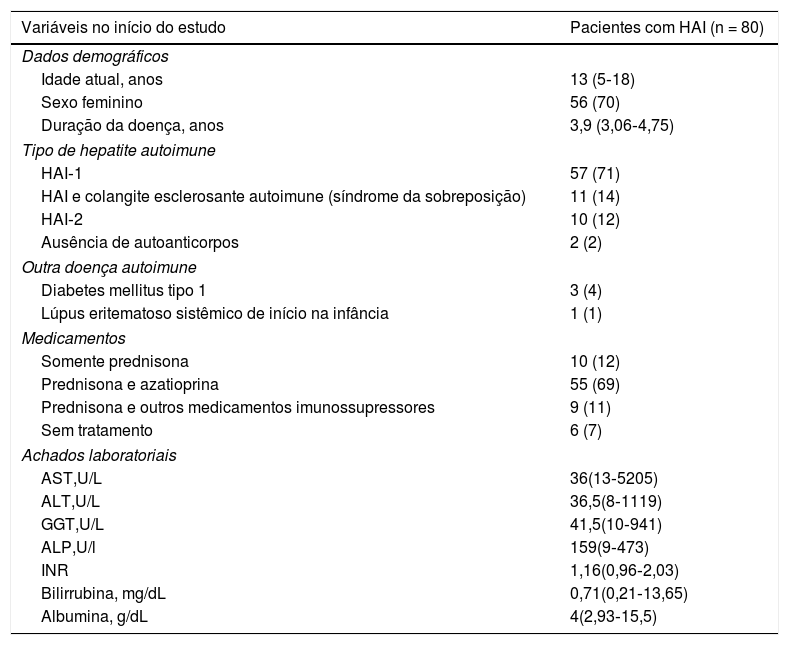
ResultadosA tabela 1 inclui os dados demográficos, os tipos de HAI, outras doenças autoimunes, medicamentos e achados laboratoriais em pacientes com HAI. A média de idade atual foi semelhante para os pacientes com HAI e controles saudáveis [13 anos (5‐18) em comparação com 14 anos (3‐18), p = 0,804). HAI tipo 1 foi observada em 57 pacientes (971%), colangite esclerosante autoimune em 11 (14%), HAI Tipo 2 em 10 (12%) e ausência de autoanticorpos em dois (2%). A comorbidade DMT1 foi observada em três pacientes (4%) e a comorbidade cSLE em um (1%).
Dados demográficos, tipos de hepatite autoimune (HAI), outras doenças autoimunes, medicamentos e achados laboratoriais para pacientes com HAI no início do estudo
| Variáveis no início do estudo | Pacientes com HAI (n = 80) |
|---|---|
| Dados demográficos | |
| Idade atual, anos | 13 (5‐18) |
| Sexo feminino | 56 (70) |
| Duração da doença, anos | 3,9 (3,06‐4,75) |
| Tipo de hepatite autoimune | |
| HAI‐1 | 57 (71) |
| HAI e colangite esclerosante autoimune (síndrome da sobreposição) | 11 (14) |
| HAI‐2 | 10 (12) |
| Ausência de autoanticorpos | 2 (2) |
| Outra doença autoimune | |
| Diabetes mellitus tipo 1 | 3 (4) |
| Lúpus eritematoso sistêmico de início na infância | 1 (1) |
| Medicamentos | |
| Somente prednisona | 10 (12) |
| Prednisona e azatioprina | 55 (69) |
| Prednisona e outros medicamentos imunossupressores | 9 (11) |
| Sem tratamento | 6 (7) |
| Achados laboratoriais | |
| AST,U/L | 36(13‐5205) |
| ALT,U/L | 36,5(8‐1119) |
| GGT,U/L | 41,5(10‐941) |
| ALP,U/l | 159(9‐473) |
| INR | 1,16(0,96‐2,03) |
| Bilirrubina, mg/dL | 0,71(0,21‐13,65) |
| Albumina, g/dL | 4(2,93‐15,5) |
Os resultados são apresentados em mediana (intervalo) e n (%).
Ao avaliar as características clínicas de todos os pacientes entrevistados, a queixa mais comum foi dor abdominal, relatada por 20 pacientes com HAI (25%). Somente um paciente se queixou de hipertricose como efeito colateral do uso de prednisona e não houve queixas de ganho de peso ou estrias. Foram detectados histórico de hipertensão portal em sete pacientes (58,4%), de sangramento gastrointestinal superior em dois (16,6%) e de ascite em três (25%). Remissão foi observada em 62 (77,5%) pacientes com HAI‐1 e HAI‐2 e remissão incompleta ou não remissão em 18 com HAI‐1 (22,5%).
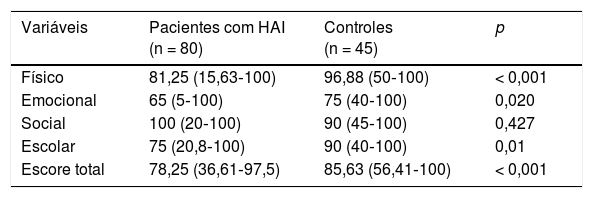
A tabela 2 ilustra os escores dos pacientes do PedsQL 4.0 em comparação com controles saudáveis e escores dos pais em comparação com os pais dos controles. Os escores físico, emocional, escolar e total foram significativamente menores em pacientes com HAI em comparação com os controles saudáveis. Os escores físico e total foram significativamente menores em pais dos indivíduos com HAI em comparação com os pais dos controles.
Escores do Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0) de acordo com os relatos de pacientes com hepatite autoimune (HAI) e controles saudáveis e seus pais
| Variáveis | Pacientes com HAI (n = 80) | Controles (n = 45) | p |
|---|---|---|---|
| Físico | 81,25 (15,63‐100) | 96,88 (50‐100) | < 0,001 |
| Emocional | 65 (5‐100) | 75 (40‐100) | 0,020 |
| Social | 100 (20‐100) | 90 (45‐100) | 0,427 |
| Escolar | 75 (20,8‐100) | 90 (40‐100) | 0,01 |
| Escore total | 78,25 (36,61‐97,5) | 85,63 (56,41‐100) | < 0,001 |
| Pais de crianças com HAI (n = 58) | Pais de controles (n = 47) | p | |
|---|---|---|---|
| Físico | 84,37 (3,13‐100) | 96,88 (53,13‐100) | < 0,001 |
| Emocional | 67,5 (5‐100) | 75 (25‐100) | 0,071 |
| Social | 100 (10‐100) | 90 (45‐100) | 0,120 |
| Escolar | 77,50(20‐100) | 85 (35‐100) | 0,246 |
| Escore total | 79,06 (35,47‐100) | 86,25 (57,5‐100) | 0,016 |
Os resultados são apresentados em mediana (intervalo) pelo teste de Mann‐Whitney.
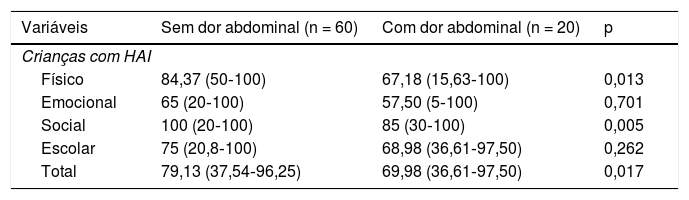
A tabela 3 mostra a média dos escores físico, social e total em pacientes com HAI que apresentaram dor abdominal em comparação com os que não apresentaram dor abdominal. Foi observado um prejuízo significativo na QVRS nos escores físico, social, escolar e total em pacientes com HAI com dor abdominal com base no relato dos pais.
Escores do Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0) de crianças e adolescentes com hepatite autoimune (HAI) e seus pais, de acordo com a presença de dor abdominal
| Variáveis | Sem dor abdominal (n = 60) | Com dor abdominal (n = 20) | p |
|---|---|---|---|
| Crianças com HAI | |||
| Físico | 84,37 (50‐100) | 67,18 (15,63‐100) | 0,013 |
| Emocional | 65 (20‐100) | 57,50 (5‐100) | 0,701 |
| Social | 100 (20‐100) | 85 (30‐100) | 0,005 |
| Escolar | 75 (20,8‐100) | 68,98 (36,61‐97,50) | 0,262 |
| Total | 79,13 (37,54‐96,25) | 69,98 (36,61‐97,50) | 0,017 |
| Pais de crianças com HAI | (n = 42) | (n = 16) | p |
|---|---|---|---|
| Físico | 87,50 (43,75‐100) | 75 (3,13‐100) | 0,016 |
| Emocional | 65 (25‐100) | 70 (5‐95) | 0,910 |
| Social | 100 (20‐100) | 95 (10‐100) | 0,027 |
| Escolar | 85 (55‐100) | 67,50(20‐95) | 0,012 |
| Total | 81,79 (57,97‐100) | 72,50 (35,47‐93,13) | 0,016 |
Os resultados são apresentados em mediana (intervalo) pelo teste de Mann‐Whitney.
A análise dos pacientes com HAI em remissão incompleta ou não remissão em comparação com os pacientes em remissão revelou média de escores físico, emocional, social, escolar ou total não significativa nos autorrelatos dos pacientes com HAI ou nos relatos dos pais dos pacientes com HAI. Uma análise com base na gravidade da doença não mostrou diferenças significativas em qualquer domínio nos relatos dos pacientes ou dos pais.
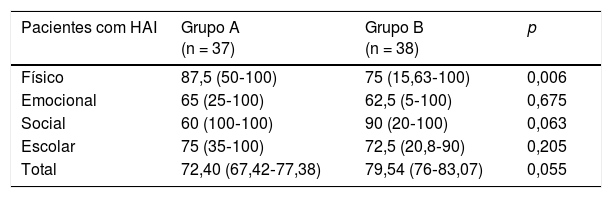
Uma análise adicional dos pacientes com HAI com base na dose de prednisona, em que o grupo A tomou uma dose de prednisona de < 0,16mg/kg/dia e o grupo B uma dose de prednisona de ≥ 0,16mg/kg/dia, revelou que o escore físico foi significativamente menor no grupo B. Nenhuma diferença foi vista nos escores físico, emocional, social, escolar ou total entre os grupos de uso de dose de prednisona com base nos relatos dos pais (tabela 4).
Escores do Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0) de crianças e adolescentes de acordo com a mediana da dose de prednisona no momento da entrevista: Grupo A (< 0,16mg/kg/dia) em comparação com o Grupo B (≥ 0,16mg/kg/dia)
| Pacientes com HAI | Grupo A (n = 37) | Grupo B (n = 38) | p |
|---|---|---|---|
| Físico | 87,5 (50‐100) | 75 (15,63‐100) | 0,006 |
| Emocional | 65 (25‐100) | 62,5 (5‐100) | 0,675 |
| Social | 60 (100‐100) | 90 (20‐100) | 0,063 |
| Escolar | 75 (35‐100) | 72,5 (20,8‐90) | 0,205 |
| Total | 72,40 (67,42‐77,38) | 79,54 (76‐83,07) | 0,055 |
| Pais de crianças com HAI | Grupo A (n = 23) | Grupo B (n = 31) | p |
|---|---|---|---|
| Físico | 86,41 (81,09‐91,73) | 74,63 (66,36‐82,90) | 0,056 |
| Emocional | 67,60 (58,36‐76,84) | 63,22 (54,86‐71,58) | 0,434 |
| Social | 91,95 (85,18‐98,72) | 89,83 (81,79‐97,88) | 0,965 |
| Escolar | 79,13 (71,70‐86,55) | 77,31 (72,53‐82,08) | 0,578 |
| Total | 81,27 (76,66‐85,89) | 76,25 (70,83‐81,67) | 0,290 |
Os resultados são apresentados em mediana (intervalo) pelo teste de Mann‐Whitney.
O presente estudo é a primeira investigação da QVRS em pacientes pediátricos com HAI na América do Sul. Encontramos escores reduzidos em quase todos os domínios (físico, emocional, escolar e total) em pacientes com HAI em comparação com os controles.
As doenças crônicas são conhecidas por colocar a QVRS em risco em todas as idades e apesar de as crianças de um a três anos geralmente não conseguirem se expressar verbalmente, elas conseguem comunicar seus problemas. Esses sinais não devem ser subestimados durante a consulta clínica.22 No caso de adolescentes, uma melhoria na QVRS é essencial na promoção de adesão ao tratamento. Apesar dessa importância, estima‐se que menos de 25% dos pediatras usam as medições de qualidade de vida em suas consultas.23 Há um interesse cada vez maior na adaptação e criação de instrução para medir a QVRS em crianças e adolescentes devido a um aumento na prevalência de doenças crônicas nessa faixa etária. A maior parte desses instrumentos é quantitativa e muitos deles são específicos para algumas doenças. Um grande desafio é incorporar as medições de QVRS na prática clínica.7 A qualidade de vida é um conceito relacionado a aspectos culturais; assim, os instrumentos de medição da QVRS devem ser adaptados a culturas e idiomas locais. Não há um questionário específico para crianças e adolescentes com hepatite autoimune (HAI) e pouco se sabe sobre a QVRS desses pacientes.
As principais vantagens do presente estudo são a avaliação sistemática da QVRS em crianças e adolescentes com hepatite autoimune com uma amostra relativamente grande, apesar dos poucos estudos anteriores, e a exclusão de pacientes submetidos a transplante de fígado, pois essa doença pode reduzir a QVRS.24 Além disso, um grupo de controle saudável com perfil de idade semelhante foi incluído no presente estudo. A principal limitação deste estudo foi o uso de somente uma ferramenta genérica para medir a QVRS em crianças com HAI e seus pais. Um possível viés foi a comparação exclusiva com um grupo de controle saudável; contudo, não há dados publicados sobre a QVRS de crianças e adolescentes com doença hepática crônica no Brasil para outras comparações. Como nossa amostra foi composta de crianças de diferentes regiões do Brasil, podemos usar um grupo de controle de qualquer região com confiança.
As queixas dos pais com relação a manifestações clínicas foram muito mal relatadas, com exceção de dor abdominal, que chamou nossa atenção. Nossos dados confirmam os relatos anteriores de que dor abdominal está associada a redução na QVRS.10 Esse achado pode estar relacionado aos efeitos colaterais de agentes imunossupressores, complicações da HAI ou mesmo manifestação psicossomáticas.25
Observamos que a dose de corticosteroide está associada a redução nos escores físicos em crianças e adolescentes com HAI.9 Mesmo baixas doses de corticosteroides não devem ser subestimadas, pois esses medicamentos podem afetar a composição corporal e hipertricose, acne, estrias, ganho de peso e alterações no crescimento e, assim, afetar os escores da QVRS.26 Apesar dessas manifestações não terem sido observadas em nossa amostra, os escores físicos dos pacientes com HAI mostraram redução.
Aproximadamente um quinto de nossos pacientes com HAI estava em remissão incompleta no momento da entrevista, apesar de essa variável não influenciar a QVRS. Esse achado também foi observado na população adulta com HAI. Portanto, a QVRS poderá ser reduzida em pacientes em remissão, bem como em pacientes que iniciam tratamento. Esses achados corroboram a visão de que a QVRS é uma medida individual e subjetiva que deve ser considerada no tratamento individualizado de cada paciente.9,22
Um histórico prévio de complicações não influenciou a QVRS de crianças ou adolescentes com HAI. Os relatos dos pais revelaram escores de QVRS mais baixos somente no domínio físico, um achado que difere de um relato anterior que sugere que todos os domínios, exceto o social, foram prejudicados.10 Adicionalmente, a avaliação da QVRS pelos pais difere de pacientes em que quase todos os domínios apresentam redução. Talvez os pais tenham confundido os sintomas emocionais dos filhos com sintomas físicos e tenham interpretado de forma errônea tristeza como dor física. Existe a possibilidade de que as diferenças culturais e socioeconômicas entre nossa amostra de pais e a amostra no estudo anterior tenham levado a essa discrepância nos achados, apesar de o instrumento ser validado para situação cultural e socioeconômica.
As doenças crônicas na população pediátrica reduzem a QVRS, principalmente doenças com dor física grave ou aquelas que exigem tratamentos mais agressivos.27 Apesar de a HAI não mostrar essas características e geralmente responder bem a tratamento, nossos resultados mostram uma redução significativa na QVRS em todos os domínios, exceto social, para pacientes com HAI em comparação com controles saudáveis.10,28 Para pacientes com HAI, o tratamento de quaisquer sintomas físicos que podem ocorrer não elimina a doença crônica na infância e adolescência e o alívio dos sintomas físicos não necessariamente indica melhor QVRS. Apesar de todos os domínios testados estarem relacionados entre si, ou seja, caso o prejuízo emocional afete o domínio físico, os domínios físico e escolar devem ser mais investigados, pois a HAI não causa sintomas físicos ou redução cognitiva significativos. Existe a possibilidade de faltas escolares causadas por consultas regulares de acompanhamento, necessárias para exames médicos, poderem prejudicar o desempenho escolar.
Notavelmente, uma pesquisa anterior indica que as crianças conseguem demonstrar seus próprios sentimentos e queixas com uma avaliação confiável de sua própria QVRS.29 Assim, instrumentos específicos para medir a QVRS em várias doenças em crianças e adolescentes têm sido desenvolvidos e serão necessários estudos adicionais que avaliem novas ferramentas específicas para avaliar a QVRS em pacientes com HAI.
Escores reduzidos nos domínios físico, emocional e escolar foram observados em pacientes pediátricos com HAI. Dor abdominal e dose de corticosteroide influenciaram negativamente a QVRS em crianças e adolescentes com HAI. A gravidade da doença e o estado de remissão da doença não influenciaram a QVRS na população pediátrica com HAI.
Por fim, nossos resultados destacam a urgência de dar atenção a sintomas físicos, escolares e emocionais de pacientes com HAI e ao desenvolvimento de um instrumento específico de medição da QVRS para crianças e adolescentes com HAI.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Dr. James W. Varni, Dr. Claudio A. Len e Dra. Denise A. Klatchoian por fornecerem o instrumento Inventário Pediátrico de Qualidade de Vida 4.0 (PedsQL 4.0).
Como citar este artigo: Bozzini AB, Neder L, Silva CA, Porta G. Decreased health‐related quality of life in children and adolescents with autoimmune hepatitis. J Pediatr (Rio J). 2019;95:87–93.