A hérnia diafragmática congênita (HDC) continua a ser uma das anomalias congênitas mais temidas nas Unidades de Terapia Intensiva Neonatal (UTIN). A herniação de órgãos abdominais devido à mal formação do diafragma durante o desenvolvimento fetal pode levar a hipoplasia pulmonar quase letal e à deformidade cardíaca. A hipertensão pulmonar persistente neonatal (HPPN) grave, insuficiência respiratória hipóxica e a disfunção cardíaca frequentemente complicam o curso clínico dos recém‐nascidos com HDC. O reconhecimento da interdependência dos sistemas pulmonar e cardiovascular, especialmente no contexto de fisiologia anormal, é de suma importância ao fornecer tratamento médico a esses pacientes.
A incidência de HDC é estimada em aproximadamente um caso por 3.000 nascidos vivos. Uma estimativa confiável, no entanto, é comprometida pela interrupção da gravidez, coleta imprecisa de dados e casos não relatados de recém‐nascidos que morrem da doença sem um diagnóstico pré‐natal conhecido (chamado de “mortalidade oculta”).1 A condição é incomum o suficiente para que a maioria das UTINs regionais faça o manejo de menos de uma dúzia de casos de HDC anualmente, o que também explica os contínuos desafios na feitura de estudos randomizados prospectivos. Em 1995, foi estabelecido o registro de um Grupo de Estudos de HDC (CDHSG, CDH Study Group) com o objetivo de unir centros de referência terciários em quatro continentes para compilar dados sobre bebês nascidos vivos com HDC e avaliar terapias e desfechos.2 Com exceção dos ensaios clínicos randomizados, registros como o CDHSG e estudos observacionais, como o estudo de Carmo et al.3 nesta edição do Jornal de Pediatria, fornecem uma importante fonte de conhecimento.
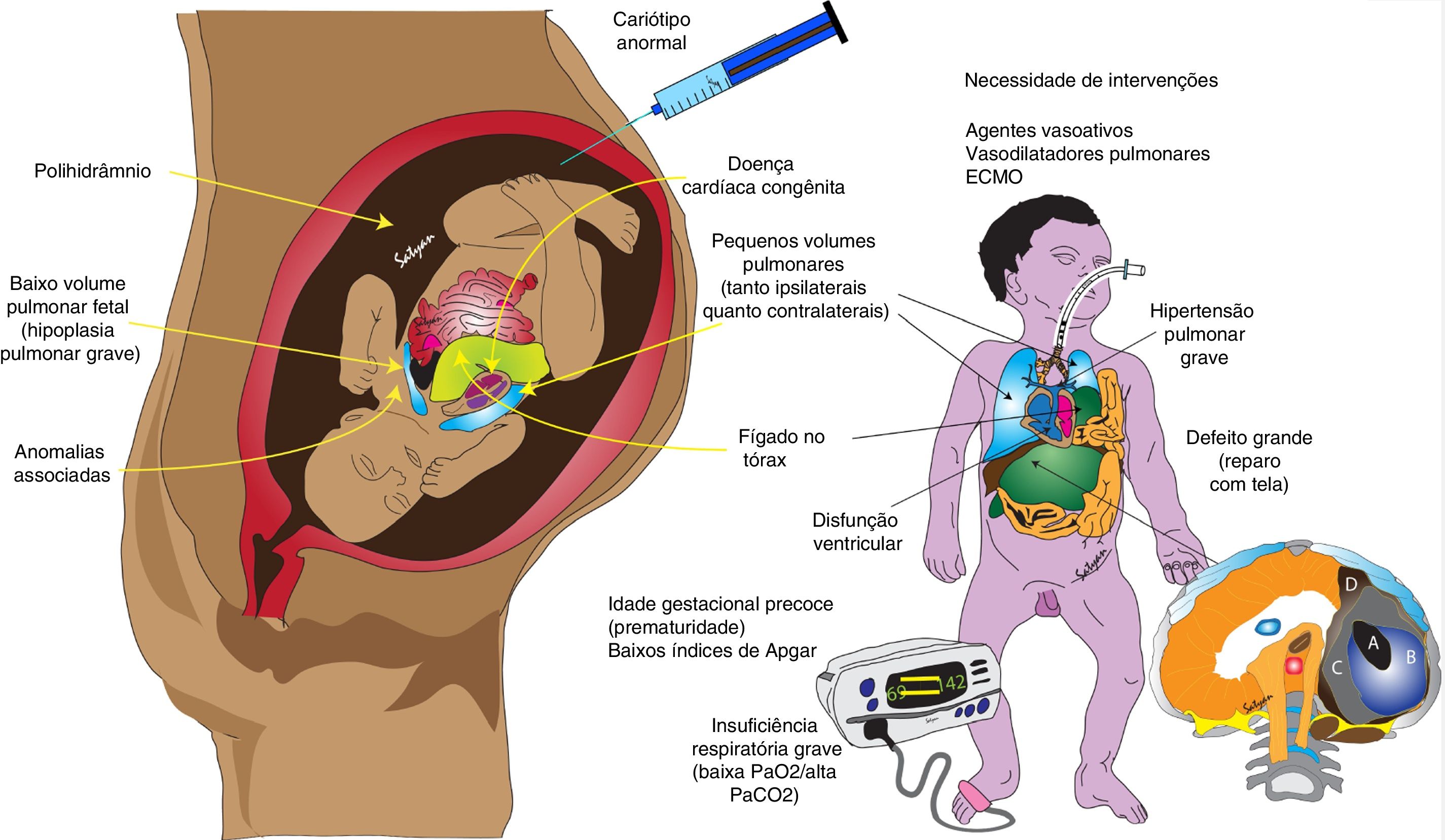
Cento e vinte e nove recém‐nascidos com diagnóstico pré‐natal de HDC nasceram em uma grande UTIN no Rio de Janeiro, Brasil, de 2005 a 2015. As características relatadas do recém‐nascido (i.e., idade gestacional ao nascimento, sexo, lado da HDC, herniação de fígado, incidência associada de anomalias congênitas etc.) são semelhantes a outros relatos publicados sobre HDC. A mortalidade geral de 61%, no entanto, é significativamente maior em comparação com a mortalidade estimada de aproximadamente 20 a 30% relatada em grandes registros, que incluem centros nos quais a oxigenação por membrana extracorpórea (ECMO, extracorporeal membrane oxygenation) está disponível.2–6 Essa grande discrepância na mortalidade pode ser parcialmente explicada pela falta de ECMO. Considerando que 30,3% dos pacientes com HDC relatados nos registros entre 2007 e 2013 foram submetidos à ECMO4 e quase 51% dos pacientes com HDC submetidos à ECMO não sobrevivem,7 apenas metade das mortes relatadas por Carmo et al.3 pode ser explicada, provavelmente pela falta de ECMO. Obter um entendimento melhor sobre por que a mortalidade é muito maior em uma UTIN terciária com outros recursos é crucial para identificar áreas de inadequação que podem ser abordadas para melhorar os resultados. Como é da natureza dos estudos observacionais, o presente trabalho sofre limitações que tornam incompleta a interpretação dos indicadores prognósticos. Nenhuma informação é fornecida sobre a avaliação do volume pulmonar fetal, avaliação ecocardiográfica da função cardíaca ou tamanho do defeito, fatores que demonstraram correlacionar‐se fortemente com a sobrevida (fig. 1).
Fatores associados ao prognóstico ruim da hérnia diafragmática congênita (HDC).
Fatores pré‐natais, como baixo volume pulmonar fetal, anomalias associadas (especialmente cardíacas), polihidrâmnio, cariótipo anormal e fígado localizado no tórax podem estar associados a menor sobrevida. Fatores pós‐natais associados à hipertensão pulmonar grave (baixa PaO2), hipoplasia pulmonar (alta PaCO2), grande defeito que requer reparo com tela, disfunção ventricular e necessidade de agentes vasoativos e/ou ECMO, estão associados a maior mortalidade.
Direitos autorais: Satyan Lakshminrusimha.
A relação entre o tamanho do defeito diafragmático e a sobrevida foi relatada pela primeira vez após a análise de 3.062 casos de HDC a partir de dados coletados pelo registro do CDHSG durante 9 anos, de 1995 a 2004, e foi observado que o tamanho do defeito teve o impacto mais importante na sobrevida.8 Posteriormente, um sistema de classificação que incluiu o tamanho do defeito (classificado como “A” para pequeno a “D”’ como agenesia do diafragma – fig. 1)9 e a presença ou ausência de anomalias cardíacas principais associadas, foi incluído na análise dos dados. Relatos posteriores mostraram que bebês com tamanho de defeito “A” e sem grandes anomalias cardíacas têm sobrevida de 99% em comparação com 39% dos pacientes com tamanho de defeito “D”, com importante defeito cardíaco congênito.10 A análise mais recente do registro do CDHSG, inclusive 7.617 casos desde o início do registro em 1995 até 2013, relatou um aumento marginal na sobrevida global de 67,6% em 1995‐2000 para 71,6% em 2007‐2013.4 No entanto, pacientes que necessitaram de um reparo com tela obtiveram um aumento maior na sobrevida, de 68,1% para 76,9%.4 Apesar de uma possível incidência maior de grandes defeitos nas últimas duas décadas, conforme indicado pela maior necessidade de reparo com tela, a melhoria na sobrevida nesses pacientes mostra uma tendência promissora. Deve‐se ter em mente, no entanto, que a maioria dos centros que pertencem a esse registro tem acesso à ECMO, o que pode aumentar as chances de sobrevida.11
O diagnóstico pré‐natal de HDC, melhores modalidades de testes de imagem (ressonância magnética [RM] vs. ultrassonografia) e o uso de ecocardiografia fetal podem fornecer informações que ajudam a determinar o sucesso da sobrevida e a necessidade de ECMO. Dados da Canadian Pediatric Surgery Network, inclusive 140 neonatos com diagnóstico pré‐natal de HDC (75 neonatos nascidos na maternidade e 65 nascidos em outro local), relataram que a probabilidade de mortalidade era significativamente maior para neonatos nascidos em outro local (odds ratio 2,8) ao ajustar para a gravidade da doença.6 No estudo acima mencionado, a mortalidade entre neonatos nascidos na maternidade e nascidos em outro local não alcançou significância estatística em 17/75 (20%) em comparação com 21/65 (38%), respectivamente (p = 0,25). No entanto, os pacientes nascidos na maternidade apresentaram um índice de gravidade da doença significativamente maior. Em uma análise mais recente de dados do estudo Diaphragmatic Hernia Research and Exploration, Advancing Molecular Science (DHREAMS), inclusive 220 casos de HDC, pacientes que foram transferidos (ou seja, nascidos em outro local) apresentaram maior sobrevida a 85% (68/80) em comparação com 71,4% (100/140) dos pacientes nascidos na maternidade.5 Não há conclusões definitivas desses estudos em relação à taxa de sobrevida e ao local do parto, mas os dados apoiam que neonatos nascidos em outro local com diagnóstico de HDC que sobrevivemà transferência para um centro de referência podem apresentar um quadro menos grave da doença.
Se um diagnóstico pré‐natal de HDC for confirmado, uma avaliação fetal cuidadosa por ultrassonografia, ressonância magnética e ecocardiografia fetal pode identificar vários preditores prognósticos dos desfechos do neonato, que incluem herniação de fígado na cavidade torácica, avaliação do volume pulmonar (por exemplo, relação pulmão/cabeça [LHR, lung‐to‐head ratio], percentual do volume pulmonar previsto [PPLV, percent predicted lung volume] e volume pulmonar total [TLV, total lung volume]), evidência de hipoplasia do ventrículo esquerdo (VE) e quaisquer anomalias congênitas associadas.12 Em uma metanálise recente, a confirmação de hérnia hepática (407 fetos) em comparação com nenhuma visualização do fígado na cavidade torácica (303 fetos) foi associada a uma sobrevida significativamente menor (45,4% vs. 73,9%, respectivamente).13 Além disso, a necessidade de ECMO foi significativamente maior nos casos de HDC com herniação de fígado.14 A ressonância magnética demonstrou ter valor preditivo superior ao ultrassom na avaliação do volume pulmonar.15 PPLV < 15% e TLV < 20mL demonstraram ser fortes preditores de desfecho ruim e maior uso da ECMO,16 como seria de se esperar, uma vez que volumes pulmonares mais baixos implicam em hipoplasia grave. A estimativa do volume pulmonar fetal pode, portanto, melhorar a sobrevida dos bebês afetados mais gravemente, se for possível organizar a transferência materna antes do parto para um centro com ECMO.
Observações feitas em estudos de anatomia post‐mortem mais de três décadas atrás em bebês que morreram de HDC revelaram corações esquerdos hipoplásicos e diminuição da massa cardíaca.17 Além disso, estudos ecocardiográficos fetais em fetos com HDC que mostraram evidências de hipoplasia do VE antes de 24 semanas de gestação relataram 100% de mortalidade após o nascimento.18 Recentemente, a avaliação precoce da função cardíaca por ecocardiografia em bebês com HDC mostrou que a função cardíaca diminuída é um melhor preditor da necessidade de ECMO do que a gravidade da hipertensão pulmonar.19
O momento e o modo preferido de parto nas gestações comHDC continuam controversos. Stevens et al. sugeriram inicialmente que o parto prematuro pode conferir uma vantagem na HDC.20 No entanto, Hutcheon et al. mostraram que a mortalidade infantil diminuiu significativamente com o avanço da gestação, de 36% em 37 semanas de gestação para 20% em 40 semanas de gestação.21 Além disso, um estudo de Odibo et al. de 107 casos de HDC encontrou que a idade gestacional no parto era inversamente correlacionada com a necessidade de ECMO.22 Em contraste, Safavi et al. não encontraram diferença na mortalidade ao dividir em categorias a idade gestacional no parto, em menos de 37 semanas, 37‐38 semanas e mais de 39 semanas.23 Não houve diferença na mortalidade entre parto vaginal e cesariana. Na ausência de evidências robustas, parece razoável programar o parto em 39 semanas ou mais e em um ambiente com acesso a serviços terciários de UTIN.
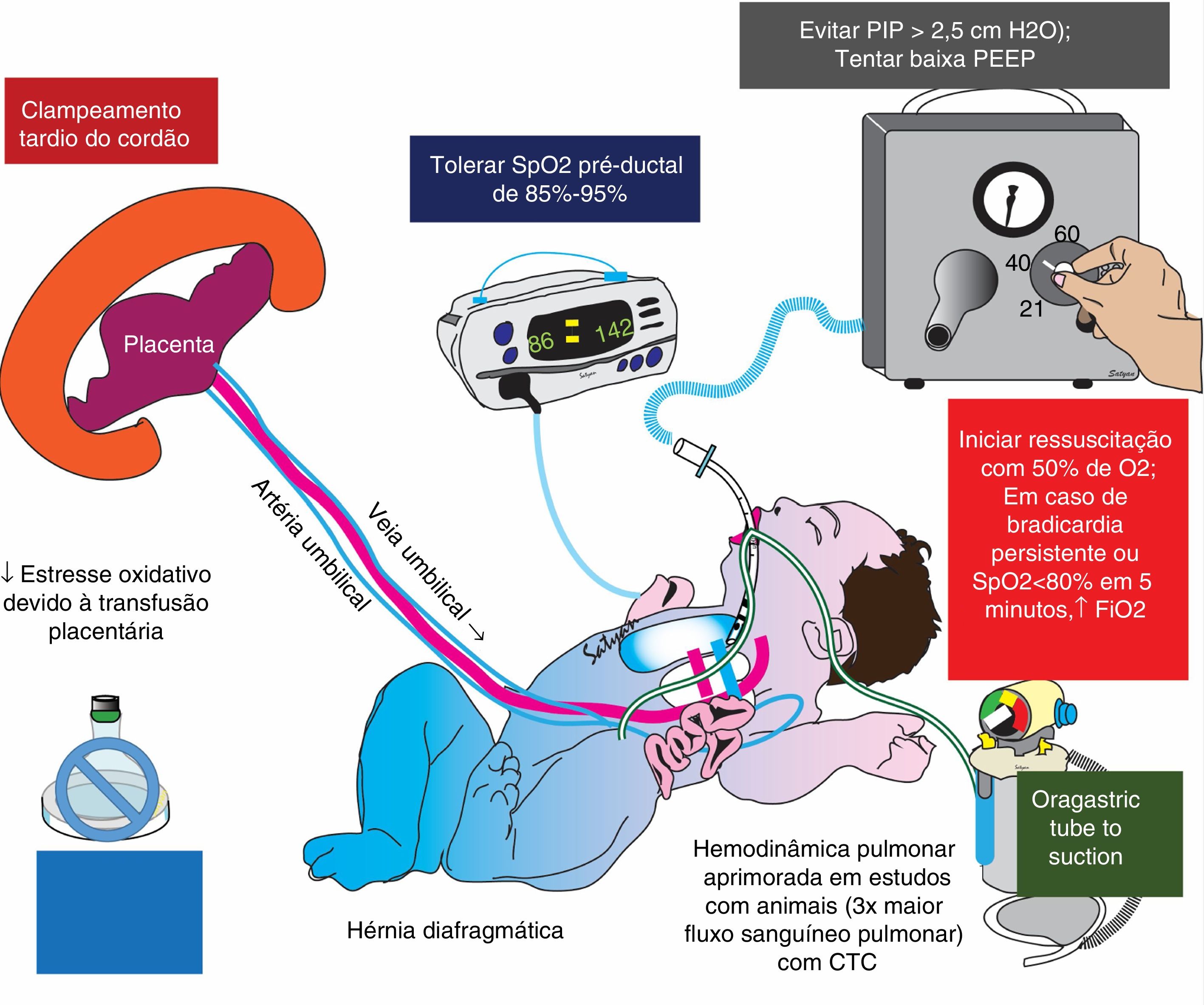
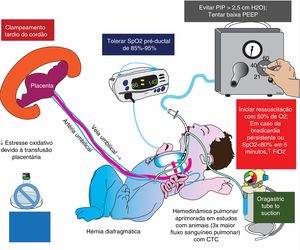
O clampeamento tardio do cordão está sendo investigado em um estudo piloto para bebês nascidos com HDC (NCT03314233). Estudos em cordeiros sugerem que o clampeamento fisiológico/tardio do cordão reduz a resistência vascular pulmonar (RVP) e aumenta significativamente o fluxo sanguíneo pulmonar na HDC.24 Uma estratégia que combina ventilação com níveis mais baixos de oxigênio inspirado com pressões ventilatórias mais baixas25,26 e com um cordão intacto pode ser uma abordagem eficaz durante a ressuscitação na sala de parto de neonatos com HDC (fig. 2).
Manejo na sala de parto da hérnia diafragmática congênita (HDC).
O estresse oxidativo desempenha um papel importante na patogênese da hipertensão pulmonar e na lesão dos pulmões hipoplásicos na HDC. O clampeamento tardio do cordão umbilical, que limita o barotrauma (com baixas pressões ventilatórias) e restringe a FiO2 para atingir a SpO2 pré‐ductal, entre 85‐95%, é uma estratégia importante para limitar o estresse oxidativo na HDC.
CTC; clampeamento tardio do cordão umbilical; PEEP (positive end‐expiratory pressure), pressão expiratória final positiva.
Direitos autorais Satyan Lakshminrusimha.
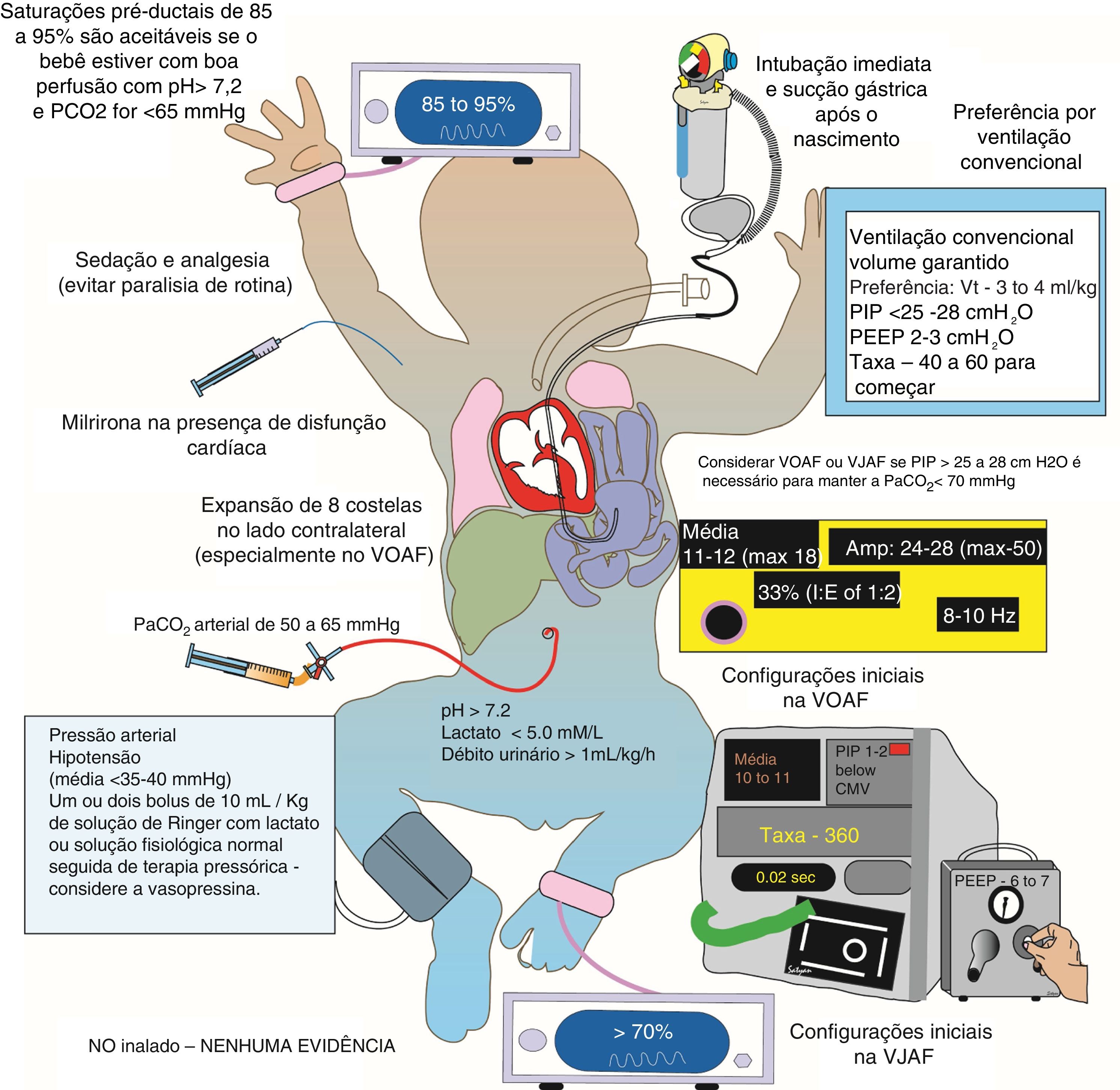
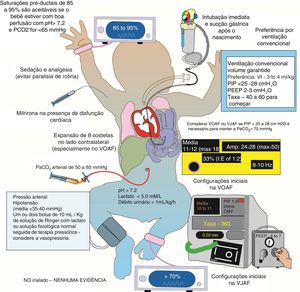
A HDC é uma síndrome complexa e implacável, pela qual uma compreensão incompleta da fisiopatologia subjacente à insuficiência respiratória hipóxica, bem como a HPPN e a disfunção cardíaca associadas, pode causar o risco de uma deterioração abrupta do paciente se o tratamento médico não for aprimorado. Os pulmões hipoplásicos são particularmente sensíveis à lesão pulmonar induzida por ventilador. A ventilação suave com volumes tidais baixos (3‐4mL/kg), pressões médias baixas de vias aéreas e baixa pressão expiratória final positiva (aceitando assim hipercapnia permissiva com valores de CO2 entre 50‐65mm Hg) demonstraram melhorar os desfechos e devem ser consideradas antes da ventilação de alta frequência.27 Garantir metas adequadas de saturação pré‐ductal (85‐95%) de oxihemoglobina (SpO2) e prevenir extremos de hipoxemia (SpO2 < 80%, que demonstram aumentar a resistência vascular pulmonar) ou hiperóxia (SpO2 > 95%, conhecida por produzir excesso de espécies reativas de oxigênio e causar biotrauma), aprimorarão a oxigenação (fig. 3).28
Manejo pós‐natal de hérnia diafragmática congênita (HDC) na UTIN.
São elementos importantes no manejo de HDC na UTIN: tolerar saturações de oxigenação pré‐ductal na faixa de 85‐95%, preferência de ventilação convencional com baixa PEEP e hipercapnia permissiva utilizando estratégias de ventilação suave.
VJAF, ventilação por jato de alta frequência; VMC, ventilação mecânica convencional; VOAF ventilação oscilatória de alta frequência; PEEP, pressão positiva expiratória final; PIP, Pressão positiva inspiratória.
Direitos autorais: Satyan Lakshminrusimha.
Apesar dos melhores esforços dos médicos para adotar estratégias de proteção pulmonar e acesso prontamente disponível a vasodilatadores pulmonares seletivos (por exemplo, óxido nítrico inalado [NOi]), o número total de crianças que são colocadas na ECMO não mudou na última década. A HDC continua a ser a indicação mais comum para a feitura de ECMO e apenas aproximadamente metade dos pacientes sobrevive à alta hospitalar.7 O motivo pelo qual não houve redução no número de casos de ECMO por HDC e nenhuma melhoria na sobrevida após a ECMO nessa população pode ser porque pacientes atuais com CDH submetidos à ECMO estão mais gravemente doentes como resultado de um melhor tratamento médico em comparação com seus antecessores de alguns anosatrás.
Evidências recentes sugerem que a disfunção cardíaca (especialmente a função do VE diminuída) pode estar na raiz de uma falha cardiopulmonar irreversível e iminente, mais do que a gravidade da HPPN.19,29,30 É esperado que uma função ruim do VE leve ao aumento da pressão atrial esquerda com resultante congestão venosa pulmonar e aumento da pressão venosa pulmonar. A diminuição da pressão arterial pulmonar em consequência da função ruim do VE pode levar a edema pulmonar e agravar ainda mais o estado respiratório. Fornecer apoio à função cardíaca, portanto, pode ser tão crítico quanto o manejo da HPPN em bebês com HDC. O papel da milrinona (um vasodilatador pulmonar também conhecido por ter efeitos inotrópicos e lusitrópicos cardíacos) está sendo avaliado atualmente em um estudo randomizado nos centros participantes da rede de pesquisa neonatal.31 Ao mesmo tempo, um estudo europeu controlado randomizado, multicêntrico, está investigando a sildenafila intravenosa e o NOi incorporando avaliação da função cardíaca (estudo CoDiNOS–Eudra CT número 2017‐000421‐13).
A criação de algoritmos que abordam a fisiopatologia cardíaca associada à HDC provavelmente levará a melhorias substanciais no atendimento a esses pacientes. Os ensaios clínicos acima mencionados que investigam o papel dos medicamentos vasodilatadores cardiotrópicos e pulmonares podem ajudar a resolver essa hipótese e melhorar a sobrevida. Uma abordagem sistemática e baseada em evidências para o gerenciamento de HDC na sala de parto (fig. 2) e UTIN (fig. 3) tem o potencial de reduzir a mortalidade.
FinanciamentoO trabalho recebeu apoio financeiro através de subvenções do NIH HD096299 (PV) e HD072929 (SL).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.