To compare the biochemical and immunological profiles of pediatric patients with acute myeloid leukemia (AML) with healthy children and adolescents.
MethodsThis was a cross‐sectional study in which 21 therapy‐naïve patients with AML were compared with a group of 24 healthy individuals. The following data were analyzed: serum proteins, leucocytes and subgroups, erythrocytes, hematocrit, hemoglobin, platelets, cytokines in peripheral blood mononuclear cells cultures under spontaneous and BCG‐ or PHA‐stimulated conditions, immunoglobulin A. and erythrocytic glutathione. Statistical analysis was performed using SPSS software, considering as significant p‐values<0.05.
ResultsSerum albumin levels were higher (p<0.0001) in the control group, as well as all the parameters related to red blood cells (p<0.0001). For leucocytes and subgroups, no statistical difference was found between the AML and the control groups. For cytokines, the concentrations were significantly higher under spontaneous and BCG‐stimulated conditions for TNF‐α, IL‐6, IL‐10, and IFN‐γ in the control group. Under PHA‐stimulated conditions, the concentration was higher (p=0.002) only for IL‐6. No difference was found between the two groups for the other cytokines and for IgA in the saliva. Erythrocytic glutathione was higher (p<0.0001) in AML patients.
ConclusionsIt was possible to characterize the biochemical and immunological profile of pediatric patients with AML, as well as highlight some significant differences in these parameters when comparing with healthy children and adolescents.
Comparar o perfil bioquímico e imunológico de pacientes pediátricos portadores de leucemia mieloide aguda (LMA) em relação a um grupo de crianças e adolescentes saudáveis.
Métodos Estudo transversal, em que foram avaliados 21 pacientes com LMA virgens de terapia e 24 indivíduos saudáveis. Foram analisados: proteínas séricas, leucócitos e subgrupos, eritrócitos, hematócrito, hemoglobina e plaquetas, citocinas em cultura de células mononucleares do sangue periférico sob condição espontânea e estimulada por BCG ou PHA, imunoglobulina A e glutationa eritrocitária. Análise estatística foi feita com o software SPSS considerando p<0,05.
ResultadosAlbumina sérica foi superior (p<0,0001) no grupo de controle, bem como todos os parâmetros relacionados com os glóbulos vermelhos (p<0,0001). Para os leucócitos e subgrupos não houve diferença estatística entre os pacientes com LMA e o grupo controle. As concentrações foram significativamente mais elevadas sob condições espontânea e estimulada por BCG para as citocinas TNF‐α, IL‐6, IL‐10 e IFN‐γ no grupo controle. Sob condição estimulada com PHA a concentração foi superior (p=0,002) apenas para a IL‐6. Não houve diferença estatística para as demais citocinas e para IgA salivar entre os dois grupos. Glutationa eritrocitária foi superior (p<0,0001) nos pacientes LMA.
ConclusõesDiante do exposto, foi possível caracterizar o perfil bioquímico e imunológico de pacientes pediátricos com LMA, bem como evidenciar diferenças significativas em alguns desses parâmetros ao se compararem os indivíduos doentes e o grupo de crianças e adolescentes saudáveis.
Os tipos comuns de câncer na infância são: leucemias, principalmente a leucemia linfoide aguda (LLA), leucemia mieloide aguda (LMA), tumor no sistema nervoso central, linfoma, neuroblastoma, tumor de Wilms, osteossarcoma e sarcoma de Ewing. De todos os casos de LLA, 80% ocorrem em crianças, ao passo que apenas 10% dos casos de LMA ocorrem nessa faixa etária. Tem sido observada uma ocorrência cada vez maior de câncer infantil no Brasil.1‐3A leucemia aguda é a principal neoplasia da medula óssea caracterizada por um grupo heterogêneo de doenças nas quais ocorre uma substituição dos elementos medulares e sanguíneos normais por células imaturas chamadas blastos e um acúmulo dessas células em outros tecidos.4
Segundo Casciato,5 as células leucêmicas se reproduzem mais lentamente do que as células normais correspondentes. A hematopoiese se torna anormal antes mesmo de a proporção de células na medula apresentar um aumento perceptível. Os precursores dos leucócitos imaturos que apresentam mau funcionamento substituem de maneira progressiva a medula óssea e se infiltram em outros tecidos.
Os sinais e sintomas da leucemia aguda resultam da queda na quantidade de células sanguíneas, o que leva a anemia, fraqueza, desconforto geral, palidez, fadiga, palpitação e dispneia ao se exercitar. Podem ocorrer febre e infecções como consequência da redução dos granulócitos.5,6
A caracterização do perfil bioquímico e imunológico de pacientes com LMA é importante para intervenções nutricionais e médicas e, após o crescimento e o desenvolvimento normais de crianças e adolescentes, melhorar a resposta imunológica e a tolerância de pacientes ao tratamento, bem como sua qualidade de vida.
O objetivo desta investigação foi comparar os perfis bioquímico e imunológico de pacientes pediátricos com LMA aos perfis de indivíduos saudáveis de mesma idade.
MétodosPopulaçãoA amostra estudada foi de pacientes internados no Centro Infantil Boldrini, Campinas, SP, Brasil, para tratamento de leucemia imediatamente após o diagnóstico de leucemia mieloide aguda (LMA) e participação em um ensaio clínico de intervenção nutricional.
Os critérios de inclusão de pacientes foram: diagnóstico confirmado de LMA, não ter recebido tratamento anterior, faixa de 0‐19 anos e Termo de Consentimento Livre e Esclarecido assinado pelo paciente ou por um responsável legal após ter sido informado sobre os objetivos e os métodos usados na pesquisa e estar ciente dos procedimentos e desconfortos aos quais os participantes seriam submetidos. Estavam livres para aceitar a participação ou não, sem restrições.
Um grupo de controle de crianças e adolescentes saudáveis da mesma faixa etária também participou do estudo. Os critérios de inclusão desse grupo foram: o indivíduo não deve apresentar patologia nem receber medicação no momento da seleção ou da coleta de amostras, deve assinar o Termo de Consentimento Livre e Esclarecido e estar ciente dos objetivos e do desconforto envolvidos.
Ao término da investigação, foram avaliados 21 pacientes com LMA, 11 do sexo feminino e dez do masculino, com idade média de 6,83 (0,58‐19,83) anos. O grupo de controle foi composto de 24 indivíduos entre crianças e adolescentes distribuídos entre 17 do sexo feminino e sete do masculino, com idade média de 9,67 (1,5‐18,25) anos. A idade dos grupos não foi significativamente diferente (p=0,351), segundo o teste de Mann‐Whitney.
Avaliação bioquímica e imunológicaColeta de amostrasAs amostras biológicas foram coletadas dos pacientes pela equipe de enfermagem do Instituto Infantil Boldrini, onde todos os pacientes foram diagnosticados e recrutados. Entre 15‐20mL de sangue foram cuidadosamente coletados e evitou‐se hemólise.
A coleta de sangue dos indivíduos saudáveis foi feita no ambulatório do Centro de Investigação em Pediatria (CIPED) pelo enfermeiro responsável. Uma pipeta de Pasteur plástica, estéril e descartável, com capacidade de 1mL, foi usada para coleta de saliva. Os participantes foram orientados a não comer ou beber, exceto água, uma hora antes da coleta e a fazerem higiene bucal com água limpa.
Dosagens das proteínas séricas do sangueA fração de pré‐albumina sérica foi determinada por nefelometria e a albumina sérica pela reação colorimétrica com verde de bromocresol e espectrofotometria. Essas análises foram feitas no laboratório de bioquímica do Departamento de Patologia Clínica (DPC) do Hospital de Clínicas da Universidade Estadual de Campinas (Unicamp).
HemogramasOs hemogramas foram feitos no Instituto Infantil Boldrini como parte de uma rotina durante o tratamento clínico. Para indivíduos saudáveis (grupo de controle), os hemogramas foram feitos no Laboratório de Patologia Clínica do Hospital de Clínicas da Unicamp.
Glutationa eritrocitária reduzidaO ensaio seguiu uma modificação insignificante do método descrito por Beutler,7 proposto por Penna:8 200μL (duzentos microlitros) de sangue periférico EDTA foram lisados com 1,8mL de água destilada. Então, foram adicionados 2mL de solução de ácido metafosfórico a 1,67% e a mistura foi filtrada; 4mL de solução Na2HPO4 0,3mol foram adicionados a 1mL do filtrado claro e lidos a 412nm em um espectrofotômetro Beckman. Uma segunda leitura de densidade ótica foi feita após o acréscimo de 100mL de solução de ácido ditionitrobenzoico (DTNB) aos filtrados. Os resultados foram expressos em mg/dL.
Estímulos usados em culturasBacilos de Calmette‐Guérin (BCG) liofilizados (ampolas de vacina, cepas Moreau Rio de Janeiro, Brasil) foram recém‐reconstituídos com o meio de cultura RPMI 1640 (Sigma, Aldrich, EUA) e usados a 5×105UFC/mL. Fito‐hemaglutinina (PHA, Sigma Aldrich, EUA) foi usada em um controle positivo não específico a 7,5μg/mL e um meio isolado foi usado como controle negativo.
Concentração de citocina em sobrenadantes das culturas de células mononucleares do sangue periférico (CMSP)A concentração de citocina foi medida em culturas de CMSP por meio de uma modificação do protocolo de Gaines et al. 9 CMSP novas de pacientes e controles foram isoladas por centrifugação em gradiente de densidade com Histopaque® (Sigma, Aldrich, EUA), lavadas, diluídas a 2×106 células/mL em meio RPMI 1640 (Sigma, Aldrich, EUA), suplementadas com soro AB humano a 10% (Sigma, Aldrich, EUA), glutamina a 1% (Sigma, Aldrich, EUA) e gentamicina a 0,1% e estimuladas por 48 horas com BCG, PHA ou meio isolado reconstituídos a 37°C com CO2 a 5% em placas para cultura de tecidos com 96 poços de fundo redondo (Nunc, Thermo Fisher Cientific, EUA).
Os sobrenadantes das culturas foram coletados e armazenados a ‐80°C para teste de imunoadsorção enzimática (Elisa), sanduíche para detecção de dois anticorpos monoclonais. Foram usados kits comerciais (Sistemas RD, Duoset, EUA) para medir o interferão‐γ (IFN‐γ), fator de necrose tumoral‐α (TNF‐α), interleucina 6 (IL‐6) e concentração da IL‐10, segundo o protocolo do fabricante. Os níveis do fator de transformação do crescimento beta (TGF‐β) e IL‐8 foram medidos no plasma sanguíneo. Todas as amostras foram medidas em duplicidade e os resultados foram expressos em pg/mL.
Imunoglobulina A na salivaA saliva coletada foi centrifugada a 1.000g durante sete minutos e, então, armazenada a ‐80°C até o momento da análise, com resultados expressos em mg/mL. A concentração de imunoglobulina A (IgA) foi feita por meio de nefelometria.
Aspectos éticosTodos os aspectos éticos foram observados conforme recomendado para pesquisa biomédica que envolve seres humanos, de acordo com a resolução n° 196, de 1996, do Conselho Nacional de Saúde. O protocolo de pesquisa foi aprovado pelo Comitê Nacional de Ética em Pesquisa (Conep) e registrado sob o n° 14097.
Análise estatísticaTodos os resultados foram analisados pelo software SPSS® para Windows (Inc. Released 2007. SPSS for Windows, versão 16.0, EUA). A análise descritiva das variáveis foi apresentada como mediana (valores mínimos e máximos). A comparação da avaliação bioquímica entre o grupo de pacientes e o de controle foi feita com o teste não paramétrico de Mann‐Whitney, considerando p<0,05.
ResultadosParticiparam desta pesquisa 21 pacientes com LMA e 24 indivíduos saudáveis pareados por idade e não houve diferenças estatísticas.
De acordo com a classificação franco‐americana‐britânica (FAB), dentre os pacientes avaliados na pesquisa nove foram classificados como M5; quatro como M2; um como M1; um como M7 e seis não apresentaram a especificação de seu subtipo no gráfico.
Proteínas séricas albumina e pré‐albuminaA tabela 1 apresenta os resultados comparativos para os níveis de albumina e pré‐albumina séricas dos pacientes com LMA e dos indivíduos saudáveis (controle). Constatou‐se que tanto os níveis de albumina sérica quanto de pré‐albumina sérica eram significativamente maiores (p<0,0001) nos indivíduos saudáveis em comparação com os pacientes com LMA.
Níveis de albumina sérica e pré‐albumina em pacientes com leucemia mieloide aguda (LMA) e em indivíduos saudáveis (controle) na mesma faixa etária
A tabela 2 apresenta os resultados comparativos referentes aos parâmetros hematológicos entre pacientes com LMA e indivíduos saudáveis.
Parâmetros hematológicos determinados em pacientes pediátricos com leucemia mieloide aguda (LMA) e indivíduos saudáveis (controle) na mesma faixa etária
| Parâmetros | LMA(n=21) | Controle(n=24) | pa |
|---|---|---|---|
| Leucócitos (células x 109/L) | 13,1b (1,1‐494,0) | 6,51b (1,79‐15,11) | 0,219 |
| Linfócitos (células x 109/L) | 2,3 (0,6‐58,4) | 2,8 (1,83‐8,64) | 0,368 |
| Monócitos (células x 109/L) | 1,3 (0,1‐10,6) | 0,45 (0,24‐0,91) | 0,308 |
| Granulócitos (células x 109/L) | 4,3 (0,1‐48,6) | 3,64 (1,91‐5,57) | 0,825 |
| Eritrócitos (células x 1012/L) | 2,55 (1,78‐4,36) | 4,82 (4,17‐5,4) | < 0,0001 |
| Hematócrito (%) | 23,4 (16,6‐36,6) | 40,7 (34,1‐47,2) | < 0,0001 |
| Hemoglobina (g/dL) | 7,7 (5,6‐12,5) | 13,55 (11,1‐15,5) | < 0,0001 |
| Plaquetas (células x 109/L) | 38,0 (16‐220) | 307,0 (162‐461) | < 0,0001 |
Não houve diferença estatística nos níveis medianos do total de leucócitos e subgrupos (linfócitos, monócitos e granulócitos) entre os dois grupos. Contudo, os maiores valores de eritrócitos, hematócrito, hemoglobina e plaquetas (p<0,0001) devem ser observados no grupo de controle em comparação com os pacientes com LMA.
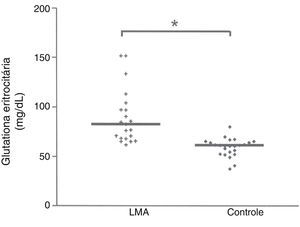
Concentração de glutationa eritrocitária reduzida (GSH)A concentração de GSH mediana no eritrócito de pacientes com LMA era significativamente maior (p<0,0001) do que os valores medidos nos indivíduos saudáveis, conforme ilustrado na figura 1. A concentração de GSH era de 82,88 (61,94‐151,77) mg/dL no grupo com LMA, em comparação com 61,72mg/dL no grupo de controle.
Concentração de citocina em sobrenadantes das culturas de CMSPA produção comparativa de citocinas foi determinada em sobrenadantes da cultura de células mononucleares do sangue periférico (CMSP) em três diferentes condições do grupo com LMA e de controle: espontânea (meio de cultura sem estímulo); meio de cultura mais a vacina BCG; meio de cultura mais fito‐hemaglutinina (PHA). Os resultados em termos de valores do meio e a disseminação (mínima‐máxima) são apresentados na tabela 3.
Concentração de citocinas (pg/mL) determinada em sobrenadantes das culturas de CMSP de pacientes com leucemia mieloide aguda (LMA) e em indivíduos saudáveis (controle) na mesma faixa etária
| Citocinas | Grupo | Condições | ||
|---|---|---|---|---|
| Espontânea | BCG | PHA | ||
| TNF‐α | LMA | 40,491a | 831,47 a | 683,17 a |
| Controle | (0,0‐418,9)22,42(0,0‐316,7) | (41,01‐15,825,3)4,800,42(1,408,7‐13,101,1) | (38,6‐1,977,2)986,61(87,7‐2,7882,1) | |
| pb | 0,011 | < 0,0001 | 0,052 | |
| IL‐6 | LMAControlepb | 455,641(0,0‐10,328,2)736,17(19,8‐5,044,4)0,197 | 4,807,2(41,0‐31,186,7)28,961,67(25,176,7‐293,344,6)< 0,0001 | 3,010,4(54,2‐28,250)9,654,65(1,904‐29,051,1)0,002 |
| IL‐10 | LMAControlepb | 0,0(0,0‐1,796,8)0,0(0,0‐119,7)0,065 | 124,54(0,0‐1,783,05)615,46(118,6‐2,204,9)0,003 | 393,80(63,8‐1,127,9)627,52(61,5‐1,465,2)0,284 |
| IFN‐γ | LMA | 23,17 | 98,71 | 150,23 |
| Controle | (0,0‐70,6)0,0(0,0‐48,9) | (0,0‐1,665)676,77(0,0‐1,935,3) | (0,0‐3,913,8)87,96(0,0‐630,5) | |
| pb | 0,012 | 0,003 | 0,273 |
TNF, fator de necrose tumoral; IL, interleucina; IFN, interferão.
Em condição espontânea, a concentração de TNF‐α e IFN‐γ era significativamente maior nos pacientes com LMA do que nos indivíduos saudáveis. Não foi encontrada diferença entre os dois grupos com relação à IL‐6 e IL‐10 nessa condição.
Na condição estimulada por BCG, todas as concentrações de citocinas (TNF‐α, IL‐6, IL10, IFN‐γ) eram significativamente maiores do que no grupo de controle.
Na presença de PHA, somente a concentração de IL‐6 era significativamente maior (p<0,002) no controle, comparado com o grupo com LMA. A TNF‐α também era maior no controle do que no grupo com LMA, contudo não atingiu relevância estatística. Não foi encontrada diferença entre os dois grupos com relação à IL‐10 e IFN‐γ nessa condição.
A concentração de TGF‐β e IL‐8, mensurada no plasma sanguíneo em ambos os grupos, e apenas na presença de BCG, não apresentou diferença estatística entre os grupos (dados não apresentados).
Determinação de IgA na salivaA imunoglobulina A (IgA) foi determinada na saliva dos indivíduos em ambos os grupos de estudo.
A concentração de IgA era de 6,5 (1‐17,4) mg/dL no grupo com LMA e de 9,05 (1,8‐25,1) mg/dL no grupo de controle e não apresentou diferença (p=0,693) entre os grupos.
DiscussãoAs proteínas séricas foram usadas como indicador sensível de desnutrição. Entretanto, outros fatores não relacionados à situação nutricional podem afetar o nível de proteína sérica, como: estado de hidratação, redução da síntese de proteínas hepáticas, permeabilidade capilar alterada devido a infecções ou catabolismo com deficiência de zinco em períodos de estresse e hipermetabolismo em certas neoplasias.10,11
Nossos resultados de albumina (4,8g/dL) e pré‐albumina (21,45mg/dL) nas crianças e nos adolescentes saudáveis (controle) foram estatisticamente maiores (p<0,0001) do que os valores encontrados nos pacientes com LMA. Esses resultados refletem diferenças esperadas no estado nutricional de crianças e adolescentes saudáveis conforme comparados com pacientes com LMA pareados por idade.
Em um estudo feito em 226 pacientes adultos com câncer, Marín Caro et al.12 constataram que 32% da população estudada apresentaram concentração de albumina sérica entre 3,0 a 3,5g/dL (classificada como desnutrição leve), e existe uma correlação negativa entre os níveis de proteína sérica e problemas de alimentação.
Pacientes gravemente doentes normalmente apresentam alterações metabólicas nos carboidratos, lipídios e proteínas. Essas alterações resultam de uma necessidade de catabolismo energético e proteico cada vez maior e contribuem para as alterações imunológicas e gastrointestinais.13
No que diz respeito aos parâmetros hematológicos (tabela 2), não foi encontrada diferença estatística entre pacientes com LMA e indivíduos saudáveis com relação aos leucócitos linfócitos, monócitos e granulócitos. Embora os valores médios tendam a ser mais elevados no grupo com LMA, essa falta de relevância estatística pode ser explicada como uma função de dois fatores: a) o número relativamente pequeno de indivíduos em nossas amostras; b) a grande variabilidade normalmente encontrada em glóbulos brancos (leucócitos) em pacientes com leucemia.5
Viana et al.14 conduziram um estudo em 83 crianças com LMA e também constataram uma grande variação na quantidade de leucócitos/mL de sangue.
Em nosso estudo, a quantidade total de leucócitos (13,1×109 células/L) no grupo com LMA pode ser considerada ligeiramente acima do normal e para o grupo de controle, normal (6,5×109 células/L), pois os valores de referência de normalidade variam entre 4,5 e 10,5×109 células/L.
Por outro lado, os eritrócitos, o hematócrito, a hemoglobina e as plaquetas eram todos significativamente maiores (p<0,0001) nos indivíduos normais (grupo de controle) em comparação com o grupo com LMA (tabela 2). Esses dados parecem explicar a forte tendência à anemia em pacientes com LMA.
A imunidade contra tumores mediada pelas células pode aumentar pela expressão de citocinas e coestimuladores em células tumorais e pelo tratamento de indivíduos com tumores por meio de citocinas, que estimulam a proliferação e a diferenciação de linfócitos T e de células Natural Killer (NK). IFN‐γ e TNF‐α são considerados agentes antitumorais eficientes em modelos animais, porém seu uso em pacientes é limitado devido a graves efeitos colaterais tóxicos. Fatores de crescimento, como o fator estimulador de colônias de granulócitos e macrófagos (GM‐CSF) e o fator estimulador de colônias de granulócitos (G‐CSF), são usados em protocolos de tratamento de câncer para diminuir os períodos de neutropenia e trombocitopenia após a quimioterapia ou o transplante autólogo de medula óssea.15
O estudo comparou os níveis de citocinas pró‐inflamatórias em pacientes adultos com câncer com os de um grupo de indivíduos saudáveis (grupo de controle). Descobriu‐se que os níveis séricos de IL‐1β e TNF‐α no sangue eram maiores (p<0,0001) em pacientes com câncer em comparação com o grupo de controle.16
Em nossos resultados, a produção espontânea (sem estímulo) de TNF‐α e IFN‐γ em sobrenadantes de CMSP foi significativamente maior em pacientes com LMA em relação a indivíduos saudáveis. Isso sugere que estresse oxidativo e inflamação estão envolvidos na LMA. Por outro lado, não houve diferença significativa entre os grupos quanto à produção de IL‐6 e IL‐10, que agem mais como citocinas reguladoras.
Existe uma comprovação cada vez maior na literatura de que a geração de estresse oxidativo induzido por espécies reativas de oxigênio (ERO) desempenha um papel na leucemia. Uma forte associação entre o estresse oxidativo e a incidência de recidiva da doença foi demonstrada por Zhou et al.17 Esses pesquisadores mostraram que as atividades da adenosina desaminase e da xantina oxidase foram maiores na recidiva da LMA, ao passo que as atividades da glutationa peroxidase, monoamina oxidase, superóxido dismutase e a capacidade antioxidante total (CAT) foram menores no grupo com a doença do que no grupo de controle. Segundo esses autores, o estresse oxidativo é uma característica crucial da AML e provavelmente afeta seu desenvolvimento e suas recidivas.
Em nossos resultados (tabela 3), todas as citocinas investigadas apresentaram concentrações significativamente maiores no grupo de controle em comparação com o grupo com LMA na presença da vacina BCG, fator antígeno específico, o que sugere uma capacidade menor de os pacientes com LMA reagirem positivamente a antígenos. Por outro lado, na presença de PHA, fator de estimulação mitogênica não específico, apenas a IL‐6 apresentou concentração significativamente maior no controle (p<0,002) em comparação com o grupo com LMA. TNF‐α, IL‐10 e IFN‐γ não apresentaram diferença entre os dois grupos.
É necessária uma concentração adequada de glutationa para a proliferação de células normais, inclusive linfócitos e células epiteliais no intestino.18 A glutationa (GSH) também é essencial para a ativação de linfócitos T e leucócitos polimorfonucleares e também para a produção de citocinas; portanto, indispensável para a expressão da resposta imune em situações de alterações imunológicas.19 Os autores citados acima mencionaram que as concentrações celulares de GSH são drasticamente reduzidas em situações como desnutrição proteica, estresse oxidativo e em várias doenças patológicas, como desnutrição proteico‐energética, síndrome da imunodeficiência adquirida (Aids) e neoplasias avançadas.
Um estudo feito por Russo et al.20 demonstrou que os níveis de GSH em células cancerosas podem ser várias vezes maiores do que em células normais correspondentes. Segundo Engin,21 os níveis de glutationa eritrocitária eram 31% maiores em pacientes com carcinoma localizado e 78% maiores em pacientes com câncer metastático, em comparação com controles saudáveis. Esses resultados podem refletir os níveis elevados de GSH em tumores e também que esses níveis elevados podem estar associados à resistência das células tumorais ao tratamento quimioterapêutico.
Os resultados de nossa investigação estão de acordo com os de Russo et al. 20 e Engin21 e revelam uma maior concentração de GSH nos pacientes com LMA (p<0,0001), em comparação com o grupo de indivíduos saudáveis (controle), conforme ilustrado na figura 1.
Um estudo publicado recentemente22 indicou que as células CD34+ com LMA têm expressão elevada de proteínas reguladoras com múltiplas vias de biossíntese da glutationa, presumivelmente como um mecanismo para compensar o aumento do estresse oxidativo em células leucêmicas. Compatível com essa observação, as células CD34+ com LMA têm níveis mais baixos de níveis de glutationa reduzida (GSH) e níveis maiores de glutationa oxidada (GSSG). Esses achados sugerem que o equilíbrio intrínseco, a homeostase e a razão GSH/GSSG são alterados (de forma anormal) nas células CD34+ com LMA.
Os autores citados acima propõem que a redução no nível de GSH deve‐se ao maior consumo de GSH em vários processos necessários para a sobrevida das células cancerosas, inclusive: 1) redução das espécies reativas de oxigênio, como H2O2; 2) a S‐glutationilação adequada do proteoma em resposta ao estresse oxidativo e 3) desintoxicação da produção aumentada de peróxidos lipídicos.
Esses mesmos autores também apresentaram novos agentes, como partenolídeo (PTL) e piperlongumina (PLM), com grande efeito inibidor sobre o sistema GSH com leucemia, mas apenas uma alteração limitada e transitória em células normais. O mesmo grupo de pesquisadores mostrou anteriormente23 que o PTL erradicou efetivamente as células estaminais e progenitoras da LMA tipicamente resistentes/refratárias à quimioterapia convencional.
A imunoglobulina A secretora (sIgA) da saliva é um importante parâmetro para avaliar a condição imunológica da mucosa gastrointestinal, com a vantagem de usar um procedimento não invasivo e basicamente sem desconforto para o paciente. É considerada o mediador humoral mais importante da imunidade da mucosa e coopera para vários mecanismos protetores. Ela apresenta maior resistência à degradação proteolítica do que qualquer outra classe de imunoglobulina, pode ser encontrada em todo o sistema digestivo e respiratório e impede a absorção de grande quantidade de antígenos.24,25
Segundo Souza et al.,26 em pacientes com câncer, a síntese de anticorpos pode diminuir ou aumentar. Depende dos mecanismos imunológicos envolvidos na proliferação de células tumorais e determina uma elevação ou redução nas concentrações de frações de imunoglobulina.
No presente estudo, não foi encontrada diferença estatística na concentração de IgA salivar (p=0,693) entre os pacientes com LMA e os grupos de controle saudáveis, apesar de se detectarem níveis maiores nos pacientes.
Na comparação de pacientes pediátricos com LMA com indivíduos normais combinados por idade, algumas conclusões poderiam ser tiradas: a) o grupo com LMA revelou concentrações significativamente menores de albumina e pré‐albumina séricas, o que sugere perigo iminente de desnutrição proteica; b) os pacientes com LMA apresentaram valores menores (p<0,0001) com relação a todos os parâmetros de glóbulos vermelhos, o que sugere um estado de anemia desses pacientes; c) a menor produção estatística de citocinas do grupo com LMA sob condição espontânea e estimulada por BCG parece indicar uma queda na resposta imunológica de pacientes em comparação com os indivíduos normais; d) a concentração de GSH significativamente maior nos eritrócitos de pacientes com LMA, em comparação com o grupo de controle, pode refletir o metabolismo anormal da glutationa e homeostase descrito na referência.22
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosAo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro e pela concessão de uma bolsa ao primeiro autor.
Como citar este artigo: Sanches FL, Nitsch TM, Vilela MM, Sgarbieri VC. Comparison of biochemical and immunological profile of pediatric patients with acute myeloid leukemia in relation to healthy individuals. J Pediatr (Rio J). 2015;91:478–84.
Estudo feito na Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil.