To describe aspects of the microcephaly epidemic in the state of Piauí.
MethodsAll cases of congenital microcephaly confirmed in the state between 2015 and 2016 were included (n=100). Investigation forms of the Regional Reference Center for Microcephaly were reviewed. Discarded cases (n=63) were used as a comparison group.
ResultsIn October, November, and December 2015 incidence rates reached 4.46, 6.33 and 3.86/1000 live births, respectively; 44 cases were reported in the state capital. Among the mothers of confirmed and discarded cases, the frequency of skin rash during pregnancy was 50/97 (51.5%) and 8/51 (15.7%), respectively (p<0.001); 33 confirmed cases (35.9%) had a head circumference z‐score between −2 and −3, 23 (25%) between −3 and −4, and 8 (8.7%) had a z‐score of less than −4. Head computer tomography scans revealed calcifications in 78/95 (82.1%) cases. Lissencephaly, hydrocephalus and agenesis of the corpus callosum were also frequently observed. Ophthalmic findings included retinal pigment epithelium rarefaction and atrophy. Absence of otoacoustic emissions was observed in 21/70 cases. One newborn also presented lower limb muscle atrophy. There were no significant differences in vaccination rates for influenza, diphtheria‐tetanus‐acellular pertussis, and hepatitis B in either group.
ConclusionsThe state of Piauí, like others in the northeastern region, faced an epidemic of congenital microcephaly between 2015 and 2016, presumably related to congenital Zika virus infection, more intense in the capital. Current challenges include the improvement of vector control, basic research, scaling‐up of diagnostic tools for pre‐natal screening of Zika virus, vaccines, and health care for affected children.
Descrever os aspectos da epidemia de microcefalia no Estado do Piauí.
MétodosForam incluídos todos os casos de microcefalia congênita confirmados no estado entre 2015‐2016 (n = 100). Os formulários de investigação do Centro Regional de Referência em Microcefalia foram analisados. Os casos descartados (n = 63) foram usados como grupo de comparação.
ResultadosEm outubro, novembro e dezembro de 2015, as taxas de incidência atingiram 4,46, 6,33 e 3,86/1.000 nascidos vivos, respectivamente; 44 casos foram relatados na capital do estado. Entre as mães de casos confirmados e descartados, a frequência de erupção cutânea durante a gravidez foi 50/97 (51,5%) e 8/51 (15,7%), respectivamente (p < 0,001); 33 casos confirmados (35,9%) apresentaram um escore z de perímetro cefálico entre -2 e -3, 23 (25%) entre -3 e -4 e 8 (8,7%) apresentaram escore z inferior a -4. As tomografias computadorizadas cerebrais revelaram calcificações em 78/95 (82,1%) dos casos. Lisencefalia, hidrocefalia e agenesia do corpo caloso também foram observadas com mais frequência. Os achados oftalmológicos incluíram rarefação e atrofia do epitélio pigmentar da retina. Foram observadas ausência de emissões otoacústicas em 21/70 casos. Um recém‐nascido também apresentou atrofia muscular dos membros inferiores. Não houve diferenças significativas nas taxas de vacinação para gripe, vacina difteria tétano e coqueluche acelular e hepatite B em qualquer grupo.
ConclusõesO Estado do Piauí, como outros na região Nordeste, enfrentou, entre 2015 e 2016, uma epidemia de microcefalia congênita, supostamente relacionada à infecção congênita pelo vírus Zika, mais intensa na capital. Os desafios atuais incluem melhora do controle de vetores, pesquisa básica, ampliação de ferramentas de diagnóstico para exame pré‐natal do vírus Zika, vacinas e cuidados de saúde para crianças afetadas.
Desde meados de 2015 foi observado um aumento significativo da incidência de microcefalia e outras malformações do sistema nervoso central (SNC) no Brasil, principalmente na Região Nordeste.1
Em 2015, o vírus Zika (ZIKV) foi identificado por reação em cadeia da polimerase (PCR) em pacientes com erupção cutânea, febre, conjuntivite e artralgia no Nordeste do Brasil, durante uma epidemia de uma doença exantemática.2 Foi proposta uma associação entre a infecção congênita com o ZIKV e a microcefalia. A causalidade foi elucidada em várias etapas: i) identificação da PCR do ZIKV no líquido amniótico de grávidas que deram à luz bebês com microcefalia,3 ii) identificação do ZIKV e partículas semelhantes ao arbovírus por microscopia eletrônica no cérebro de um feto microcefálico abortado,4 iii) estudo caso‐controle no Estado de Pernambuco que mostrou uma maior proporção de infecção por ZIKV entre crianças com microcefalia, em comparação com os controles.5
A microcefalia é definida por um perímetro cefálico (PC) mais de dois desvios‐padrão (escore z M −2) abaixo da média para a idade gestacional. Microcefalia grave é definida como escore z do PC <−3.6 A microcefalia é uma manifestação clínica que representa interrupção na neurogênese e morte dos progenitores neurais.7
As causas mais bem reconhecidas de microcefalia incluem alterações genéticas, infecções congênitas (como citomegalovírus [CMV], herpes vírus simples [HSV], vírus da rubéola, Toxoplasma gondii e sífilis) ou exposição embrionária a substâncias teratogênicas.8‐10 A Zika congênita é uma síndrome caracterizada por microcefalia grave, aumento do tecido cerebral com padrão específico de dano, inclusive calcificações subcorticais, lesão de fundo de olho, contraturas congênitas e hipertonia.11
De novembro de 2015 a dezembro de 2016, 10.867 casos de microcefalia congênita foram investigados no Brasil. Desses, 2.366 foram confirmados, 49 foram classificados como prováveis, 5.269 foram considerados não microcefálicos (descartados) e, em 31 de dezembro de 2016, 3.183 casos continuaram sob investigação. Os critérios para confirmação incluíram achados típicos de infecção congênita, como calcificações cerebrais ou alterações da fossa ventricular e posterior, entre outros sinais clínicos observados por qualquer método de imagem ou positividade para ZIKV em testes de laboratório.12
Do número total de casos confirmados, 100 foram relatados no Piauí, Nordeste do Brasil. O presente estudo visa a descrever as características clínicas, radiológicas e epidemiológicas dos casos de microcefalia no Estado do Piauí durante a epidemia em 2015‐2016.
Pacientes e métodosA área do Estado do Piauí é de 251.577,738km2. A população é de 3.194.718 habitantes; 847.430 vivem na capital, Teresina. Piauí é o segundo estado mais pobre do Brasil, com um produto interno bruto per capita de US$ 3.777,60. Ele tem o quarto menor índice de desenvolvimento humano do país (0,646).
Foi feito um estudo de série de casos. Foram incluídos todos os casos de microcefalia congênita confirmados no Estado do Piauí entre 8 de novembro de 2015 e 31 de dezembro de 2016. A inclusão dependia de o recém‐nascido ser submetido ao protocolo de investigação do Centro Regional de Referência em Microcefalia (CRRM) estabelecido durante a epidemia. Ao término do período mencionado, o CRRM investigou 188 recém‐nascidos; 88 casos foram descartados. Os critérios do CRRM para confirmação dos casos foram a presença de achados clínicos, laboratoriais e radiológicos compatíveis com as malformações do SNC.12 As taxas de incidência mensais foram calculadas como o número de casos confirmados de microcefalia X número 1.000 nascidos vivos/ mês.
Dos casos descartados, 63 apresentaram dados disponíveis. Os casos descartados foram usados como um grupo de comparação para avaliar algumas associações entre as variáveis clínicas e epidemiológicas e a presença de microcefalia. Os escores z da PC foram calculados para as idades gestacionais com o software Intergrowth‐21st, disponível no site http://intergrowth21.ndog.ox.ac/pt/ManualEntry. O teste de Fisher foi usado para comparar as frequências das variáveis categóricas e o teste de Kruskal‐Wallis foi usado para comparar as medianas das variáveis contínuas. Para cada comparação, o número de casos confirmados e descartados variou, de acordo com a disponibilidade de informações de cada variável.
Para as análises geoespaciais, o mapa de base foi adquirido do Instituto Brasileiro de Geografia e Estatística (IBGE). O Google Earth® foi usado para determinar as coordenadas de endereço de todos os casos confirmados e descartados. As coordenadas foram registradas no sistema de coordenadas geodésicas WGS 84 Datum (World Geodetic System 1984). Os dados espaciais foram analisados em uma plataforma GIS com o software ArcGis 9.3 (Environmental Systems Research Institute, Redlands, CA, EUA). Com essa análise, o objetivo foi descrever a distribuição geográfica dos casos de microcefalia e mostrar as áreas com altas concentrações de casos ou altas intensidades de casos por área individual. A técnica de densidade de Kernel foi aplicada para avaliar a intensidade de incidência por área individual. Essa técnica produz uma superfície não topográfica que mostra a distribuição da doença.
O Comitê de Ética em Pesquisa do Instituto Oswaldo Cruz/Fundação Oswaldo Cruz aprovou este estudo (protocolo n° 2.121.367).
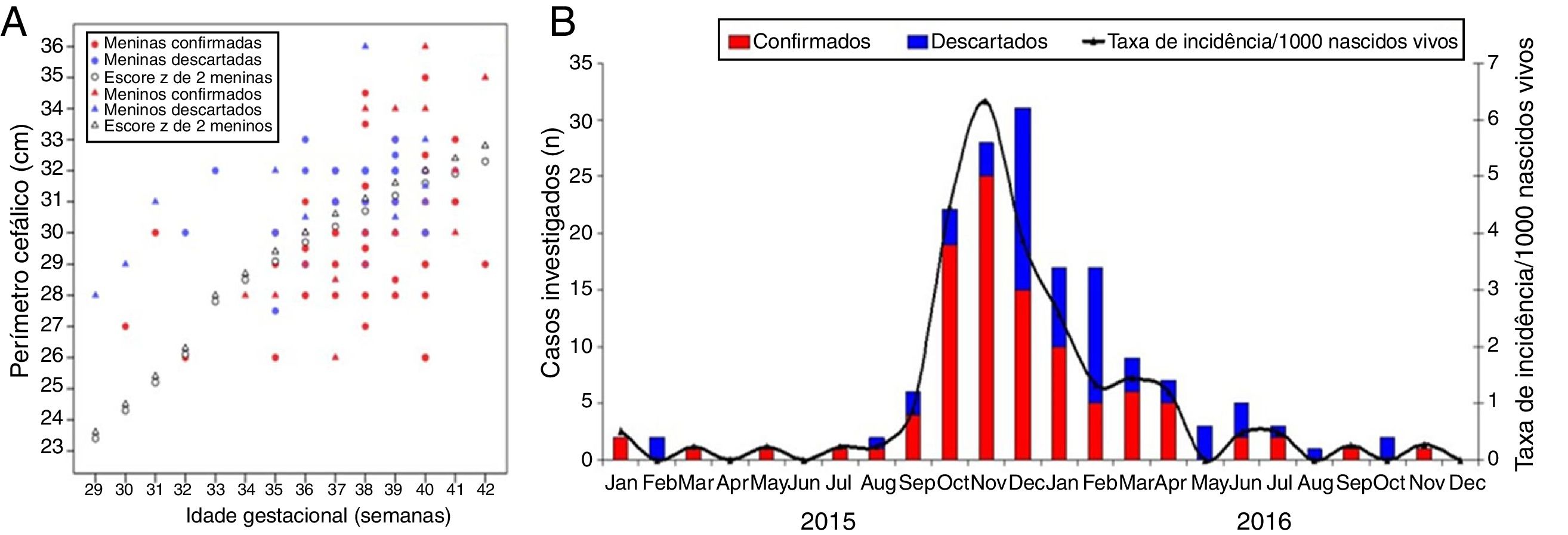
ResultadosDistribuição espaço‐temporal dos casos de microcefaliaA figura 1A demonstra a curva da epidemia de microcefalia, inclusive os casos inicialmente suspensos e posteriormente descartados. O número de casos aumentou a partir de setembro de 2015, com quatro casos confirmados. O pico da epidemia foi observado em novembro de 2015, quando nasceram 25 neonatos com microcefalia confirmada no Estado do Piauí (1/4 das confirmações totais). Em 2015, em outubro, novembro e dezembro, nasceram quase 60% dos casos confirmados. A epidemia reduziu desde abril de 2016. Durante o período pré‐epidemia (janeiro a agosto de 2015), a média da taxa de incidência mensal da microcefalia congênita no Piauí foi 0,18 casos/1.000 nascidos vivos. Em setembro de 2015, a incidência mensal aumentou cinco vezes em comparação com o período pré‐epidemia, atingiu 0,89/1.000 nascidos vivos. Em outubro, novembro e dezembro de 2015, houve um aumento altamente significativo, com taxas de incidência mensais de 4,46, 6,33 e 3,86/1.000 nascidos vivos, respectivamente. Durante o pico da epidemia em novembro de 2015, a taxa de confirmação atingiu 89%.
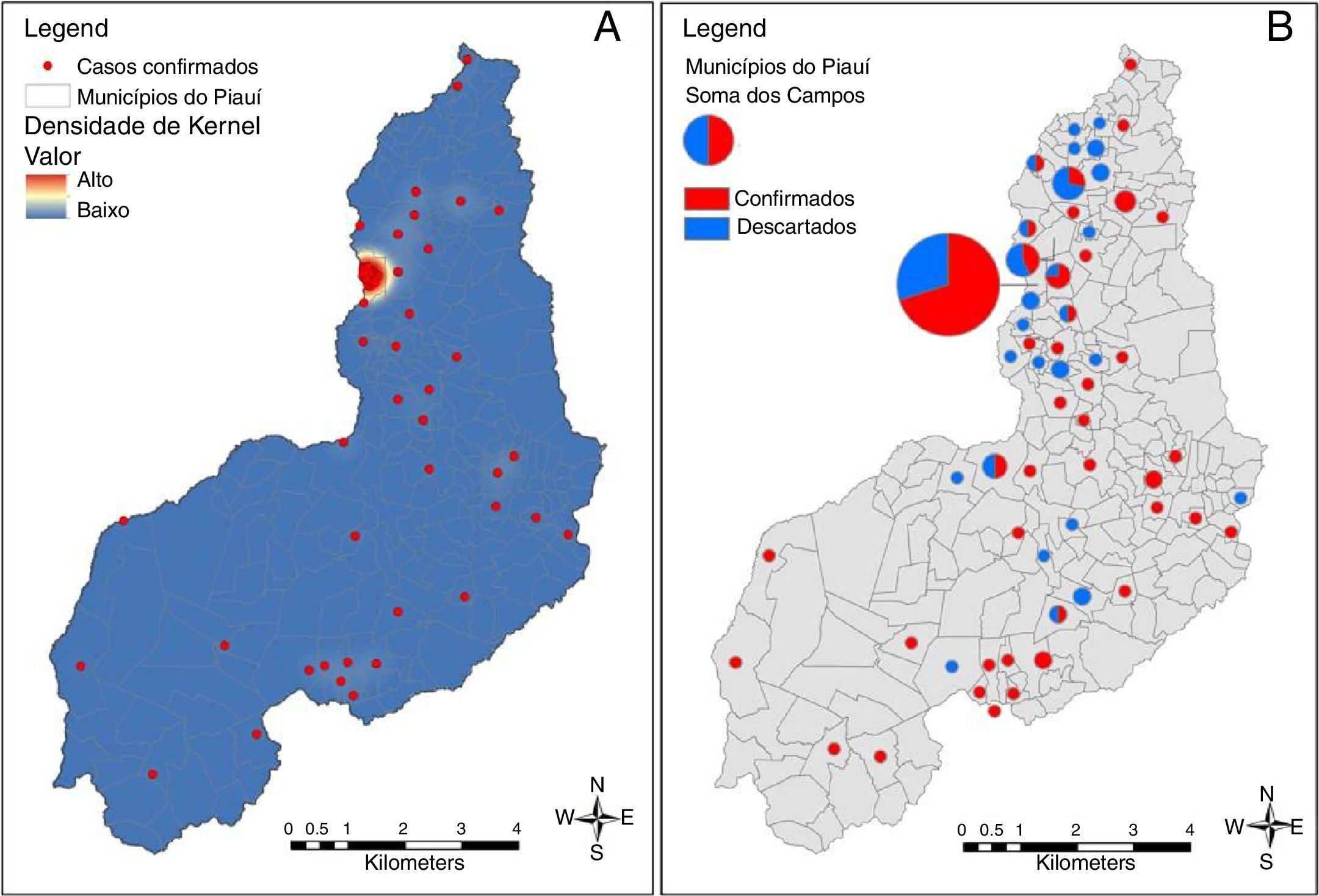
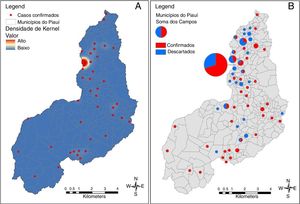
O mapa na figura 2 mostra a distribuição espacial dos casos de microcefalia. Quase metade dos casos (44/100 [44%]) foi relatada na capital, Teresina; 46 (20,5%) dos 224 municípios no Piauí registraram pelo menos um caso confirmado. Exceto Teresina, onde o número máximo de casos por município foi três. Assim, Teresina representou a área mais intensa de desenvolvimento da epidemia no Piauí. O georreferenciamento dos casos confirmados e descartados e a análise da densidade de Kernel revelaram um padrão agrupado de casos confirmados em Teresina.
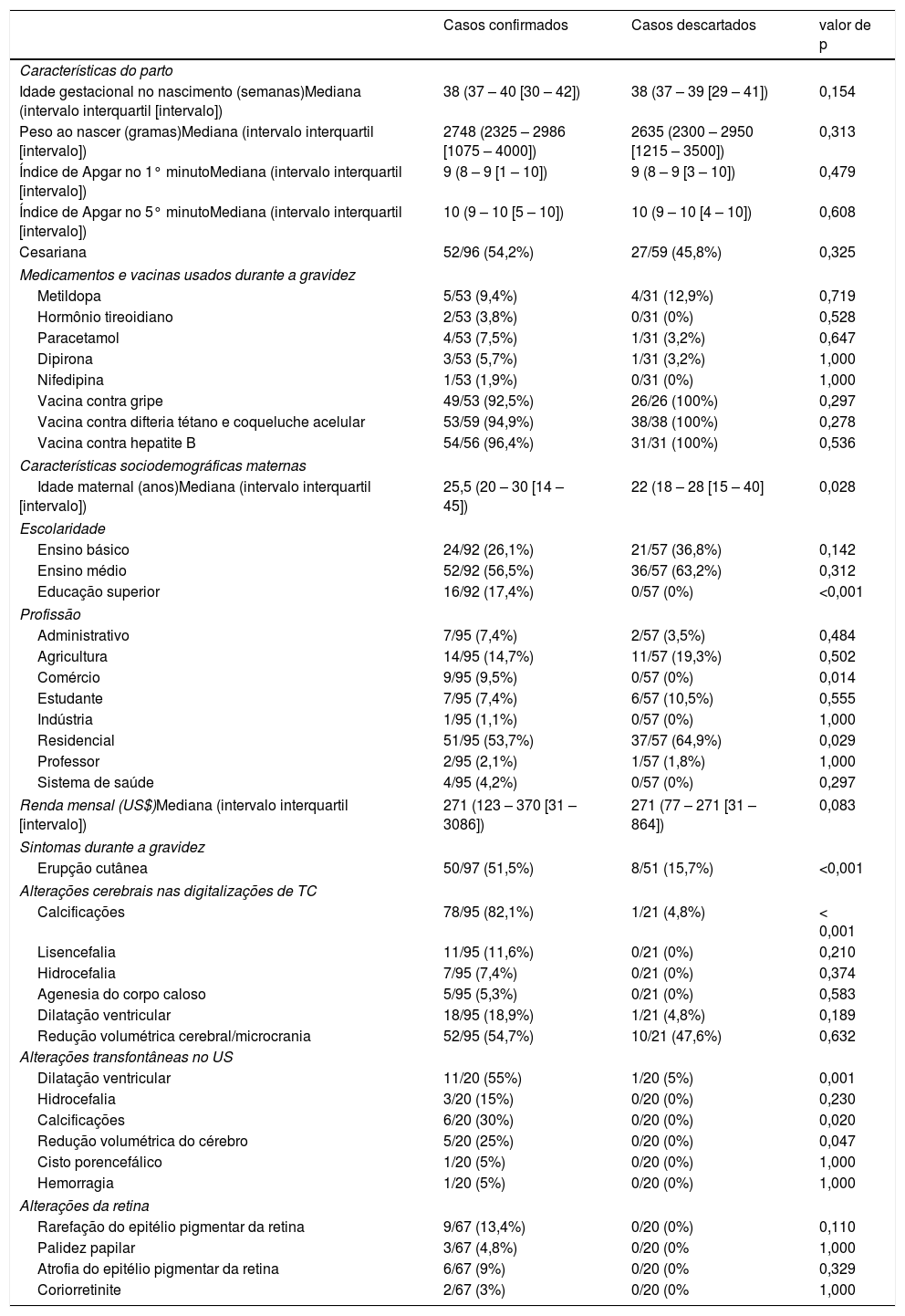
Dados obstétricos e de partoA tabela 1 apresenta os dados obstétricos e de parto. A idade maternal foi ligeiramente, porém significativamente, maior no grupo de casos confirmados. A mediana da idade gestacional de 38 semanas no nascimento mostra que, nos dois grupos, as gravidezes a termo predominaram, com uma pequena proporção de partos prematuros. Além disso, as medianas do peso ao nascer foram semelhantes entre os casos confirmados e descartados, com frequência semelhante de baixo peso ao nascer e uma pequena proporção de muito baixo peso ao nascer. A asfixia perinatal foi uma doença rara entre os neonatos com microcefalia e os casos descartados, conforme demonstrado pelos altos índices de Apgar nos minutos 1 e 5 após o parto nos dois grupos.
Parto, gravidez e características maternas, achados radiológicos e alterações radiológicas e retinianas (fundoscópicas) em casos confirmados e descartados de microcefalia no Estado do Piauí, Brasil, 2015‐2016
| Casos confirmados | Casos descartados | valor de p | |
|---|---|---|---|
| Características do parto | |||
| Idade gestacional no nascimento (semanas)Mediana (intervalo interquartil [intervalo]) | 38 (37 – 40 [30 – 42]) | 38 (37 – 39 [29 – 41]) | 0,154 |
| Peso ao nascer (gramas)Mediana (intervalo interquartil [intervalo]) | 2748 (2325 – 2986 [1075 – 4000]) | 2635 (2300 – 2950 [1215 – 3500]) | 0,313 |
| Índice de Apgar no 1° minutoMediana (intervalo interquartil [intervalo]) | 9 (8 – 9 [1 – 10]) | 9 (8 – 9 [3 – 10]) | 0,479 |
| Índice de Apgar no 5° minutoMediana (intervalo interquartil [intervalo]) | 10 (9 – 10 [5 – 10]) | 10 (9 – 10 [4 – 10]) | 0,608 |
| Cesariana | 52/96 (54,2%) | 27/59 (45,8%) | 0,325 |
| Medicamentos e vacinas usados durante a gravidez | |||
| Metildopa | 5/53 (9,4%) | 4/31 (12,9%) | 0,719 |
| Hormônio tireoidiano | 2/53 (3,8%) | 0/31 (0%) | 0,528 |
| Paracetamol | 4/53 (7,5%) | 1/31 (3,2%) | 0,647 |
| Dipirona | 3/53 (5,7%) | 1/31 (3,2%) | 1,000 |
| Nifedipina | 1/53 (1,9%) | 0/31 (0%) | 1,000 |
| Vacina contra gripe | 49/53 (92,5%) | 26/26 (100%) | 0,297 |
| Vacina contra difteria tétano e coqueluche acelular | 53/59 (94,9%) | 38/38 (100%) | 0,278 |
| Vacina contra hepatite B | 54/56 (96,4%) | 31/31 (100%) | 0,536 |
| Características sociodemográficas maternas | |||
| Idade maternal (anos)Mediana (intervalo interquartil [intervalo]) | 25,5 (20 – 30 [14 – 45]) | 22 (18 – 28 [15 – 40] | 0,028 |
| Escolaridade | |||
| Ensino básico | 24/92 (26,1%) | 21/57 (36,8%) | 0,142 |
| Ensino médio | 52/92 (56,5%) | 36/57 (63,2%) | 0,312 |
| Educação superior | 16/92 (17,4%) | 0/57 (0%) | <0,001 |
| Profissão | |||
| Administrativo | 7/95 (7,4%) | 2/57 (3,5%) | 0,484 |
| Agricultura | 14/95 (14,7%) | 11/57 (19,3%) | 0,502 |
| Comércio | 9/95 (9,5%) | 0/57 (0%) | 0,014 |
| Estudante | 7/95 (7,4%) | 6/57 (10,5%) | 0,555 |
| Indústria | 1/95 (1,1%) | 0/57 (0%) | 1,000 |
| Residencial | 51/95 (53,7%) | 37/57 (64,9%) | 0,029 |
| Professor | 2/95 (2,1%) | 1/57 (1,8%) | 1,000 |
| Sistema de saúde | 4/95 (4,2%) | 0/57 (0%) | 0,297 |
| Renda mensal (US$)Mediana (intervalo interquartil [intervalo]) | 271 (123 – 370 [31 – 3086]) | 271 (77 – 271 [31 – 864]) | 0,083 |
| Sintomas durante a gravidez | |||
| Erupção cutânea | 50/97 (51,5%) | 8/51 (15,7%) | <0,001 |
| Alterações cerebrais nas digitalizações de TC | |||
| Calcificações | 78/95 (82,1%) | 1/21 (4,8%) | < 0,001 |
| Lisencefalia | 11/95 (11,6%) | 0/21 (0%) | 0,210 |
| Hidrocefalia | 7/95 (7,4%) | 0/21 (0%) | 0,374 |
| Agenesia do corpo caloso | 5/95 (5,3%) | 0/21 (0%) | 0,583 |
| Dilatação ventricular | 18/95 (18,9%) | 1/21 (4,8%) | 0,189 |
| Redução volumétrica cerebral/microcrania | 52/95 (54,7%) | 10/21 (47,6%) | 0,632 |
| Alterações transfontâneas no US | |||
| Dilatação ventricular | 11/20 (55%) | 1/20 (5%) | 0,001 |
| Hidrocefalia | 3/20 (15%) | 0/20 (0%) | 0,230 |
| Calcificações | 6/20 (30%) | 0/20 (0%) | 0,020 |
| Redução volumétrica do cérebro | 5/20 (25%) | 0/20 (0%) | 0,047 |
| Cisto porencefálico | 1/20 (5%) | 0/20 (0%) | 1,000 |
| Hemorragia | 1/20 (5%) | 0/20 (0%) | 1,000 |
| Alterações da retina | |||
| Rarefação do epitélio pigmentar da retina | 9/67 (13,4%) | 0/20 (0%) | 0,110 |
| Palidez papilar | 3/67 (4,8%) | 0/20 (0% | 1,000 |
| Atrofia do epitélio pigmentar da retina | 6/67 (9%) | 0/20 (0% | 0,329 |
| Coriorretinite | 2/67 (3%) | 0/20 (0% | 1,000 |
Foi avaliada a exposição a vacinas oferecidas rotineiramente às grávidas. Não houve diferenças significativas nas taxas de vacinação para gripe, vacina contra difteria tétano e coqueluche acelular (DTaP) e hepatite B em qualquer grupo. De fato, a taxa de cobertura da imunização foi alta nas mães que deram à luz neonatos com microcefalia e nas dos casos descartados.
Entre as mães de neonatos conformados com microcefalia, 50/97 (51,5%) relataram a presença de erupção cutânea durante a gravidez. Esse número é significativamente maior do que o observado entre as mães de casos descartados (8/51 [15,7%]; p <0,001).
Características clínicas e radiológicas dos casos confirmados e descartados de microcefaliaEntre os casos confirmados nos quais foi possível recuperar os valores exatos do PC (n=92), foi observado que 33 neonatos (35,9%) apresentaram escore z do PC entre −2 e −3, 23 (25%) apresentaram escores z entre −3 e −4 e 8 (8,7%) apresentaram escores z inferiores a −4. Quinze crianças nasceram com PC normal (escore z> −2). A mediana do PC entre as crianças confirmadas foi 30cm (intervalo interquartil [IIQ]=29‐31cm; intervalo [I]=26‐36cm), ao passo que entre os casos descartados foi 31cm (IIQ=30,5‐32cm; I=27,5‐36cm), p <0,001 (teste de Kruskal‐Wallis). A figura 1B apresenta a correlação entre a idade gestacional e o PC dos casos confirmados e descartados, informação do sexo do recém‐nascido. Uma grande proporção de casos confirmados apresentou escore z do PC abaixo de −2 para a idade gestacional. A mediana dos escores z do PC entre os casos confirmados e descartados foi −2,51 (IIQ=−3,19 – −1,63; I=−5,22‐1,43) e – 1,49 (IIQ=−2,01 – −0,91; R=−3,45‐2), p <0,001 (teste de Kruskal‐Wallis), respectivamente.
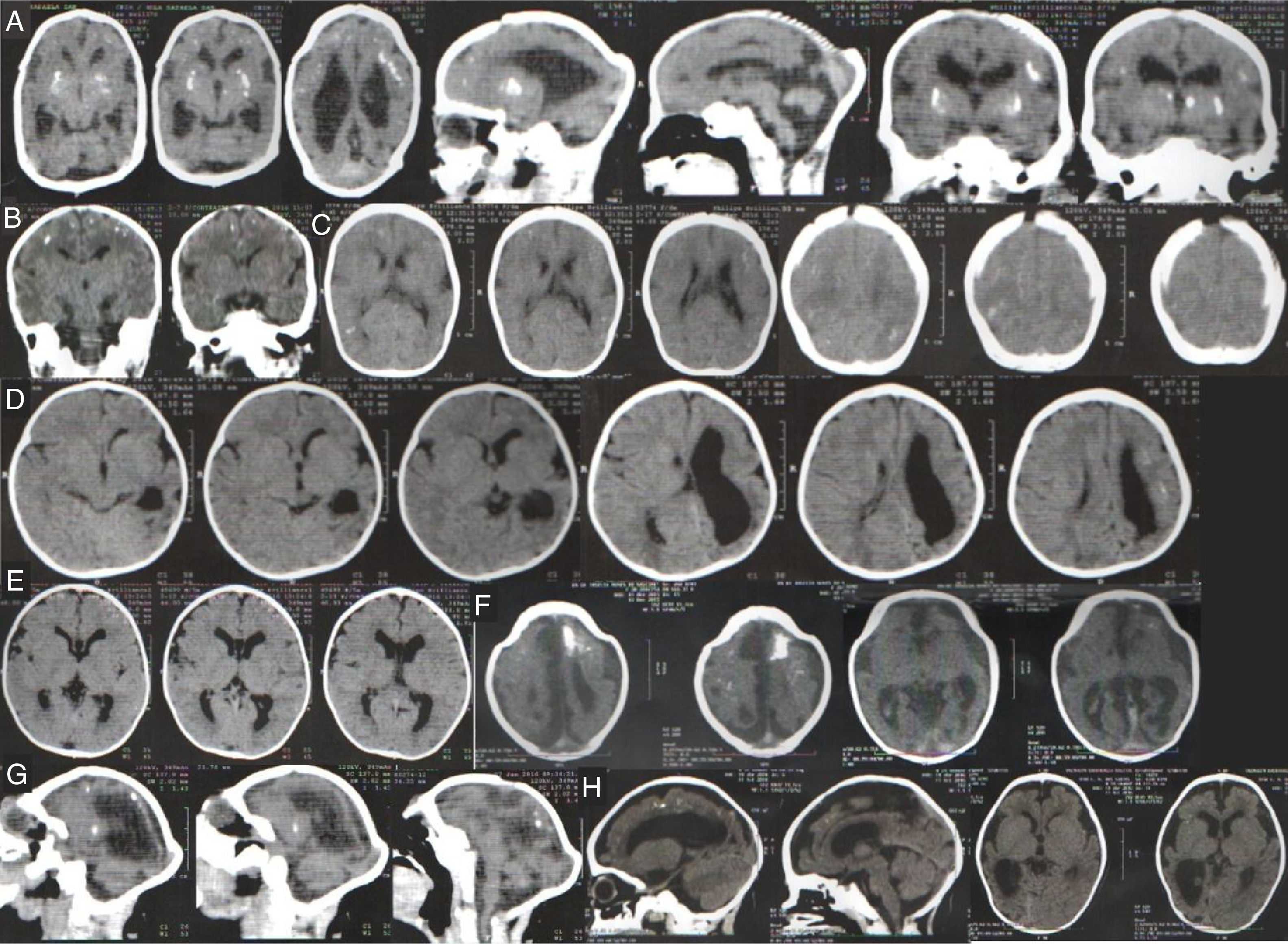
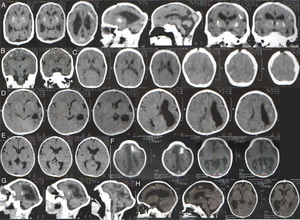
A tabela 1 resume os achados clínicos e radiológicos. Foi possível acessar as digitalizações da tomografia computadorizada (TC) da cabeça de 95 neonatos confirmados com microcefalia e 21 casos descartados. Alguns achados radiológicos são apresentados na figura 3. As digitalizações da TC revelaram calcificações intracranianas em 78/95 (82,1%) dos casos confirmados de microcefalia e 1/25 (4,8%) dos casos descartados (p <0,001). Entre as crianças confirmadas com calcificações, duas apresentaram calcificações dos núcleos basais (não mostrados). Dez (10,5%) dos casos confirmados apresentaram alterações do espectro de lisencefalia‐paquigiria, sete (7,4%) apresentaram hidrocefalia e cinco (5,3%) apresentaram agenesia do corpo caloso. Além disso, 40 neonatos foram submetidos a ultrassom (US) transfontanelar (20 casos confirmados e 20 descartados). Entre os neonatos com microcefalia confirmada, 11 (55%) apresentaram ventrículos cerebrais dilatados e três (15%) apresentaram diagnóstico ultrassonográfico de hidrocefalia. O US transfontanelar detectou seis (30%) crianças com calcificações.
1 Digitalizações da tomografia computadorizada da cabeça dos casos confirmados de microcefalia no Estado do Piauí; 1; Brasil, 2015‐2016.
A. Calcificações na interface entre a substância branca e cinza e nas regiões do núcleo da base. Ectasia ventricular moderada associada a paralelismo dos ventrículos laterais, sugere disgenesia do corpo caloso; 1; Deformidade do esqueleto e redução do volume do cerebelo devido a atrofia, com aumento do espaço do fluido cerebrospinal da fossa posterior.
B. Pequenas calcificações no intervalo entre a substância branca e cinza; 1; Escassez dos sulcos corticais, configura alteração do espectro de lisencefalia.
C. Pequenas calcificações no intervalo entre a substância branca e cinza, linear e puntiforme; 1; Escassez dos sulcos corticais, configura alteração do espectro de lisencefalia.
D. Pequenas calcificações no intervalo entre as substâncias branca e cinza, linear e puntiforme; 1;1; Assimetria dos hemisférios cerebrais com acentuação dos sulcos corticais e redução do volume do hemisfério esquerdo devido a atrofia, com ectasia compensatória consequente do ventrículo lateral.
E. Leve paralelismo dos ventrículos laterais, sugere disgenesia do corpo caloso.
F. Pequenas calcificações puntiformes na interface entre a substância branca e cinza e calcificação grosseira no lóbulo frontal esquerdo. Escassez dos sulcos corticais com poucos sulcos rasos, configura alteração do espectro de lisencefalia. Leve paralelismo dos ventrículos laterais, sugere disgenesia do corpo caloso; 1; Deformidade do esqueleto na região frontal alta.
G. Pequenas calcificações puntiformes no intervalo entre a substância branca e cinza e a região periventricular. Escassez dos sulcos corticais, configura alteração do espectro de lisencefalia. Redução volumétrica do cerebelo; 1; Deformidade do esqueleto.
H. Pequenas calcificações puntiformes na interface entre a substância branca no lobo frontal esquerdo. Escassez dos sulcos corticais, além dos sulcos rasos, configura alteração do espectro de lisencefalia. Expansão dos espaços de fluido extra‐axial, mais evidente nas fossas temporais. Redução do volume do hemisfério direito com ectasia compensatória do ventrículo lateral direito.
Nessa série, 87 recém‐nascidos foram submetidos a avaliação oftalmológica (67 casos confirmados e 20 casos descartados). Os achados fundoscópicos mais frequentes nos casos confirmados foram rarefação do epitélio pigmentar da retina (9/67 [13,4%]), atrofia do epitélio pigmentar da retina (6/67 [9%]) e palidez papilar (3/67 [4,8%]). Todos os exames dos casos descartados foram normais. Com o objetivo de triagem neonatal para surdez, o CRRM avaliou as emissões otoacústicas em 91 recém‐nascidos na primeira semana de vida (70 casos confirmados e 21 descartados). A frequência de ausência de emissões otoacústicas foi 21/70 (30%) entre os casos confirmados e 2/21 (9,5%) entre os casos descartados (p=0,051).
Dois recém‐nascidos com microcefalia também apresentaram envolvimento musculoesquelético e alterações nas extremidades, inclusive um com atrofia muscular dos membros inferiores associada a deslocamento do quadril e um com dedos sobrepostos. A ecocardiografia detectou malformações cardíacas em dois neonatos; um com forame oval patente e defeito do septo ventricular e um com forame oval patente e hipertensão pulmonar leve.
Dados sorológicos relacionados a outras infecções congênitasOnze casos confirmados apresentaram comprovação sorológica (IgM positivo) de infecção com outros patógenos teratogênicos, inclusive CMV, herpes e sífilis. As frequências de IgM reativo para rubéola, citomegalovírus, toxoplasmose, herpes, dengue e chikungunya entre os casos confirmados foram 0/74 (0%), 5/89 (5,6%), 0/81 (0%), 5/79 (6,3%), 8/76 (10,5%) e 6/62 (9,7%), respectivamente. Entre os casos descartados, essas frequências foram 0/29 (0%), 1/30 (3,3%), 0/31 (0%), 0/22 (0%), 3/23 (13%) e 1/14 (7,1%), respectivamente. VDRL positivo entre os casos confirmados e descartados foi 3/84 (3,6%) e 0/28 (0%), respectivamente. Entre os casos de CMV positivo para microcefalia, dois apresentaram hepatoesplenomegalia, icterícia, anemia e trombocitopenia.
DiscussãoO presente estudo descreve a suposta epidemia de microcefalia relacionada ao ZIKV no Piauí. A curva da epidemia mostra uma concentração de casos durante o período de oito meses de setembro de 2015 a abril de 2016. A epidemia atingiu seu pico em novembro de 2015, quando a taxa de incidência aumentou quase 15 vezes em relação à incidência média pré‐epidemia. Esse período também corresponde ao maior número de casos relatados em todos os estados do Nordeste. Nenhum dos casos relatados apresentou confirmação laboratorial para infecção por ZIKV. É importante observar que, no momento da epidemia, não houve testes sorológicos específicos para ZIKV que pudessem ser usados para detectar imunoglobulinas IgG ou IgM em recém‐nascidos ou nas mães. Portanto, durante a epidemia, as confirmações laboratoriais tiveram como base testes moleculares (PCR); contudo, eles dependem fortemente da presença de viremia (ou seja, ácidos nucleicos virais) e, portanto, não são muito úteis no diagnóstico de infecção em neonatos após o nascimento, considerando que a infecção e reprodução viral ocorrem durante a gravidez. Entre os casos confirmados no Piauí, 68 amostras de sangue foram enviadas para PCR para constatação de ZIKV, porém todos mostraram resultados negativos. Nenhuma amostra de fluido cerebrospinal de neonatos afetados foi enviada para teste de laboratório para infecções virais.
É notável que a microcefalia supostamente relacionada ao Zika mostrou um padrão de comportamento da epidemia, o que contrasta com os agentes endêmicos com os quais a microcefalia está associada, como CMV, herpes e Toxoplasma gondii, que existem em uma relação não epidêmica com a população humana. O Brasil tem uma alta cobertura vacinal contra rubéola, que reduziu substancialmente a incidência da rubéola congênita.13 Atualmente, o Brasil apresenta uma incidência cada vez maior de sífilis congênita.14
O mapa da densidade de Kernel mostra que durante todo o período do estudo o município mais afetado pelo surto de Zika no Piauí foi a capital. Teresina concentra mais de um quarto da população do estado e apresenta sérios problemas de saneamento, infraestrutura, gestão de resíduos e, consequentemente, controle de vetores. Outra doença transmitida por artrópodes, a leishmaniose visceral, é endêmica na cidade. De 2007 a 2012, uma média anual de 3.745 casos de dengue (aproximadamente 50% dos casos no estado) foram relatados em Teresina, o que destaca as dificuldades do local no controle de mosquitos. Por outro lado, a ocorrência de casos de microcefalia em outros municípios do Piauí ilustra a propagação da epidemia de microcefalia na região semiárida do Brasil, conforme observado em outros estados. No Nordeste do Brasil, o prolongamento da seca nos quatro anos anteriores à epidemia de microcefalia levou a um aumento nos sistemas de armazenamento de água potável abaixo do padrão, cujo uso pode ter contribuído para um aumento na densidade de mosquitos.
Com relação aos dados maternos e obstétricos, as crianças a termo predominaram entre os casos, porém com peso relativamente baixo ao nascer para as idades gestacionais. Em geral, elas eram crianças sem asfixia perinatal e, portanto, não expostas a hipóxia. Consequentemente, a hipóxia não pode servir para explicar o comprometimento neurológico dos neonatos. O cronograma de vacinação das grávidas no Brasil inclui duas doses da vacina contra difteria e tétano (dT), uma dose da vacina contra difteria tétano e coqueluche acelular (DTaP), duas doses da vacina contra gripe e três doses da vacina contra hepatite B. Nossos dados demonstram que a frequência de vacinação materna com essas vacinas foi semelhante entre os casos confirmados e descartados.
Com relação ao quadro clínico, observou‐se que a maior parte das crianças apresentou escore z do PC <−2, cerca de um quarto de casos mostrou microcefalia grave (escore z do PC <−3). Alguns neonatos afetados apresentaram PC normal. O quadro clínico e radiológico mais frequente foi microcrania associada a calcificações cerebrais, com apresentação frequente de dilatação ventricular ex‐vácuo, às vezes constituiu hidrocefalia e lisencefalia. Uma avaliação mais detalhada das imagens do SNC dos neonatos com microcefalia supostamente relacionada ao Zika demonstrou baixo desenvolvimento dos giros com córtex “enrugado” irregular, mais compatível com polimicrogiria.15
Uma pequena proporção dos casos apresentou alterações musculoesqueléticas, porém não ocorreu artrogripose, conforme observado em outros estados do Nordeste do Brasil.16 A frequência das malformações cardíacas associadas também foi baixa.
Com relação ao comprometimento ocular, mais de um quarto dos recém‐nascidos afetados apresentou alterações no exame fundoscópico compatíveis com lesões epiteliais na retina, aproximadamente a mesma proporção relatada em uma casuística no Estado da Bahia, Brasil.17 Recentemente, foi demonstrado que a infecção congênita por ZIKV está associada à degeneração central da retina com perda da camada de células ganglionares, camada nuclear interna e perda de fotorreceptores.18 Um exame de perda de audição por meio de emissões otoacústicas mostrou que quase 1/3 dos neonatos afetados são potencialmente deficientes auditivos. Uma avaliação audiológica mais detalhada em bebês microencefálicos nascidos durante a epidemia no Estado de Pernambuco demonstrou que quase 1/4 não passou no primeiro teste de rastreio em pelo menos uma orelha.19
Outras infecções congênitas que podem explicar os achados clínicos foram identificadas em um pequeno número de casos, que apresentaram IgM positivo no teste de sorologia para CMV, herpes e sífilis. Nesse caso, existe a possibilidade de que uma pequena proporção dos casos não tenha sido causada por infecção congênita por ZIKV.
É interessante observar a natureza explosiva da epidemia de microcefalia no Brasil e no Piauí. O número de casos confirmados foi significativamente reduzido no primeiro semestre de 2016. O número de casos de febre Zika também caiu em todo o Brasil. Assim, a grande pergunta agora é se a síndrome da Zika congênita assumirá o mesmo padrão epidemiológico de outras infecções teratogênicas (como CMV, toxoplasmose e herpes), que produz casos de forma mais ou menos estável e endêmica. A probabilidade de a febre Zika (e consequentemente de infecções congênitas por ZIKV) se tornar endêmica na América Latina foi avaliada por meio da modelagem matemática e propôs que há de fato um risco de essa infecção estabelecer um perfil endêmico.20
Contudo, a dinâmica de transmissão – e consequentemente o número de produção básico – das infecções por ZIKV é muito diferente da observada em outros arbovírus, devido a algumas características biológicas: i) o ZIKV pode ser transmitido diretamente, de pessoa para pessoa, sexualmente e talvez por meio da saliva,21,22 ii) existe a possibilidade de outras espécies de mosquito, como o Culexquinquefaciatus (que tem uma densidade muito em praticamente todas as áreas urbanas do Brasil) transmitirem ZIKV,23 iii) o ZIKV tem somente um sorotipo24 e iv) a maior parte das infecções por ZIKV é assintomática.25 Essas características podem levar à indução mais rápida da imunização em massa por infecção natural e redução dos grupos suscetíveis. Assim, a renovação da população suscetível ao ZIKV exigiria mais tempo, para que a doença não se comporte de forma endêmica nos próximos anos.
No Brasil, as infecções por ZIKV apresentaram queda de 170.535 casos em 2016 para 7.911 em 2017. Em maio de 2017, o Ministério da Saúde declarou o fim da emergência nacional para Zika. Atualmente, a falta de disponibilidade de um teste sorológico específico prejudica os exames em massa para infecção congênita por Zika em grávida nos cuidados primários à saúde no Sistema Único de Saúde. Assim, somente grávidas com quadro clínico sugestivo de infecção por ZIKV são submetidas a teste molecular por PCR.
Os desafios atuais no Brasil incluem melhor controle de vetores (inclusive a definição do papel de outras espécies de mosquito na transmissão), intensificação das pesquisas para caracterizar as forma de transmissão independentes do mosquito, o desenvolvimento e ampliação de ferramentas de diagnóstico sorológico eficazes para exame pré‐natal, o desenvolvimento de vacinas e melhores cuidados de saúde para as crianças afetadas.
FinanciamentoEsta pesquisa foi patrocinada por recursos da Fundação Oswaldo Cruz (Fiocruz).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A todos os envolvidos nos cuidados das mães e das crianças afetadas pela epidemia de microcefalia no Piauí.
Como citar este artigo: Almeida IM, Ramos CV, Rodrigues DC, Sousa AC, Nascimento ML, Silva MV, et al. Clinical and epidemiological aspects of microcephaly in the state of Piauí, northeastern Brazil, 2015‐2016. J Pediatr (Rio J). 2019;95:466–74.