To describe the frequency and characteristics of adverse drug events in pediatric inpatients in a Brazilian tertiary teaching hospital.
MethodsA cross‐sectional study was conducted by retrospective and manual chart review of 240 pediatric admissions to identify adverse drug events using 17 triggers. When triggers were detected in the chart, reviewers investigated the chart in depth to decide whether an event occurred. Consensus about the occurrence of the event was obtained in meeting with a healthcare team. Events were classified by harm category and drugs were classified according to the Anatomical Therapeutic Chemical Classification. Patients who had suffered were compared to those who had not experienced events using the chi‐squared test and the Mann–Whitney U test.
ResultsA total of 62 adverse events were found, and 18.8% of the patients had at least one event. Adverse events rates were 25.83 per 100 admissions, 20.27 per 1000 patient‐days, 25.94 per 1000 drugs, and 2.12 per 1000 drug doses. All events found were classified as temporary harm, and cardiovascular drugs were most frequently related to events. Groups of patients with and without event were segregated (p<0.05) by the length of stay, number of drugs, and drug doses.
ConclusionThe use of triggers demonstrated its utility in a pediatric setting by identifying harm. Adverse events rates were found to be higher than those of previous studies, but the harm rate was lower than other studies. This study enables the measurement of adverse events in order to define strategies to mitigate or reduce harm.
Descrever a frequência e as características dos eventos adversos a medicamentos em pacientes pediátricos internados em um hospital universitário terciário brasileiro.
MétodosFoi realizado um estudo transversal por meio da análise retrospectiva e manual de prontuários de 240 internações pediátricas para identificar eventos adversos a medicamentos utilizando 17 rastreadores. Quando foram identificados rastreadores no prontuário, os analistas investigaram extensivamente o prontuário para decidir a respeito da existência de um evento. O consenso sobre a ocorrência do evento foi obtido em reunião com uma equipe de profissionais da saúde. Os eventos foram classificados por categoria de dano e os medicamentos foram classificados de acordo com a Classificação Anatômica Terapêutico‐Química. Os pacientes que sofreram eventos adventos foram comparados aos que não apresentaram eventos adversos, com o teste qui‐quadrado e o teste U de Mann‐Whitney.
ResultadosVerificou-se um total de 62 eventos adversos e 18,8% dos pacientes apresentaram ao menos evento. As taxas de eventos adversos foram de 25,83 por 100 internações, 20,27 por 1.000 pacientes/dia, 25,94 por 1.000 medicamentos e 2,12 por 1.000 doses de medicamentos. Todos os eventos encontrados foram classificados como dano temporário e os medicamentos cardiovasculares foram frequentemente associados aos eventos. Grupos de pacientes com e sem eventos apresentaram diferenças (p < 0,05) em relação ao tempo de internação, número e doses de medicamentos.
ConclusãoO uso de rastreadores demonstrou sua utilidade no contexto pediátrico ao identificar danos. As taxas de eventos adversos foram maiores do que as taxas de estudos anteriores, porém a categoria de dano foi menor que em outros estudos. Este estudo possibilita a medição dos eventos adversos a fim de definir estratégias para minimizar ou reduzir os danos.
O risco de evento adverso (EA) é inerente a qualquer intervenção na área de saúde.1 Eventos adversos a medicamentos (EAM) são um dos tipos mais comuns de EA associados a danos durante a hospitalização.2 Estudos demonstram que o EA acontece em 30% das internações e 50% dos eventos estão relacionados ao uso de medicamentos.3 O EAM é definido como um dano ao paciente devido à exposição ao medicamento. A definição abrange reações adversas a medicamentos (RAM) e erros de medicação (EM). A RAM não é um EAM evitável e ocorre até mesmo quando os medicamentos são usados adequadamente. Em contrapartida, o EAM evitável é classificado como EM, o qual atinge o paciente e provoca danos.4
Diferenças fisiológicas e de desenvolvimento em crianças, a necessidade de uma dosagem de medicamentos específica com base no peso das crianças e sua incapacidade de comunicar as queixas podem torná‐las mais vulneráveis à ocorrência de danos em ambientes hospitalares.5,6 Contudo, a frequência e a natureza dos EAM são menos caracterizadas em crianças em comparação com as informações disponíveis sobre EAM em pacientes adultos.7 Assim, a identificação da frequência de EAM em pacientes pediátricos hospitalizados é essencial para evitar ou reduzir danos, mas ainda é um desafio nas instituições médicas, principalmente em países em desenvolvimento. As taxas de EAM em pacientes pediátricos hospitalizados variam de 6,6 a 49,8 eventos por 1.000 pacientes/dia.8–11
Esforços têm sido feitos para incentivar a melhoria da segurança do paciente na área da pediatria, a fim de estimular mudanças nas práticas de saúde.5 Para isso, é necessário um método robusto, eficiente e confiável para quantificar os danos sofridos em hospitais e fornecer evidências de mudanças nas taxas de danos ao longo do tempo.12 A análise manual de prontuários com base em rastreadores é um método prático e sistemático para monitorar o EA na assistência à saúde de pacientes hospitalizados.13 O gatilho não é um EA, porém é um sinal que potencialmente ajuda a identificar esses eventos.14 Até onde sabemos, a abordagem de rastreadores foi raramente descrita na literatura científica para estimar a frequência de EAM em pacientes pediátricos hospitalizados no Brasil.
Assim, os objetivos deste estudo são descrever, por meio de rastreadores, a frequência e as características dos EAM identificadas em pacientes pediátricos hospitalizados.
MétodosProjeto, ambiente e pacientesFoi feito um estudo transversal com o uso de rastreadores por meio da análise retrospectiva de prontuários de pacientes pediátricos hospitalizados para a busca de EAM. O estudo foi feito no departamento pediátrico (inclusive Enfermaria, Emergência e Unidade de Terapia Intensiva Neonatal) de um hospital universitário terciário com aproximadamente 290 leitos no centro‐oeste do Brasil.
O Comitê de Ética em Pesquisa do Hospital das Clínicas, na Universidade Federal de Goiás (UFG), Brasil, aprovou a pesquisa com número de protocolo 1.007.134/2015.
O processo de medicação hospitalar tem como base várias fases e começa com a receita médica e, posteriormente, os pedidos são transferidos para o Departamento de Farmácia. Nesse momento, os medicamentos são distribuídos com o uso de um sistema de dosagem individual. Nesse sistema, os medicamentos são distribuídos no berçário por um período de 24 horas e para cada paciente, conforme solicitado pela receita. Além disso, os enfermeiros distribuem medicamentos com doses múltiplas (fluidos orais), conforme necessário. A equipe de enfermagem prepara e administra os medicamentos e monitora os pacientes. Nota‐se que não existem prontuários computadorizados no hospital e todas as anotações são escritas manualmente em um prontuário de papel.
A amostra foi selecionada aleatoriamente das internações de pacientes entre 1° de janeiro de 2014 e 31 de dezembro de 2014, com tempo de internação de pelo menos 48 horas e idade entre dois dias e 18 anos. Não foram incluídas as internações de pacientes no hospital sem receitas de medicamentos. Vinte internações foram selecionadas de cada mês, conforme recomendado pela ferramenta de busca,15 pois a ferramenta de rastreadores é projetada para amostras pequenas ao longo do tempo. Todas as internações em 2014 foram pesquisadas no sistema de controle de internação e categorizadas por mês de internação. Os pesquisadores identificaram todas as internações que atendiam aos critérios de seleção e cada internação de pacientes recebeu um número. Em seguida, uma estratégia de geração de números aleatórios foi usada para selecionar 20 desses números por mês. Então o prontuário correspondente ao número sorteado foi solicitado do arquivo do departamento médico. Quando o prontuário não era recuperado após três solicitações consecutivas, outra internação era selecionada aleatoriamente para substituição.
Durante um ano de estudo, foram avaliadas 240 internações. Os parâmetros para cálculo do tamanho da amostra foram uma população de 467 pessoas, com uma estimativa de 7,29% de pacientes com EAM,10 com nível de confiança de 99,99% e margem de erro aceitável de 5%. O cálculo do tamanho da amostra foi de 218.
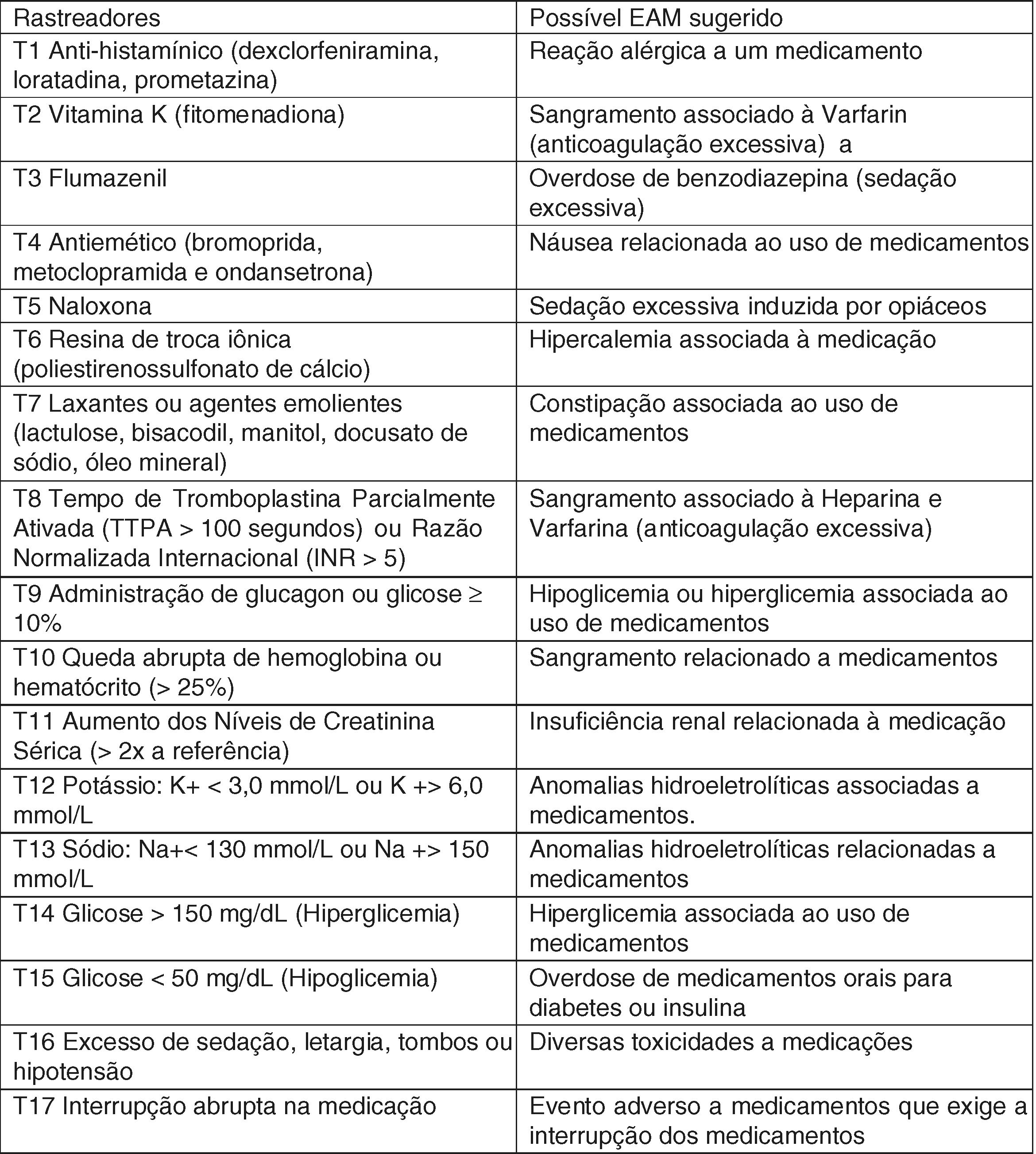
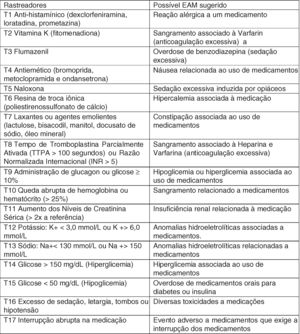
Processo de análise retrospectiva de prontuáriosO instrumento de pesquisa usado neste estudo foi adaptado e validado anteriormente para o contexto hospitalar brasileiro.16 O instrumento inclui uma lista de rastreadores pediátricos específicos (fig. 1), com suas definições detalhadas e o EAM correspondente, exemplos de casos de danos e formulários‐padrão de coleta de dados.15
Um farmacêutico com experiência clínica e um estudante de farmácia fizeram independentemente o processo de análise de prontuários e cada um ficou responsável pela análise de prontuários diferentes. Os analistas concluíram um treinamento intensivo sobre o método antes de iniciar a coleta de dados. Um farmacêutico do Departamento de Segurança do Paciente fez as sessões de treinamento com o uso de um manual de estudo,15,17 trabalhos anteriores10,16 e exemplos de casos de detecção de EAM com base em rastreadores. Foi feito como pré‐teste um processo sistemático de análise de prontuários com dez prontuários, nos quais o treinador sabia da presença do gatilho e EAM. É importante ressaltar que o analista farmacêutico já tinha analisado aproximadamente 40 prontuários em um estudo anterior.
Os analistas aplicaram o método padronizado de análise de prontuários por meio da ferramenta de pesquisa15 para avaliar as internações selecionadas. Os prontuários foram avaliados na seguinte ordem para a pesquisa de rastreadores: resultados de testes laboratoriais, ordens médicas e anotações de progresso de enfermeiros e da equipe multidisciplinar. Caso nenhum dos 17 rastreadores fosse identificado, o analista finalizava a análise dos prontuários. Quando um ou mais rastreadores eram encontrados, os analistas faziam uma análise detalhada do prontuário para verificar uma possível associação entre o gatilho e a ocorrência de EAM. Mais de um gatilho poderia ser associado a um único EAM. Também foram considerados EAM sem relação com um gatilho descritos no prontuário dos pacientes. Os analistas coletaram todos os medicamentos usados pelo paciente. Não havia prazo para a análise dos prontuários.
Para cada EAM identificado, a gravidade foi estabelecida de acordo com o índice das categorias de E a I (Material Complementar) do Conselho Nacional de Coordenação para a Notificação e Prevenção de Erros de Medicação (NCC MERP). Foi usada a base de dados Micromedex® Solutions (Truven Health Analytics Inc., 2016) como fonte de informações dos medicamentos para estabelecer relações entre o gatilho, o medicamento e o EAM. Não foi determinada a capacidade de prevenção do EAM detectado.
Após a análise dos prontuários, dois analistas se encontraram para discutir e organizar os dados para fornecer um resumo do possível evento e das informações relevantes relacionadas ao caso. Em seguida, eles apresentaram os resultados para um grupo de especialistas em reuniões presenciais e on‐line. Os especialistas discutiram cada possível EAM para atingir um consenso se o EAM ocorreu ou não e a gravidade do dano associado ao evento. Um enfermeiro, um médico e três farmacêuticos formaram a equipe profissional para avaliar os dados. Para uma melhor precisão na identificação e confirmação ou rejeição de EAM, a equipe usou um resumo do evento identificado pelos analistas dos prontuários e informações clínicas relevantes sobre o paciente (idade, sexo, tempo de internação, diagnósticos e medicamentos). Foi usada a seguinte pergunta para avaliar a ocorrência de um EAM: o EAM pode ser associado ao medicamento suspeito, considerando suas propriedades, a situação clínica do paciente e a relação entre seu uso e o evento?18
Análise de dadosOs dados foram analisados e as estatísticas foram calculadas com os softwares Epi Info™ 3.5.4 (Centro de Controle e Prevenção de Doenças, Atlanta, EUA) e Stata® 12.0 (StataCorp, College Station, Texas, EUA). Os resultados encontrados foram: (1) EAM por 100 internações, (2) EAM por 1.000 pacientes/dia, (3) EAM por 1.000 medicamentos, (4) EAM por 1.000 doses de medicamentos, (5) percentual de internações com EAM (prevalência), (6) gravidade do dano e (7) número de EAM identificados pela análise retrospectiva sem a presença de rastreadores (Material Complementar). As taxas foram calculadas com intervalos de confiança Poisson de 95% (IC). Além disso, os medicamentos foram descritos pela classificação Anatômica Terapêutico‐Química (ATC), de acordo com a classificação do primeiro e segundo níveis.19
Os dados foram analisados com estatísticas descritivas, inclusive as características dos pacientes. As variáveis categóricas foram descritas como frequência e percentual absolutos (%). A distribuição normal foi apurada com o teste de Shapiro‐Wilk para variáveis contínuas. As características dos pacientes (variáveis com distribuição anormal) foram descritas em médias e intervalos interquartis.
As comparações entre o grupo de pacientes com e sem EAM foram feitas com o teste qui‐quadrado de Pearson para variáveis categóricas (sexo) e o teste U de Mann‐Whitney para variáveis contínuas (idade, tempo de internação, número e doses de medicamentos) (p < 0,05).
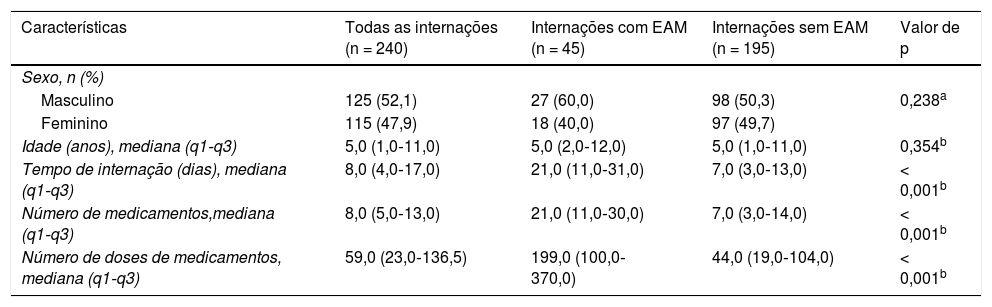
ResultadosForam selecionadas 240 internações aleatoriamente para a busca de rastreadores e EAM, total de 3,079 pacientes/dia. As principais características dos pacientes e das internações estão descritas na tabela 1. A população estudada consistiu em 52,1% (n = 125) de pacientes do sexo masculino e a média de idade foi de cinco anos. O tempo de internação variou de dois a 74 dias e a média foi de oito dias. Os pacientes pediátricos hospitalizados receberam uma média de oito medicamentos e 59 doses. Os grupos de pacientes com e sem EAM divergiram com relação ao tempo de internação, número de medicamentos e número de doses de medicamentos (p < 0,05).
Características dos perfis de pacientes com e sem eventos adversos a medicamentos (EAM) em um hospital brasileiro de 1° de janeiro a 31 de dezembro de 2014 (n = 240)
| Características | Todas as internações (n = 240) | Internações com EAM (n = 45) | Internações sem EAM (n = 195) | Valor de p |
|---|---|---|---|---|
| Sexo, n (%) | ||||
| Masculino | 125 (52,1) | 27 (60,0) | 98 (50,3) | 0,238a |
| Feminino | 115 (47,9) | 18 (40,0) | 97 (49,7) | |
| Idade (anos), mediana (q1‐q3) | 5,0 (1,0‐11,0) | 5,0 (2,0‐12,0) | 5,0 (1,0‐11,0) | 0,354b |
| Tempo de internação (dias), mediana (q1‐q3) | 8,0 (4,0‐17,0) | 21,0 (11,0‐31,0) | 7,0 (3,0‐13,0) | < 0,001b |
| Número de medicamentos,mediana (q1‐q3) | 8,0 (5,0‐13,0) | 21,0 (11,0‐30,0) | 7,0 (3,0‐14,0) | < 0,001b |
| Número de doses de medicamentos, mediana (q1‐q3) | 59,0 (23,0‐136,5) | 199,0 (100,0‐370,0) | 44,0 (19,0‐104,0) | < 0,001b |
O valor de p foi obtido pelo:
Foram detectados 62 EAM em 18,8% das internações, resultaram em 25,83 EAM por 100 internações (IC 95% 19,81‐33,12). Este estudo apresentou as seguintes taxas médias: 20,14 EAM por 1.000 pacientes/dia (IC 95% 15,44‐25,81), 25,94 EAM por 1.000 medicamentos (IC 95% 19,89‐33,26) e 2,12 EAM por 1.000 doses de medicamentos (IC 95% 1,63‐2,72). Dos pacientes, 31 (12,92%) apresentaram somente um EAM e 14 (5,83%) apresentaram duas ou três EAM durante a internação.
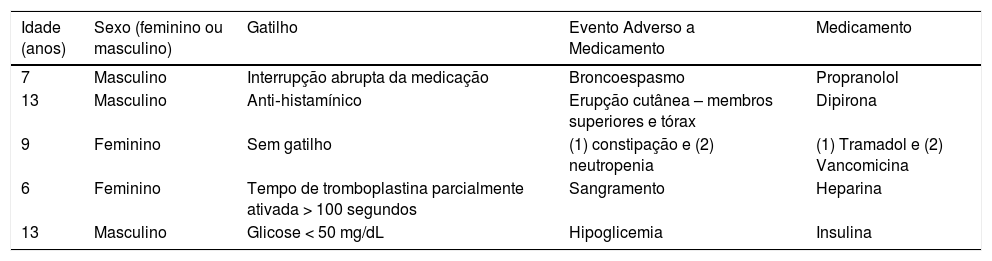
Exemplos de EAM são descritos na tabela 2. Quinze (24,9%) dos 62 EAM identificados não foram associados a um gatilho e não houve apresentação voluntária de relatórios durante o período do estudo. Todos os EAM identificados foram classificados na categoria de dano E do NCC MERP (contribuiu ou resultou em dano temporário ao paciente e foi necessária uma intervenção).
Exemplos de eventos adversos a medicamentos (EAM) que ocorreram em pacientes pediátricos hospitalizados em um hospital brasileiro de 1° de janeiro a 31 de dezembro de 2014
| Idade (anos) | Sexo (feminino ou masculino) | Gatilho | Evento Adverso a Medicamento | Medicamento |
|---|---|---|---|---|
| 7 | Masculino | Interrupção abrupta da medicação | Broncoespasmo | Propranolol |
| 13 | Masculino | Anti‐histamínico | Erupção cutânea – membros superiores e tórax | Dipirona |
| 9 | Feminino | Sem gatilho | (1) constipação e (2) neutropenia | (1) Tramadol e (2) Vancomicina |
| 6 | Feminino | Tempo de tromboplastina parcialmente ativada > 100 segundos | Sangramento | Heparina |
| 13 | Masculino | Glicose < 50 mg/dL | Hipoglicemia | Insulina |
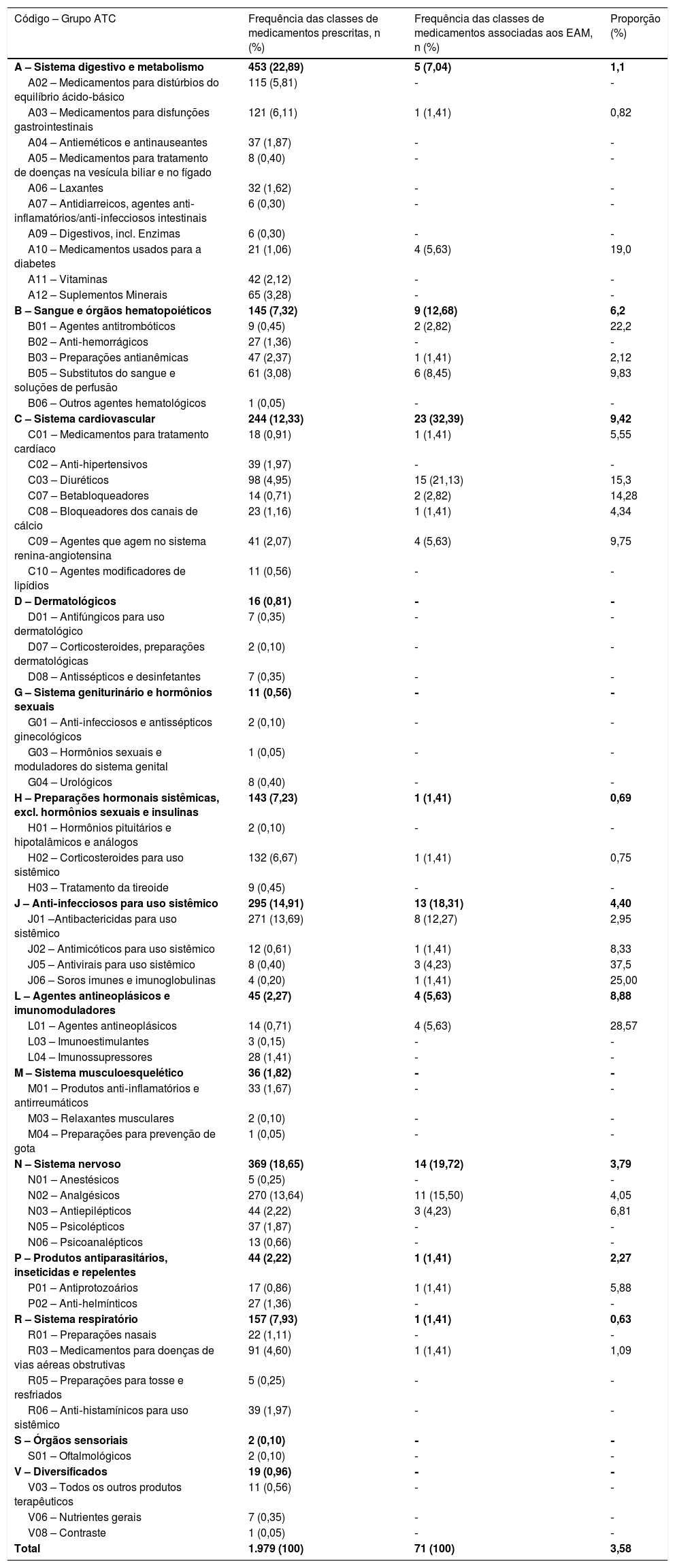
Os EAM observados foram associados a 71 medicamentos. Os grupos de medicamentos mais associados à ocorrência de EAM foram os que agiam no sistema cardiovascular (32,39%), no sistema nervoso (19,72%) e como anti‐inflamatórios para uso sistêmico (18,31%) (tabela 3). Os medicamentos mais frequentemente associados a EAM foram furosemida (11,28%), espironolactona (8,45%), albumina (7,04%) e tramadol (7,04%).
O número de classes de medicamentos prescritos e o número associado a eventos adversos a medicamentos (EAM) que ocorreram em pacientes pediátricos hospitalizados em um hospital brasileiro de 1° de janeiro a 31 de dezembro de 2014 de acordo com o primeiro e o segundo níveis da classificação Anatômica Terapêutico‐Química (ATC)
| Código – Grupo ATC | Frequência das classes de medicamentos prescritas, n (%) | Frequência das classes de medicamentos associadas aos EAM, n (%) | Proporção (%) |
|---|---|---|---|
| A – Sistema digestivo e metabolismo | 453 (22,89) | 5 (7,04) | 1,1 |
| A02 – Medicamentos para distúrbios do equilíbrio ácido‐básico | 115 (5,81) | ‐ | ‐ |
| A03 – Medicamentos para disfunções gastrointestinais | 121 (6,11) | 1 (1,41) | 0,82 |
| A04 – Antieméticos e antinauseantes | 37 (1,87) | ‐ | ‐ |
| A05 – Medicamentos para tratamento de doenças na vesícula biliar e no fígado | 8 (0,40) | ‐ | ‐ |
| A06 – Laxantes | 32 (1,62) | ‐ | ‐ |
| A07 – Antidiarreicos, agentes anti‐inflamatórios/anti‐infecciosos intestinais | 6 (0,30) | ‐ | ‐ |
| A09 – Digestivos, incl. Enzimas | 6 (0,30) | ‐ | ‐ |
| A10 – Medicamentos usados para a diabetes | 21 (1,06) | 4 (5,63) | 19,0 |
| A11 – Vitaminas | 42 (2,12) | ‐ | ‐ |
| A12 – Suplementos Minerais | 65 (3,28) | ‐ | ‐ |
| B – Sangue e órgãos hematopoiéticos | 145 (7,32) | 9 (12,68) | 6,2 |
| B01 – Agentes antitrombóticos | 9 (0,45) | 2 (2,82) | 22,2 |
| B02 – Anti‐hemorrágicos | 27 (1,36) | ‐ | ‐ |
| B03 – Preparações antianêmicas | 47 (2,37) | 1 (1,41) | 2,12 |
| B05 – Substitutos do sangue e soluções de perfusão | 61 (3,08) | 6 (8,45) | 9,83 |
| B06 – Outros agentes hematológicos | 1 (0,05) | ‐ | ‐ |
| C – Sistema cardiovascular | 244 (12,33) | 23 (32,39) | 9,42 |
| C01 – Medicamentos para tratamento cardíaco | 18 (0,91) | 1 (1,41) | 5,55 |
| C02 – Anti‐hipertensivos | 39 (1,97) | ‐ | ‐ |
| C03 – Diuréticos | 98 (4,95) | 15 (21,13) | 15,3 |
| C07 – Betabloqueadores | 14 (0,71) | 2 (2,82) | 14,28 |
| C08 – Bloqueadores dos canais de cálcio | 23 (1,16) | 1 (1,41) | 4,34 |
| C09 – Agentes que agem no sistema renina‐angiotensina | 41 (2,07) | 4 (5,63) | 9,75 |
| C10 – Agentes modificadores de lipídios | 11 (0,56) | ‐ | ‐ |
| D – Dermatológicos | 16 (0,81) | ‐ | ‐ |
| D01 – Antifúngicos para uso dermatológico | 7 (0,35) | ‐ | ‐ |
| D07 – Corticosteroides, preparações dermatológicas | 2 (0,10) | ‐ | ‐ |
| D08 – Antissépticos e desinfetantes | 7 (0,35) | ‐ | ‐ |
| G – Sistema geniturinário e hormônios sexuais | 11 (0,56) | ‐ | ‐ |
| G01 – Anti‐infecciosos e antissépticos ginecológicos | 2 (0,10) | ‐ | ‐ |
| G03 – Hormônios sexuais e moduladores do sistema genital | 1 (0,05) | ‐ | ‐ |
| G04 – Urológicos | 8 (0,40) | ‐ | ‐ |
| H – Preparações hormonais sistêmicas, excl. hormônios sexuais e insulinas | 143 (7,23) | 1 (1,41) | 0,69 |
| H01 – Hormônios pituitários e hipotalâmicos e análogos | 2 (0,10) | ‐ | ‐ |
| H02 – Corticosteroides para uso sistêmico | 132 (6,67) | 1 (1,41) | 0,75 |
| H03 – Tratamento da tireoide | 9 (0,45) | ‐ | ‐ |
| J – Anti‐infecciosos para uso sistêmico | 295 (14,91) | 13 (18,31) | 4,40 |
| J01 –Antibactericidas para uso sistêmico | 271 (13,69) | 8 (12,27) | 2,95 |
| J02 – Antimicóticos para uso sistêmico | 12 (0,61) | 1 (1,41) | 8,33 |
| J05 – Antivirais para uso sistêmico | 8 (0,40) | 3 (4,23) | 37,5 |
| J06 – Soros imunes e imunoglobulinas | 4 (0,20) | 1 (1,41) | 25,00 |
| L – Agentes antineoplásicos e imunomoduladores | 45 (2,27) | 4 (5,63) | 8,88 |
| L01 – Agentes antineoplásicos | 14 (0,71) | 4 (5,63) | 28,57 |
| L03 – Imunoestimulantes | 3 (0,15) | ‐ | ‐ |
| L04 – Imunossupressores | 28 (1,41) | ‐ | ‐ |
| M – Sistema musculoesquelético | 36 (1,82) | ‐ | ‐ |
| M01 – Produtos anti‐inflamatórios e antirreumáticos | 33 (1,67) | ‐ | ‐ |
| M03 – Relaxantes musculares | 2 (0,10) | ‐ | ‐ |
| M04 – Preparações para prevenção de gota | 1 (0,05) | ‐ | ‐ |
| N – Sistema nervoso | 369 (18,65) | 14 (19,72) | 3,79 |
| N01 – Anestésicos | 5 (0,25) | ‐ | ‐ |
| N02 – Analgésicos | 270 (13,64) | 11 (15,50) | 4,05 |
| N03 – Antiepilépticos | 44 (2,22) | 3 (4,23) | 6,81 |
| N05 – Psicolépticos | 37 (1,87) | ‐ | ‐ |
| N06 – Psicoanalépticos | 13 (0,66) | ‐ | ‐ |
| P – Produtos antiparasitários, inseticidas e repelentes | 44 (2,22) | 1 (1,41) | 2,27 |
| P01 – Antiprotozoários | 17 (0,86) | 1 (1,41) | 5,88 |
| P02 – Anti‐helmínticos | 27 (1,36) | ‐ | ‐ |
| R – Sistema respiratório | 157 (7,93) | 1 (1,41) | 0,63 |
| R01 – Preparações nasais | 22 (1,11) | ‐ | ‐ |
| R03 – Medicamentos para doenças de vias aéreas obstrutivas | 91 (4,60) | 1 (1,41) | 1,09 |
| R05 – Preparações para tosse e resfriados | 5 (0,25) | ‐ | ‐ |
| R06 – Anti‐histamínicos para uso sistêmico | 39 (1,97) | ‐ | ‐ |
| S – Órgãos sensoriais | 2 (0,10) | ‐ | ‐ |
| S01 – Oftalmológicos | 2 (0,10) | ‐ | ‐ |
| V – Diversificados | 19 (0,96) | ‐ | ‐ |
| V03 – Todos os outros produtos terapêuticos | 11 (0,56) | ‐ | ‐ |
| V06 – Nutrientes gerais | 7 (0,35) | ‐ | ‐ |
| V08 – Contraste | 1 (0,05) | ‐ | ‐ |
| Total | 1.979 (100) | 71 (100) | 3,58 |
Os achados confirmam que o EAM ocorre com mais frequência no contexto pediátrico, em 18,8% dos pacientes neste estudo. O monitoramento das internações ocorreu por mais de um ano no hospital estudado, o que nos permitiu identificar 25,83 danos por 100 internações em pacientes pediátricos. Essa taxa de EAM é maior do que as encontradas em estudos anteriores que usaram rastreadores (11,1 e 25,0 EAM por 100 internações),10,11 bem como em estudos que usaram outras metodologias (6,0 e 2,3 EAM por 100 internações).8,9 Com relação à EAM por 1.000 pacientes/dia, nossa taxa foi 128 vezes maior do que a de Takata et al.10 e 247 vezes menor do que a de Kirkendall et al.11
As taxas de danos em pacientes podem variar, depende da definição de dano usada, dos critérios de amostragem e da metodologia do estudo usada,20 o que dificulta a comparação dos estudos que avaliam as taxas de ocorrência de EAM. Estudos que usam rastreadores como método de pesquisa parecem ser mais efetivos, eficientes e robustos na identificação de EAM do que outros estudos que usam notificação voluntária,10,14 análise de prontuários médicos não direcionados por rastreadores14,21 ou dados administrativos.22
A comparação entre estudos que usaram rastreadores também é limitada pelo fato de as taxas serem dependentes da lista de rastreadores, da experiência do analista e do tipo de prontuário. Kirkendall et al.11 mostraram os resultados da análise de 240 prontuários em formato eletrônico em um único hospital, nos quais os principais analistas eram enfermeiros. Takata el al.10 relataram as taxas de EAM de 960 internações em 12 hospitais nos Estados Unidos, nos quais os analistas em cada local eram enfermeiros, médicos ou farmacêuticos. Call et al.23 usaram um pacote de ferramentas de gatilho eletrônicas associado a um prontuário médico eletrônico para identificar rastreadores automaticamente em 390 prontuários em um único hospital, nos quais os analistas de possíveis EAM eram um médico e um farmacêutico.
Durante o período do estudo, não houve notificação voluntária de EAM, o que reflete a cultura de segurança do paciente. Contudo, algumas instituições de saúde usam rotineiramente notificações de EAM, pois elas podem identificar danos significativos em pacientes.23 Aproximadamente um quarto dos EAM detectados neste estudo não foi associado a um gatilho, porém foram identificados durante a análise de prontuários na busca por rastreadores. Esse achado sugere que o uso de dois métodos de detecção é a melhor abordagem para quantificar EAM em hospitais.10,24
Este estudo fornece evidências adicionais e corrobora que deve ser prestada atenção especial em pacientes que tomam vários medicamentos, bem como em pacientes com internação prolongada. A comparação entre o grupo de pacientes com e sem EAM destaca o maior tempo de internação entre os pacientes com EAM. A relação entre um maior tempo de internação e a ocorrência de EAM foi mostrada em diversos estudos;25,26 assim, essa associação está relacionada ao maior risco de saúde para o paciente decorrente da assistência hospitalar.
A comparação entre os grupos também revela o maior uso de medicamentos entre pacientes que apresentaram EAM. Um estudo anterior mostrou que o consumo de múltiplos medicamentos aumenta as chances de desenvolvimento de EAM e as preocupações sobre risco de segurança de medicamentos nos serviços de saúde, que é um desafio reconhecido na segurança dos pacientes.27
Foram detectados vários tipos de EAM, como náusea, vômito e erupção cutânea, e classes diversificadas de medicamentos foram associadas à ocorrência desses eventos. Em conformidade com este estudo, analgésicos opioides e antibióticos estão entre as classes de medicamentos mais associadas à ocorrência de EAM.9,10 Os opioides são considerados medicamentos de alto risco em muitos estudos, pois têm potencial para causar danos significativos ao paciente.28 Além disso, medicamentos cardiovasculares são responsáveis por um grande número de EAM. Os medicamentos dessa classe são amplamente prescritos, contribuem, assim, para a ocorrência mais frequente de EAM.26,29
A gravidade de EAM encontrada neste estudo foi menor do que nos estudos anteriores,10,11 uma vez que todos os danos foram descritos como categoria E (dano temporário). Takata et al.10 relataram 2,8% de eventos na categoria F (dano temporário com necessidade de internação inicial ou prolongada) e o restante dos EAM, na categoria E. Kirkendall et al.11 identificaram 51% de danos na categoria E, 44% na categoria F e 5% na categoria H (necessidade de intervenção para a sobrevivência). O entendimento do que são danos é uma parte essencial dos serviços de saúde, pois sua mensuração possibilita a detecção de situações de risco e a identificação precoce de recursos, limita consequentemente os danos ao paciente.
Portanto, os medicamentos causam danos em pacientes pediátricos hospitalizados e os EAM merecem atenção mesmo quando são classificados na menor categoria de dano. Os dados apresentados aqui corroboram fortemente a ferramenta de rastreadores como um método robusto para avaliar os EAM e eles podem ajudar a melhorar o conhecimento sobre a frequência e os tipos de EAM, bem como sobre as classes de medicamentos associadas a danos no departamento de pediatria dos hospitais brasileiros. Trata‐se de informações importantes que estão de acordo com uma das primeiras etapas do Terceiro Desafio Global de Segurança do Paciente: Medicação sem Danos, anunciado pela Organização Mundial de Saúde (ONU) em 2017, que está “melhorando a qualidade dos dados para monitorar os danos associados a medicações”.30
Contudo, é necessária uma investigação mais aprofundada para avaliar a concordância entre os avaliadores quanto à aplicação de rastreadores na avaliação da relevância da ferramenta quando aplicada por diferentes profissionais do setor de saúde. Além disso, vale a pena investigar a associação entre a ocorrência de EAM e o tempo de internação ou o número de medicamentos para a busca de fatores de risco de EAM em pacientes pediátricos brasileiros hospitalizados. Além disso, a metodologia deste estudo pode ser aplicada a outros hospitais do Brasil para a geração de dados de rotina, que podem caracterizar a ocorrência de EAM em diferentes partes do país.
Pontos fortes e limitaçõesEste estudo tem aplicabilidade tanto nas pesquisas quanto na prática clínica. Em geral, o principal objetivo dos dados é mostrar a ocorrência de EAM e o processo de identificação que pode ser aprimorado ou alterado em ambientes da área da saúde. A análise retrospectiva de prontuários com o uso de rastreadores não permite uma observação direta na assistência à saúde dos pacientes. Contudo, o método permite gerar informações sobre os processos de cuidado e contribui para o desenvolvimento de estratégias para reduzir os danos ou até mesmo eliminar a ocorrência de novos eventos.
Existem limitações no estudo inerentes ao modelo retrospectivo. Por exemplo, os estudos retrospectivos exigem boa qualidade de prontuários médicos, porém percebemos em nossa análise que faltavam algumas informações. Assim, o número de EAM pode ser subestimado como resultado da falta de descrição de informações relevantes, como a ordem temporal dos eventos. Mesmo assim, a análise retrospectiva de prontuários é considerada uma metodologia excelente para pesquisas sobre EAM em comparação com outros métodos.
Além disso, a análise retrospectiva de prontuários envolve subjetividade, inclusive a categorização do nível de dano. Todos os EAM detectados foram classificados como nível de dano E, o que pode ser influenciado pelo modo como as anotações foram registradas no prontuário. Nesse sentido, fizemos análise retrospectiva de prontuários com o uso de um manual específico com um modelo padrão e rastreadores validados e uma equipe de profissionais de saúde que incluiu enfermeiros, farmacêuticos e médicos, que discutiram todos os dados coletados.
Nosso estudo foi desenvolvido em um hospital onde os prontuários foram preenchidos manualmente. Portanto, não conseguimos ter acesso ao prontuário físico em alguns casos específicos, porque o paciente estava em uma nova internação ou o prontuário estava em auditoria, por exemplo. Nesses casos, selecionamos aleatoriamente outra internação para substituir a anterior, o que não comprometeu os resultados do estudo.
O método recomenda que cada prontuário seja analisado em 20 minutos. Contudo, o tempo de análise de prontuários não foi levado em consideração. Vinte minutos de análise de prontuários permitem simplificar os processos. Contudo, esse período foi insuficiente em nosso estudo para identificar os eventos em internações com tempo de internação prolongado ou em casos complexos. Além disso, foi difícil identificar alguns rastreadores, por exemplo, excesso de sedação, letargia, tombos ou hipotensão, que exigiram análises mais cuidadosas pelos analistas em todas as notificações.
Por fim, este estudo foi feito em um único departamento pediátrico de um hospital universitário terciário, o que limita generalizações dos resultados. Contudo, esse hospital é considerado um serviço de referência em especialidades pediátricas e a assistência é oferecida de graça para pacientes de diferentes partes do país.
FinanciamentoCoordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes) e Fundação de Amparo à Pesquisa do Estado de Goiás (Fapeg) (bolsas AUXPE 1665/2016).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Silva LT, Modesto AC, Martins RR, Lopes FM. Characterization of adverse drug events identified by trigger in Brazilian pediatric inpatients. J Pediatr (Rio J). 2020;96:393–401.