The potential role of procalcitonin (PCT) in the diagnosis of catheter‐related bloodstream infection (CRBSIs) is still unclear and requires further research. The diagnostic value of serum PCT for the diagnosis of CRBSI in children is evaluated here.
MethodThis study was conducted between October 2013 and November 2014, and included patients with suspected CRBSI from 1 month to 18 years of age who were febrile, with no focus of infection, and had a central venous catheter. Levels of PCT and other serum markers were measured, and their utility as CRBSI markers was assessed. Additionally, the clinical performance of a new, automated, rapid, and quantitative assay for the detection of PCT was tested.
ResultsAmong the 49 patients, 24 were diagnosed with CRBSI. The PCT‐Kryptor and PCT‐RTA values were significantly higher in proven CRBSI compared to those in unproven CRBSI (p=0.03 and p=0.03, respectively). There were no differences in white blood cell count and C‐reactive protein (CRP) levels between proven CRBSI and unproven CRBSI. Among the 24 patients with CRBSI, CRP was significantly higher among those with Gram‐negative bacterial infection than in those with Gram‐positive bacterial infections. PCT‐Kryptor was also significantly higher among patients with Gram‐negative bacterial infection than in those with Gram‐positive bacterial infections (p=0.01 and p=0.02, respectively).
ConclusionsThe authors suggest that PCT could be a helpful rapid diagnostic marker in children with suspected CRBSIs.
O possível papel da procalcitonina (PCT) no diagnóstico de infecções de corrente sanguínea relacionadas a cateter (ICSRCs) ainda não está claro e precisa ser mais pesquisado. O valor diagnóstico da PCT sérica para o diagnóstico de ICSRC em crianças é avaliado neste estudo.
MétodoEste estudo foi feito entre outubro de 2013 e novembro de 2014 e incluiu pacientes com suspeita de ICSRC de um mês a 18 anos que estavam febris, não tinham foco de infecção e tinham cateter venoso central. Foram medidos os níveis de PCT e de outros marcadores séricos, cuja utilidade como marcadores de ICSRC foi avaliada. Adicionalmente, foi testado o desempenho clínico de um novo ensaio quantitativo automatizado e rápido para a detecção de PCT.
ResultadosDentre 49 pacientes, 24 foram diagnosticados com ICSRC. Os valores de PCT‐Kryptor e PCT‐RTA foram significativamente maiores em ICSRCs comprovadas do que em ICSRCs não comprovadas (p=0,03 e p=0,03, respectivamente). Não houve diferença na contagem de glóbulos brancos e nos níveis de proteína C reativa (PCR) entre ICSRCs comprovadas e ICSRCs não comprovadas. Dentre os 24 pacientes com ICSRC, a PCR era significativamente maior entre aqueles com infecção bacteriana gram‐negativa do que naqueles com infecção bacteriana gram‐positiva. O PCT‐Kryptor também foi significativamente maior entre pacientes com infecção por bactérias gram‐negativas do que naqueles com infecção por bactérias gram‐positivas (p=0,01 e p=0,02, respectivamente).
ConclusõesSugerimos que a PCT pode ser um marcador de diagnóstico rápido útil em crianças com suspeita de ICSRCs.
Cateteres venosos centrais (CVCs) normalmente são usados para administrar fluidos intravenosos, medicamentos, hemoderivados e fluidos de nutrição parenteral, monitorar o estado hemodinâmico e fazer a hemodiálise.1 Infecções de corrente sanguínea relacionadas a cateter (ICSRCs) são a principal causa da sepse hospitalar, incluindo a sepse neonatal,2 e estão relacionadas a morbidez, mortalidade e custos hospitalares.1,3 O diagnóstico precoce de ICSRCs e o tratamento adequado poderão reduzir a morbidez e a mortalidade relacionadas.4,5 Os critérios laboratoriais de diagnóstico de ICSRCs são precisos; contudo, as diferenças nas definições e nas metodologias entre vários estudos dificultaram a comparação de resultados.1,6 A confirmação de ICSRCs exige a identificação de micro‐organismos do sangue e de pontas de cateteres. Apesar de a hemocultura ser o melhor método para o diagnóstico de infecções da corrente sanguínea, os resultados do teste não ficam prontos rapidamente. Além disso, apenas 15%‐25% das pontas de CVCs que chegam ao laboratório de microbiologia apresentam resultado positivo para culturas. Adicionalmente, nem todas as ICSRCs exigem a retirada do cateter.7,8 Portanto, o diagnóstico de ICSRCs por meio de métodos conservadores (sem a retirada do cateter) parece mais razoável em ambientes clínicos para evitar a remoção desnecessária do cateter vascular e o uso excessivo de antibióticos.9
Como a remoção desses dispositivos normalmente é desafiadora, a ICSRC deve ser confirmada para se diferenciar de hemoculturas contaminadas, colonização do cateter sem infecção da corrente sanguínea concomitante ou febre causada por outra fonte. Vários métodos foram usados anteriormente para diagnosticar ICSRCs sem a remoção do cateter.1 Biomarcadores precoces e estabelecidos poderão ser úteis no diagnóstico, prognóstico e monitoramento da resposta à terapia.10 Biomarcadores comumente usados, como glóbulos brancos (GBs) ou proteína C reativa (PCR), não têm a especificidade adequada para o diagnóstico de infecções bacterianas.9 A procalcitonina (PCT) sérica, um polipeptídeo de 116 aminoácidos, surgiu recentemente como biomarcador do diagnóstico de várias infecções bacterianas. Descobriu‐se que a PCT tem maior precisão de diagnóstico em comparação com outros parâmetros laboratoriais comumente usados, como GB e PRC.11–13 Descobriu‐se que os níveis de PCT são mais baixos no soro de humanos saudáveis, porém significativamente elevados em pessoas que sofrem de infecções graves, principalmente a sepse.14,15 No melhor de nosso conhecimento, apenas alguns estudos avaliaram a lógica entre os níveis de PCT no diagnóstico preciso de ICSRCs,16,17 principalmente em crianças.
Assim, este estudo visou a avaliar a precisão da PCT no diagnóstico de ICSRCs em crianças. Além disso, também foi examinado o desempenho clínico de um novo ensaio quantitativo automatizado e rápido.
Materiais e métodosEste estudo foi feito entre outubro de 2013 e novembro de 2014 em pacientes com suspeita clínica de ICSRC e elegíveis para inclusão. Pacientes entre um mês e 18 anos, febris, sem foco de infecção e que tinham um cateter venoso central foram incluídos no estudo A investigação foi analisada e aprovada pelo comitê de ética do Hospital Maternidade Universitário Zekai Tahir Burak, Ministério da Saúde, Ancara, Turquia.
A suspeita clínica de ICSRC teve como base o acometimento das seguintes características sugestivas de infecção: a) manifestações clínicas de infecção (febre, calafrios e/ou hipotensão), b) cateter venoso central instalado havia mais de 48 horas e c) nenhuma outra fonte evidente de infecção.1 Em caso de suspeita de ICSRC, foram obtidas amostras de sangue pareadas do cateter e de uma veia periférica, as quais foram submetidas ao teste de cultura.1
Segundo diretrizes publicadas anteriormente, um diagnóstico definitivo de ICSRC exige que tanto o isolamento do mesmo organismo da hemocultura periférica e da cultura da ponta do cateter quanto a cultura positiva do cubo do cateter e do sangue da veia periférica atendam aos critérios de ICSRC.1,16
Os pacientes com qualquer infecção ativa que não ICSRC ou aqueles que mostraram negatividade da cultura apesar da suspeita de ICSRC foram excluídos (13). Caso um paciente tivesse tido mais de um episódio de suspeita de ICSRC durante o período do estudo, apenas o primeiro episódio foi incluído.
Para fins de monitoramento, os pacientes com ICSRC comprovada foram categorizados em dois subgrupos, a depender do controle de infecções: a) Controlada, pacientes com infecção controlada (n=20), definida como melhoria clínica e microbiológica e b) Não controlada, pacientes com infecção não controlada (n=4), definida como bacteremia persistente (o mesmo patógeno responsável pelo episódio 1 foi cultivado 72 horas após a remoção do cateter ou 72 horas após o início do tratamento adequado), superinfecção (ICSRC devido a outro patógeno durante o período da terapia) ou óbito relacionado a ICSRC.16 A mortalidade foi definida como relacionada à ICSRC caso o óbito tivesse ocorrido nos primeiros 28 dias de suspeita de ICSRC.
As amostras de sangue foram avaliadas para verificar os quadros hematológico e bioquímico de rotina, bem como os níveis de PCT e PCR. Os níveis de PCT foram determinados com o analisador de imunoensaio compacto Brahms Kryptor® (Thermofisher, Hennigsdorf, Alemanha) e o dispositivo de medição de procalcitonina RTA® (RTA, Kocaeli, Turquia) simultaneamente. Ambos os ensaios exigiram no mínimo 80μL de soro e foram positivos em caso de níveis de PCT superiores a 0,5 ng/mL, de acordo com as instruções do fabricante. Preferencialmente, foram usadas amostras de soro fresco nas medições. Contudo, caso não fossem usadas no mesmo dia, as amostras eram congeladas a ‐20°C.
Análise estatísticaOs dados foram analisados com a versão 19.0 do SPSS (SPSS, Inc., Chicago, EUA). As estatísticas descritivas foram usadas para resumir as características básicas dos participantes, incluindo médias, desvios padrão (DPs), medianas e intervalos interquartis de variáveis contínuas e distribuições de frequência de variáveis categóricas. Para comparar as características básicas de acordo com a ocorrência de ICSRC, foi usado o teste qui‐quadrado de variáveis categóricas. A normalidade de variáveis quantitativas foi medida pelo teste de Kolmogorov‐Smirnov. Para as variáveis contínuas, foi usado o teste t de grupos independentes de variáveis com distribuição normal ou o teste não paramétrico U de Mann‐Whitney, se a suposição de normalidade fosse violada. A área sob a curva de características de operação do receptor (ROC) foi calculada para avaliar a significância do diagnóstico e prognóstico dos parâmetros testados. Os dados foram expressos como área sob as curvas ROC com intervalos de confiança (ICs) de 95%. O índice de Youden (nível máximo de sensibilidade+nível máximo de especificidade) foi usado para encontrar os pontos de corte ideais. Foram calculados a sensibilidade, a especificidade, o valor preditivo positivo (VPP) e o valor preditivo negativo (VPN). As concordâncias dos valores de PCT entre os dois dispositivos PCT foram determinadas pelo coeficiente Kappa de Cohen. Em todas as análises, os valores de p bicaudais<0,05 foram considerados estatisticamente significativos.
ResultadosCaracterísticas da população estudadaA suspeita clínica de ICSRC foi observada em 62 crianças, que não mostraram uma fonte opcional óbvia para infecção. A cultura microbiológica de urina, bem como o raio‐X de tórax, foi negativa. Foram excluídas 13 crianças com infecção que não ICSRC durante a internação. Dos 49 pacientes restantes, 25 (51%) provaram não sofrer de ICSRC (ICSRC não comprovada) e 24 (49%) foram positivos para ICSRC (ICSRC comprovada).
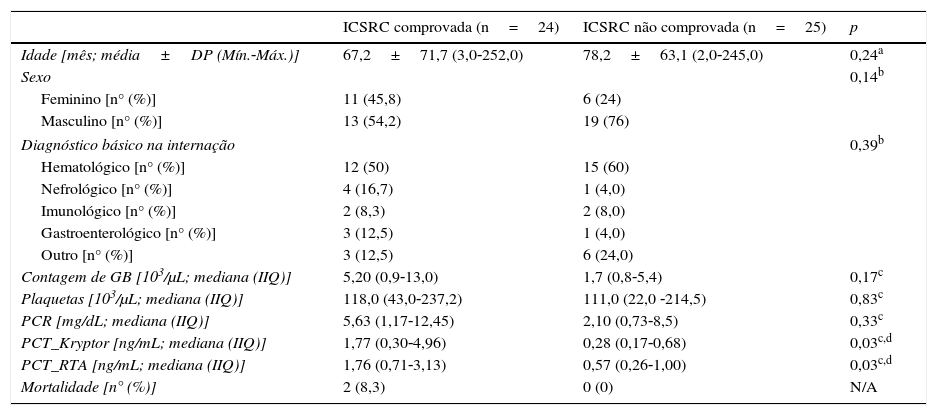
As características demográficas e clínicas dos pacientes estão resumidas na tabela 1. Durante o período do estudo, foram incluídos 49 pacientes (34,7% do sexo feminino, n=17; 65,3% do masculino, n=32) dos 240 leitos na Unidade Pediátrica do Hospital Universitário, Ancara, Turquia, com média de 72,8±66,9 meses (faixa: 2‐252). Nenhuma diferença estatisticamente significativa foi encontrada em termos de idade (p=0,24) e sexo (p=0,14) (tabela 1). As comorbidades que acompanharam a infecção foram as seguintes: 25 (52%) pacientes apresentaram diagnóstico não oncológico, incluindo diarreia crônica, colestase, insuficiência renal, doenças neurológicas que exigem nutrição parenteral total contínua, ao passo que 24 (48%) pacientes apresentaram malignidades/doenças hematológicas ou oncológicas, incluindo leucemia linfoblástica aguda, leucemia mieloide aguda ou tumores do sistema nervoso central (p. ex., ependiromas, tumor neuroectodérmico primitivo) (tabela 1).
Características demográficas e clínicas dos pacientes
| ICSRC comprovada (n=24) | ICSRC não comprovada (n=25) | p | |
|---|---|---|---|
| Idade [mês; média±DP (Mín.‐Máx.)] | 67,2±71,7 (3,0‐252,0) | 78,2±63,1 (2,0‐245,0) | 0,24a |
| Sexo | 0,14b | ||
| Feminino [n° (%)] | 11 (45,8) | 6 (24) | |
| Masculino [n° (%)] | 13 (54,2) | 19 (76) | |
| Diagnóstico básico na internação | 0,39b | ||
| Hematológico [n° (%)] | 12 (50) | 15 (60) | |
| Nefrológico [n° (%)] | 4 (16,7) | 1 (4,0) | |
| Imunológico [n° (%)] | 2 (8,3) | 2 (8,0) | |
| Gastroenterológico [n° (%)] | 3 (12,5) | 1 (4,0) | |
| Outro [n° (%)] | 3 (12,5) | 6 (24,0) | |
| Contagem de GB [103/μL; mediana (IIQ)] | 5,20 (0,9‐13,0) | 1,7 (0,8‐5,4) | 0,17c |
| Plaquetas [103/μL; mediana (IIQ)] | 118,0 (43,0‐237,2) | 111,0 (22,0 ‐214,5) | 0,83c |
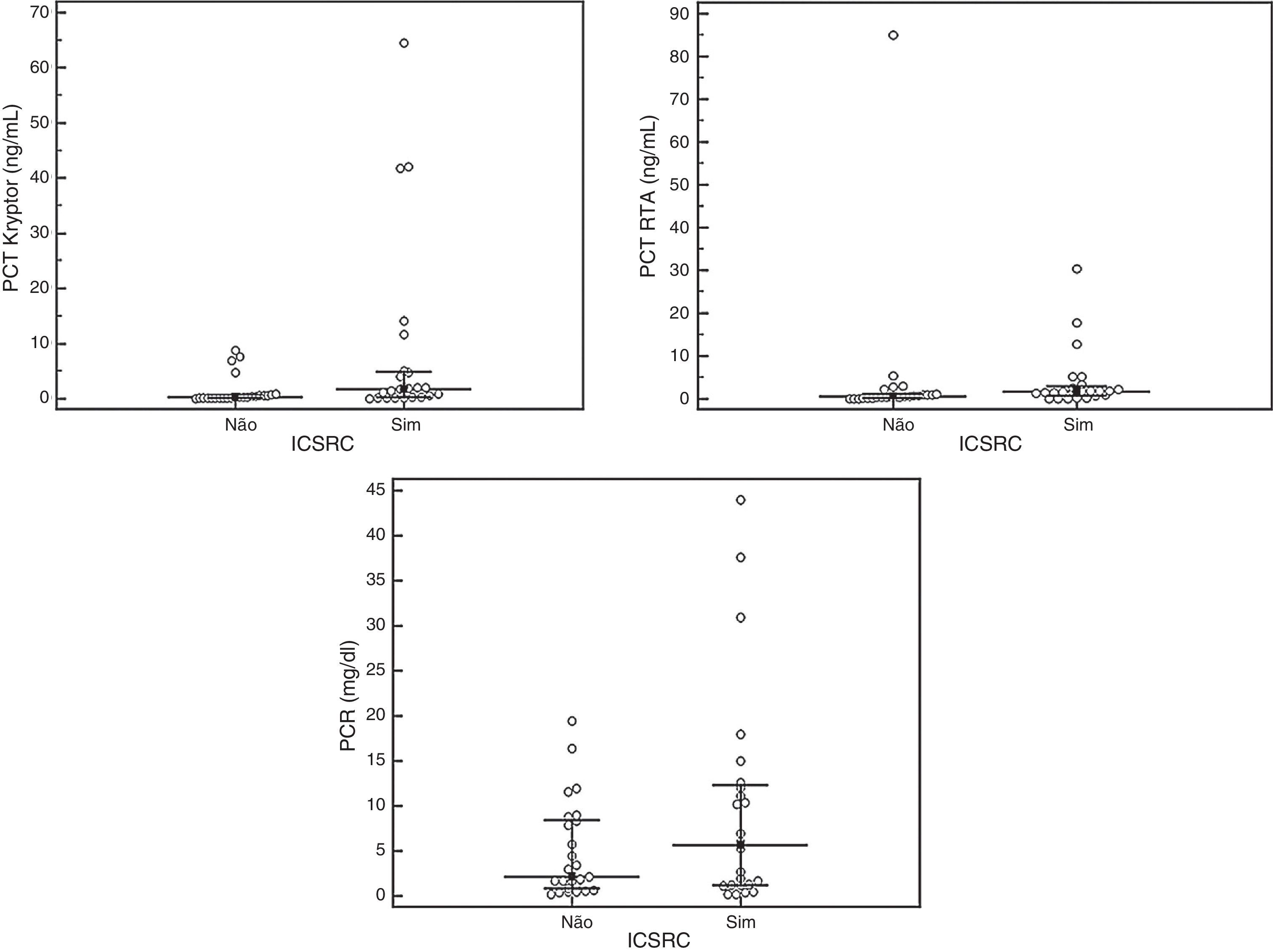
| PCR [mg/dL; mediana (IIQ)] | 5,63 (1,17‐12,45) | 2,10 (0,73‐8,5) | 0,33c |
| PCT_Kryptor [ng/mL; mediana (IIQ)] | 1,77 (0,30‐4,96) | 0,28 (0,17‐0,68) | 0,03c,d |
| PCT_RTA [ng/mL; mediana (IIQ)] | 1,76 (0,71‐3,13) | 0,57 (0,26‐1,00) | 0,03c,d |
| Mortalidade [n° (%)] | 2 (8,3) | 0 (0) | N/A |
GB, glóbulos brancos; PCR, proteína C reativa; PCT, procalcitonina; IIQ, intervalo interquartil; ICSRC, infecção de corrente sanguínea relacionada a cateter; N/A, não aplicável; DP, desvios padrão.
Dentre os 24 pacientes com ICSRC provada, 12 (50%) mostraram bacteremia gram‐positiva, 10 (41,7%) bacteremia gram‐negativa e dois (8,3%) candidemia. Os micro‐organismos considerados responsáveis pela ICSRC foram Staphylococcus epidermidis (n=7), Klebsiella pneumoniae (n=4), Escherichia coli (n=3), Staphylococcus aureus (n=2), Staphylococcus haemolyticus (n=2), Pseudomonas aeruginosa (n=1), Klebsiella oxytoca (n=1), Acinetobacter baumannii (n=1), Enterococcus faecalis (n=1), Candida parapsilosis (n=1) e Candida lusiteniae (n=1). O grupo de pacientes com uma infecção não controlada incluiu um com bacteremia persistente, um com superinfecção e dois que faleceram devido à ICSRC. Os patógenos isolados de pacientes com infecção não controlada foram organismos gram‐negativos, incluindo Escherichia coli (n=1) e Klebsiella oxytoca (n=1) (responsável pelo óbito); os organismos gram‐positivos incluíram Staphylococcus epidermidis (n=1) e Staphylococcus aureus (n=1).
Os valores de PCT‐Kryptor e PCT‐RTA foram significativamente maiores em pacientes com ICSRC comprovada do que naqueles com ICSRC não comprovada (p=0,03 e p=0,03, respectivamente). Os pacientes com ICSRC não apresentaram aumento significativo nos valores de PCR em comparação com pacientes sem ICSRC (p=0,33) (tabela 1). A distribuição dos valores de PCT e PCR de acordo com o grupo de pacientes é apresentada na figura 1. Entre os 24 pacientes com ICSRC, a PCR era significativamente maior entre pacientes com infecção bacteriana gram‐negativa (12,30 [5,65‐32,57]) do que em pacientes com infecção bacteriana gram‐positiva (2,33 [0,40‐9,15], p=0,01). O PCT‐Kryptor também foi significativamente maior entre pacientes com infecção bacteriana gram‐negativa (4,40 [1,69‐19,22]) do que naqueles com infecção bacteriana gram‐positiva (0,32 [0,08‐2,10], p=0,02). Entre os 24 pacientes com ICSRC, aqueles com infecção não controlada não apresentaram aumentos significativos de PCT‐Kryptor, PCT‐RTA e PCR em comparação com pacientes com infecção controlada (p=0,91; 0,48 e 0,14, respectivamente). A concordância dos valores de PCT entre os dispositivos PCT‐Kryptor e PCT‐RTA foi considerada um grau intermediário (Kappa: 0,548).
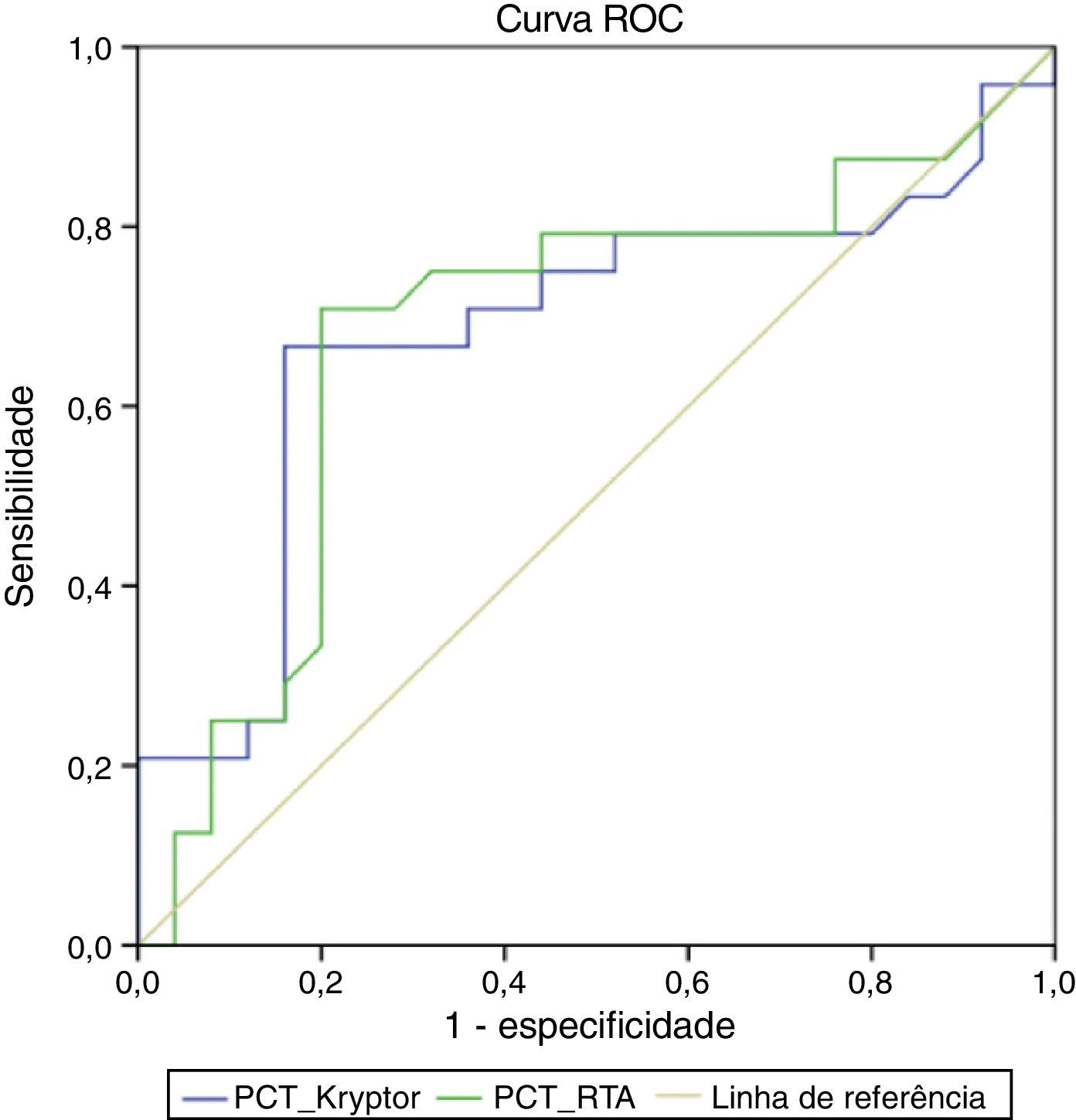
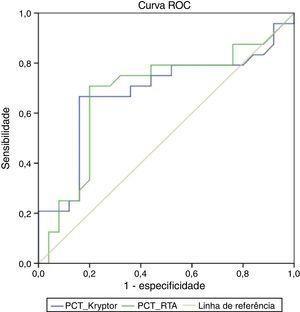
As áreas sob as curvas ROC no diagnóstico de ICSRC foram 0,684 (IC de 95%, 0,526‐0,843; p=0,03) para PCT‐RTA (melhor ponto de corte: 1,18 ng/mL) e 0,683 (IC de 95%, 0,525‐0,842; p=0,03) para PCT‐Kryptor (melhor ponto de corte: 0,86 ng/mL; figura 2). A área sob as curvas ROC no diagnóstico de ICSRC foi 0,581 (IC de 95%, 0,417‐0,745; p=0,33) para PCR. A sensibilidade, especificidade, VPP, VPN e a precisão de PCT‐RTA foram 0,71; 0,80; 0,77; 0,74 e 0,75, respectivamente. A sensibilidade, especificidade, VPP, VPN e a precisão de PCT‐Kryptor foram 0,66; 0,84; 0,80; 0,72 e 0,75, respectivamente.
DiscussãoOs atuais métodos de diagnóstico de ICSRCs levam tempo maior e têm como base técnicas de cultura que exigem 24‐48 horas para confirmar o diagnóstico. Portanto, os parâmetros que diferenciam de forma precisa ICSRC de não ICSRC em um estágio inicial são importantes.17 No presente estudo, a PCT foi considerada um bom marcador de diagnósticos em comparação com GB e PCR. A PCT pode diferenciar pacientes com ICSRC de pacientes com infecções da corrente sanguínea (ICS) de outras fontes. Além disso, no dia da suspeita clínica de infecção, um ponto de corte de 0,86 ng/mL de PCT mostrou diferenciar pacientes com e sem ICSRC. A especificidade do teste foi de 0,84 e o resultado positivo em qualquer paciente poderá ser usado para remover CVCs imediatamente. O ensaio de RTA‐PCT apresentou uma concordância moderada com o método Kryptor estabelecido, com ponto de corte ideal de 1,18 ng/mL. Portanto, essa técnica pode ser considerada uma ferramenta útil em vários ambientes clínicos, embora exija avaliação futura em estudos maiores.
Nossos achados estão de acordo com alguns dos relatos recentes que avaliam o valor diagnóstico de PCT para detecção antecipada de diferentes infecções na unidade de terapia intensiva (UTI).16,18,19 O valor diagnóstico de PCT em ICSRCs também foi avaliado em um estudo de coorte diferente e nossos achados são compatíveis com os relatos.16,17 Contudo, os autores desses relatos não avaliaram especificamente a ICSRC em crianças e uma proporção de seus pacientes sofria de episódios sépticos.
Os biomarcadores de inflamação, como a contagem de GB e os níveis de PCR, também podem ser avaliados para diagnosticar as ICSRCs, apesar de sua especificidade ser menor.20 Vários estudos relataram o valor clínico de PCR no diagnóstico de infecções bacterianas, principalmente a sepse.14,21–23 Além disso, Theodorou et al.16 relataram que a precisão do diagnóstico de PCT em pacientes com ICSRCs é significativamente maior em comparação com a dos GB e da PCR. De acordo com esse relato, não foram observadas diferenças significativas nos níveis de PCR entre pacientes com ou sem ICSRCs.
Na ordem de prevalência, quatro grupos de microrganismos que mais comumente causam ICSRC associada a inserção percutânea são os estafilococos coagulase‐negativos, S. aureus, espécies de candida e bacilos gram‐negativos entéricos.1 De acordo com este relato,1 observou‐se que o agente causador dominante de ICSRC neste estudo foram os estafilococos coagulase‐negativos. Contudo, ao contrário de nossos achados, Theodorou et al.16 relataram que bactérias gram‐negativas foram predominantemente recuperadas de pacientes com ICSRC comprovada e seus pacientes ficaram gravemente doentes com internação prolongada na UTI. De forma compatível com os achados de Chen et al.,17 nossos achados também destacaram que as concentrações de PCT, bem como os níveis de PCR, foram mais elevadas entre pacientes com bacteremia gram‐negativa do que entre aqueles com infecções bacterianas gram‐positivas. Dandona et al.24 e Linscheid et al.25 descreveram que os níveis da PCT sérica poderão ser acentuadamente aumentados por endotoxinas (lipopolissacarídeos) e nosso achado possivelmente poderá ser explicado por essas simulações. Além disso, a maioria das infecções bacterianas gram‐positivas no presente estudo foi causada por estafilococos coagulase‐negativos, um organismo menos virulento do que quaisquer dos gram‐negativos listados. Assim, a determinação do VPN do teste provavelmente será mais significativa que o VPP para iniciar a terapia antimicrobiana empiricamente.
Diversos casos de UTI podem ser empiricamente administrados sem retirada imediata do cateter. Em muitas ocasiões, a espera vigilante é uma abordagem prudente.26 Algumas ICSRCs em pacientes hemodinamicamente estáveis podem ser tratadas in situ com antibióticos e, frequentemente, a bacteremia é curada e o cateter é esterilizado.8,27 Em 20 dos 24 pacientes com ICSRC no presente estudo, a bacteremia foi curada e o cateter foi esterilizado com antimicrobianos adequados, sem remoção. Esse resultado foi especialmente importante em crianças, considerando as razões subjacentes em nosso estudo, incluindo malignidades. Contudo, as bactérias gram‐negativas foram recuperadas de duas das crianças mortas. Ao categorizar os pacientes com infecção controlada ou não controlada neste estudo, embora a PCT ou os GBs e a PCR não tenham sido os biomarcadores discriminadores, os resultados dos níveis de PCT poderão ter sido a primeira oportunidade de remover um cateter durante a espera dos resultados da hemocultura.
Algumas limitações de nosso estudo devem ser destacadas. Primeiro, a amostra populacional era relativamente pequena e heterogênea com relação às condições da doença de base. Portanto, nossos resultados precisam ser confirmados em um conjunto maior e mais homogêneo. Um grupo controle não foi criado neste estudo, mas dois grupos que incluem ICSRC comprovada e ICSRC não comprovada. Por outro lado, uma população controle com infecções de corrente sanguínea, porém sem cateteres centrais, proporcionará um melhor entendimento das infecções relacionadas a cateter e como diferenciá‐las de outras infecções de corrente sanguínea. Contudo, nossos resultados são especificamente importantes devido à escassez de estudos no que diz respeito ao diagnóstico precoce de ICSRC em crianças. Além disso, excluímos os pacientes que tinham qualquer outra infecção e a remoção de possíveis variáveis de confusão pode aumentar a força de nossos achados sobre biomarcadores como ferramentas de diagnóstico e de monitoramento. Segundo, não pudemos fazer a análise sequencial dos biomarcadores infecciosos para entender as alterações longitudinais na concentração de PCT e o momento ideal da PCT para valor prognóstico devido a considerações financeiras.
Concluindo, a PCT poderá ser um biomarcador diagnóstico rápido e útil em caso de suspeita de ICSRC em crianças. O novo ensaio quantitativo automatizado e rápido, PCT‐RTA (RTA, Kocaeli, Turquia), tem alguns benefícios como o tamanho pequeno, fácil implantação em um laboratório e fácil interpretação dos resultados da medida de valores de PCT. Esse ensaio, com sensibilidade e especificidade de 71% e 80%, respectivamente, é um teste imunocromatográfico para obter a detecção quantitativa de PCT e também é fácil de usar em situações de emergência.
FinanciamentoO estudo foi parcialmente financiado pela empresa Dialab Tibbi Urunler ve Ozel Saglik.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Sevilay Karahan (Departamento de Bioestatística, Faculdade de Medicina da Universidade Hacettepe, Ancara, Turquia) pelas análises estatísticas.
Como citar este artigo: Ozsurekci Y, Oktay Arıkan K, Bayhan C, Karadağ‐Öncel E, Emre Aycan A, Gürbüz V, et al. Can procalcitonin be a diagnostic marker for catheter‐related blood stream infection in children? J Pediatr (Rio J). 2016;92:414–20.