To assess bone mineral density (BMD) in children with idiopathic nephrotic syndrome (NS) and normal glomerular filtration rate (GFR).
MethodsCross‐sectional case‐control study carried out on 50 children: 25 cases of NS (16 steroid‐sensitive [SSNS] and nine steroid‐resistant [SRNS] under follow up in the pediatric nephrology unit of Menoufia University Hospital, which is tertiary care center, were compared to 25 healthy controls with matched age and sex. All of the participants were subjected to complete history taking, thorough clinical examination, laboratory investigations (serum creatinine, blood urea nitrogen [BUN], phosphorus [P], total and ionized calcium [Ca], parathyroid hormone [PTH], and alkaline phosphatase [ALP]). Bone mineral density was measured at the lumbar spinal region (L2‐L4) in patients group using dual‐energy X‐ray absorptiometry (DXA).
ResultsTotal and ionized Ca were significantly lower while, serum P, ALP, and PTH were higher in SSNS and SRNS cases than the controls. Osteopenia was documented by DXA scan in 11 patients (44%) and osteoporosis in two patients (8%). Fracture risk was mild in six (24%), moderate in two (8%), and marked in three (12%) of patients.
ConclusionBone mineralization was negatively affected by steroid treatment in children with NS.
Avaliar a densidade mineral óssea (DMO) em crianças com síndrome nefrótica idiopática (SNI) e com taxa de filtração glomerular (TFG) normal.
MétodosO estudo transversal de caso‐controle foi feito com 50 crianças: 25 casos de SNI [16 sensíveis a esteroides (SNSE) e nove resistentes a esteroides (SNRE) com acompanhamento na unidade de nefrologia pediátrica do hospital da Menoufia University, centro de cuidados terciário] foram comparados com 25 controles saudáveis do grupo de controle com idade e sexo equivalentes. Todos os participantes foram submetidos a anamnese completa, exame clínico completo, exames laboratoriais [creatinina sérica, nitrogênio ureico no sangue (BUN), fósforo (P), cálcio (Ca) total e ionizado, paratormônio (PTH) e fosfatase alcalina (ALP)]. A densidade mineral óssea foi mensurada na região da coluna lombar (L2‐L4) no grupo de pacientes com a absorciometria por raios X de dupla energia (DXA).
ResultadosOs níveis de cálcio total e ionizado eram significativamente menores, ao passo que o fósforo sérico, a FA e o PTH eram maiores em casos de SNSE e SNRE do que nos controles. A osteopenia foi documentada pelo exame DXA em 11 pacientes (44%) e a osteoporose em dois (8%). O risco de fratura era leve em seis (24%), moderado em dois (8%) e acentuado em três (12%).
Conclusão: A mineralização dos ossos foi afetada negativamente pelo tratamento com esteroides em crianças com SNI.
A síndrome nefrótica (SN) na infância é definida por proteinúria nefrótica, edema generalizado, hipoalbuminemia e hiperlipidemia com função renal normal.1 A síndrome nefrótica idiopática (SNI) é a doença renal mais frequente nas crianças.2 A SN na infância normalmente segue um curso remitente‐recorrente, normalmente exige cursos recorrentes de glicocorticoides (GC), porém com baixa inflamação sistêmica durante a remissão.3
A deposição de massa óssea começa durante a vida fetal e continua durante a infância e adolescência, estabiliza‐se no início da vida adulta.4 A remodelação óssea, bem como sua maturidade, apresenta variação conforme o sexo durante a infância e adolescência. A doença óssea metabólica (DOM) é caracterizada por mudanças na mineralização do esqueleto devido ao baixo conteúdo mineral ósseo (CMO).5 As crianças podem ser especialmente vulneráveis aos efeitos dos GC sobre a formação óssea que influenciam na massa óssea.6
A prednisona é o tratamento de primeira linha para a SNI para induzir a remissão, evitar recidivas e os efeitos colaterais da doença.7 A administração prolongada da prednisona interfere no crescimento e na mineralização óssea e tem efeitos prejudicais sobre os mecanismos celulares básicos importantes no desenvolvimento e na manutenção da força óssea.7,8 Os esteroides são conhecidos por causar a osteoporose e afetar o CMO e a densidade mineral óssea (DMO) nas crianças.9 Os glicocorticoides têm um efeito supressor sobre a osteoblastogênese na medula óssea, promovem a apoptose de osteoblastos e osteócitos e levam, assim, à redução da formação óssea.10 Há algumas evidências que sugerem que os GCs podem aumentar a reabsorção óssea e a vida útil de osteoclastos pré‐existentes.11 Os glicocorticoides também podem aumentar a eliminação renal e entérica de cálcio e esse cálcio negativo pode, sozinho, levar ao aumento da atividade osteoclástica devido ao hiperparatiroidismo secundário.12
As crianças com SNI apresentam risco de DOM, acompanhada de importantes alterações do metabolismo mineral e ósseo.13
Portanto, trabalhamos com a hipótese de que os pacientes com SN teriam déficits de DMO em comparação com seus pares. Este estudo foi projetado para determinar a DMO em crianças com SNI e com TFG normal.
MétodosEste estudo foi feito com 50 crianças após a aprovação do Comitê de Ética da Faculdade de Medicina da Menoufia University, foi obtido um consentimento por escrito dos responsáveis dos pacientes. As crianças foram divididas em dois grupos:
Grupo IIncluiu 25 crianças entre 1‐15 anos que atendiam aos critérios clínicos de SNI (forte proteinúria>40mg/m2/h, hipoalbuminemia<2,5g/L, hipercolesterolemia>250mg/dL e edema) com função renal normal (filtração glomerular normal de acordo com a fórmula de Schwartz.14 Pacientes com SN secundária com outras doenças não relacionadas à SN que poderiam afetar a saúde óssea e pacientes que receberam medicação prévia para osteoporose ou preparações de vitamina D antes ou durante o estudo foram excluídos.
Todas as crianças com SNI foram tratadas de acordo com o protocolo padrão.14 A terapia inicial consistia em uma dose diária de prednisona a 60mg/m2/dia (no máximo 80mg por dia) por quatro semanas, seguida de 40mg/m2/dia em dias intercalados como dose única por no mínimo quatro semanas. A dose em dias intercalados foi, então, reduzida lentamente e descontinuada nos 1‐2 meses seguintes. Recidivas (proteinúria>40mg/h/m2 por três dias consecutivos após remissão) foram tratadas com 60mg/m2/dia em uma única dose de manhã até a criança entrar em remissão (proteinúria<4mg/m2/h por três dias consecutivos). Foi fornecido aconselhamento alimentar às famílias para que fornecessem a seus filhos uma dieta rica em cálcio, ingestão calórica adequada e ingestão adequada de proteínas (1g/kg/dia) sem adição de sal para limitar a sobrecarga de fluidos. A dose diária de prednisona foi, então, alterada para uma dose em dias alternados como terapia inicial e foi gradualmente reduzida em 4‐8 semanas. Pacientes com SNI foram classificados em três grupos, a depender de sua resposta à terapia com GC: [i] SN esteroide‐dependente: duas recidivas consecutivas durante a terapia com corticosteroides ou dentro de 14 dias após a interrupção da terapia (SNED: 14 pacientes; [ii] SN resistente a esteroides: inexistência de remissão após a dose de 60mg/m2 de prednisona por quatro semanas seguida de três pulsos de metilprednisolona (SNRE: nove pacientes); [iii] Recidivas infrequentes:<quatro vezes em 12 meses (RIF: dois pacientes).14
Grupo IIForam inscritas como grupo controle 25 crianças aparentemente saudáveis de idade e sexo equivalentes. Elas foram escolhidas a partir de uma clínica ambulatorial pediátrica.
Todos os pacientes e controles foram submetidos a anamnese completa, inclusive o tipo de tratamento, sua duração e as datas e o número de recidivas. As doses acumuladas de prednisona que cada paciente recebeu durante a terapia foram calculadas a partir de seus prontuários médicos. Um exame clínico completo, incluindo altura, peso e índice de massa corporal (IMC), foi registrado e traçado nas curvas de desvio padrão da OMS. As investigações do laboratório incluíram creatinina sérica, nitrogênio ureico no sangue (BUN), fósforo e cálcio total e ionizado; o paratormônio (PTH) e a fosfatase alcalina (FA) foram estimados.
A DMO foi medida na região da coluna lombar (L2‐L4) com absorciometria por raios X de dupla energia (DXA) (densitômetro ósseo, Challenger Envision, DMS, Inglaterra). A DMO foi classificada de acordo com Bakr15 com base no escore z de DMO. Os escores foram calculados com a seguinte equação: escore z=[DMO (g/cm3) do paciente ‐ DMO preditivo para a idade e sexo/DP para DMO (idade, sexo e estatura combinados)]. Um paciente era considerado osteopênico se o escore z fosse<‐1,0. Se o escore z fosse ≤ ‐2,5, o paciente era classificado como osteopênico grave (osteoporose). As chances de fratura osteoporótica de<10%, 10%‐19% e>20% foram consideradas de baixo, médio e alto risco de fratura, respectivamente.16
Análise estatísticaOs resultados foram analisados estatisticamente com o software SPSS (versão 17; SPSS Inc., Chicago, IL, EUA). A análise estatística foi feita por meio da análise de variância unidirecional (teste F) com os testes post hoc, t de Student e qui‐quadrado. As correlações foram determinadas pela correlação de Pearson e pela análise de regressão linear. As variáveis contínuas foram apresentadas como média±desvio padrão, ao passo que, para as variáveis categóricas, foram usados números (%). A relevância foi considerada no valor de p<0,05.
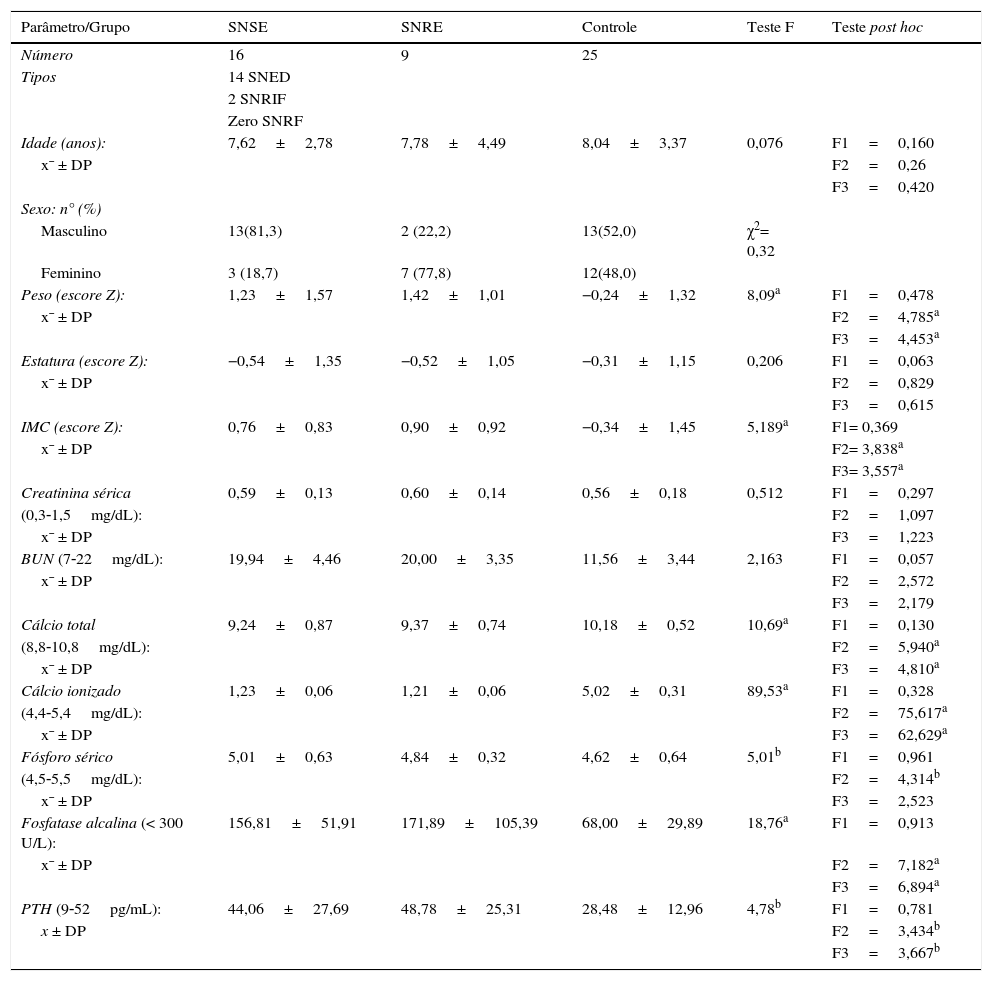
ResultadosAs características demográficas e antropométricas dos participantes com SNSE, SNRE e do grupo de controle foram resumidas na tabela 1. O peso e os escores z de IMC foram significativamente maiores nos pacientes com SNSE e SNRE do que nos controles, sem diferença significativa entre eles quanto aos escores z de estatura. Em termos de marcadores séricos da remodelação óssea, o cálcio sérico (total e ionizado) era significativamente menor, ao passo que o fósforo sérico e a fosfatase alcalina eram significativamente maiores nos pacientes com SNSE e SNRE do que nos controles. Dores ósseas foram constatadas em oito pacientes (32%).
Dados demográficos e clínicos dos grupos estudados
| Parâmetro/Grupo | SNSE | SNRE | Controle | Teste F | Teste post hoc |
|---|---|---|---|---|---|
| Número | 16 | 9 | 25 | ||
| Tipos | 14 SNED | ||||
| 2 SNRIF | |||||
| Zero SNRF | |||||
| Idade (anos): | 7,62±2,78 | 7,78±4,49 | 8,04±3,37 | 0,076 | F1=0,160 |
| x¯ ± DP | F2=0,26 | ||||
| F3=0,420 | |||||
| Sexo: n° (%) | |||||
| Masculino | 13(81,3) | 2 (22,2) | 13(52,0) | χ2= 0,32 | |
| Feminino | 3 (18,7) | 7 (77,8) | 12(48,0) | ||
| Peso (escore Z): | 1,23±1,57 | 1,42±1,01 | −0,24±1,32 | 8,09a | F1=0,478 |
| x¯ ± DP | F2=4,785a | ||||
| F3=4,453a | |||||
| Estatura (escore Z): | −0,54±1,35 | −0,52±1,05 | −0,31±1,15 | 0,206 | F1=0,063 |
| x¯ ± DP | F2=0,829 | ||||
| F3=0,615 | |||||
| IMC (escore Z): | 0,76±0,83 | 0,90±0,92 | −0,34±1,45 | 5,189a | F1= 0,369 |
| x¯ ± DP | F2= 3,838a | ||||
| F3= 3,557a | |||||
| Creatinina sérica | 0,59±0,13 | 0,60±0,14 | 0,56±0,18 | 0,512 | F1=0,297 |
| (0,3‐1,5mg/dL): | F2=1,097 | ||||
| x¯ ± DP | F3=1,223 | ||||
| BUN (7‐22mg/dL): | 19,94±4,46 | 20,00±3,35 | 11,56±3,44 | 2,163 | F1=0,057 |
| x¯ ± DP | F2=2,572 | ||||
| F3=2,179 | |||||
| Cálcio total | 9,24±0,87 | 9,37±0,74 | 10,18±0,52 | 10,69a | F1=0,130 |
| (8,8‐10,8mg/dL): | F2=5,940a | ||||
| x¯ ± DP | F3=4,810a | ||||
| Cálcio ionizado | 1,23±0,06 | 1,21±0,06 | 5,02±0,31 | 89,53a | F1=0,328 |
| (4,4‐5,4mg/dL): | F2=75,617a | ||||
| x¯ ± DP | F3=62,629a | ||||
| Fósforo sérico | 5,01±0,63 | 4,84±0,32 | 4,62±0,64 | 5,01b | F1=0,961 |
| (4,5‐5,5mg/dL): | F2=4,314b | ||||
| x¯ ± DP | F3=2,523 | ||||
| Fosfatase alcalina (< 300 U/L): | 156,81±51,91 | 171,89±105,39 | 68,00±29,89 | 18,76a | F1=0,913 |
| x¯ ± DP | F2=7,182a | ||||
| F3=6,894a | |||||
| PTH (9‐52pg/mL): | 44,06±27,69 | 48,78±25,31 | 28,48±12,96 | 4,78b | F1=0,781 |
| x ± DP | F2=3,434b | ||||
| F3=3,667b |
BUN, nitrogênio ureico no sangue; F, teste de análise de variância unidirecional; F1, diferença entre SNSE e SNRE; F2, diferença entre SNSE e controle; F3, diferença entre SNRE e controle IMC, índice de massa corporal; PTH, paratormônio; SNRE, síndrome nefrótica resistente a esteroides; SNSE, síndrome nefrótica sensível a esteroides; χ2, teste qui‐quadrado; x¯ ± DP, média±desvio padrão.
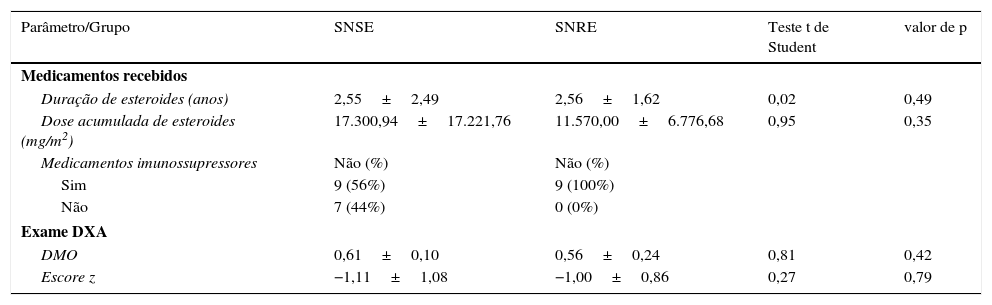
Nenhuma diferença estatística significativa foi encontrada nos pacientes com SNSE e SNRE com relação aos medicamentos recebidos e às medições de DXA (tabela 2); 72% dos pacientes com SNSE receberam medicamentos imunossupressores da seguinte maneira: 48% terapia com ciclosporina, 4% com micofenolato de mofetila, 8% com ciclofosfamida e 12% com imunossupressores misturados.
Medicamento recebido e exame DXA no grupo de pacientes
| Parâmetro/Grupo | SNSE | SNRE | Teste t de Student | valor de p |
|---|---|---|---|---|
| Medicamentos recebidos | ||||
| Duração de esteroides (anos) | 2,55±2,49 | 2,56±1,62 | 0,02 | 0,49 |
| Dose acumulada de esteroides (mg/m2) | 17.300,94±17.221,76 | 11.570,00±6.776,68 | 0,95 | 0,35 |
| Medicamentos imunossupressores | Não (%) | Não (%) | ||
| Sim | 9 (56%) | 9 (100%) | ||
| Não | 7 (44%) | 0 (0%) | ||
| Exame DXA | ||||
| DMO | 0,61±0,10 | 0,56±0,24 | 0,81 | 0,42 |
| Escore z | −1,11±1,08 | −1,00±0,86 | 0,27 | 0,79 |
DMO, densidade mineral óssea; DXA, absorciometria por raios X de dupla energia; SNRE, síndrome nefrótica resistente a esteroides; SNSE, síndrome nefrótica sensível a esteroides.
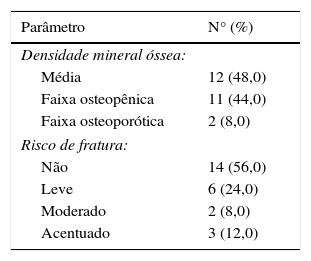
A densidade mineral óssea (DMO) e o risco de fratura entre os participantes com síndrome nefrótica são apresentados na tabela 3. A osteopenia foi documentada pelo exame DXA em 11 pacientes (44%) (sete SNED, quatro SNRE) e a osteoporose em dois pacientes (8%) (dois SNED). O risco de fratura era leve em seis (24%) (um SNRIF, dois SNED, três SNRE), moderado em dois (8%) (um SNED, um SNRE) e acentuado em três (12%) (dois SNED, um SNRE).
Uma correlação estatística significativa foi observada entre os escores z de DMO e a idade dos pacientes (r=0,43; p<0,05), escore Z de peso (r=0,56; p<0,001), escore Z de estatura (r=0,57; p<0,05), duração (r=‐0,46; p<0,05) e dose acumulada da terapia de GCs (r=‐0,88; p<0,001). As análises de regressão linear na tabela 4 mostram que a dose acumulada de esteroides foi o único fator de risco independente significativo.
Coeficientes de regressão linear não padronizados e padronizados das correlações entre o escore Z e alguns parâmetros estudados
| Parâmetro | Coeficientes não padronizados B | Coeficientes padronizados B | valor de p |
|---|---|---|---|
| Idade (anos) | 0,06 | 0,19 | > 0,05 |
| IMC | 0,103 | 0,268 | > 0,05 |
| Duração de esteroides (anos) | 0,05 | 0,11 | > 0,05 |
| Dose acumulada de esteroides (mg/m2) | 0,12 | 0,23 | < 0,05a |
IMC, índice de massa corporal.
Apesar de os GCs serem o tratamento preferencial para crianças com SN idiopática, os efeitos colaterais de obesidade e mineralização óssea devem ser considerados.7 Neste estudo, as análises mostraram claramente um impacto dos GCs sobre o peso corporal e o IMC nos participantes com síndrome nefrótica. Como esperado, os pacientes com SNSE e SNED apresentaram escores z de peso e IMC significativamente maiores do que os controles, porém com diferença estatística insignificante entre SNSE e SNED. Resultados semelhantes foram relatados por Lestari et al.17 e Ribeiro et al.7 em suas análises da obesidade na síndrome nefrótica sensível a esteroides e esteroide‐dependente. O uso de doses elevadas e de longo prazo de esteroides leva à ingestão elevada de alimentos e ao gasto inibido de energia por meio do estímulo do neuropeptídeo‐Y e da liberação inibida do hormônio liberador de corticotrofina. O processo desencadeia um processo anabólico e leva à obesidade.14 A hipocalcemia em pacientes com a SN relatada neste estudo estava em linha com Koşan et al.18 Os GCs causam hipocalcemia ao reduzir a adsorção de cálcio do intestino e dos rins.7
No entanto, alguns estudos relataram níveis normais de cálcio sérico em crianças com SN devido ao PTH elevado.19
Havia níveis mais elevados significativos de fósforo sérico, ALP e PTH nos pacientes com SN do que nos controles. Esses resultados estão de acordo com Pańczyk‐Tomaszewska et al.19 e Esmaeeili et al.20 Koşan et al.18 sugeriram que os GC afetam indiretamente os ossos por meio da redução da absorção intestinal de cálcio e do aumento das perdas de cálcio pela urina. O hiperparatiroidismo relatado neste estudo ocorreu provavelmente devido à hipocalcemia induzida pelos GCs; os níveis elevados de PTH induziram a reabsorção de cálcio dos ossos, conforme mencionado por Aceto et al.21 A FA específica do osso, uma das isoenzimas produzida pelo osteoblasto e boa marcadora de formação óssea,22 estava mais elevada em nossos pacientes do que em crianças saudáveis. Seu aumento durante a terapia com GCs em crianças com SN também foi constatado por Koşan et al.18 Essa elevação pode estar relacionada ao aumento da remodelação óssea e à melhoria da proteinúria massiva.
Este estudo relatou o efeito adverso dos GCs sobre a DMO; a terapia com GCs foi associada à diminuição do escore Z da DMO, à osteoporose e ao aumento do risco de fratura em crianças com síndrome nefrótica e diferença estatística significativa entre o grupo SNSE e SNRE. De fato, foi registrada a correlação linear entre a dose acumulada de GCs e a DMO. Nossos resultados estavam de acordo com aqueles relatados por Pańczyk‐Tomaszewska et al.19 Eles concluíram que crianças com SN tratadas com corticosteroides correm o risco de perda de massa óssea. Além disso, Aceto et al.21 mostraram que o escore Z de DMO reduzido por GCs no grupo SNSE e o escore Z da DMO estão significativamente correlacionados com a dose total de prednisona.
Canalis23 elucidou que os corticosteroides suprimem a diferenciação de osteoblastos e aprimoram a apoptose dos osteoblastos maduros, o que resulta na redução da formação óssea e na perda de DMO. Também foi relatado que a terapia com esteroides causa osteoporose ou aumenta a osteoporose pré‐existente e leva a fraturas patológicas.24 Basiratnia et al.25 concluíram que a perda de massa óssea ocorre em alguns pacientes com síndrome nefrótica esteroide‐dependente, principalmente naqueles com dose acumulada de esteroides mais alta; a dose acumulada mais alta foi associada ao maior consumo de esteroides e, consequentemente, à maior perda de massa óssea.
Concluímos que a osteopenia, avaliada pela DXA, era frequente em crianças com SN, principalmente naquelas em que foram administradas doses mais altas de esteroides (SNED ou SNRE). A mineralização dos ossos foi afetada negativamente pelo tratamento com esteroides em crianças com SN. Este estudo teve algumas limitações, como o pequeno número de pacientes e a curta duração disponível para o estudo. Portanto, recomendamos mais estudos com tamanho maior de amostra e maior duração. A avaliação regular da DMO deve ser feita em crianças com SN e deve ser planejada uma abordagem terapêutica adequada.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Prof. Mohamed Hamed Bahbah, fundador e chefe da Unidade de Nefrologia Pediátrica da Menoufia University, no Egito.
Como citar este artigo: El‐Mashad GM, El‐Hawy MA, El‐Hefnawy SM, Mohamed SM. Bone mineral density in children with idiopathic nephrotic syndrome. J Pediatr (Rio J). 2017;93:142–7.