To investigate the association between serum uric acid concentration according to the presence or absence of non-alcoholic fatty liver disease (NAFLD) and/or metabolic syndrome (MS) in overweight or obese children and adolescents.
MethodsThis was a cross-sectional study conducted from April of 2009 to March of 2010, including 129 children and adolescents treated at the Center for Childhood Obesity. Anthropometric data, blood pressure measurements, and laboratory test results were obtained, and NAFLD diagnosis was made by ultrasound. The diagnosis of MS was made using the criteria of the National Cholesterol Education Program/Adult Treatment Panel III, adapted to age range. The chi-squared test or or Fisher's test were used to evaluate the association of uric acid with the groups, with a 95% confidence interval. One- way analysis of variance (ANOVA) was used for comparison of means. Multiple logistic regression was used for adjustment of variables. The data were analyzed with the Statistical Package for Social Sciences (SPSS), release 17.
ResultsHigh levels of uric acid were significantly associated with adolescence, MS, and systolic blood pressure. The highest quartile of uric acid showed significantly higher values of body mass index, waist circumference, systolic blood pressure, diastolic blood pressure, triglycerides, total cholesterol, and homeostatic model assessment index (HOMA-IR), and lower mean values of HDL cholesterol. In the final model, only age range and the presence of MS remained associated with uric acid levels.
ConclusionsHigh levels of uric acid were associated with MS and adolescence, which was not observed with NAFLD.
Verificar a relação entre a concentração de ácido úrico sérico de acordo com a presença ou não de esteatose hepática não alcoólica e/ou síndrome metabólica (SM) em crianças e adolescentes com sobrepeso ou obesidade.
MétodosEstudo transversal desenvolvido no período de abril/2009 a março/2010, incluindo 129 crianças e adolescentes atendidos no Centro de Obesidade Infantil. Foi realizada antropometria, aferição da pressão arterial, dosagem dos exames laboratoriais e o diagnóstico de esteatose hepática por exame ultrassonográfico. Para o diagnóstico de SM, foram utilizados os critérios da National Cholesterol Education Program/Adult Treatment Panel III adaptados para faixa etária. Para avaliação da associação do ácido úrico com os grupos, foi realizado o teste do Qui-quadrado ou Fisher, adotando-se o intervalo de confiança de 95%. Para comparação de médias, utilizou-se o ANOVA One Way. Para o ajuste das variáveis foi utilizada a regressão logística múltipla. Os dados foram processados no SPSS versão 17.
ResultadosNíveis elevados de ácido úrico associaram-se significativamente à adoles- cência, SM e pressão arterial sistólica. O maior quartil de ácido úrico apresentou valores médios significativamente mais elevados de índice de massa corpórea, circunferência abdominal, pressão arterial sistólica, pressão arterial diastólica, triglicerídeos, colesterol total e HOMA-IR, e menor média do colesterol HDL. No modelo final só permaneceram associadas aos níveis de ácido úrico a faixa etária e a presença de síndrome metabólica.
ConclusõesNíveis elevados de ácido úrico estiveram associados à síndrome metabólica e à adolescência, o que não foi observado com a esteatose hepática.
O ácido úrico em concentrações plasmáticas usuais tem sido conhecido por exercer efeito neuroprotetor, agindo como um destruidor de radicais livres; no entanto, vários estudos observacionais indicam que altos níveis de ácido úrico sérico associam-se ao risco de doenças cardiovascu- lares, podendo ser útil na avaliação do risco cardiovascular individual. Além disso, altos níveis de ácido úrico também têm sido associados com resistência insulínica (RI), diabe- tes mellitus 2 (DMT2) e síndrome metabólica (SM).1,2
Dentre estas alterações cardiometabólicas, a SM tem merecido destaque, pois representa um conjunto de fato- res de risco, que consiste em alterações do metabolismo dos glicídios – hiperinsulinemia, resistência à insulina, into- lerância à glicose ou diabetes mellitus tipo 2 (DM2); alte- rações do metabolismo dos lipídeos – aumento de triglice- rídeos e/ou diminuição de colesterol ligado à lipoproteína de densidade alta (HDL-colesterol); obesidade abdominal; aumento da pressão arterial.3
A expressão hepática da síndrome metabólica é a doença hepática gordurosa não alcoólica (DHGNA), que é caracte- rizada pela deposição de gordura nos hepatócitos de indiví- duos com pouca ou nenhuma ingestão de álcool.4 Em estudo realizado com 102 adultos com diagnóstico de diabetes, concluiu-se que quase metade dos pacientes apresentou DHGNA, os quais tiveram IMC e ácido úrico mais elevados do que os indivíduos sem DHGNA.5
Apesar das evidências de que o ácido úrico é considera- do fator de risco cardiometabólico,6 não há referência na literatura a respeito da relação entre esta variável bioquí- mica e a esteatose na população pediátrica, especialmente entre obesos ou com sobrepeso. Desta forma, o presente estudo objetiva verificar a relação entre a concentração de ácido úrico sérico de acordo com a presença ou não de esteatose hepática não alcoólica e/ou síndrome metabólica em crianças e adolescentes com sobrepeso ou obesidade.
2MétodosEstudo transversal, com abordagem quantitativa, realizado entre julho/2009 e março/2010, como parte de um projeto maior intitulado “Prevalência de fatores de risco cardio- metabólicos entre crianças e adolescentes obesos ou com sobrepeso” aprovado no Comitê de Ética em Pesquisa da Universidade Estadual da Paraíba sob o número de processo n°0040.0.133.000-08.
A amostra foi, por conveniência, envolvendo crianças e adolescentes entre dois e 18 anos com sobrepeso ou obe- sidade que foram encaminhados pelas equipes de saúde ao Centro de Obesidade Infantil (COI) implantado no Instituto de Saúde Elpídio de Almeida (ISEA), situado em Campina Grande-PB, através da divulgação da pesquisa nas Unidades Básicas de Saúde, pela secretaria de saúde deste mesmo município. O COI é formado por pesquisadores e equipe multiprofissional, composta por endocrinologistas, nutri- cionistas, psicóloga, enfermeira, farmacêuticos, assistente social e preparador físico.
Foram avaliados nesse período 131 indivíduos. Excluíram- se aqueles que, no momento da coleta de dados, fossem portadores de alguma doença crônica, como hipertensão secundária, diabetes tipo 1, diagnóstico de doença hepá- tica ou processo inflamatório, etilismo, tabagismo ou que estivessem em uso de medicamentos que interferissem no metabolismo glicídico ou lipídico, como o corticoide. Dois indivíduos foram excluídos por uso de corticoide, perfazen- do, no final, um total de 129 indivíduos avaliados.
Após o esclarecimento dos objetivos, métodos e condutas a serem seguidos, os pais ou responsáveis que concordaram em participar da pesquisa assinaram o Termo de Consenti- mento Livre e Esclarecido.
Foram obtidas informações sobre questões socioeconô- micas, história pessoal e familiar; aferidas as medidas antropométricas por discentes previamente treinados; e agendados os exames laboratoriais e ultrassonográfico.
Foram realizadas duas medidas dos dados antropométri- cos (peso, estatura e circunferência abdominal) no mesmo dia, sendo considerado o valor médio das duas aferições.
Para a classificação do estado nutricional, utilizou-se os softwares WHO Anthro (para crianças abaixo de cinco anos) e WHO AnthroPlus (≥ 5 anos), obtendo-se o escore-z refe- rente ao índice de massa corpórea (IMC) para idade.
Para crianças menores de cinco anos, recomenda-se a uti- lização da referência internacional da Organização Mundial de Saúde (OMS) publicada em 2006, classificando-os em: risco para sobrepeso (IMC > escore-z +1 e ≤ escore z +2), sobrepeso (IMC > escore-z +2 e ≤ escore z +3) e obesidade (IMC > escore-z +3). Para crianças de cinco anos a 19 anos, recomenda-se o uso da referência publicada pela OMS em 2007, considerando-se as seguintes categorias: sobrepeso (IMC > escore-z +1 e ≤ escore-z +2), obesidade (IMC > escore-z+2 e ≤ escore-z +3) e obesidade grave (IMC > escore-z +3).7 Para análise estatística, o estado nutricional foi categoriza- do em dois grupos, sendo considerado, nos menores de cinco anos, sobrepeso aqueles com IMC > escore-z +1 e ≤ escore-z +3 e obesidade, IMC > escore-z +3, e nos maiores ou igual a cinco anos, sobrepeso aqueles que estavam com o IMC ≥ escore-z +1 e < escore-z +2 e obesidade, IMC ≥ escore-z + 2.
A circunferência abdominal (CA) foi avaliada com fita métrica inelástica no ponto médio entre a borda superior da crista ilíaca e o último rebordo costal. Valores acima do percentil 90 foram considerados aumentados. No entanto, meninas com CA ≥ 88cm e meninos com CA ≥ 102cm já são considerados alterados independentemente do percentil.8
Foram realizadas três medidas da pressão arterial com intervalo aproximado de dois minutos, de acordo com o méto- do estabelecido nas V Diretrizes Brasileiras de Hipertensão Arterial.9 A média das duas últimas medidas foi considerada como as pressões sistólica (PAS) e diastólica (PAD).
O diagnóstico de esteatose baseou-se no resultado da ultrassonografia de abdome superior, realizado no Hospital Universitário Alcides Carneiro (HUAC), por um único médico radiologista, sem o conhecimento prévio de dados clíni- cos e resultados dos exames laboratoriais. O equipamento utilizado foi da marca MedisonSonoAce 8000EX Prime com transdutor convexo multifrequencial de 5 MHz. As alte- rações do parênquima hepático foram classificadas como normal, esteatose difusa leve, moderada e grave.10 Essa classificação utiliza como parâmetros a ecogenicidade hepática em comparação com o córtex renal, a intensidade de penetração do eco no parênquima hepático, a visibili- dade diafragmática e a ecogenicidade das estruturas vas- culares hepáticas.11
A coleta sanguínea foi realizada após jejum de 10 a 12 horas, no Laboratório de Análises Clínicas da Universidade Estadual da Paraíba (LAC/UEPB).
A mensuração do ácido úrico, HDL-c, triglicerídeos (TG) e glicemia foram avaliados através do método colorimétrico enzimático, em equipamento automático (Modelo BioSys- tems 310), de acordo com as recomendações do fabricante do kit Labtest®. A insulina foi mensurada através do méto- do de quimioluminescência, em equipamento automatizado IMMULITE 1000 (SIEMENS®). Considerou-se hiperuricemia valores superiores a 5,5 mg/dL.12
Como critério para diagnóstico da resistência insulínica (RI), foi utilizado o índice Homeostatic model assessment (HOMA- IR). Como ponto de corte, utilizou-se HOMA-IR ≥ 2,5.13
O diagnóstico da SM foi realizado através dos critérios recomendados pela National Cholesterol Education Pro- gram/Adult Treatment Panel III14 adaptados para faixa etária que considera a presença de, pelo menos, três dos seguintes itens: CA acima ou no percentil 90 para sexo, idade e raça; triglicerídeos ≥ 130 mg/dL e/ou HDL-c < 45 mg/dL, glicemia de jejum ≥100mg/dL, pressão sistólica e/ou diastólica acima do percentil 90 para o sexo, estatura e idade. Os pontos de corte para TG, HDL-c e glicemia de jejum seguiram os valores recomendados na I Diretriz de Prevenção da Aterosclerose na Infância e Adolescência.15
Foram considerados os seguintes grupos, de acordo com a presença e/ou ausência da SM e esteatose hepática: G1 – presença de SM e esteatose; G2 – presença de SM sem esteatose; G3 – ausência de SM e presença de esteatose; G4 – ausência de SM e de esteatose.
Os dados foram apresentados através de proporções, médias e desvios-padrão (DP). Após realização do teste de Kolmogorov-smirnoff para averiguação da normalidade, foi verificada a associação dos níveis de ácido úrico de acordo com sexo, faixa etária, cor, estado nutricional, CA, PAS, PAD, TG, glicemia de jejum, RI, SM e esteatose hepática através do teste do Qui-quadrado de Pearson ou teste exato de Fisher, quando necessário, sendo descritos intervalo de confiança (IC 95%) e razão de prevalência (RP). Já para comparação das médias dos componentes da SM de acordo com os quartis do ácido úrico adotou-se o teste de variância (ANOVA-oneway) e, quando necessário, o teste post hoc de Bonferroni.
Para o ajuste das variáveis foi utilizada a regressão logís- tica múltipla, cujo critério definido para a inclusão das variáveis foi a associação com a variável dependente na análise bivariada com um valor de “p” inferior a 0,20. As variáveis foram incluídas na análise de regressão pelo méto- do enter, de acordo com o valor decrescente da odds ratio. Como medida de qualidade de ajuste dos modelos de regres-são logística foi utilizado o teste de Hosmer e Lemeshow, no qual um p ≥ 0,05 indica que o modelo está ajustado.
Todas as análises foram bicaudais e realizadas com a versão 17.0 do programa SPSS (SPSS Inc, Chicago, EUA), e foi considerado o nível de significância de 5%.
3ResultadosDas 129 crianças e adolescentes avaliados, 62,8% (81/129) eram do sexo feminino e 65,9% (85/129) não brancos. A média de idade foi 11,27 (DP = ±3,72, e a distribuição etá- ria indicou que 61,4% (86/129) eram adolescentes (10 a 18 anos). Na caracterização socioeconômica, 56,6% (69/122) tinham renda familiar correspondente a, no máximo, dois salários mínimos. No que se refere à escolaridade materna, 57,5% (73/127) haviam concluído o ensino médio.
A média de ácido úrico encontrada foi 4,191 mg/dL (DP = ± 2,32). A hiperuricemia foi observada em 12,4% (16/129) dos avaliados, a SM em 49,6% (64/129) e a RI foi diagnos- ticada em 44,2% (57/129). Já a esteatose hepática não alcoólica esteve presente em 28,7% (37/129) das crianças e adolescentes.
O HDL-c baixo esteve presente em 85,3% (110/129) dos avaliados, e 39,5% (51/129) apresentaram hipertrigliceride- mia. A hiperglicemia foi observada em apenas 0,8% (1/129) dos avaliados. A PAS esteve elevada em 34,1% (44/129) e a PAD em 64,3% (83/129).
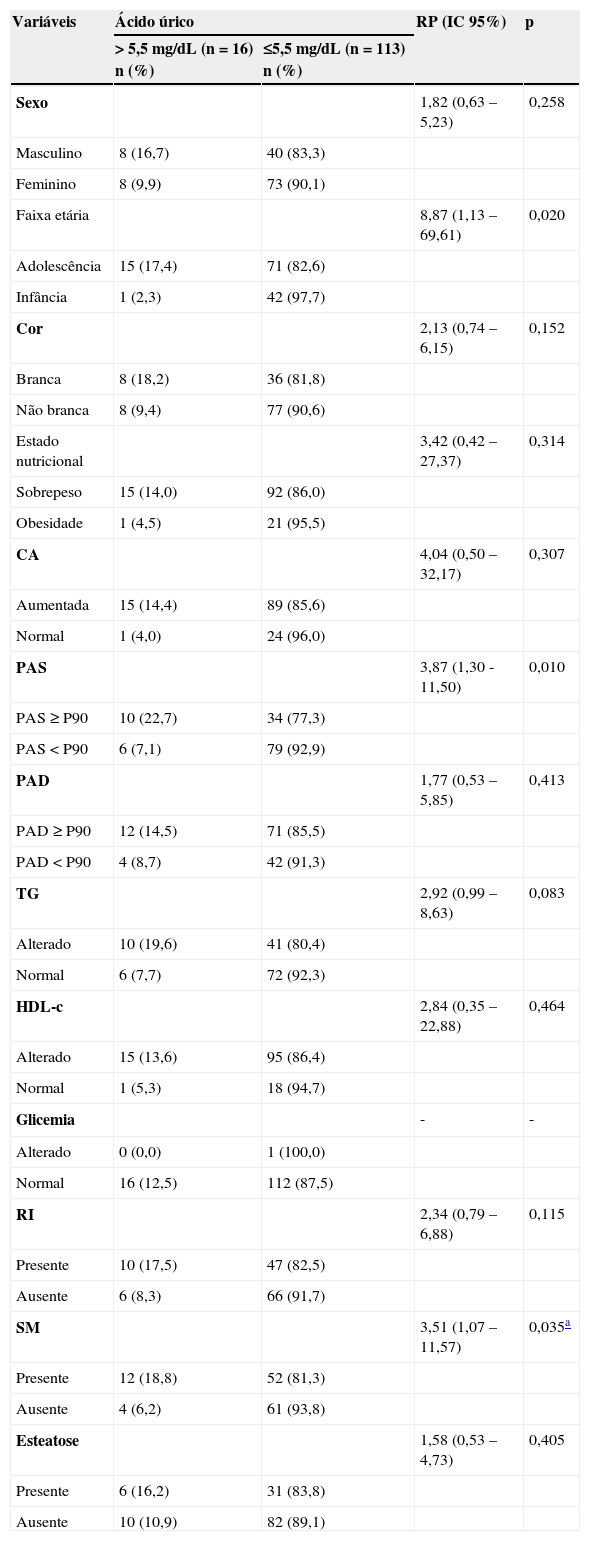
Na tabela 1, foi verificado que valores superiores de ácido úrico associaram-se significativamente à adolescência, PAS alterada, hipertrigliceridemia e SM. Quando se relacionou os níveis de ácido úrico com a presença de esteatose não foi observada significância. A chance de apresentar hipe- ruricemia foi maior nos seguintes grupos: adolescência (RP = 8,87), PAS elevada (RP = 3,87) e naqueles com SM (RP = 3,51).
Variáveis sociais, antropométricas e clínico-laboratoriais de acordo com os níveis séricos de ácido úrico em 129 crianças e adolescentes com sobrepeso ou obesidade. Centro de Obesidade Infantil, ISEA, Campina Grande-PB, 2009-2010.
| Variáveis | Ácido úrico | RP (IC 95%) | p | |
|---|---|---|---|---|
| > 5,5 mg/dL (n = 16) n (%) | ≤5,5 mg/dL (n = 113) n (%) | |||
| Sexo | 1,82 (0,63 – 5,23) | 0,258 | ||
| Masculino | 8 (16,7) | 40 (83,3) | ||
| Feminino | 8 (9,9) | 73 (90,1) | ||
| Faixa etária | 8,87 (1,13 – 69,61) | 0,020 | ||
| Adolescência | 15 (17,4) | 71 (82,6) | ||
| Infância | 1 (2,3) | 42 (97,7) | ||
| Cor | 2,13 (0,74 – 6,15) | 0,152 | ||
| Branca | 8 (18,2) | 36 (81,8) | ||
| Não branca | 8 (9,4) | 77 (90,6) | ||
| Estado nutricional | 3,42 (0,42 – 27,37) | 0,314 | ||
| Sobrepeso | 15 (14,0) | 92 (86,0) | ||
| Obesidade | 1 (4,5) | 21 (95,5) | ||
| CA | 4,04 (0,50 – 32,17) | 0,307 | ||
| Aumentada | 15 (14,4) | 89 (85,6) | ||
| Normal | 1 (4,0) | 24 (96,0) | ||
| PAS | 3,87 (1,30 -11,50) | 0,010 | ||
| PAS ≥ P90 | 10 (22,7) | 34 (77,3) | ||
| PAS < P90 | 6 (7,1) | 79 (92,9) | ||
| PAD | 1,77 (0,53 – 5,85) | 0,413 | ||
| PAD ≥ P90 | 12 (14,5) | 71 (85,5) | ||
| PAD < P90 | 4 (8,7) | 42 (91,3) | ||
| TG | 2,92 (0,99 – 8,63) | 0,083 | ||
| Alterado | 10 (19,6) | 41 (80,4) | ||
| Normal | 6 (7,7) | 72 (92,3) | ||
| HDL-c | 2,84 (0,35 – 22,88) | 0,464 | ||
| Alterado | 15 (13,6) | 95 (86,4) | ||
| Normal | 1 (5,3) | 18 (94,7) | ||
| Glicemia | - | - | ||
| Alterado | 0 (0,0) | 1 (100,0) | ||
| Normal | 16 (12,5) | 112 (87,5) | ||
| RI | 2,34 (0,79 – 6,88) | 0,115 | ||
| Presente | 10 (17,5) | 47 (82,5) | ||
| Ausente | 6 (8,3) | 66 (91,7) | ||
| SM | 3,51 (1,07 – 11,57) | 0,035a | ||
| Presente | 12 (18,8) | 52 (81,3) | ||
| Ausente | 4 (6,2) | 61 (93,8) | ||
| Esteatose | 1,58 (0,53 – 4,73) | 0,405 | ||
| Presente | 6 (16,2) | 31 (83,8) | ||
| Ausente | 10 (10,9) | 82 (89,1) | ||
CA, circunferência abdominal; HDL–c, high-density lipoprotein; IC, intervalo de confiança; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; RI, resistência insulínica; RP, razão de prevalência; SM, síndrome metabólica; TG, triglicerídeos.
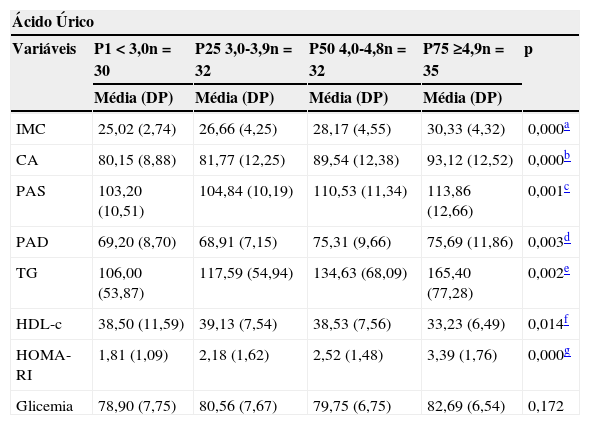
Os quartis de ácido úrico encontrados foram: < 3,0; 3,0- 3,9; 4,0-4,8 e ≥ 4,9. Na tabela 2 observa-se que o grupo cons- tituído pelos indivíduos do quarto quartil (percentil acima de 75 para os valores de ácido úrico) apresentou valores médios significativamente mais elevados de IMC, CA, PAS, PAD, TG e HOMA-RI e menor média de HDL-c (tabela 2).
Valores médios de IMC, glicemia, CA, PAS, PAD e HOMA- RI de acordo com os quartis de ácido úrico de 129 crianças e adolescentes com sobrepeso ou obesidade. Centro de Obesidade Infantil, ISEA, Campina Grande-PB, 2009-2010.
| Ácido Úrico | |||||
|---|---|---|---|---|---|
| Variáveis | P1 < 3,0n = 30 | P25 3,0-3,9n = 32 | P50 4,0-4,8n = 32 | P75 ≥4,9n = 35 | p |
| Média (DP) | Média (DP) | Média (DP) | Média (DP) | ||
| IMC | 25,02 (2,74) | 26,66 (4,25) | 28,17 (4,55) | 30,33 (4,32) | 0,000a |
| CA | 80,15 (8,88) | 81,77 (12,25) | 89,54 (12,38) | 93,12 (12,52) | 0,000b |
| PAS | 103,20 (10,51) | 104,84 (10,19) | 110,53 (11,34) | 113,86 (12,66) | 0,001c |
| PAD | 69,20 (8,70) | 68,91 (7,15) | 75,31 (9,66) | 75,69 (11,86) | 0,003d |
| TG | 106,00 (53,87) | 117,59 (54,94) | 134,63 (68,09) | 165,40 (77,28) | 0,002e |
| HDL-c | 38,50 (11,59) | 39,13 (7,54) | 38,53 (7,56) | 33,23 (6,49) | 0,014f |
| HOMA- RI | 1,81 (1,09) | 2,18 (1,62) | 2,52 (1,48) | 3,39 (1,76) | 0,000g |
| Glicemia | 78,90 (7,75) | 80,56 (7,67) | 79,75 (6,75) | 82,69 (6,54) | 0,172 |
CA, circunferência abdominal; DP, desvio-padrão; HDL-c, high-density lipoprotein; HOMA- RI, índice Homeostatic model assessment; IMC, índice de massa corpórea; PAD, pressão arterial diastólica; PAS, pressão arterial sistólica; TG, triglicerídeos.
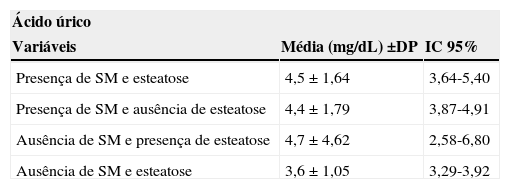
Não houve associação entre os níveis de ácido úrico e os grupos combinados de acordo com a presença/ausência de SM e esteatose hepática não alcoólica (tabela 3).
Valores de ácido úrico de acordo com a presença e/ou ausência de SM e esteatose hepática em 129 crianças e adolescentes com sobrepeso ou obesidade. Centro de Obesidade Infantil, ISEA, Campina Grande-PB, 2009 - 2010.
| Ácido úrico | ||
|---|---|---|
| Variáveis | Média (mg/dL) ±DP | IC 95% |
| Presença de SM e esteatose | 4,5 ± 1,64 | 3,64-5,40 |
| Presença de SM e ausência de esteatose | 4,4 ± 1,79 | 3,87-4,91 |
| Ausência de SM e presença de esteatose | 4,7 ± 4,62 | 2,58-6,80 |
| Ausência de SM e esteatose | 3,6 ± 1,05 | 3,29-3,92 |
DP, desvio-padrão; IC, intervalo de confiança; SM, síndrome metabólica. p = 0,220.
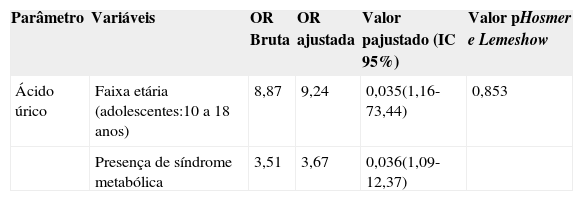
Por meio da análise de regressão logística múltipla veri- ficou-se que, no modelo final, só permaneceram associadas aos níveis de ácido úrico a faixa etária e a presença de síndrome metabólica. Observou-se que, dentre os adoles- centes, a chance de ter ácido úrico aumentado é cerca de nove vezes maior do que entre crianças, com relação aos portadores de síndrome metabólica essa chance foi 3,7 vezes maior. Conforme demonstrado pelo resultado do teste de Hosmer e Lemeshow, o modelo apresentou um bom ajuste (tabela 4).
Valores de odds ratio bruta e ajustada (intervalos de confiança de 95%) de alterações do ácido úrico em 129 crianças e adolescentes com sobrepeso ou obesidade. Centro de Obesidade Infantil, ISEA, Campina Grande-PB, 2009 - 2010.
| Parâmetro | Variáveis | OR Bruta | OR ajustada | Valor pajustado (IC 95%) | Valor pHosmer e Lemeshow |
|---|---|---|---|---|---|
| Ácido úrico | Faixa etária (adolescentes:10 a 18 anos) | 8,87 | 9,24 | 0,035(1,16-73,44) | 0,853 |
| Presença de síndrome metabólica | 3,51 | 3,67 | 0,036(1,09-12,37) |
Ácido úrico sérico é o principal produto final do metabo- lismo das purinas em seres humanos; e o seu nível é rigo-rosamente controlado pelo equilíbrio entre a produção e excreção.16 No presente estudo, níveis elevados de ácido úrico associaram-se com adolescência e síndrome meta- bólica. É importante destacar que não houve associação entre níveis aumentados de ácido úrico com o diagnóstico de sobrepeso e obesidade e com a presença de esteatose hepática não alcoólica.
Neste estudo, a prevalência de SM foi maior que a encon- trada por outros autores que avaliaram crianças e ado- lescentes obesos17,18 e corrobora os resultados anteriores de uma amostra de adultos hipertensos de Cuiabá – Mato Grosso – em que a prevalência de ácido úrico elevado é significativamente maior no grupo com SM.19
As evidências que explicam a associação dos níveis de ácido úrico com a SM são baseadas em dois mecanismos. O primeiro está relacionado ao fato de a captação de glicose no músculo esquelético depender, em parte, do aumento no fluxo sanguíneo mediado pela insulina, estimulando a liberação de óxido nítrico a partir de células endoteliais. Componentes da síndrome metabólica se desenvolveram em camundongos com síntese de óxido nítrico endotelial. O segundo mecanismo diz respeito ao ácido úrico induzir alterações inflamatórias e oxidativas nos adipócitos, devido a xantina oxidoredutase (a enzima que gera o ácido úrico a partir da xantina) ser expressa nos adipócitos e ser funda- mental para o processo de adipogênese.20
Pacifico et al.,21 em estudo realizado na Itália com o objetivo de verificar a associação da hiperuricemia com a síndrome metabólica e aterosclerose em crianças e ado- lescentes obesos, concluíram que pacientes com elevadas concentrações de ácido úrico tiveram incidência maior da aterosclerose carotídea avaliada através do espessamento do complexo médio-intimal da carótida pela ultrassonogra- fia com dopler nesta região.
Observou-se que aqueles com PAS elevada apresentaram aproximadamente quatro vezes mais chances de terem hiperuricemia. A explicação biológica para tal fato tem como ponto de apoio as pesquisas realizadas em modelo animal com ratos, em que, após a indução de hiperurice- mia, houve desenvolvimento de hipertensão arterial por provável redução do óxido nítrico na mácula densa renal e por estímulo direto do sistema renina-angiotensina, sendo ambos os mecanismos causadores de vasoconstrição e, por- tanto, de elevação da pressão arterial.22
Em relação às variáveis do metabolismo lipídico, tem sido demonstrada associação entre os níveis de ácido úrico e as médias de TG e HDL, sendo inversa com a última,1,23 ratificando os achados do presente estudo.
O achado de hiperglicemia nesta faixa etária é incomum, visto que a manifestação de metabolismo glicídico mais frequente é a resistência insulínica, sendo esta um meca- nismo compensatório, enquanto a tolerância à glicose per- manece normal.24
Apesar de não ter sido verificada associação com estea- tose hepática nesta amostra, estudos recentes têm descrito uma relação significativa entre os níveis elevados de ácido úrico e a DHGNA, representando um fator de risco indepen- dente para a doença hepática.25–27 A explicação mais plausí- vel para esta associação, que tem sido inferida a partir da compreensão atual da progressão da DHGNA, seria a teoria “2-hit”. Segundo esta teoria, o acúmulo de gordura no fígado é o “hit” em primeiro lugar, que torna os hepatócitos mais vulneráveis a danos maiores devido a determinados disparadores, tais como resistência à insulina, inflamação em excesso, consumo de álcool e obesidade. Neste proces- so, a resistência à insulina desempenha um papel central no círculo vicioso, que promove lipólise do tecido adiposo periférico e aumenta livre influxo de ácidos graxos para o fígado. Esta resistência à insulina leva à hiperinsulinemia, que aumenta a síntese de ácido úrico e reduz a excreção renal do mesmo.24
O estresse oxidativo parece ser o processo envolvi- do no “hit”, que promove a peroxidação lipídica e uma resposta inflamatória. O ácido úrico reflete a taxa de renovação celular, o que em si pode ser uma parte do processo inflamatório, tornando-o um fator pró-inflama- tório. O ácido úrico aumenta a interleucina (IL)-6 e o fator de necrose tumoral alfa (TNF-α). Desta forma, os níveis sanguíneos de ácido úrico elevados devem-se ao estresse oxidativo que ocorre em resposta a distúrbios metabólicos.28
Estudo realizado por Roberts et al.29 observou que a depuração de ácido úrico no grupo obeso era menor do que no grupo controle, sugerindo que a hiperuricemia na popu- lação obesa seria principalmente atribuída a uma dimi- nuição na depuração do ácido úric,o e não a uma superpro- dução de uratos.
Considerou-se uma limitação do presente estudo o méto- do diagnóstico da esteatose hepática não alcoólica, pois opadrão ouro é a biópsia, uma técnica invasiva e onerosa. Desta forma, optou-se pela a técnica ultrassonográfica, que tem sido bastante utilizada em estudos de saúde pública devido ao seu fácil acesso, segurança e excelente sensi-bilidade, principalmente quando se avalia a faixa etária infanto-juvenil.
Conclui-se que níveis elevados de ácido úrico estiveram associados a síndrome metabólica e à adolescência, o que não foi observado com a esteatose hepática não alcoóli- ca. A possibilidade de complicações cardiovasculares não depende de um elemento em particular, mas sim da pre- sença concomitante de características individuais capazes de incrementar esta eventualidade – sintomática ou não – dos órgãos alvo e das complicações clínicas associadas. Desta forma, sugere-se a inclusão do ácido úrico em pro- tocolos de avaliação de crianças e adolescentes obesos ou com sobrepeso a fim de conhecer possíveis complicações precoces de alterações cardiovasculares.
FinanciamentoPesquisa financiada pela Fundação de Apoio à Pesquisa do Estado da Paraíba – FAPESQ, através do edital 01/2008- FAPESQ/PB-MCT/CNPq Termo de Concessão n°198/08 e pela Universidade Estadual da Paraíba, no Programa de Incentivo à Pós-Graduação e Pesquisa (PROPESQ) Edital 01/2008 – PRPGP/UEPB, Termo de Concessão n°98/2008.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Cardoso AS, Gonzaga NC, Medeiros CC, Carvalho DF. Association of uric acid levels with components of meta-bolic syndrome and non-alcoholic fatty liver disease in overweight or obese children and adolescents. J Pediatr (Rio J). 2013;89:412-8.