To evaluate neopterin plasma concentrations in patients with active juvenile idiopathic arthritis (JIA) and correlate them with disease activity.
MethodsSixty patients diagnosed as active JIA, as well as another 60 apparently healthy age‐ and gender‐matched children as controls, were recruited from the Pediatrics Allergy and Immunology Clinic, Ain Shams University. Disease activity was assessed by the Juvenile Arthritis Disease Activity Score 27 (JADAS‐27). Laboratory investigations were performed for all patients, including determination of hemoglobin concentration (Hgb), erythrocyte sedimentation rate (ESR), and C‐reactive protein. Serum concentrations of tumor necrosis factor‐alpha (TNF‐α), interleukin‐6 (IL‐6), monocyte chemoattractant protein‐1 (MCP‐1), and neopterin were measured.
ResultsSignificant differences were found between JIA patients and controls with regard to the mean levels of Hgb, ESR, TNF‐α, IL‐6, and MCP‐1 (p<0.05). A statistically significant higher mean level serum neopterin concentration (p<0.05) was found in JIA patients (20.43±8.73 nmol/L) than in controls (6.88±2.87 nmol/L) (p<0.05). Positive significant correlations were detected between serum neopterin and ESR, TNF‐α, IL‐6, MCP‐1, and JADAS‐27 (p<0.05). No correlation was found between serum neopterin and CRP (p>0.05). Multiple linear regression analysis showed that JADAS‐ 27 and ESR were the main variables associated with serum neopterin in JIA patients (p<0.05).
ConclusionThe elevation of plasma neopterin concentrations in early JIA patients may indicate stimulation of immune response. Serum neopterin can be used as a sensitive marker for assaying background inflammation and disease activity score in JIA patients.
Avaliar as concentrações plasmáticas de neopterina em pacientes com artrite idiopática juvenil (AIJ) ativa e correlacioná‐las com a atividade da doença.
MétodosForam recrutados da clínica de Alergia e Imunologia Infantil da Universidade Ain Shams 60 pacientes diagnosticados com AIJ ativa, bem como 60 crianças aparentemente saudáveis com a mesma idade e o mesmo sexo no grupo de controle. A atividade da doença foi avaliada pelo Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações (JADAS‐27). Foram feitas investigações laboratoriais em todos os pacientes, incluindo a determinação da concentração de hemoglobinas, a taxa de sedimentação de eritrócitos e a proteína C‐reativa. Foram mensuradas as concentrações séricas do fator de necrose tumoral alfa, interleucina‐6 e proteína quimiotática de monócitos‐1 e neopterina.
ResultadosFoi encontrada uma diferença significativa entre os pacientes com AIJ e os controles quanto às médias de Hb, TSE, FNT‐α, IL‐6 e MCP‐1 (p<0,05). Foi encontrado um nível estatística e significativamente maior de concentração média de neopterina sérica (p<0,05) em pacientes com AIJ (valor médio de 20,43±8,73 nmol/L) do que em controles (valor médio de 6,88±2,87 nmol/L) (p<0,05). Foram detectadas correlações positivas significativas entre a neopterina sérica e TSE, FNT‐α, IL‐6, MCP‐1 e JADAS‐27 (p<0,05). Não foi encontrada correlação entre a neopterina sérica e a PCR (p>0,05). A análise de regressão linear múltipla mostrou que o JADAS‐27 e a TSE foram as principais variáveis associadas à neopterina sérica em pacientes com AIJ (p<0,05).
ConclusãoA elevação das concentrações plasmáticas de neopterina em pacientes com AIJ precoce pode indicar um estímulo de resposta imune. A neopterina sérica pode ser usada como um indicador sensível para analisar o histórico de inflamações e o escore de atividade da doença em pacientes com AIJ.
A artrite idiopática juvenil (AIJ) geralmente é considerada uma síndrome clínica que envolve diversos subconjuntos de doenças, com vários fluxos inflamatórios, e leva a uma futura via comum em que a sinovite persistente e o dano relacionado à cartilagem articular e ao osso subjacente estão presentes.1 O principal processo inflamatório na fisiopatologia da AIJ consiste na superprodução do fator de necrose tumoral, que leva à superprodução de muitas citocinas, como a interleucina‐6, que causa inflamação persistente e destruição da articulação.2‐4 A doença surge em um indivíduo geneticamente suscetível devido a fatores ambientais.5 Ademais, foi especulado que um processo autoimune motivado por um antígeno media a patologia inflamatória de alguns casos de artrite (p. ex., oligoartrite, poliartrite). Em contrapartida, não existem sinais de respostas imunes específicas para o antígeno e mediadas pelos linfócitos em indivíduos no acometimento sistêmico da doença. Investigações recentes na fisiopatologia do acometimento sistêmico da doença indicaram que esse distúrbio deve‐se a uma ativação descontrolada do sistema imune inato.6 Independentemente das diferenças na patogênese subjacente dos vários tipos de AIJ, citocinas pró‐inflamatórias são sistematicamente superproduzidas e estão relacionadas às manifestações clínicas em todos os tipos de AIJ.7
O sistema de classificação da Liga Internacional de Associações de Reumatologia (ILAR) divide a AIJ em sete subgrupos clínicos.8 As poucas estimativas com base na população disponíveis indicam que a prevalência da AIJ é de aproximadamente 1‐2 casos em cada 1.000 crianças e a incidência é de 11‐14 novos casos em cada 100.000 crianças.9
A neopterina, composto de pirazino‐pirimidina, é sintetizada por monócitos e macrófagos em resposta ao interferon‐γ (IFN‐γ) produzido por células T ativadas. É um marcador de resposta imune celular. Seus níveis se tornam elevados em condições de ativação de células T ou macrófagos, incluindo doenças autoimunes, como o lúpus eritematoso sistêmico e a artrite reumatoide.10,11
O atual estudo foi feito para avaliar a associação do nível plasmático da neopterina com a atividade inflamatória e da doença em pacientes com AIJ.
Indivíduos e métodosEste estudo incluiu 60 pacientes (30 do sexo masculino e 30 do feminino) diagnosticados com AIJ ativa (grupo 1), bem como 60 crianças aparentemente saudáveis com a mesma idade e o mesmo sexo no grupo de controle (grupo 2). Os pacientes foram recrutados da clínica de Alergia e Imunologia Infantil da Universidade Ain Shams. Os consentimentos informados por escrito foram obtidos dos pais após a explicação do objetivo do estudo. O protocolo e todos os documentos correspondentes foram aprovados pelo Comitê de Ética em Pesquisa do Centro Nacional de Pesquisa. Suas idades variavam de cinco a 15 anos, com idade média de 12,20±2,8 anos. Eles eram elegíveis caso atendessem aos critérios da Liga Internacional de Associações de Reumatologia da Edmonton (segunda revisão) de um diagnóstico de AIJ.8 A atividade da doença foi mensurada com um escore validado, o Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações (JADAS‐27).12 Esse escore inclui quatro medidas: avaliação global médica de atividade da doença com uma escala visual analógica (VAS), avaliação global dos pais sobre o bem‐estar da criança determinada por uma VAS, contagem de articulações com doença ativa (avaliação de 27 articulações) e TSE (taxa de sedimentação de eritrócitos). A TSE é normalizada para um escore que varia de 0 a 10, pela fórmula (ESR ‐ 20)/10. O JADAS‐27 é calculado como a soma linear simples dos escores de seus quatro componentes e gera um escore total de 0‐57, com os maiores escores associados à pior atividade da doença. Trinta e oito pacientes (63,3%) tinham AIJ com acometimento poliarticular, 15 (25%) tinham acometimento pauciarticular e sete (11,7%) tinham AIJ com acometimento sistêmico.
Todos os pacientes foram submetidos a anamnese completa e a exame clínico. Foram feitas investigações laboratoriais de todos os pacientes, incluindo a determinação da concentração de hemoglobina (Hb em g/dL) e da taxa de sedimentação de eritrócitos (TSE em mm/h) pelo método de Westergren e a detecção de proteína C‐reativa (PCR em mg/L) pelo teste de aglutinação em látex em placas. As concentrações séricas do fator de necrose tumoral alfa (FNT‐α), interleucina‐6 (IL‐6) e proteína quimiotática de monócitos‐1 (MCP‐1) foram mensuradas pelo ensaio imunossorvente ligado a enzima (ELISA) multiplex (Millipore®, Merck KgaA, Darmstadt, Alemanha).
Ensaio de neopterina sérica (nmol/L)Os níveis de neopterina sérica foram examinados com um kit de ELISA (Neopterin ELISA, IBL, Hamburgo, Alemanha). O ensaio foi feito com base no princípio básico de concorrência entre um antígeno conjugado e não conjugado a peróxido em uma determinada quantidade de locais de ligação de anticorpos. Os complexos antígeno‐anticorpo conjugado a peroxidase que se ligam aos poços das tiras de microfiltro são revestidos com um bom anticorpo antirrábico. O antígeno não conjugado é, então, eliminado por lavagem. Após a reação do substrato, a densidade ótica é mensurada em 450nm. Uma curva padrão é traçada e a concentração de neopterina na amostra é determinada pela interpolação da curva padrão.
Análise estatísticaA análise estatística foi feita com a versão 16 do pacote estatístico para as ciências sociais (SPSS) do Windows (SPSS Inc., Chicago, IL, EUA). Os dados contínuos foram expressos como média±desvio padrão e foram comparados pelo uso do teste t de Student. A análise de correlação de Pearson foi feita para avaliar a associação entre exposição contínua e covariáveis contínuas. A análise de regressão linear múltipla foi feita para identificar a influência de múltiplas variáveis (idade, sexo, TSE, PCR, FNT‐α, IL‐6, MCP‐1 e JADAS‐27) em uma variável dependente (neopterina sérica). Um valor de p<0,05 foi considerado estatisticamente significativo.
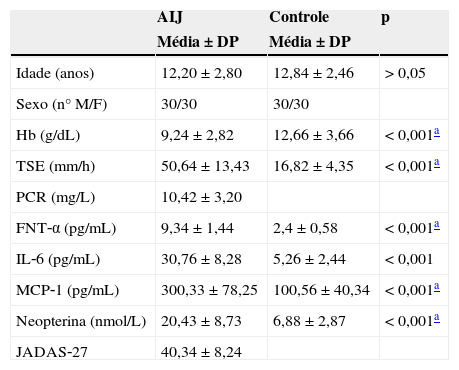
ResultadosAs características clínicas dos pacientes com AIJ e dos indivíduos controle são apresentadas na tabela 1. Não foi detectada diferença significativa entre pacientes e controles no que diz respeito à idade média (p>0,05). Contudo, foram encontradas diferenças significativas entre ambos os grupos no que diz respeito à média das outras variáveis (Hb, TSE, FNT‐α, IL‐6, MCP‐1 e neopterina) (p<0,05).
Características demográficas, bioquímicas e de doença de todos os indivíduos
| AIJ | Controle | p | |
|---|---|---|---|
| Média±DP | Média±DP | ||
| Idade (anos) | 12,20±2,80 | 12,84±2,46 | > 0,05 |
| Sexo (n° M/F) | 30/30 | 30/30 | |
| Hb (g/dL) | 9,24±2,82 | 12,66±3,66 | < 0,001a |
| TSE (mm/h) | 50,64±13,43 | 16,82±4,35 | < 0,001a |
| PCR (mg/L) | 10,42±3,20 | ||
| FNT‐α (pg/mL) | 9,34±1,44 | 2,4±0,58 | < 0,001a |
| IL‐6 (pg/mL) | 30,76±8,28 | 5,26±2,44 | < 0,001 |
| MCP‐1 (pg/mL) | 300,33±78,25 | 100,56±40,34 | < 0,001a |
| Neopterina (nmol/L) | 20,43±8,73 | 6,88±2,87 | < 0,001a |
| JADAS‐27 | 40,34±8,24 |
AIJ, artrite idiopática juvenil; Hb, concentração de hemoglobina; TSE, taxa de sedimentação de eritrócitos; PCR, proteína C‐reativa; FNT‐α, fator de necrose tumoral alfa; IL‐6, interleucina‐6; MCP‐1, proteína quimiotática de monócitos‐1; JADAS‐27, Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações.
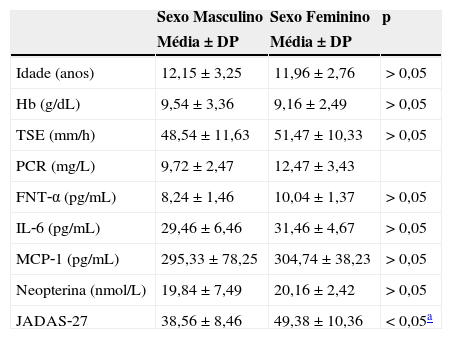
As características demográficas e bioquímicas foram comparadas entre homens e mulheres no grupo de pacientes da tabela 2. O JADAS‐27 médio era maior nas meninas do que nos meninos e a diferença foi significativa (p<0.05), ao passo que nenhuma diferença significativa foi detectada com relação às outras variáveis.
Características demográficas, bioquímicas e de doença nos pacientes do sexo masculino e feminino com AIJ
| Sexo Masculino | Sexo Feminino | p | |
|---|---|---|---|
| Média±DP | Média±DP | ||
| Idade (anos) | 12,15±3,25 | 11,96±2,76 | > 0,05 |
| Hb (g/dL) | 9,54±3,36 | 9,16±2,49 | > 0,05 |
| TSE (mm/h) | 48,54±11,63 | 51,47±10,33 | > 0,05 |
| PCR (mg/L) | 9,72±2,47 | 12,47±3,43 | |
| FNT‐α (pg/mL) | 8,24±1,46 | 10,04±1,37 | > 0,05 |
| IL‐6 (pg/mL) | 29,46±6,46 | 31,46±4,67 | > 0,05 |
| MCP‐1 (pg/mL) | 295,33±78,25 | 304,74±38,23 | > 0,05 |
| Neopterina (nmol/L) | 19,84±7,49 | 20,16±2,42 | > 0,05 |
| JADAS‐27 | 38,56±8,46 | 49,38±10,36 | < 0,05a |
AIJ, artrite idiopática juvenil; Hb, concentração de hemoglobina; TSE, taxa de sedimentação de eritrócitos; PCR, proteína C‐reativa; FNT‐α, fator de necrose tumoral alfa; IL‐6, interleucina‐6; MCP‐1, proteína quimiotática de monócitos‐1; JADAS‐27, Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações.
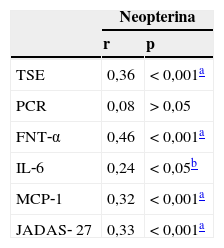
As correlações entre neopterina sérica e atividade da doença e mediadores inflamatórios em pacientes com AIJ são apresentadas na tabela 3. Foram detectadas correlações positivas significativas entre a neopterina sérica e TSE, FNT‐α, IL‐6, MCP‐1 e JADAS‐27 (p<0,05). Não foi encontrada correlação significativa entre a neopterina sérica e a PCR (p>0,05).
Correlações entre a neopterina e os marcadores inflamatórios e atividade da doença em pacientes com AIJ
| Neopterina | ||
|---|---|---|
| r | p | |
| TSE | 0,36 | < 0,001a |
| PCR | 0,08 | > 0,05 |
| FNT‐α | 0,46 | < 0,001a |
| IL‐6 | 0,24 | < 0,05b |
| MCP‐1 | 0,32 | < 0,001a |
| JADAS‐ 27 | 0,33 | < 0,001a |
AIJ, artrite idiopática juvenil; TSE, taxa de sedimentação de eritrócitos; PCR, proteína C‐reativa; FNT‐α, fator de necrose tumoral alfa; IL‐6, interleucina‐6; MCP‐1, proteína quimiotática de monócitos‐1; JADAS‐27, Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações.
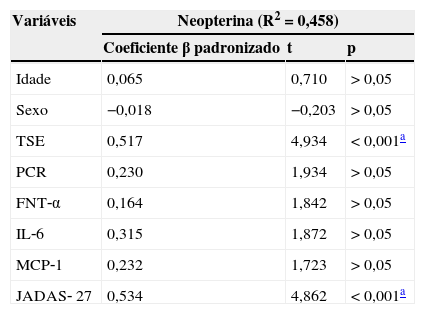
A análise da regressão linear múltipla para a associação de diferentes variáveis à neopterina sérica é apresentada na tabela 4. Após o ajuste por idade, sexo e marcadores inflamatórios, o JADAS‐27 e a TSE foram os principais preditores dos altos níveis de neopterina vistos em pacientes com AIJ (p<0,05). Os efeitos do FNT‐α, da IL‐6 e da MCP‐1 foram atenuados pelo ajuste de todas as variáveis.
Análise de regressão linear múltipla da neopterina e diferentes variáveis independentes
| Variáveis | Neopterina (R2=0,458) | ||
|---|---|---|---|
| Coeficiente β padronizado | t | p | |
| Idade | 0,065 | 0,710 | > 0,05 |
| Sexo | −0,018 | −0,203 | > 0,05 |
| TSE | 0,517 | 4,934 | < 0,001a |
| PCR | 0,230 | 1,934 | > 0,05 |
| FNT‐α | 0,164 | 1,842 | > 0,05 |
| IL‐6 | 0,315 | 1,872 | > 0,05 |
| MCP‐1 | 0,232 | 1,723 | > 0,05 |
| JADAS‐ 27 | 0,534 | 4,862 | < 0,001a |
AIJ, artrite idiopática juvenil; TSE, taxa de sedimentação de eritrócitos; PCR, proteína C‐reativa; FNT‐α, fator de necrose tumoral alfa; IL‐6, interleucina‐6; MCP‐1, proteína quimiotática de monócitos‐1; JADAS‐27, Escore de Atividade da Doença da Artrite Juvenil em 27 Articulações.
Este estudo mostrou um alto nível de neopterina sérica como marcador de ativação macrofágica em pacientes com artrite idiopática juvenil. A neopterina e a TSE são preditores significativos de atividade da doença nesses pacientes.
Estudos anteriores de neopterina em artrite reumatoide (AR) foram feitos para definir a relação entre neopterina e a atividade da doença. Geralmente, foi constatado que a neopterina estava correlacionada com a atividade da doença na AR e diminuiu com o tratamento.11,13,14 Em contrapartida ao estudo atual, um estudo anterior no Japão detectou o aumento significativo da neopterina em pacientes com LES (lúpus eritematoso sistêmico) (p<0,001), porém não em pacientes com AR. Contudo, pacientes com AR apresentaram maior concentração de neopterina no fluido sinovial.15
No que diz respeito aos estudos recentes, Rho et al. mostraram, em 2011,16 que as concentrações de neopterina eram significativamente maiores em pacientes com LES (mediana 8,0, [6,5‐9,8] nmol/L) do que no grupo de controle (5,7; [4,8‐7,1] nmol/L) e eram maiores em pacientes com LES do que com AR (todos p<0,001). Em pacientes com LES, a neopterina estava significativamente correlacionada com a TSE (p=0,001), FNT‐α (p<0,001), MCP‐1 (p=0,005) e as concentrações de homocisteína (p=0,01), porém, em pacientes com AR, apenas com a TSE (p=0,01). Os resultados deste estudo estiveram de acordo com isso no atual estudo. Em 2012, Ozkan et al.17 avaliaram a utilidade dos níveis de degradação do triptofano e neopterina em pacientes com artrite reumatoide ativa em terapia. Foi descoberto que os níveis de neopterina estavam positivamente correlacionados com a quinurenina (r=0,582, p<0,02), quinurenina/triptofano (r=0,486, p<0,05) e a taxa de sedimentação de eritrócitos (r=0,472, p<0,05) e o fator reumatoide (FR) (r=0,478, p<0,05) em um grupo de pacientes com artrite reumatoide de acordo com os resultados deste estudo. Porém, em comparação com nossos resultados, foi constatado que os níveis de neopterina e de fator de necrose tumoral alfa não apresentaram diferenças estatisticamente significativas entre pacientes e grupos de controle. A diferença pode ser devido à faixa etária em seu estudo, como foi a faixa etária adulta. Em 2013, D’agostino et al.18 avaliaram as concentrações plasmáticas de neopterina em pacientes com artrite reumatoide (AR) precoce e as correlacionaram com a atividade da doença. De acordo com nossos resultados, eles detectaram uma elevação estatisticamente significativa da média de concentração de neopterina em pacientes com AR precoce: valor médio de 8,92±0,93 [3,94‐28,3] nmol/L (p<0,001). A correlação do momento do produto de Pearson sugeriu uma correlação entre as concentrações de neopterina e o DAS‐28 (r=0,208, p=0,065). Os mesmos resultados foram obtidos por Arshadi et al.,19 que detectaram um nível significativamente maior de neopterina em pacientes com AR em comparação com os controles saudáveis. Ademais, o nível de neopterina no plasma aumentou em pacientes com doença ativa e também foi correlacionado aos parâmetros de atividade da doença. Os resultados anteriores estavam de acordo com nossos resultados. Porém, em contraste com nossos resultados, descobriram um nível mais elevado de neopterina em pacientes com AR do sexo masculino em comparação com pacientes do sexo feminino e uma correlação significativa do nível de neopterina no plasma com a idade tanto no grupo com AR quanto no grupo de controle. A diferença nos resultados pode ser atribuída à faixa etária adulta de seu estudo em comparação com a faixa etária juvenil em nosso estudo. Fagerer et al. também estudaram, em 2013,20 o envolvimento de quimiocinas específicas no processo inflamatório em pacientes com AR e doença cardiovascular com produção ativada da neopterina pteridina. De acordo com o atual estudo, eles descobriram níveis elevados de neopterina em pacientes com AR e concentrações significativamente elevadas de neopterina em pacientes com AR mais doença cardiovascular (DCV) em comparação com AR sem DCV (p<0,03).
No melhor de nosso conhecimento, poucos estudos incluíram a neopterina como um marcador pró‐inflamatório e de artrite idiopática juvenil. Dois estudos constataram elevadas concentrações séricas de IL‐10, IL‐18, IL‐6 e neopterina em pacientes com AIJ sistêmica complicada pela síndrome de ativação macrofágica. Eles constataram que a IL‐10 e a IL‐8 continuaram elevadas na doença inativa, ao passo que outras citocinas pró‐inflamatórias foram normalizadas na fase inativa da doença.21,22 Em 2014, Brunner et al.23 avaliaram o triptofano como biomarcador na AIJ e o correlacionaram com a neopterina no fluido sérico e sinovial. Eles detectaram que o triptofano sérico não apresentava diferença relevante nos pacientes com AIJ em comparação com os controles, o que contrastou com a neopterina, que era maior nos pacientes do que nos controles.
Nosso estudo tem diversas limitações. Seu modelo é transversal e, portanto, não se podem fazer inferências causais. Além disso, os efeitos do tipo de terapia sobre os níveis de neopterina não foram acompanhados, de forma que não se pode avaliar seu uso como marcador da eficácia terapêutica. O tamanho da amostra relativamente pequeno poderia ser responsável pelo poder estatístico inadequado. Tamanhos de amostra maiores teriam maiores números em cada categoria de AIJ e permitiriam maior precisão na avaliação dos marcadores pró‐inflamatórios entre as categorias.
Concluindo, este estudo destaca que a ativação macrofágica, refletida pela maior quantidade de neopterina sérica, é um indicador sensível para avaliar o histórico de inflamações e o escore de atividade da doença em pacientes com AIJ.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Abu Shady MM, Fathy HA, Ali A, Youness ER, Fathy GA. Association of neopterin as a marker of immune system activation and juvenile rheumatoid arthritis activity. J Pediatr (Rio J). 2015;91:352–7.