This study aims to investigate the role of metabolic syndrome (MetS) and the hypertriglyceridemic‐waist (HW) phenotype in determining cardiometabolic risk factors and elevated liver enzymes in a national sample of Iranian pediatric population.
MethodThis nationwide study was conducted in the framework of the third survey of a surveillance program. Students, aged 10‐18 years, were recruited from 27 provinces in Iran. The prevalence of cardiometabolic risk factors was compared in students with and without HW and MetS. The association of HW with different cardiometabolic risk factors was determined.
ResultsThe mean age of studied population was 14.73±2.41 years. Prevalence of HW and MetS was 3.3% and 4%, respectively. Sixty‐nine (71.1%) participants with HW had MetS. The prevalence of obesity, elevated systolic blood pressure, hypercholesterolemia, and elevated ALT was significantly higher in subjects with HW phenotype and MetS than in their peers (p<0.05). A significant association was observed between HW and elevated levels of cholesterol and ALT, as well as between obesity and low HDL‐C (p<0.05).
ConclusionsThe current findings serve as complementary evidence to previous studies, which have been mainly conducted among adults, suggesting that the HW phenotype is associated with cardiometabolic risk factors, especially with elevated cholesterol and ALT. The authors propose that, in primary care settings and in large epidemiological studies, the measurement of all MetS components can be replaced by studying HW as a screening tool for identifying children at high risk for cardiometabolic disorders.
Investigar o desempenho da síndrome metabólica (SM) e do fenótipo de cintura hipertrigliceridêmica (CH) na determinação de fatores de risco cardiometabólico e enzimas hepáticas elevadas em uma amostra nacional da população pediátrica iraniana.
MétodoEstudo nacional feito na estrutura da terceira pesquisa de um programa de vigilância. Foram recrutados alunos de 10‐18 anos de 27 províncias do Irã. A prevalência de fatores de risco cardiometabólico foi comparada em alunos com e sem CH e SM. Foi determinada a associação da CH com diferentes fatores de risco cardiometabólico.
ResultadosA média de idade da população estudada foi de 14,73±2,41 anos. A prevalência de CH e SM foi de 3,3% e 4%, respectivamente; 69 (71,1%) dos participantes com CH apresentaram SM. A prevalência de obesidade, pressão arterial sistólica elevada, hipercolesterolemia e alanina aminotransferase (ALT) elevada foi significativamente maior em meninos e meninas com fenótipo CH e SM do que em seus outros pares (p<0,05). A associação de CH foi significativa com elevados níveis de colesterol e ALT, bem como obesidade e HDL‐C baixo (p<0,05).
ConclusõesOs achados atuais servem de evidência complementar de estudos anteriores, conduzidos principalmente com adultos, e sugerem que o fenótipo CH está associado a fatores de risco cardiometabólico, principalmente com colesterol e ALT altos. Propomos que, em ambientes de cuidados básicos e em grandes estudos epidemiológicas, a medição de todos os componentes de SM possa ser substituída pelo estudo da CH como ferramenta de triagem para identificar crianças com alto risco de apresentarem distúrbios cardiometabólicos.
As doenças não transmissíveis, principal causa da mortalidade e da morbidez na maioria das populações, têm origem no início da vida.1 O acúmulo de fatores de risco aumenta o risco de doenças crônicas. Diferentes combinações de fatores de risco são sugeridas para identificar as crianças em risco de doenças não transmissíveis. A síndrome metabólica (SM) é uma dessas combinações bem documentadas como fator predisponente para a maior parte das doenças crônicas. Contudo, o exame de todos os cinco componentes da SM em grandes estudos de base populacional é difícil e custoso. Ademais, existe, na verdade, uma controvérsia substancial entre várias definições de SM e dos parâmetros de exame clínico e pontos de corte propostos por diferentes organizações.2 Atualmente, não existe uma definição universalmente aceita para SM na faixa etária pediátrica. Assim, devem ser desenvolvidos índices de exames simples para estudos de triagem de base populacional. A cintura hipertrigliceridêmica (CH), ou seja, a coexistência de adiposidade abdominal e hipertrigliceridemia, é uma simples combinação de fatores de risco.3–5 Descobriu‐se que tanto a SM quanto a CH estão associadas ao aumento do risco cardiometabólico, incluindo resistência à insulina, dislipidemia aterogênica, hipertensão, disfunção endotelial, inflamação de baixo grau e hemostasia prejudicada.6,7
Lemieux et al.3 foram o primeiro grupo a documentar a associação do fenótipo CH com o aumento do risco cardiometabólico em homens adultos. O fenótipo CH foi associado principalmente à tríade aterogênica de hiperinsulinemia, concentrações elevadas de apolipoproteína B e pequenas partículas densas de colesterol de lipoproteína de baixa densidade (LDL‐C). Estudos posteriores confirmaram a associação de CH com fatores de risco cardiometabólico;8–10 contudo, a maioria desses estudos foi feita nas populações adultas.
Um corpo cada vez maior de evidências sugere a associação de testes da função hepática com componentes da SM. Essa correlação é demonstrada até em crianças e adolescentes.11,12 Existe uma experiência limitada sobre a associação do fenótipo CH com fatores de risco cardiometabólico e enzimas hepáticas elevadas na faixa etária pediátrica.
Buscamos comparar a frequência dos fatores de risco cardiometabólico e das enzimas hepáticas elevadas em crianças e adolescentes com os fenótipos CH e SM, a fim de investigar o desempenho do fenótipo CH na determinação dos fatores de risco mencionados nesse grupo de população.
MétodosEste estudo transversal foi conduzido na estrutura da terceira pesquisa de um programa nacional de vigilância escolar intitulado Estudo de Vigilância e Prevenção na Infância e Adolescência de Doenças da Vida Adulta Não Transmissíveis (CASPIAN‐III). Sua metodologia detalhada foi publicada anteriormente13 e o descrevemos brevemente aqui.
Esse projeto foi aprovado pelos comitês de ética e outras organizações reguladoras nacionais relevantes. O consentimento informado por escrito e o consentimento verbal foram obtidos dos pais e dos alunos, respectivamente. Os membros da equipe do projeto foram treinados e um manual de operação abrangente foi entregue a eles. O Conselho de Monitoramento de Dados e Segurança do projeto considerou diferentes níveis de controle de qualidade. Um grupo de avaliadores e supervisores externos verificou o desempenho dos funcionários e monitorou e calibrou os equipamentos.
Este estudo incluiu 5.625 alunos entre 10 e 18 anos, recrutados por meio de amostragem aleatória por conglomerado em múltiplos estágios em áreas urbanas e rurais de 27 províncias no Irã. Selecionamos aleatoriamente escolas elegíveis para nosso estudo da lista de escolas, que foram estratificadas de acordo com o banco de informações do Ministério da Educação. Os alunos também foram selecionados aleatoriamente em cada escola selecionada. Os alunos que tinham qualquer doença crônica ou receberam medicamentos não foram incluídos na pesquisa.
Exame físicoUma equipe de médicos, enfermeiros e profissionais de saúde treinados fez o exame físico segundo os protocolos padrão e usou instrumentos calibrados. O peso e a estatura dos alunos foram medidos com roupas leves e sem sapatos. O índice de massa corporal (IMC) foi calculado como peso (kg) dividido pela altura ao quadrado (m2). A circunferência da cintura (CC) foi medida por uma fita não elástica e arredondada para 0,2cm mais próximo ao fim da expiração, no ponto médio entre o alto da crista ilíaca e a última costela em posição ereta. O nível máximo do quadril sem qualquer pressão sobre a superfície do corpo foi considerado para medição da circunferência do quadril. As pressões arteriais sistólica e diastólica (PAS e PAD) foram medidas segundo o protocolo padrão com um manguito de tamanho adequado. A pressão arterial (PA) foi medida duas vezes após pelo menos cinco minutos de descanso. A PAS foi considerada a audição clara do primeiro som (primeira fase de Korotkoff) e a PAD, o desaparecimento do som (quinta fase de Korotkoff).14
Testes de laboratórioNo que diz respeito à amostragem de sangue, os alunos, acompanhados de um de seus pais, foram convidados para o centro de saúde mais próximo de sua escola após 12 horas de jejum. A amostra de sangue venoso foi obtida da veia antecubital entre 8h e 9h30. As amostras de sangue foram centrifugadas por 10 minutos a 3.000rpm em 30 minutos de flebotomia. As amostras frescas foram analisadas por kits padrão (Pars Azmoun, Teerã, Irã) no Laboratório Provincial Central, que está sob controle de qualidade do Laboratório de Referência Nacional, centro de colaboração da Organização Mundial de Saúde (OMS).
Definição de fatores de riscoUsamos a definição da Federação Internacional de Diabetes (IDF) para SM em crianças e adolescentes.15 O sobrepeso e a obesidade foram definidos como IMC entre o 85° e 95° percentis e IMC igual ou maior que o 95° percentil, respectivamente. A CC acima do 90° percentil específico da idade e do sexo foi considerada obesidade abdominal.16
Lipídios séricos anormais foram definidos como colesterol total (CT), colesterol de lipoproteína de baixa densidade (LDL‐C) ou triglicerídeos (TG) acima do nível correspondente ao 95° percentil específico da idade e do sexo ou como colesterol de lipoproteína de alta densidade (HDL‐C) inferior ao 5° percentil específico da idade e do sexo.17 A glicemia de jejum (GJ) em níveis iguais ou superiores a 100mg/dL foi considerada alta.16 A média de PAS ou PAD acima do 90° percentil específico da idade e do sexo foi considerada PA elevada.18 A ALT e a aspartato aminotransferase (AST) foram consideradas elevadas caso seus níveis fossem iguais ou superiores ao valor do 90° percentil calculado para crianças e adolescentes.19
Definição do fenótipo de cintura hipertrigliceridêmica (CH)O fenótipo CH foi definido pela coexistência de CC acima do 90° percentil específico da idade e do sexo e de níveis de triglicerídeos séricos acima do 95° percentil específico da idade e do sexo.10
Análise estatísticaVariáveis contínuas e categóricas são expressas como médias±desvio padrão (DP) e percentuais, respectivamente. O teste t independente foi usado para comparar variáveis contínuas e o teste qui‐quadrado, para dados categóricos. As análises de regressão logística binária foram usadas para avaliar a associação da CH com fatores de risco cardiometabólico em cada modelo como possíveis variáveis de confusão. A análise foi feita com o pacote estatístico SPSS, versão 16.0 para Windows (SPSS Inc., Chicago, EUA). Foram relatados valores de P bilaterais. O valor de P inferior a 0,05 foi considerado estatisticamente significativo.
ResultadosNesta pesquisa, foram estudados 5.625 alunos, 2.824 (50,2%) meninos e 2.801 (49,8%) meninas. A média de idade da população estudada foi de 14,73±2,41 anos. A prevalência de CH (3% dos meninos e 3,5% das meninas) e de SM (3% dos meninos e 5,1% das meninas) foi de 3,3% e 4%, respectivamente; 69 (71,1%) participantes com CH apresentaram SM.
Como alguns alunos selecionados não cooperaram na amostragem de sangue e algumas medições bioquímicas e laboratoriais não foram adequadamente feitas, alguns casos estão ausentes.
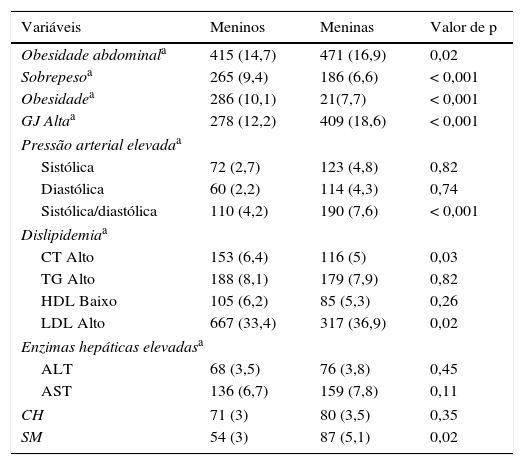
As médias e a prevalência de variáveis antropométricas, enzimas hepáticas e fatores de risco cardiometabólico de acordo com a idade e faixa etária são apresentados na tabela 1. Os níveis médios de enzimas hepáticas, CC, PAS, PAD e GJ, foram significativamente maiores em meninas do que em meninos (p<0,001). As médias de IMC, colesterol total, TG e LDL‐C foram significativamente maiores em meninos do que em meninas (p<0,001). A prevalência de SM, obesidade abdominal, GJ elevada, alto nível de PAS e PAD, bem como alto nível de LDL‐C, foi significativamente maior em meninas do que em meninos (p<0,05). A prevalência de sobrepeso/obesidade e hipercolesterolemia foi significativamente maior em meninos do que em meninas (p<0,05).
Frequência dos fatores de risco cardiometabólico e enzimas hepáticas em crianças e adolescentes de acordo com o sexo: o estudo CASPIAN‐IIIa
| Variáveis | Meninos | Meninas | Valor de p |
|---|---|---|---|
| Obesidade abdominala | 415 (14,7) | 471 (16,9) | 0,02 |
| Sobrepesoa | 265 (9,4) | 186 (6,6) | < 0,001 |
| Obesidadea | 286 (10,1) | 21(7,7) | < 0,001 |
| GJ Altaa | 278 (12,2) | 409 (18,6) | < 0,001 |
| Pressão arterial elevadaa | |||
| Sistólica | 72 (2,7) | 123 (4,8) | 0,82 |
| Diastólica | 60 (2,2) | 114 (4,3) | 0,74 |
| Sistólica/diastólica | 110 (4,2) | 190 (7,6) | < 0,001 |
| Dislipidemiaa | |||
| CT Alto | 153 (6,4) | 116 (5) | 0,03 |
| TG Alto | 188 (8,1) | 179 (7,9) | 0,82 |
| HDL Baixo | 105 (6,2) | 85 (5,3) | 0,26 |
| LDL Alto | 667 (33,4) | 317 (36,9) | 0,02 |
| Enzimas hepáticas elevadasa | |||
| ALT | 68 (3,5) | 76 (3,8) | 0,45 |
| AST | 136 (6,7) | 159 (7,8) | 0,11 |
| CH | 71 (3) | 80 (3,5) | 0,35 |
| SM | 54 (3) | 87 (5,1) | 0,02 |
CASPIAN, estudo de vigilância e prevenção na infância e adolescência de doenças da vida adulta não transmissíveis; CH, cintura hipertrigliceridêmica; IMC, índice de massa corporal; GJ, glicemia de jejum; SM, síndrome metabólica.
Dislipidemia: colesterol total (CT), colesterol de lipoproteína de baixa densidade (LDL‐C) e triglicerídeos (TG) acima do nível correspondente ao 95° percentil específico da idade e do sexo; e/ou colesterol de lipoproteína de alta densidade (HDL‐C) abaixo do 5° percentil específico da idade e do sexo; pressão arterial elevada: pressão arterial sistólica e diastólica acima do 90° percentil para a idade e o sexo; enzima hepática elevada: alanina aminotransferase (ALT) e aspartato aminotransferase (AST) acima do valor do 90° percentil para crianças e adolescentes iranianos; GJ alta: ≥ 100mg/dL; obesidade: IMC ≥ 95° percentil; obesidade abdominal: circunferência da cintura acima do 90° percentil específico da idade e do sexo; sobrepeso: 85°<IMC<95° percentil.
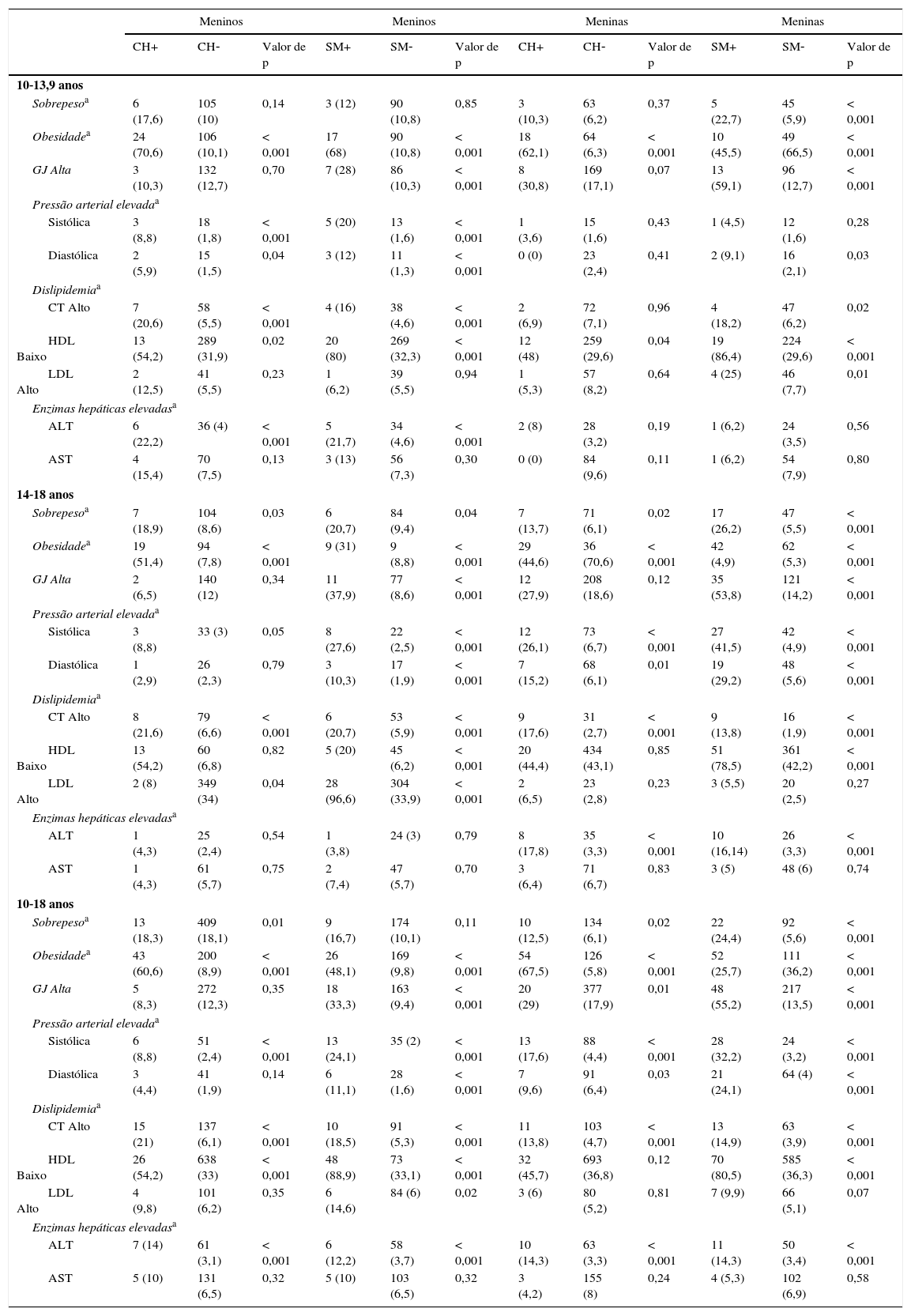
A tabela 2 apresenta a frequência dos fatores de risco cardiometabólico e de enzimas hepáticas elevadas em participantes com e sem CH e SM por sexo e faixas etárias. A frequência de obesidade, PAS elevada, hipercolesterolemia e alto nível de ALT foi significativamente maior em meninos e meninas com fenótipo CH e SM do que em seus outros pares (p<0,05).
Frequência dos fatores de risco metabólico e enzimas hepáticas elevadas em crianças e adolescentes com e sem cintura hipertrigliceridêmica e síndrome metabólica: o estudo CASPIAN‐III
| Meninos | Meninos | Meninas | Meninas | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CH+ | CH‐ | Valor de p | SM+ | SM‐ | Valor de p | CH+ | CH‐ | Valor de p | SM+ | SM‐ | Valor de p | |
| 10‐13,9 anos | ||||||||||||
| Sobrepesoa | 6 (17,6) | 105 (10) | 0,14 | 3 (12) | 90 (10,8) | 0,85 | 3 (10,3) | 63 (6,2) | 0,37 | 5 (22,7) | 45 (5,9) | < 0,001 |
| Obesidadea | 24 (70,6) | 106 (10,1) | < 0,001 | 17 (68) | 90 (10,8) | < 0,001 | 18 (62,1) | 64 (6,3) | < 0,001 | 10 (45,5) | 49 (66,5) | < 0,001 |
| GJ Alta | 3 (10,3) | 132 (12,7) | 0,70 | 7 (28) | 86 (10,3) | < 0,001 | 8 (30,8) | 169 (17,1) | 0,07 | 13 (59,1) | 96 (12,7) | < 0,001 |
| Pressão arterial elevadaa | ||||||||||||
| Sistólica | 3 (8,8) | 18 (1,8) | < 0,001 | 5 (20) | 13 (1,6) | < 0,001 | 1 (3,6) | 15 (1,6) | 0,43 | 1 (4,5) | 12 (1,6) | 0,28 |
| Diastólica | 2 (5,9) | 15 (1,5) | 0,04 | 3 (12) | 11 (1,3) | < 0,001 | 0 (0) | 23 (2,4) | 0,41 | 2 (9,1) | 16 (2,1) | 0,03 |
| Dislipidemiaa | ||||||||||||
| CT Alto | 7 (20,6) | 58 (5,5) | < 0,001 | 4 (16) | 38 (4,6) | < 0,001 | 2 (6,9) | 72 (7,1) | 0,96 | 4 (18,2) | 47 (6,2) | 0,02 |
| HDL Baixo | 13 (54,2) | 289 (31,9) | 0,02 | 20 (80) | 269 (32,3) | < 0,001 | 12 (48) | 259 (29,6) | 0,04 | 19 (86,4) | 224 (29,6) | < 0,001 |
| LDL Alto | 2 (12,5) | 41 (5,5) | 0,23 | 1 (6,2) | 39 (5,5) | 0,94 | 1 (5,3) | 57 (8,2) | 0,64 | 4 (25) | 46 (7,7) | 0,01 |
| Enzimas hepáticas elevadasa | ||||||||||||
| ALT | 6 (22,2) | 36 (4) | < 0,001 | 5 (21,7) | 34 (4,6) | < 0,001 | 2 (8) | 28 (3,2) | 0,19 | 1 (6,2) | 24 (3,5) | 0,56 |
| AST | 4 (15,4) | 70 (7,5) | 0,13 | 3 (13) | 56 (7,3) | 0,30 | 0 (0) | 84 (9,6) | 0,11 | 1 (6,2) | 54 (7,9) | 0,80 |
| 14‐18 anos | ||||||||||||
| Sobrepesoa | 7 (18,9) | 104 (8,6) | 0,03 | 6 (20,7) | 84 (9,4) | 0,04 | 7 (13,7) | 71 (6,1) | 0,02 | 17 (26,2) | 47 (5,5) | < 0,001 |
| Obesidadea | 19 (51,4) | 94 (7,8) | < 0,001 | 9 (31) | 9 (8,8) | < 0,001 | 29 (44,6) | 36 (70,6) | < 0,001 | 42 (4,9) | 62 (5,3) | < 0,001 |
| GJ Alta | 2 (6,5) | 140 (12) | 0,34 | 11 (37,9) | 77 (8,6) | < 0,001 | 12 (27,9) | 208 (18,6) | 0,12 | 35 (53,8) | 121 (14,2) | < 0,001 |
| Pressão arterial elevadaa | ||||||||||||
| Sistólica | 3 (8,8) | 33 (3) | 0,05 | 8 (27,6) | 22 (2,5) | < 0,001 | 12 (26,1) | 73 (6,7) | < 0,001 | 27 (41,5) | 42 (4,9) | < 0,001 |
| Diastólica | 1 (2,9) | 26 (2,3) | 0,79 | 3 (10,3) | 17 (1,9) | < 0,001 | 7 (15,2) | 68 (6,1) | 0,01 | 19 (29,2) | 48 (5,6) | < 0,001 |
| Dislipidemiaa | ||||||||||||
| CT Alto | 8 (21,6) | 79 (6,6) | < 0,001 | 6 (20,7) | 53 (5,9) | < 0,001 | 9 (17,6) | 31 (2,7) | < 0,001 | 9 (13,8) | 16 (1,9) | < 0,001 |
| HDL Baixo | 13 (54,2) | 60 (6,8) | 0,82 | 5 (20) | 45 (6,2) | < 0,001 | 20 (44,4) | 434 (43,1) | 0,85 | 51 (78,5) | 361 (42,2) | < 0,001 |
| LDL Alto | 2 (8) | 349 (34) | 0,04 | 28 (96,6) | 304 (33,9) | < 0,001 | 2 (6,5) | 23 (2,8) | 0,23 | 3 (5,5) | 20 (2,5) | 0,27 |
| Enzimas hepáticas elevadasa | ||||||||||||
| ALT | 1 (4,3) | 25 (2,4) | 0,54 | 1 (3,8) | 24 (3) | 0,79 | 8 (17,8) | 35 (3,3) | < 0,001 | 10 (16,14) | 26 (3,3) | < 0,001 |
| AST | 1 (4,3) | 61 (5,7) | 0,75 | 2 (7,4) | 47 (5,7) | 0,70 | 3 (6,4) | 71 (6,7) | 0,83 | 3 (5) | 48 (6) | 0,74 |
| 10‐18 anos | ||||||||||||
| Sobrepesoa | 13 (18,3) | 409 (18,1) | 0,01 | 9 (16,7) | 174 (10,1) | 0,11 | 10 (12,5) | 134 (6,1) | 0,02 | 22 (24,4) | 92 (5,6) | < 0,001 |
| Obesidadea | 43 (60,6) | 200 (8,9) | < 0,001 | 26 (48,1) | 169 (9,8) | < 0,001 | 54 (67,5) | 126 (5,8) | < 0,001 | 52 (25,7) | 111 (36,2) | < 0,001 |
| GJ Alta | 5 (8,3) | 272 (12,3) | 0,35 | 18 (33,3) | 163 (9,4) | < 0,001 | 20 (29) | 377 (17,9) | 0,01 | 48 (55,2) | 217 (13,5) | < 0,001 |
| Pressão arterial elevadaa | ||||||||||||
| Sistólica | 6 (8,8) | 51 (2,4) | < 0,001 | 13 (24,1) | 35 (2) | < 0,001 | 13 (17,6) | 88 (4,4) | < 0,001 | 28 (32,2) | 24 (3,2) | < 0,001 |
| Diastólica | 3 (4,4) | 41 (1,9) | 0,14 | 6 (11,1) | 28 (1,6) | < 0,001 | 7 (9,6) | 91 (6,4) | 0,03 | 21 (24,1) | 64 (4) | < 0,001 |
| Dislipidemiaa | ||||||||||||
| CT Alto | 15 (21) | 137 (6,1) | < 0,001 | 10 (18,5) | 91 (5,3) | < 0,001 | 11 (13,8) | 103 (4,7) | < 0,001 | 13 (14,9) | 63 (3,9) | < 0,001 |
| HDL Baixo | 26 (54,2) | 638 (33) | < 0,001 | 48 (88,9) | 73 (33,1) | < 0,001 | 32 (45,7) | 693 (36,8) | 0,12 | 70 (80,5) | 585 (36,3) | < 0,001 |
| LDL Alto | 4 (9,8) | 101 (6,2) | 0,35 | 6 (14,6) | 84 (6) | 0,02 | 3 (6) | 80 (5,2) | 0,81 | 7 (9,9) | 66 (5,1) | 0,07 |
| Enzimas hepáticas elevadasa | ||||||||||||
| ALT | 7 (14) | 61 (3,1) | < 0,001 | 6 (12,2) | 58 (3,7) | < 0,001 | 10 (14,3) | 63 (3,3) | < 0,001 | 11 (14,3) | 50 (3,4) | < 0,001 |
| AST | 5 (10) | 131 (6,5) | 0,32 | 5 (10) | 103 (6,5) | 0,32 | 3 (4,2) | 155 (8) | 0,24 | 4 (5,3) | 102 (6,9) | 0,58 |
CASPIAN, estudo de vigilância e prevenção na infância e adolescência de doenças da vida adulta não transmissíveis; CH, cintura hipertrigliceridêmica; GJ, glicemia de jejum; IMC, índice de massa corporal; SM, síndrome metabólica.
Dislipidemia: colesterol total (CT), colesterol de lipoproteína de baixa densidade (LDL‐C) e triglicerídeos (TG) acima do nível correspondente ao 95° percentil específico da idade e do sexo e/ou colesterol de lipoproteína de alta densidade (HDL‐C) abaixo do 5° percentil específico da idade e do sexo; obesidade: IMC ≥ 95° percentil; sobrepeso: 85°<IMC<95° percentil; enzima hepática elevada: alanina aminotransferase (ALT) e aspartato aminotransferase (AST) acima do valor do 90° percentil para crianças e adolescentes iranianos.
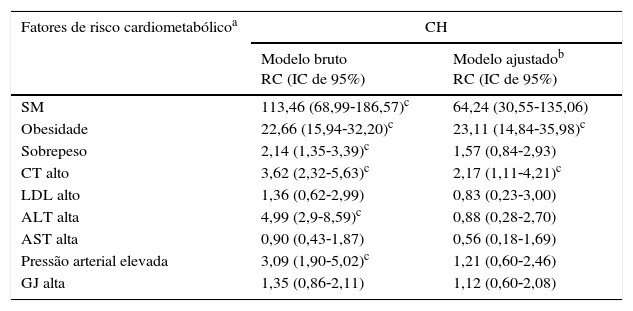
Na tabela 3, a relação do fenótipo CH com os fatores de risco cardiometabólico e as enzimas hepáticas é apresentada após o ajuste pelas variáveis de confusão, como sexo, condição socioeconômica, nível de escolaridade dos pais, histórico familiar de doenças crônicas, estilo de vida sedentário e IMC. Os fatores de risco cardiometabólico foram definidos de acordo com os critérios do Painel de Tratamento de Adultos III (ATP III) modificados para crianças e adolescentes da seguinte forma: sobrepeso: IMC: 85°‐95°; obesidade: IMC>95°; HDL baixo:<40mg/dL, LDL alto:>130mg/dL; TG alto: ≥ 150mg/dL; CT alto:>200mg/dL; GJ alta>100mg/dL; pressão arterial elevada:>95° (ajustados pela idade, sexo e altura).
Associação de fatores de risco cardiometabólico com cintura hipertrigliceridêmica no modelo de regressão logística: o Estudo CASPIAN‐III
| Fatores de risco cardiometabólicoa | CH | |
|---|---|---|
| Modelo bruto RC (IC de 95%) | Modelo ajustadob RC (IC de 95%) | |
| SM | 113,46 (68,99‐186,57)c | 64,24 (30,55‐135,06) |
| Obesidade | 22,66 (15,94‐32,20)c | 23,11 (14,84‐35,98)c |
| Sobrepeso | 2,14 (1,35‐3,39)c | 1,57 (0,84‐2,93) |
| CT alto | 3,62 (2,32‐5,63)c | 2,17 (1,11‐4,21)c |
| LDL alto | 1,36 (0,62‐2,99) | 0,83 (0,23‐3,00) |
| ALT alta | 4,99 (2,9‐8,59)c | 0,88 (0,28‐2,70) |
| AST alta | 0,90 (0,43‐1,87) | 0,56 (0,18‐1,69) |
| Pressão arterial elevada | 3,09 (1,90‐5,02)c | 1,21 (0,60‐2,46) |
| GJ alta | 1,35 (0,86‐2,11) | 1,12 (0,60‐2,08) |
ALT, alanina aminotransferase; AST, aspartato aminotransferase; CASPIAN, estudo de vigilância e prevenção na infância e adolescência de doenças da vida adulta não transmissíveis; CH, cintura hipertrigliceridêmica; CT, colesterol total; GJ, glicemia de jejum; HDL, lipoproteína de alta densidade; LDL, lipoproteína de baixa densidade; SM, síndrome metabólica.
Fatores de risco cardiometabólico de acordo com os critérios do Painel de Tratamento de Adultos III (ATP III) modificados para crianças e adolescentes (sobrepeso: IMC: 85°‐95°; Obesidade: IMC>95°; HDL Baixo:<40mg/dL, LDL alto:>130mg/dL; CT alto:>200mg/dL; GJ alta>100mg/dL; pressão arterial elevada:>95° (ajustados pela idade, sexo e altura).
A CH apresentou associação significativa com elevados níveis de colesterol e ALT, bem como obesidade e HDL‐C baixo (p<0,05).
DiscussãoOs achados deste estudo indicaram que, na faixa etária pediátrica, o fenótipo CH está associado a um nível elevado de colesterol e ALT, bem como à obesidade e HDL‐C baixo.
Embora a utilidade do fenótipo CH na determinação de fatores de risco cardiometabólico tenha sido analisada em alguns estudos anteriores entre a população adulta e em diferentes grupos de pacientes, há poucos estudos nesse campo com a população pediátrica.8–10 A associação do fenótipo CH a enzimas hepáticas elevadas ainda não foi analisada em crianças e adolescentes.
Evidências sugerem que a CH é um fenótipo clínico simples que representa excesso de tecido adiposo visceral. A acumulação de gordura visceral está fortemente associada a fatores de risco cardiometabólico mesmo em crianças.20
A CH é considerada uma ferramenta prática e simples que poderia ser usada como um conceito opcional à SM e poderá ser usada para a triagem de populações de alto risco.21 A CC é um indicador antropométrico associado a alguns fatores metabólicos, incluindo obesidade abdominal, hiperinsulinemia e aumento dos níveis de apolipoproteína. A concentração de TG, outro componente da CH, está associada principalmente a HDL‐C baixo e LDL‐C elevado. O LDL‐C alto poderia ser predito pela hipertrigliceridemia antes de sua manifestação. Sugere‐se que há uma associação entre a hipertrigliceridemia e a presença de pequenas partículas densas de LDL‐C.18,22,23
Neste estudo, a prevalência tanto da CH quanto da SM foi investigada em crianças e adolescentes. Neste estudo, a prevalência de CH foi de 8,5%. A taxa de prevalência de CH relatada em estudos anteriores na faixa etária pediátrica variou entre 6‐8,5%. No Reino Unido,9 Brasil,24 Teerã‐Irã10 e em um estudo nacional no Irã,25 a taxa de prevalência de CH foi de 7,3%, 7,2%, 6,4% e 8,5%, respectivamente.
Diferenças em hábitos de vida, histórico genético, etnia, bem como diferenças em medições laboratoriais, poderiam explicar, pelo menos em parte, as várias taxas de prevalência de CH nas populações estudadas. Além disso, a definição usada para CH não foi semelhante nos estudos mencionados.
Os achados deste estudo mostraram que cerca de 70% dos adolescentes com fenótipo CH atenderam aos critérios da IDF com relação à SM. Conforme relatado em um estudo anterior, adolescentes com o fenótipo CH estão mais propensos a ter SM e apresentar fatores de risco cardiovascular do que adolescentes sem esse fenótipo.10
No presente estudo, foi investigada a associação entre CH e enzimas hepáticas nos adolescentes. Nossos resultados indicaram que participantes com CH apresentaram um nível mais elevado de ALT do que aqueles sem CH. Existe uma associação significativa entre o fenótipo CH e ALT elevada. Não existe associação entre AST e o fenótipo CH. Talvez isso aconteça porque a ALT é considerada uma variável preditora de lesão hepática melhor do que a AST, porque a AST também é produzida em outros tecidos além do hepático.26
Vários estudos demonstraram a correlação entre SM e doença hepática gordurosa não alcoólica (DHGNA),11,27,28 que recentemente se tornou um importante problema de saúde na população pediátrica.28 Enzimas hepáticas elevadas geralmente são usadas como um método não invasivo para detectar casos com DHGNA. Os achados de ambos os estudos no Irã e em outras regiões confirmaram uma associação significativa entre enzimas hepáticas elevadas e fatores de risco cardiometabólico entre crianças e adolescentes. Esses estudos propuseram que ALT e AST elevadas poderiam ser consideradas um fator de risco cardiometabólico e mais um componente de SM na faixa etária pediátrica.11,27,29,30 Os resultados do estudo atual podem servir como uma evidência confirmatória para essa sugestão.
Nossos achados também são compatíveis com um estudo anterior que indicou uma relação significativa entre ALT elevada e fatores de risco cardiometabólico e fenótipo CH entre estudantes de 6 a 18 anos.11,24
Neste estudo, adolescentes com fenótipo CH apresentaram maior frequência de sobrepeso/obesidade, bem como PAS e colesterol total elevados. A GJ e a PAD elevadas eram mais prevalentes em meninas com fenótipo CH do que em outros participantes; ao passo que o HDL‐C baixo era mais prevalente entre meninos com fenótipo CH.
Após o ajuste pela idade, as meninas com fenótipo CH eram mais propensas a apresentar colesterol alto, GJ elevada, PA elevada, SM, obesidade e ALT elevada. O ajuste adicional pelos fatores, incluindo a condição socioeconômica, a escolaridade dos pais, o histórico familiar de doenças crônicas e o estilo de vida sedentário, mostrou que as meninas com fenótipo CH estavam mais suscetíveis a sobrepeso/obesidade, SM, PA elevada e ALT maior.
Após o ajuste pela idade, os meninos eram mais propensos a apresentar colesterol alto, PA elevada, SM, obesidade e ALT elevada. Com o ajuste adicional pelos fatores de confusão mencionados acima, os meninos eram mais propensos a apresentar colesterol alto e SM.
Embora existam experiências limitadas quanto ao desempenho do fenótipo CH na identificação dos fatores de risco cardiometabólico entre crianças e adolescentes, alguns estudos recentes investigaram essa relação. Bailey et al. avaliaram a associação entre CH e distúrbios cardiometabólicos em 234 adolescentes entre 10 e 19 anos no Reino Unido. Eles indicaram que adolescentes com CH apresentaram maior nível de colesterol, GJ e PAD, bem como um nível mais baixo de HDL‐C, do que aqueles sem CH. Em seu estudo, os participantes com fenótipo CH apresentaram escores médios mais elevados com relação a risco cardiometabólico. Adolescentes com fenótipo CH têm maior risco de apresentar HDL‐C baixo, glicemia de jejum prejudicada e fatores de risco cardiometabólico>1 e>2, incluindo hipercolesterolemia, HDL‐C baixo, PAS ou PAD elevada e glicemia de jejum prejudicada, do que aqueles sem esse fenótipo. Eles concluíram que a CH poderia ser um simples marcador de identificação de crianças e adolescentes com alto risco de apresentar fatores de risco cardiometabólico.9
Conceição‐Machado et al. investigaram a prevalência de CH e sua associação com anomalias metabólicas em 1.076 adolescentes brasileiros de 11‐17 anos. Dessa forma, adolescentes com fenótipo CH apresentaram maior nível de obesidade, colesterol não HDL e LDL‐C do que aqueles sem esse fenótipo. Eles relataram uma associação significativa entre o fenótipo CH e o perfil lipídico aterogênico. Eles não encontraram associação entre GJ e fenótipo CH.24
Um estudo entre adolescentes do Teerã demonstrou que o fenótipo CH estava associado à hiperlipidemia e PA elevada, porém não à GJ.10
Nossos resultados a respeito da ausência de associação entre fenótipo CH e GJ são compatíveis com aqueles relatados no Brasil23 e no Irã.10 Contudo, esses resultados não estavam de acordo com os resultados do estudo feito no Reino Unido.8 Os resultados observados poderão ser devido às diferenças nos hábitos alimentares e às diferenças étnicas nas populações estudadas.
Os achados deste estudo estão em linha com nosso estudo nacional anterior, que indicou maior taxa de hiperlipidemia entre adolescentes com fenótipo CH.24 Esses achados sugerem que o fenótipo CH poderia ser usado como uma simples ferramenta de triagem para identificação de crianças e adolescentes de alto risco.
A principal limitação deste estudo foi sua natureza transversal. Além disso, não pudemos determinar o estágio puberal dos participantes e, devido aos efeitos da puberdade sobre o perfil lipídico, principalmente entre meninos, o número de indivíduos com hipertrigliceridemia pode ser superestimado.31
Outra limitação foi a existência de dados em falta em cada variável; contudo, conforme apresentado nas tabelas, o número de dados em falta foi apenas um.
O ponto forte deste estudo foi que estudamos uma grande amostra nacional da população pediátrica. Contudo, apesar da grande amostra estudada, o número de participantes com CH e/ou SM foi pequeno; sem considerar esse grande número de participantes, não pudemos obter um tamanho adequado de amostra de crianças e adolescentes com CH ou SM. Estudos futuros com um número maior de participantes com essas doenças chegariam a resultados mais generalizáveis.
Os outros pontos fortes foram o uso de percentis específicos da idade e sexo para CC e níveis de TG, bem como o estudo de enzimas hepáticas, além de fatores de risco cardiometabólico.
Os achados deste estudo sugerem que o fenótipo CH pode ser usado como ferramenta de triagem para identificar crianças em risco elevado de apresentar ALT elevada e alguns fatores de risco cardiometabólico. Devido à simplicidade, ao baixo custo e à utilidade do índice CH, ele pode ser usado em ambientes de cuidados básicos e grandes estudos epidemiológicos, em vez de medir todos os componentes de SM. Outros estudos longitudinais são necessários para verificar as implicações clínicas dos achados atuais.
FinanciamentoEste estudo foi financiado pela Universidade de Ciências Médicas de Isfahan, Isfahan, Irã.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Kelishadi R, Jamshidi F, Qorbani M, Motlagh ME, Heshmat R, Ardalan G, et al. Association of hypertriglyceridemic‐waist phenotype with liver enzymes and cardiometabolic risk factors in adolescents: the CASPIAN‐III study. J Pediatr (Rio J). 2016;92:512–20.