To present the currently available evidence on transmission, clinical, diagnostic methods, treatment, and prevention methods of major arboviruses that occur in childhood.
Source of dataNon‐systematic review carried out in MEDLINE (PubMed), LILACS (VHL), Scopus, Web of Science, Cochrane, CAPES Portal, and Google Scholar databases for the past five years using the search terms arboviruses, dengue, chikungunya, Zika, Mayaro, and West Nile fever, as well as child, newborn, and adolescent.
Synthesis of dataThe main characteristic of arboviruses is the fact that part of their replication cycle occurs inside insect vectors, thus being classically transmitted to humans through the bite of mosquitoes (hematophagous arthropods), although non‐vector transmission of these viruses is also possible in specific situations. These diseases remain a major public health challenge, due to the lack of specific antiviral treatment, the co‐circulation of different arboviruses in endemic/epidemic regions, the lack of effective and safe immunizations for the vast majority of these viruses, and the great difficulty in vector control, especially in large urban centers.
ConclusionsChildren are especially vulnerable to this group of diseases due to characteristics that facilitate the development of the most severe forms. More detailed knowledge of this group of diseases allows the pediatrician to diagnose them earlier, implement the correct treatment, monitor warning signs for the most severe forms, and establish effective preventive measures.
Apresentar as evidências atualmente disponíveis sobre transmissão, quadro clínico, métodos diagnósticos, tratamento e métodos de prevenção das principais arboviroses que ocorrem na infância.
Fonte de dadosRevisão não sistemática feita nas bases de dados Medline (Pubmed), Lilacs (BVS), Scopus, Web of Science, Cochrane, portal Capes e Google Scholar nos últimos cinco anos, com o uso dos termos arboviroses, dengue, chikungunya, zika, mayaro, febre do oeste do Nilo e criança, recém‐nascido, adolescente.
Síntese de dadosOs arbovírus têm como característica principal o fato de parte de seu ciclo de replicação ocorrer em insetos vetores. Assim, são classicamente transmitidos aos seres humanos pela picada de mosquitos (artrópodes hematófagos), embora seja também possível a transmissão não vetorial desses vírus em situações específicas. Essas doenças ainda constituem um grande desafio na saúde pública, devido à inexistência de tratamento antiviral específico, à cocirculação de diferentes arbovírus em regiões endêmicas/epidêmicas, à falta de imunizações efetivas e seguras para a grande maioria desses vírus e à grande dificuldade do controle vetorial, em especial nos grandes centros urbanos.
ConclusõesAs crianças constituem um grupo especialmente vulnerável a esse grupo de doenças, pois têm características que facilitam o desenvolvimento das formas mais graves. O conhecimento mais detalhado desse grupo de doenças permite ao pediatra diagnosticar mais precocemente, instituir o tratamento correto, vigiar os sinais de alarme para as formas mais graves e colocar em prática efetivas medidas de prevenção.
Nos últimos anos, um aumento expressivo de doenças transmitidas por mosquitos vetores, em especial as arboviroses, como dengue, chikungunya, zika e a febre amarela, tem ocorrido em vários países do mundo. Interferências e modificações dos ecossistemas pela ação humana, o crescimento populacional urbano desordenado, o processo de globalização, a ampliação do intercâmbio internacional e as mudanças climáticas são alguns fatores que provavelmente contribuíram para esse aumento.1
A dengue representa um grave problema de saúde pública, especialmente em regiões tropicais e subtropicais, é a arbovirose mais comum no mundo.2 Nos últimos 5 anos, a incidência de dengue cresceu em torno de 30 vezes, as maiores taxas ocorreram em adultos jovens e as maiores taxas de letalidade em idosos, porém as crianças configuram um grupo especial, pois têm risco maior para a forma grave da doença.3
O vírus da chikungunya foi pela primeira vez descrito em 1952 durante sua epidemia em Makonde, uma província no sul da Tanzânia. Desde então, o vírus da chikungunya tem causado milhões de infecções em humanos na África, nas ilhas do Oceano Índico, Ásia, Europa e nas Américas.4
A primeira descrição de infecção pelo vírus zika em humanos ocorreu em 1952, a partir do seu isolamento em 1947 em um macaco Rhesus sentinela usado em estudos sobre a febre amarela na floresta Zika, próxima a Entebbe, antiga capital de Uganda. Desde então, esse vírus passou a ser associado a infecção em seres humanos e tem se espalhado em diferentes países da África e da Ásia. A primeira epidemia de infecção pelo vírus zika ocorreu na ilha Yap (Micronésia) em 2007. A seguir, novas epidemias ocorreram em 2013 na Polinésia francesa, em 2014 na ilha de Páscoa (Chile) e em 2015 nas Américas.5
Mais recentemente, em 2017/2018, foi registrado um dos eventos mais expressivos da história da febre amarela no Brasil, a dispersão do vírus atingiu a costa leste brasileira, na região do bioma Mata Atlântica contínua a megalópoles como São Paulo e Rio de Janeiro, o que aumentou o risco de reurbanização da doença.6,7
A febre do mayaro e a febre do oeste do Nilo também representam importantes arboviroses, em especial nos países das Américas.8
Esse grupo de doenças ainda se constitui em um grande desafio diagnóstico e de abordagem terapêutica e preventiva, em especial durante a infância, pelo fato da cocirculação de diferentes arboviroses, de não se dispor ainda de tratamento antiviral específico, de o tratamento ser apenas sintomático, de sua contenção limitar‐se ao controle vetorial e, com exceção da febre amarela, ainda não dispormos de uma imunização eficaz.
Fonte dos dadosUma revisão não sistemática foi feita nas bases de dados Medline (Pubmed), Lilacs (BVS), Scopus, Web of Science, Cochrane, portal Capes e Google Scholar, compreendeu os últimos 5 anos, usou‐se a seguinte estratégia: (“Arboviruses” OR “Arbovirus” OR “Arbovirus infection” OR “Arbovirus infections” OR “Flavivirus” OR “Dengue” OR “Zika” OR “Chikungunya” OR “Yellow Fever” OR “Mayaro” OR “West Nile Virus”) e (“Child” OR “Children” OR “Minors” OR “Infant” OR “Newborn” OR “Neonate” OR “neonatal” OR “adolescent” OR “adolescence” OR “teen” OR “teenager” OR “youth”). Após avaliação criteriosa, que tomou por base a relação com o tema proposto, foram selecionados artigos que abordavam as arboviroses no período neonatal, na infância e/ou na adolescência. A ordem da descrição das diferentes arboviroses, a seguir, respeita a frequência delas, da mais prevalente para as menos prevalentes.
DengueTransmissãoA principal forma de transmissão do vírus da dengue, assim como ocorre na chikungunya, zika e febre amarela, em humanos é através da picada das fêmeas infectadas dos mosquitos Aedes aegypti.4,5,9,10 O Aedes aegypti é um mosquito urbano de hábitos diurnos, cujas fêmeas depositam seus ovos em recipientes ou criadouros naturais que armazenem água da chuva. A fêmea, uma vez infectada, transmitirá o vírus por toda a vida (6 a 8 semanas), há a possibilidade de parte de suas descendentes já nascerem portadoras do vírus, por conta de transmissão transovariana.11,12 O Aedes albopictus é o vetor de manutenção de arboviroses na Ásia, já presente nas Américas, associado à transmissão desses vírus nessas regiões.13
Dengue por transmissão não vetorial pode ocorrer através da transfusão sanguínea, transplante de órgãos, acidentes perfuro‐cortantes e escoriações de mucosa.9
A transmissão vertical é comum em gestantes com viremia no momento do parto. O vírus da dengue pode ser encontrado no leite materno, pode ser mais uma via de transmissão do vírus da dengue.10,12,14
PatogêneseO período de transmissibilidade compreende dois ciclos: um intrínseco, que ocorre no ser humano, e outro extrínseco, que ocorre no vetor.15 Quando a fêmea do mosquito se alimenta do sangue humano no período de viremia (24 horas antes do surgimento da febre até o sexto dia da doença), o vírus infecta o intestino médio do mosquito, onde se reproduz e se dissemina até as glândulas salivares. Esse período de incubação extrínseco dura de 8 a 12 dias. Após esse período, o vírus pode ser transmitido para humanos durante futuros repastos (alimentação sanguínea para obtenção de nutrientes necessários ao desenvolvimento dos ovários e maturação dos ovos). Os sintomas normalmente surgem de 4 a 12 dias após a picada do mosquito (período intrínseco).16
Após a picada do mosquito infectado, o vírus se espalha para os linfonodos locais, se dissemina para o sistema reticulo‐endotelial, onde se prolifera e causa a viremia. A viremia está associada ao quadro febril e aos sintomas sistêmicos iniciais que duram em torno de 4 a 5 dias.11
A forma grave da dengue, que ocorre após o período de defervescência, manifesta‐se por extravasamento de plasma, leva a um quadro de choque hipovolêmico e acúmulo de líquidos em diversos órgãos, a sinais de disfunção orgânica no coração, nos pulmões, nos rins, no fígado e/ou no sistema nervoso central (SNC), além de possibilidade de sangramento grave.17 Ainda não são claramente compreendidos os mecanismos responsáveis pela forma grave da doença, porém é aceito que uma infecção secundária por um outro sorotipo seja um dos principais fatores de risco.9
Uma das explicações para essa fisiopatologia foi primeiramente postulada por Halstead et al.,18 através do modelo de aprimoramento dependente de anticorpos. Esse modelo descreve que os anticorpos com reatividade cruzada de uma infecção prévia por um sorotipo distinto do vírus facilitariam a endocitose do vírus em células do sistema imune, como monócitos, macrófagos e células dendríticas, através dos receptores Fc expressos em suas superfícies, resulta em amplificação da cascata inflamatória que potencialmente leva à lesão endotelial, com consequente extravasamento capilar e coagulopatia de consumo.9
Apesar disso, nem todos os casos graves apresentam infecções prévias por distintos sorotipos do vírus da dengue, o que acarretou a postulação de outras explicações fisiopatogênicas para a forma grave da doença. Estudos recentes buscam mutações no próprio gene do vírus que o tornariam mais resistente ao sistema imunológico, o tornariam mais reprodutível tanto em humanos como nos vetores.9 Alguns polimorfismos no gene humano parecem também ter um papel de proporcionar maior ou menor suscetibilidade à infecção pelo vírus da dengue, contribui para gênese de sua forma mais grave.9
Quadro clínicoA dengue na criança pode ser assintomática ou apresentar‐se como uma síndrome febril com sinais e sintomas inespecíficos: adinamia, sonolência, recusa da alimentação e de líquidos, vômitos e diarreia. Nos menores de dois anos o início da doença pode passar despercebido e o quadro grave da doença ser identificado como a primeira manifestação clínica, pois os sinais de alarme não são tão facilmente detectados nessa faixa etária.17
Classicamente, três fases clínicas podem ocorrer: febril, crítica e de recuperação.
- 1)
Fase febril:A primeira manifestação clássica da dengue é a febre com duração de dois a sete dias, geralmente alta (39° C a 40° C), com sintomas sistêmicos associados. O exantema está presente em 50% dos casos, predominantemente maculopapular, atinge principalmente face, tronco e membros, não poupa plantas dos pés e palmas das mãos.17
- 2)
Fase crítica:Pode estar presente em alguns pacientes, evoluir para a forma grave da doença. Ocorre após a defervescência, entre o terceiro e sétimo dia de doença. Os sinais de alarme nessa fase devem ser rotineiramente pesquisados e valorizados, pois a presença deles indica internação hospitalar imediata.17A forma grave da doença é caracterizada pela presença de choque secundário ao extravasamento capilar, hemorragias graves e/ou a presença de disfunções graves de órgãos (hepatites, encefalites ou miocardites).8 Fatores de risco individuais determinam a gravidade da doença, entre eles a idade. Crianças mais novas têm menor capacidade de compensar o extravasamento capilar e estão consequentemente em maior risco do choque secundário à dengue.12
- 3)
Fase de recuperação:Após a fase crítica há reabsorção gradual do conteúdo extravasado com progressiva melhoria clínica. Cuidados com hiper‐hidratação são essenciais nessa fase. Novo rash cutâneo, pruriginoso ou não pode, ocorrer. Infecções bacterianas secundárias ocorrem nessa fase e contribuem para a letalidade da doença.17
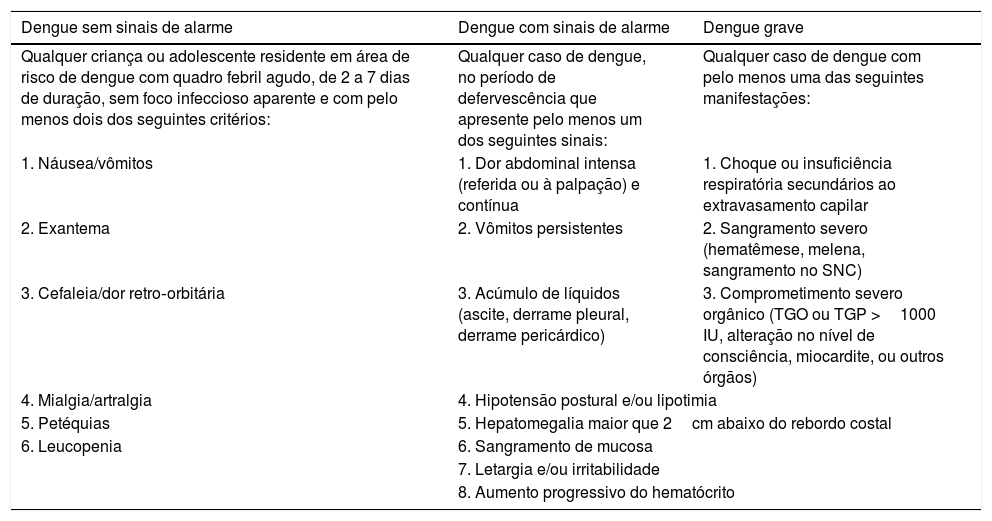
A tabela 1 descreve as principais características clínicas e laboratoriais na classificação da dengue na infância.
Classificação da dengue na infância
| Dengue sem sinais de alarme | Dengue com sinais de alarme | Dengue grave |
|---|---|---|
| Qualquer criança ou adolescente residente em área de risco de dengue com quadro febril agudo, de 2 a 7 dias de duração, sem foco infeccioso aparente e com pelo menos dois dos seguintes critérios: | Qualquer caso de dengue, no período de defervescência que apresente pelo menos um dos seguintes sinais: | Qualquer caso de dengue com pelo menos uma das seguintes manifestações: |
| 1. Náusea/vômitos | 1. Dor abdominal intensa (referida ou à palpação) e contínua | 1. Choque ou insuficiência respiratória secundários ao extravasamento capilar |
| 2. Exantema | 2. Vômitos persistentes | 2. Sangramento severo (hematêmese, melena, sangramento no SNC) |
| 3. Cefaleia/dor retro‐orbitária | 3. Acúmulo de líquidos (ascite, derrame pleural, derrame pericárdico) | 3. Comprometimento severo orgânico (TGO ou TGP >1000 IU, alteração no nível de consciência, miocardite, ou outros órgãos) |
| 4. Mialgia/artralgia | 4. Hipotensão postural e/ou lipotimia | |
| 5. Petéquias | 5. Hepatomegalia maior que 2cm abaixo do rebordo costal | |
| 6. Leucopenia | 6. Sangramento de mucosa | |
| 7. Letargia e/ou irritabilidade | ||
| 8. Aumento progressivo do hematócrito | ||
Fonte: Pan American Health Organization – PAHO (2017),8 com adaptações.
Paixão et al.19 demonstraram que dengue sintomática em gestantes está associada a um risco maior de abortos espontâneos, natimortalidade, prematuridade e baixo peso ao nascer. Quando o quadro clínico na mãe ocorre próximo ao momento de parto, a doença fetal ou neonatal pode ser grave, simula um quadro de sepse neonatal associada a trombocitopenia.
DiagnósticoLeucopenia com aumento de linfócitos atípicos e trombocitopenia são comuns na fase febril. Na fase crítica pode‐se observar concentração do hematócrito, alterações no coagulograma, além da permanência de leucopenia e trombocitopenia.9
Transaminases aumentadas podem ocorrer em qualquer fase da doença, refletem o envolvimento tanto muscular como hepático. Hipoproteinemia e hipoalbunemia podem ocorrer na fase crítica, mas podem estar mascaradas pela hemoconcentração.9
O método para confirmação laboratorial da dengue dependerá do número de dias da doença:
- 1)
Detecção de antígenos virais: NS1, isolamento viral, reação da transcriptase reversa, seguida de reação em cadeia de polimerase (RT‐PCR) e imuno‐histoquímica – até o quinto dia do início dos sintomas. Resultado positivo confirma a doença, resultado negativo indica coleta de sorologia.8,17
- 2)
Sorologia (Método Enzyme‐Linked Immunosorbent Assay – Elisa) – a partir do sexto dia do inicio dos sintomas.8,17 IgM para o vírus da dengue é detectada a partir do quarto dia da doença, com pico entre 10 e 14 dias, desaparece depois de 3 meses.9 IgG apresenta concentrações baixas no fim da primeira semana, com aumento gradual ao longo do tempo e positividade para o resto da vida.9
Há elevada chance de reação cruzada das sorologias de dengue com outras infecções por flavivírus como os vírus da zika e da febre amarela.9 Esse é um dos principais desafios no diagnóstico da dengue.
TratamentoNão existe um tratamento específico para a dengue. O tratamento é sintomático e baseado na classificação da doença em 4 grupos: grupo A (dengue sem sinais de alerta), grupo B1 (dengue sem sinais de alerta porém com comorbidade ou risco social), grupo B2 (dengue com sinais de alerta) e grupo C (forma grave da doença).8
Os pacientes do grupo A devem ser orientados para repouso e hidratação oral, uso de paracetamol e/ou dipirona para febre e/ou dor, com orientação de não uso de salicilatos ou anti‐inflamatórios não esteroides.17
Pacientes dos grupos B e C devem ser referenciados a unidades de internação hospitalar para coleta de exames, tratamento sintomático e monitoração. A internação hospitalar também está indicada naqueles com recusa de alimentos e líquidos, nos pacientes com comprometimento respiratório, com comorbidades descompensadas, nas gestantes e nos menores de 2 anos.8,9,11,17 A alta hospitalar está atrelada à presença dos seguintes critérios: estabilização hemodinâmica durante 48 horas, ausência de febre por 48 horas sem uso de antitérmicos, melhoria do quadro clínico, hematócrito normal e estável por 24 horas e plaquetas em elevação e acima de 50.000/mm3.17
Importante lembrarmos que o manejo adequado de crianças e adolescentes com dengue depende do reconhecimento precoce dos sinais de alerta, do contínuo monitoramento, do reestadiamento dos casos em acompanhamento ambulatorial ou hospitalar e da pronta reposição hídrica.
ChikungunyaTransmissãoAlém da transmissão vetorial pela espécie Aedes (aegypti e albopictus), transmissão vertical nas gestantes com viremia no período periparto e a transmissão através da transfusão de componentes sanguíneos de pessoas na fase de viremia da doença também são descritos.20,21
PatogêneseOs sinais clínicos surgem 2 a 4 dias após a picada do mosquito infectado. O vírus se reproduz no sistema reticuloendotelial. A febre é decorrente da viremia inicial e grande parte dos sintomas clínicos presentes na primeira semana da doença é decorrente do processo de eliminação viral pelo sistema imune, com elevação principalmente do interferon tipo 1. O clássico envolvimento articular envolve proliferação vascular, macrófagos perivasculares e hiperplasia sinovial. Também podem ocorrer sinovite, entesopatia e reações periosteais. O mecanismo exato da artrite ainda é desconhecido, porém mecanismos autoimunes e a persistência viral em macrófagos sinoviais podem fazer parte da fisiopatogenia da fase crônica da doença.11,22
Quadro clínicoApós um período de incubação entre um e 12 dias, a fase aguda da doença é classicamente descrita por febre maior do que 39°C associada a poliartralgia simétrica, com resolução espontânea entre 7 a 10 dias. Outros sintomas comuns são: cefaleia, náuseas e vômitos, mialgia, exantema e conjuntivite não purulenta. Casos mais graves são descritos: encefalite, doenças neurológicas autoimunes (síndrome de Guillain‐Barré e paralisias faciais), uveíte, retinite, miocardite, hepatite e nefrite.8
As fases pós‐aguda (da semana 4 até o fim do terceiro mês) e crônica (a partir do quarto mês) da doença se caracterizam principalmente pela manutenção de sintomas articulares, muitas vezes com necessidade de intervenções medicamentosas para alívio dos sintomas e consequente melhoria na qualidade de vida.8
A infecção pelo vírus chikungunya em crianças tem algumas diferenças clínicas quando comparada aos adultos. As crianças apresentam mais formas assintomáticas da doença. Quando sintomáticas, os sintomas dermatológicos e neurológicos são mais comuns, enquanto os sintomas articulares são menos frequentes.23,24
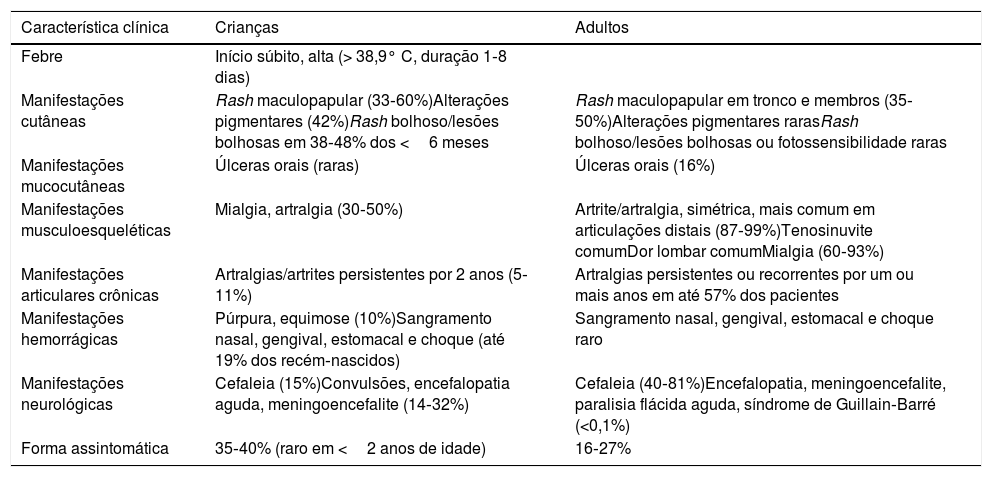
A tabela 2 resume as principais diferenças no quadro clínico entre crianças e adultos.
Apresentação clínica da chikungunya em crianças versus adultos
| Característica clínica | Crianças | Adultos |
|---|---|---|
| Febre | Início súbito, alta (> 38,9° C, duração 1‐8 dias) | |
| Manifestações cutâneas | Rash maculopapular (33‐60%)Alterações pigmentares (42%)Rash bolhoso/lesões bolhosas em 38‐48% dos <6 meses | Rash maculopapular em tronco e membros (35‐50%)Alterações pigmentares rarasRash bolhoso/lesões bolhosas ou fotossensibilidade raras |
| Manifestações mucocutâneas | Úlceras orais (raras) | Úlceras orais (16%) |
| Manifestações musculoesqueléticas | Mialgia, artralgia (30‐50%) | Artrite/artralgia, simétrica, mais comum em articulações distais (87‐99%)Tenosinuvite comumDor lombar comumMialgia (60‐93%) |
| Manifestações articulares crônicas | Artralgias/artrites persistentes por 2 anos (5‐11%) | Artralgias persistentes ou recorrentes por um ou mais anos em até 57% dos pacientes |
| Manifestações hemorrágicas | Púrpura, equimose (10%)Sangramento nasal, gengival, estomacal e choque (até 19% dos recém‐nascidos) | Sangramento nasal, gengival, estomacal e choque raro |
| Manifestações neurológicas | Cefaleia (15%)Convulsões, encefalopatia aguda, meningoencefalite (14‐32%) | Cefaleia (40‐81%)Encefalopatia, meningoencefalite, paralisia flácida aguda, síndrome de Guillain‐Barré (<0,1%) |
| Forma assintomática | 35‐40% (raro em <2 anos de idade) | 16‐27% |
Modificado de Ritz et al.24
A infecção neonatal pelo vírus da chikungunya ocorre em cerca de 50% das gestantes com viremia no período periparto.20 Em recém‐nascidos, os sintomas tendem a ocorrer entre 3 e 7 dias de vida, variam de uma apresentação clínica leve (43%) a severa, com encefalite pelo vírus (53%), que requer tratamento intensivo neonatal.25 Os sintomas mais comumente observados nessa faixa etária são febre, irritabilidade, hiperalgesia, edema de membros, rash, meningoencefalite26 e quadros clínicos semelhantes à sepse neonatal.20 A letalidade estimada nos recém‐nascidos está em torno de 2,8% e acometimento do neurodesenvolvimento em longo prazo pode ocorrer em 50% dos casos sintomáticos.20
DiagnósticoLeucopenia (especialmente linfopenia), trombocitopenia, aumento das transaminases e hipocalcemia podem ser observados.23 O método para confirmação laboratorial dependerá do número de dias da doença:
- 1)
Detecção de antígenos virais por RT‐PCR – até o quinto dia após início dos sintomas. Resultado positivo confirma a doença, resultado negativo indica coleta de sorologia.8
- 2)
Sorologia (Método Elisa) – a partir do sexto dia do início dos sintomas.8 Métodos sorológicos para o vírus da chikungunya podem apresentar resultados falso positivos por reação cruzada com outras infecções virais, como o vírus mayaro. Portanto, em áreas onde há circulação de ambos os vírus, métodos mais específicos devem ser usados (teste de neutralização por redução de placas – PRNT, do inglês plaque‐reducing neutralization test).4,23 O pico no aumento da IgM ocorre entre 3 e 5 semanas após início dos sintomas, com declínio após 2 meses.24 Níveis de IgG são detectados uma semana após o início dos sintomas e persistem por toda a vida.24
Não existe um tratamento antiviral específico para o vírus da Chikungunya. A resolução espontânea dos sintomas ocorre entre 7 a 10 dias na maior parte dos casos.23 O tratamento recomendado é hidratação e controle da febre e dos sintomas álgicos.8
Nas crianças se recomenda o uso inicial de analgésicos, como paracetamol ou dipirona.4 As drogas analgésicas de segunda linha que podem ser tentadas incluem o tramadol e a codeína (essa somente a partir dos 12 anos).8 Não se recomenda o uso de anti‐inflamatórios não esteroidais (em especial o ácido acetilsalicílico) na fase aguda da doença, em especial nas áreas onde coexistem infecções pelo vírus da dengue, pelo risco de sangramento.4,8,23 Não se recomenda o uso de corticoides nessa fase.4,8,23
Nos casos que evoluem para a fase crônica da doença, anti‐inflamatórios não esteroidais e corticoides podem ser tentados. Nos casos mais refratários, podem‐se tentar medicamentos para doença neuropática, como gabapentina e pregabalina.27 Fisioterapia motora também está indicada nos casos crônicos.8
Nos casos sintomáticos por transmissão vertical, a internação com monitoração do recém‐nascido e cuidados sintomáticos devem ser instituídos. Os recém‐nascidos assintomáticos, filhos de mães com viremia periparto confirmada, devem ser monitorados por pelo menos 5 dias, inclusive curva térmica, qualidade do aleitamento materno, sinais de dor, atenção a anormalidades cutâneas e hidratação.8
ZikaTransmissãoAlém da transmissão vetorial pelos Aedes aegypti e Aedes albopictus, a transmissão por via sexual e transplacentária é documentada na literatura.5 A transmissão sexual pode ocorrer do homem para mulher, da mulher para o homem e do homem para o homem. O vírus da Zika é presente no sêmen por até 141 dias e nas secreções vaginais por 14 dias.28,29
A transmissão vertical pode ocorrer em qualquer momento da gestação. O vírus da zika causa infecção placentária e também pode ser encontrado no líquido amniótico de gestantes infectadas.5 O vírus da zika também já foi isolado no leite humano,30 na urina, na saliva e nas lágrimas, mas infecções por essas vias ainda não foram relatadas.31
Quadro clínicoO quadro agudo pelo vírus zika em crianças parece ser bastante semelhante àquele apresentado em adultos.32 O período de incubação é de 3 a 14 dias, com estimativa de 80% dos casos serem assintomáticos.32 A febre geralmente é baixa (< 38,5° C) e o rash maculopapular surge num padrão cefalocaudal, afeta palmas das mãos e plantas dos pés. O prurido é muito comum e pode ser intenso.8
Duas revisões recentes sobre as manifestações pós‐natais da infecção pelo vírus zika na infância foram publicadas33,34 e evidenciaram que os sintomas mais comuns nessa faixa etária são rash, febre, conjuntivite e artralgia. Outros sintomas também relatados: mialgia, queixas gastrointestinais, dor retro‐orbitária e sintomas do trato respiratório superior. Nessas séries de casos, complicações neurológicas ou mortes não foram reportadas, somente um relato de um paciente com coinfecção pelo vírus da dengue que apresentou hipotensão e trombocitopenia.34
Complicações neurológicas associadas à infecção pelo vírus zika relatadas na literatura incluem a síndrome de Guillain‐Barré, polineuropatia periférica, mielite aguda e meningoencefalite.5,35
Séries de casos têm descrito algumas características congênitas e pós‐natais da infecção intraútero pelo vírus zika. Além da microcefalia, esse grupo de crianças pode apresentar retardo do crescimento intrauterino, redução do volume cerebral, malformações cerebrais (especialmente calcificações subcorticiais, ventriculomegalia e defeitos de migração cortical), desproporção craniofacial, além do acúmulo de pele na região occipital.36 O desenvolvimento de microcefalia pós‐natal em crianças expostas ao vírus zika intraútero também é relatado,37 além de efeitos negativos no crescimento e no desenvolvimento infantil.38,39 Outras características da infecção congênita pelo vírus zika são anormalidades oculares, hiperexcitabilidade, hipertonia, irritabilidade, epilepsia e artrogripose.36,39
A prevalência de defeitos congênitos e/ou anormalidades do neurodesenvolvimento relacionadas à exposição intraútero ao vírus zika se encontra entre 6 e 9% entre os recém‐nascidos expostos.40 A letalidade da infecção congênita confirmada ou provável pelo vírus zika se encontrou entre 4 a 6% numa coorte de recém‐nascidos brasileiros.41
DiagnósticoO Centers for Disease Control and Prevetion (CDC)42 recomenda para o diagnóstico de infecção pelo vírus Zika:
- •
< 14 dias após inicio dos sintomas: RT‐PCR no soro e/ou na urina;
- •
A partir de 14 dias após início dos sintomas: IgM para o vírus zika pelo método MAC‐Elisa, inclusive o teste de neutralização por redução de placas para o diagnóstico diferencial com outras arboviroses. Níveis de IgM podem ser detectados na primeira semana da infecção e persistir por até 8‐12 semanas.42
- •
Infecção congênita pelo vírus zika: RT‐PCR e IgM para vírus zika no soro e na urina do recém‐nascido. Esses mesmos exames podem ser solicitados no líquido cefalorraquidiano, placenta e líquido amniótico.42
O tratamento das infecções sintomáticas na infância é de suporte, inclusive hidratação e antitérmicos/analgésicos, deve‐se evitar o uso de anti‐inflamatórios não esteroidais pelo risco de coinfecção pelo vírus da dengue.8
Nos casos de infecção congênita, os recém‐nascidos devem ser seguidos por equipe multiprofissional. O exame neurológico deve ser feito ao nascer e repetido nos dois primeiros anos de vida e a criança deve ser referenciada para acompanhamento com neuropediatra. Exame oftalmológico deve ser feito no primeiro mês de vida e repetido com 3 meses. Potencial evocado auditivo do tronco encefálico deve ser feito no primeiro mês de vida e repetido entre 4‐6 meses. A estimulação precoce com terapias como fisioterapia motora e fonoaudiologia deve ser indicada.5
Febre amarelaTransmissãoA transmissão do vírus da febre amarela a humanos ocorre através da picada do mosquito Haemagogus ou Sabethes em áreas florestais e pelo Aedes aegypti nas áreas urbanas.8
Quadro clínicoO período de incubação varia entre 3 e 15 dias e o período de transmissibilidade vai de 24 a 48 horas antes e até 3 a 5 dias após o inicio dos sintomas.43 O mosquito infectado transmite o vírus por 6 a 8 semanas.43
O espectro clínico pode variar desde infecções assintomáticas até quadros graves e fatais (tabela 3).
Manifestações clínicas e laboratoriais comuns na febre amarela43
| Forma | Sinais e sintomas | Alterações laboratoriais |
|---|---|---|
| Leve/moderada | Febre, cefaleia, mialgia, náuseas, icterícia ausente ou leve | PlaquetopeniaElevação moderada de transaminasesBilirrubinas normais ou discretamente elevadas (predomínio de direta) |
| Grave | Todos os anterioresIcterícia intensaManifestações hemorrágicasOligúriaDiminuição da consciência | Plaquetopenia intensaAumento de creatininaElevação importante de transaminases |
| Maligna | Todos os sintomas da forma grave intensificados | Todos os anterioresCoagulação intravascular disseminada |
Deve ser considerado caso suspeito crianças com exposição em área afetada recentemente (surto) ou em ambientes rurais e/ou silvestres, com até sete dias de quadro febril agudo, acompanhado de dois ou mais dos seguintes sinais e sintomas: cefaleia, mialgia, lombalgia, mal‐estar, calafrios, náuseas, icterícia e/ou manifestações hemorrágicas, que não tenha comprovante de vacinação de febre amarela ou que tenha recebido a primeira dose há menos de 30 dias.43
Transmissão perinatal do vírus da febre amarela é relatada, assim como a transmissão antenatal, mas ambas são extremamente raras.44
Existe o risco de transmissão do vírus vacinal para a criança pelo leite materno, caso a mãe receba a vacina durante o período de aleitamento até o sexto mês de vida da criança. No caso de necessidade de vacinação da mãe durante esse período, recomenda‐se que o aleitamento seja suspenso por 10 dias.43
DiagnósticoDeve‐se solicitar hemograma completo, transaminases, bilirrubinas, provas de coagulação e elementos anormais na urina. Albuminúria está presente em 90% dos pacientes, o que auxilia no diagnóstico diferencial com as hepatites.8
RT‐PCR deve ser solicitado até o quinto dia após início da doença para detecção do vírus e confirmar a doença. A presença de IgM contra o vírus da febre amarela em crianças não vacinadas ou o aumento de quatro ou mais vezes nos títulos de IgG em crianças vacinadas também confirma a doença.8
TratamentoA conduta inicial vai depender dos achados clínicos e laboratoriais43:
- 1.
Acompanhamento ambulatorial com sintomáticos e hidratação oral pode ser feito quando se observarem:
- •
Formas clínicas leves ou moderadas;
- •
Pacientes em regular estado geral, hidratados, sem vômitos, sem história de hemorragia e com nível de consciência normal;
- •
Exames laboratoriais normais ou com alterações discretas;
- •
Possibilidade de retorno ao serviço de saúde;
- •
Presença de pessoas no domicílio que possam observar sinais de pioria (persistência de febre alta por mais de quatro dias e ou surgimento dos sinais: icterícia, hemorragias, vômitos, diminuição da diurese).
- 2.
Hospitalização está indicada na presença de pelo menos uma das seguintes situações: paciente desidratado, presença de vômitos, hemorragia ativa, alteração no nível de consciência, leucopenia, plaquetopenia, hemoconcentração, transaminases maiores do que duas vezes o limite superior, bilirrubina 1,5 vez maior do que o limite superior, presença de proteinúria e provas de coagulação anormais.
Nos pacientes internados, além da administração de sintomáticos e da hidratação venosa, recomenda‐se a monitoração e correção de distúrbios eletrolíticos, de glicemia, acidobásicos e de coagulação.43
Febre do mayaroO vírus mayaro é principalmente transmitido por mosquitos do gênero Haemagogus, Culex, Mansonia, Aedes psorophora, Sabethes e Coquillettidia.8,45 A fase aguda é caracterizada pela presença de febre por 3 a 5 dias, cefaleia, dor retro‐ocular, mialgia e prostração. A artralgia é a principal manifestação da doença, geralmente simétrica, afeta principalmente punhos, dedos, tornozelos e pés. No fim da fase febril, a artralgia é acompanhada por rash ou lesões petequiais.8,45 Não há relatos na literatura de infecção pré‐natal ou perinatal pelo vírus mayaro.25
O diagnóstico é feito por RT‐PCR ou Elisa (IgM) para o vírus Mayaro no sangue. Reação cruzada nos testes sorológicos pode ocorrer com o vírus da Chikungunya.8 Em áreas onde há circulação de ambos os vírus, métodos mais específicos devem ser utilizados como o teste de neutralização por redução de placas – PRNT.46 IgM para o vírus mayaro surge 3 dias após o início dos sintomas, persiste por cerca de 3 meses, enquanto a IgG pode persistir por anos.45
O tratamento é apenas sintomático.8,45
Febre do oeste do NiloO vírus do oeste do Nilo é tipicamente transmitido pela picada dos mosquitos do gênero Culex e Aedes. Transmissões por derivados sanguíneos e por transplante de órgãos também são relatadas na literatura.8
Após um período de incubação de 2 a 15 dias, a infecção pelo vírus do oeste do Nilo é leve e autolimitada em mais de 80% dos casos. Em menos de 20% dos casos a doença se apresenta como um quadro de febre, cefaleia, fadiga, prostração, mialgia, fraqueza, sintomas gastrointestinais, linfadenomegalia e rash maculopapular não pruriginoso morbiliforme no tronco e extremidades, poupa palmas das mãos e plantas dos pés. Esse quadro é autolimitado na maior parte dos casos.46
Em menos de 1% dos casos, ocorre a doença neuroinvasiva pelo vírus do oeste do Nilo, caracterizada por encefalite, meningite e paralisia flácida. O líquido cefalorraquidiano apresenta pleocitose linfocítica.47 Esse grupo de pacientes pode se recuperar totalmente, mas também pode apresentar sequelas neurológicas ou evoluir para óbito.8
Apesar de extremamente raro, há relatos de transmissão vertical tanto durante a gestação como no período perinatal. Recém‐nascidos infectados podem apresentar rash, coriorretinite e/ou encefalite.25
O diagnóstico é dificultado pela alta taxa de mutações do vírus, pelas baixas cargas virais, pelo baixo tempo de viremia (até 7 dias) e pela reação cruzada com outros vírus, como o da dengue e o vírus da encefalite japonesa, e naqueles vacinados para a febre amarela.46 Recomenda‐se a feitura do RT‐PCR e Elisa para IgM e IgG específicos no sangue e, nos casos de doença neuroinvasiva, também no líquor.8 O tratamento também é sintomático e de suporte.8,46
Prevenção das arbovirosesAs atuais medidas de controle e prevenção para a transmissão das arboviroses estão centradas no combate aos vetores. O Aedes aegypti é um mosquito doméstico com hábitos diurnos. Apenas a fêmea se alimenta de sangue humano, sobretudo ao amanhecer e ao entardecer, para se reproduzir. A reprodução acontece em água parada (limpa ou suja). Assim, medidas comunitárias para o combate ao mosquito devem ser estimuladas, como a higiene e limpeza semanais de locais de reserva de água, manutenção de reservatórios de água tampados e eliminação de recipientes com água parada desnecessária.47
Os repelentes de uso tópico, aplicados na pele, fazem parte dos cuidados preventivos às arboviroses. Os repelentes mais usados são à base de DEET (N,N‐dietil‐3‐metilbenzamida), IR 3535 e Icaridina.47 IR3535 na concentração de 20% pode ser usado a partir dos 6 meses de vida.48 Produtos à base de DEET e a Icaridina não devem ser usados em crianças menores de dois anos. Entre 2 e 12 anos, a concentração máxima do produto deve ser de 10% e a aplicação deve se restringir a três vezes por dia. Repelentes devem ser aplicados nas áreas expostas do corpo e por cima da roupa e para aplicação na forma spray no rosto ou em crianças deve‐se aplicar primeiro nas palmas das mãos e posteriormente espalhar no rosto ou no corpo, seguido da adequada lavagem das mãos.47
Outra importante medida de prevenção reside no desenvolvimento de vacinas. Essas podem interromper o ciclo natural de epidemias e a propagação das arboviroses.
A única vacina para dengue aprovada pela WHO é a CYD‐TDV, uma vacina quadrivalente de vírus atenuado. Apesar da eficácia comprovada a partir dos nove anos em pacientes soropositivos para um dos sorotipos da dengue, observou‐se um aumento no risco de hospitalização e desenvolvimento da forma grave da doença em paciente soronegativos. Assim, a WHO recomenda a CYD‐TDV somente em pacientes entre 9 e 45 anos e que sejam soropositivos.49 Duas novas vacinas para dengue se encontram em fase 3 de pesquisa (TV003/TV005; NCT02406729, ClinicalTrials.gov e NCT02747927, ClinicalTrials.gov) com resultados promissores.9
Até o momento, não há vacinas disponíveis contra o vírus da chikungunya e da zika para uso na população. Ensaios clínicos em fases 1 e 2 estão em andamento.4,50 Vacinas contra o vírus mayaro e o vírus do oeste do Nilo também não estão disponíveis.45,46
A vacina da febre amarela é recomendada para todos os habitantes ou viajantes para países ou áreas de risco de transmissão da doença. É uma vacina de vírus atenuado, dose única, confere imunidade para o resto da vida. A eficácia da vacina é próxima a 100%. A vacinação é recomendada a partir dos 9 meses de vida. Pode ser indicada entre 6 e 8 meses de vida em áreas onde o risco de contaminação seja muito alto.8,43
ConclusãoFaz‐se extremamente necessário o controle das arboviroses no Brasil e no mundo em função do limitado arsenal terapêutico e da carência de vacinas que previnam esse grupo de infecções. Esse controle pode ser alcançado através das vigilâncias epidemiológica e entomológica contínuas, educação contínua dos profissionais de saúde e da população e pelo controle vetorial eficiente.
As crianças constituem um grupo especialmente vulnerável a esse grupo de doenças, pois têm características que facilitam o desenvolvimento das formas mais graves. O conhecimento mais detalhado dessas doenças permite ao pediatra diagnosticar mais precocemente, instituir o tratamento correto, vigiar os sinais de alarme para as formas mais graves e colocar em prática efetivas medidas de prevenção.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.