Data on clinical practice in pediatrics on the use of analgesic, antipyretic, and nonsteroidal anti‐inflammatory drugs (NSAIDs) considering the best available evidence and regulatory‐agency approved use are uncertain. This study aimed to determine the frequency of prescription of these drugs according to the best scientific evidence and use approved by regulatory agencies.
MethodsThis was a cross‐sectional study of 150 pediatric prescriptions containing analgesic, antipyretic, and NSAIDs, followed by interview with caregivers at 18 locations (nine private drugstores and nine Basic Health Units of the Brazilian Unified Health System). The assessed outcomes included recommended use or use with no contraindication, indications with benefit evidence, and health surveillance agency‐approved use. Data were analyzed in electronic databases and the variables were summarized by simple frequency.
ResultsA total of 164 analgesic, antipyretic, and NSAIDs were prescribed to 150 children aged 1 to 4 years (38.6%). Dipyrone was included in 82 (54.6%) and ibuprofen in 40 (26.6%) prescriptions. Non‐recommended uses were identified in 15% of prescriptions and contraindicated uses were observed in 13.3%. Nimesulide (1.5%) is still prescribed to children younger than 12 years. The dose was incorrect in 74.3% of prescriptions containing dipyrone. Of the 211 reported clinical indications, 56 (26.5%) had no evidence of benefit according to the best available scientific evidence and 66 (31.3%) had indications not approved by the regulatory agencies.
ConclusionThere are significant discrepancies between clinical practice and recommended use of analgesic, antipyretic, and NSAIDs in pediatrics.
Dados sobre a prática clínica em pediatria no uso de analgésicos, antipiréticos e anti‐inflamatórios não esteroides considerando a melhor evidência disponível e o uso aprovado por agências reguladoras são incertos. Este estudo tem como objetivo verificar a frequência de prescrição de tais medicamentos segundo a melhor evidência científica e o uso aprovado por agências reguladoras.
MétodoEstudo transversal de 150 prescrições pediátricas, contendo analgésicos, antipiréticos e anti‐inflamatórios não esteroides, seguido de entrevista aos cuidadores, em 18 locais (nove drogarias privadas e nove unidades de saúde do SUS). Os desfechos avaliados incluíram uso recomendado ou sem contraindicação, indicações com evidência de benefício e o uso autorizado por agências de vigilância sanitária. Os dados foram analisados em banco eletrônico e as variáveis sumarizadas por frequência simples.
ResultadosForam prescritos 164 analgésicos, antipiréticos e anti‐inflamatórios não esteroides para as 150 crianças entre um e quatro anos (38,6%). Dipirona constou em 82 (54,6%) e ibuprofeno em 40 (26,6%). Usos não recomendados foram encontrados em 15% das receitas e usos contraindicados em 13,3%. Nimesulida (1,5%) ainda é usada em crianças com menos de 12 anos. Em 74,3% das prescrições contendo dipirona a dose estava incorreta. Das 211 indicações clínicas referidas, 56 (26,5%) não tinham evidências de benefício segundo a melhor prova científica disponível e 66 (31,3%) eram indicações não aprovadas em agências de vigilância sanitária.
ConclusãoExistem importantes discrepâncias entre prática clínica e recomendações de uso de analgésicos, antipiréticos e anti‐inflamatórios não esteroides em pediatria.
No Brasil, como em outros países em desenvolvimento, as políticas e as normas regulatórias sobre venda e prescrição de medicamentos em pediatria ainda são insuficientes para que o setor esteja livre de riscos relacionados a prescrições e usos inadequados.
Analgésicos, antipiréticos e anti‐inflamatórios não esteroides (Aine) são os medicamentos mais frequentemente prescritos na faixa etária pediátrica.1 Particularmente, naproxeno, cetoprofeno e ibuprofeno são medicamentos isentos de prescrição (MIPs), regulados pela RDC N° 138/2003.2 A nimesulida e outros fármacos do mesmo grupo, embora não constem na lista dos MIPs, podem ser adquiridos em qualquer farmácia do país, sem necessidade de prescrição.
Embora sejam agentes com potenciais efeitos adversos, são amplamente vendidos em farmácia, desconsiderando restrições de uso, indicações, toxicidade e interações medicamentosas contraindicadas. Muitas vezes são prescritos sem objetivo terapêutico definido e geram custos desnecessários.
Para dores leves e moderadas, em geral, devem‐se usar analgésicos sem efeito anti‐inflamatório (ácido acetilsalicílico e ibuprofeno em baixas doses ou paracetamol). Os Aine têm eficácia similar, sua seleção deve considerar toxicidade relativa, custo e faixa etária permitida (baseada em estudos de segurança e eficácia já confirmados para o fármaco em questão). O efeito de um Aine é do tipo tudo ou nada, ou seja, o aumento da dose não eleva sua eficácia terapêutica, mas resulta em elevação dos efeitos adversos.3
Embora a febre seja resposta benéfica na maioria dos casos, é importante causa de ansiedade para pais e médicos. A busca por tratamentos de maior eficácia levou a novos regimes de combinação de antipiréticos em pediatria, muito apreciados entre cuidadores e profissionais da saúde, porém só há poucos anos testados em ensaios clínicos.4‐6 Os novos regimes consistem em combinações de ibuprofeno e paracetamol administrados em horários variáveis. A principal preocupação com esses tratamentos é a segurança, uma vez que podem aumentar o risco de toxicidade renal e o risco de infecção por streptococcos.7,8 Portanto, ainda não se sabe se essas combinações são mais eficazes e tão seguras quanto a monoterapia em crianças com febre.6
Em países desenvolvidos, a indicação de analgésicos, antipiréticos e Aine na faixa etária pediátrica é extremamente restrita. Na agência europeia de vigilância de medicamentos (Emea), atualmente, apenas dois medicamentos estão aprovados para o tratamento da febre em crianças, são eles o paracetamol e o ibuprofeno.9 Milhões de euros foram gastos para a conscientização dos prescritores para a promoção do uso racional de medicamentos, na busca de modificar padrões e hábitos de prescrições inadequados.10
A prescrição medicamentosa é um documento legal, pelo qual se responsabilizam quem prescreve (médico) e quem dispensa o medicamento (farmacêutico) e estão sujeitos à legislação de controle e vigilância sanitários.
Crianças são consideradas como “órfãos terapêuticos”, devido à falta de estudos clínicos com essa população. Os tratamentos são baseados em extrapolações de doses desenvolvidas para adultos. Na prática, o medicamento, muitas vezes, é usado em indicações, doses e frequências para as quais não foi aprovado e se configura o uso “off label”. Essa situação pode contribuir ainda mais para a exposição das crianças aos eventos adversos, devido principalmente ao uso inadequado de medicamentos.1
Dados sobre a prática clínica em pediatria no uso desses medicamentos, considerando a melhor evidência disponível e o uso aprovado por agências reguladoras, são incertos. Para tanto, esta pesquisa se propôs verificar a frequência de prescrição de medicamentos analgésicos, antipiréticos e anti‐inflamatórios não esteroides segundo a melhor evidência científica e o uso aprovado por agências reguladoras.
MétodoDesenho, local e período do estudoTrata‐se de estudo transversal, feito a partir da análise de prescrições pediátricas e de informações fornecidas pelos cuidadores.
Optou‐se por um estudo preliminar exploratório, descritivo, com vistas a identificar, registrar e analisar as características para gerar uma hipótese sobre os padrões de prescrições pediátricas contendo analgésicos, antipiréticos e anti‐inflamatórios. Embora esse assunto possa ser alvo constante de críticas, ainda foi pouco explorado profundamente.
A pesquisa foi iniciada após a aprovação do projeto pelo Comitê de Ética em Pesquisa (CEP), Universidade de Sorocaba (Uniso), documento n¿. 037/08, 19/11/2008.
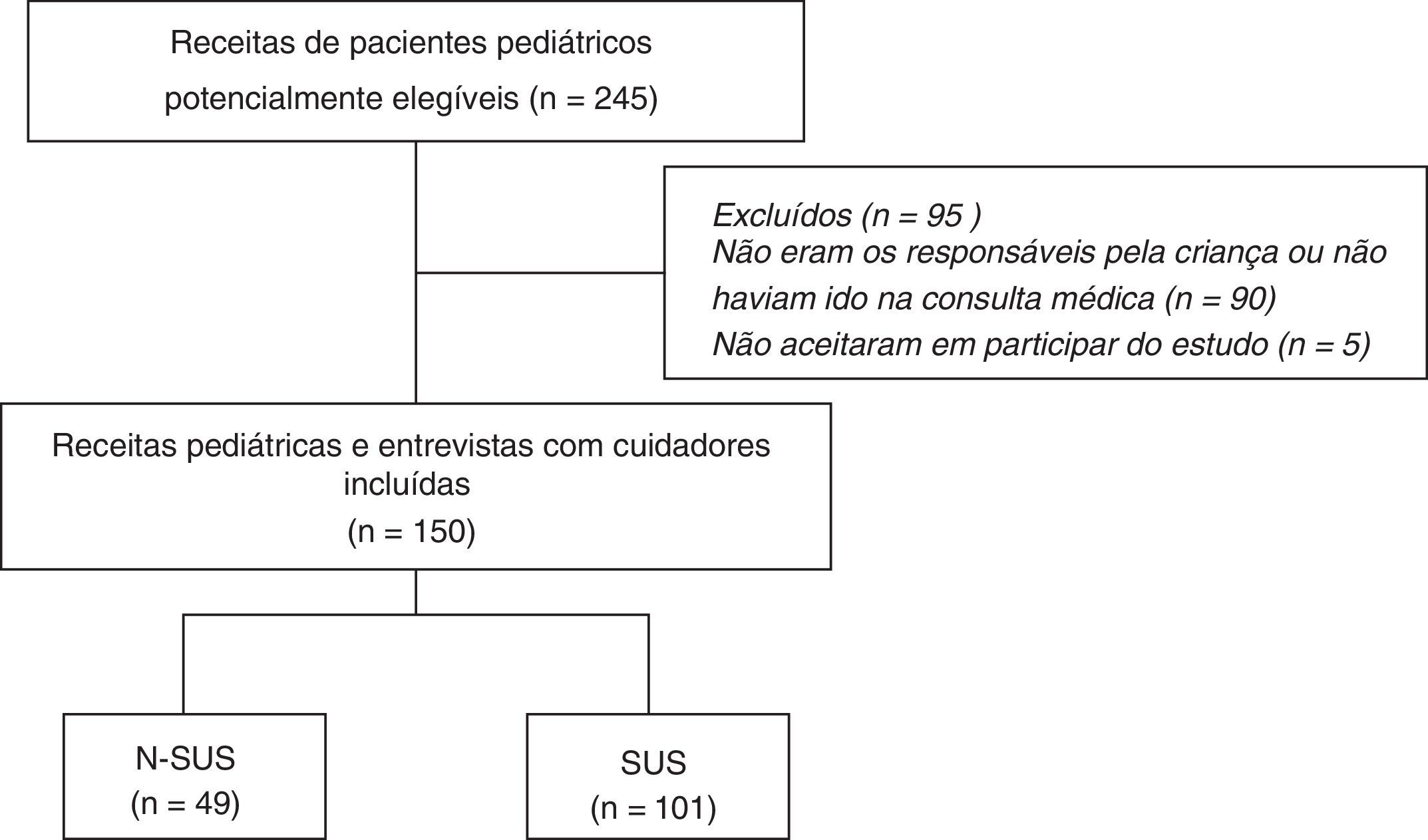
Seleção dos locais do estudo, critérios e procedimentos de abordagem dos casosA coleta de dados ocorreu em nove farmácias privadas e em nove unidades de saúde do setor público de Sorocaba (SP), sorteadas considerando a sua localização geográfica. A pesquisa em campo ocorreu durante nove meses. Os voluntários (cuidadores portando a receita pediátrica) foram recrutados para participar do estudo conforme ordem de chegada na farmácia. A pesquisa foi feita uma vez por semana em horários diversos. Neste estudo foram usadas duas fontes de dados: receitas pediátricas e entrevista com os cuidadores portadores dessas receitas. Maiores detalhes sobre critério de elegibilidade, coleta dos dados, entrevistas e questionário usado foram publicados anteriormente por Ferreira et al.11
Classificação da indicação segundo a melhor evidência disponível e a aprovação em agências reguladorasPara a classificação da indicação, segundo a melhor evidência clínica disponível de eficácia, usaram‐se como referencial teórico os dados provenientes de Dynamed® (EBSCO, MA, EUA),12 Clinical Evidence,13 Drugdex® System Thomson Micromedex.14 Para a verificação da aprovação da indicação do uso, usaram‐se dados de registro dos produtos na agência de vigilância sanitária brasileira (Anvisa) e na agência americana, Food and Drug Administration (FDA).
A indicação dos medicamentos foi classificada quanto à recomendação de uso em uso não recomendado (isto é, pode ser usado com precauções) e uso contraindicado (absolutamente impeditivo). Informações sobre as características do paciente (idade, comorbidade e outras) e do diagnóstico referido pelo cuidador foram confrontadas com as informações recomendadas de uso contidas nas bases de dados usadas.
Análise dos dadosAs variáveis contínuas foram descritas por meio de média e desvio padrão, ou mediana, valores mínimo e máximo, conforme apropriados, e variáveis binárias, por meio de proporções. Optou‐se por análise exploratória descritiva.
As indicações referidas foram classificadas em: i. com evidência científica definida; ii. sem contraindicação de uso; iii. com aprovação por agência reguladora ou iv. aquelas sem esses quesitos.
ResultadosA composição da amostra está descrita na fig. 1.
Características da amostra estão descritas em Ferreira et al.11 Verifica‐se maior prevalência de três ou mais medicamentos por prescrição, consumidos pela faixa etária de um a quatro anos (interquartil 3,5‐8,7); em 60% das receitas não havia a especialidade médica e em 51,3% as mães eram as cuidadoras que portavam as receitas.
Os 150 pacientes tomavam 506 medicamentos, dos quais 431 (85,2%) estavam prescritos. Entretanto, os cuidadores de 58 crianças referiram que essas usavam também outros medicamentos, 75 (14,8%), que não constavam nas receitas analisadas. Podiam ser, portanto, fruto de outras prescrições ou de automedicação. Noventa e um pacientes não usavam medicamentos além daqueles prescritos na receita avaliada, dados não apresentados em tabela.
Nas 150 receitas, os sete analgésicos, antipiréticos e anti‐inflamatórios encontrados foram prescritos 164 vezes para 211 indicações. Isso significa que havia prescrições com mais de um medicamento desse grupo. O fármaco mais frequente nas prescrições foi a dipirona 82 (54,7%), seguida do ibuprofeno 40 (26,7%; tabela 1). Segundo o Código Internacional de Doenças (CID 10), para a dipirona as indicações clínicas referidas mais frequentes, 68 (63,5%), foram para tratar sintomas de gripe, resfriados, infecções por influenza, amigdalites, faringites e outras doenças respiratórias (J00‐ J11.9). As indicações mais frequentes, 17 (32,7%), para o ibuprofeno foram para tratar sintomas e sinais não especificados, tais como dor, febre, cefaleia entre outros (R50‐R52).
Indicações clínicas referidas
| Nome do fármaco (Classificação ATC) | n=150 (%)Receitas | n=211 (%)Indicações |
|---|---|---|
| Ácido acetilsalicílico (N02BA01, B01A) | 5 (3,3) | 5 (2,3) |
| Cetoprofeno (M01AE03) | 16 (10,7) | 19 (9,0) |
| Dipirona (N02BB02) | 82 (54,7) | 107 (50,7) |
| Ibuprofeno (M01AE01) | 40 (26,7) | 52 (24,6) |
| Nimesulida (M01AX17) | 2 (1,3) | 3 (1,4) |
| Paracetamol (N02BE01) | 17 (11,3) | 19 (9,0) |
| Piroxicam (M01AC01) | 2 (1,3) | 6 (2,8) |
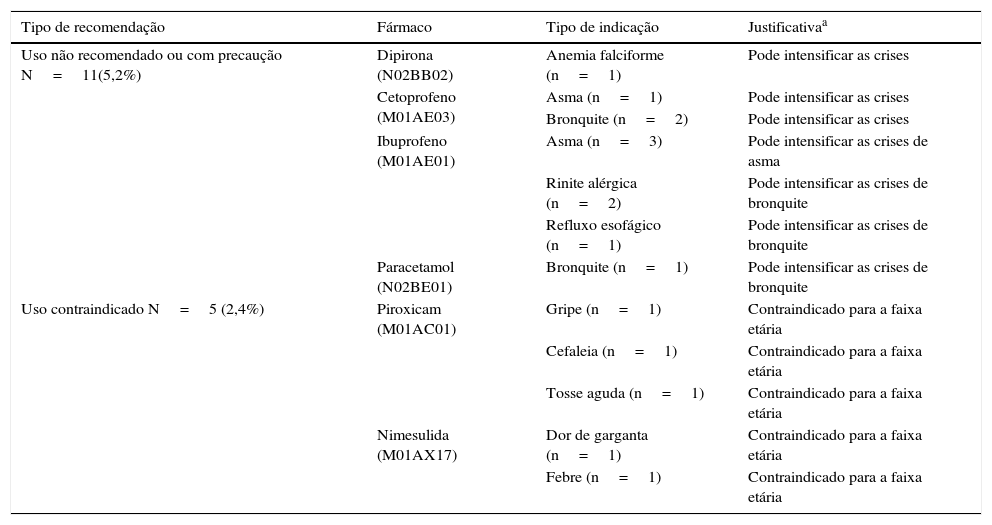
A tabela 2 mostra o uso não recomendado e o uso contraindicado dos analgésicos, antipiréticos e anti‐inflamatórios não esteroides. Nesta amostra, seis (2,84%) indicações foram para tratar sintomas associados a condições alérgicas (asma ou rinite), uso esse não recomendado por possibilidade de exacerbação da doença. Ainda verifica‐se a indicação da nimesulida (M01AX17) e piroxicam (M01AC01) para tratamento da dor e febre em crianças com menos de 12 anos.
Caracterização do uso não recomendado (uso com precaução) e da contraindicação do AA e Aine presentes nas receitas, considerando as características do paciente e indicação clínica (diagnóstico referido)
| Tipo de recomendação | Fármaco | Tipo de indicação | Justificativaa |
|---|---|---|---|
| Uso não recomendado ou com precaução N=11(5,2%) | Dipirona (N02BB02) | Anemia falciforme (n=1) | Pode intensificar as crises |
| Cetoprofeno (M01AE03) | Asma (n=1) | Pode intensificar as crises | |
| Bronquite (n=2) | Pode intensificar as crises | ||
| Ibuprofeno (M01AE01) | Asma (n=3) | Pode intensificar as crises de asma | |
| Rinite alérgica (n=2) | Pode intensificar as crises de bronquite | ||
| Refluxo esofágico (n=1) | Pode intensificar as crises de bronquite | ||
| Paracetamol (N02BE01) | Bronquite (n=1) | Pode intensificar as crises de bronquite | |
| Uso contraindicado N=5 (2,4%) | Piroxicam (M01AC01) | Gripe (n=1) | Contraindicado para a faixa etária |
| Cefaleia (n=1) | Contraindicado para a faixa etária | ||
| Tosse aguda (n=1) | Contraindicado para a faixa etária | ||
| Nimesulida (M01AX17) | Dor de garganta (n=1) | Contraindicado para a faixa etária | |
| Febre (n=1) | Contraindicado para a faixa etária |
Segundo Dynamed (https://dynamed.ebscohost.com), Clinical Evidence (http://clinicalevidence.bmj.com/x/index.html), Drugdex® System. Thomson Micromedex, Greenwood Village, Colorado, USA (http://www.micromedex.com).
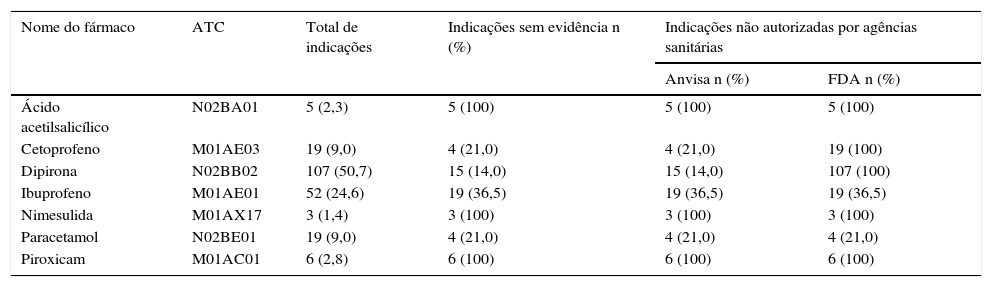
A tabela 3 mostra as indicações referidas sem evidência de benefício segundo a melhor prova científica e o número de indicações não autorizadas pela Anvisa ou pela FDA. Observa‐se que 100% das indicações de uso referidas para os fármacos ácido acetilsalicílico (N02BA01, B01A), dipirona (N02BB02), nimesulida (M01AX17) e piroxicam (M01AC01) não tinham estudos clínicos que justificassem tais usos.
Frequência de indicações referidas, sem evidência científica de benefício e não autorizadas por agencias sanitárias
| Nome do fármaco | ATC | Total de indicações | Indicações sem evidência n (%) | Indicações não autorizadas por agências sanitárias | |
|---|---|---|---|---|---|
| Anvisa n (%) | FDA n (%) | ||||
| Ácido acetilsalicílico | N02BA01 | 5 (2,3) | 5 (100) | 5 (100) | 5 (100) |
| Cetoprofeno | M01AE03 | 19 (9,0) | 4 (21,0) | 4 (21,0) | 19 (100) |
| Dipirona | N02BB02 | 107 (50,7) | 15 (14,0) | 15 (14,0) | 107 (100) |
| Ibuprofeno | M01AE01 | 52 (24,6) | 19 (36,5) | 19 (36,5) | 19 (36,5) |
| Nimesulida | M01AX17 | 3 (1,4) | 3 (100) | 3 (100) | 3 (100) |
| Paracetamol | N02BE01 | 19 (9,0) | 4 (21,0) | 4 (21,0) | 4 (21,0) |
| Piroxicam | M01AC01 | 6 (2,8) | 6 (100) | 6 (100) | 6 (100) |
ATC, Anatomical Therapeutic Chemical Code.
O ácido acetilsalicílico teve cinco indicações, quatro dessas para o tratamento de anemia falciforme e uma para dor de garganta, com a curiosa orientação de que deveria ser diluído um comprimido em meio copo de água para gargarejos a cada oito horas, por cinco dias. Essas indicações de uso não estão aprovadas nas agências sanitárias e não têm seu uso recomendado baseado em provas científicas.
Nesta amostra, a dipirona foi prescrita para 82 (54,6%) pacientes e em oito (9,7%) desses estava combinada com outros AA (analgésicos e antipiréticos) ou Aine. As doses estavam acima das recomendadas por agências reguladoras ou mesmo nas bulas em 41 (55,4%) receitas. Muitas delas vinham com formas de uso e orientações não constantes em protocolo oficial ou em base de dados consultada.
Ibuprofeno foi indicado para 52 condições clínicas, 19 (36,5%) sem prova de evidência científica ou autorizada por qualquer agência sanitária. Vale ressaltar que havia indicações para pacientes com bronquite, estomatite, refluxo, rinite‐sinusite e tosse.
O paracetamol foi indicado para 19 condições clínicas, quatro (21%) sem evidência científica, incluindo alergia respiratória, refluxo, tosse e estomatite.
DiscussãoPrincipais achadosAs prescrições (150) com os sete analgésicos, antipiréticos e anti‐inflamatórios (ácido acetilsalicílico, cetoprofeno, dipirona, ibuprofeno, nimesulida, paracetamol e piroxicam) para uso pediátrico tiveram 56 (26,5%) indicações sem evidência científica. Das 211 indicações referidas, 14 (6,6%) não são autorizadas por qualquer agência reguladora, 11 (5,2%) foram uso não recomendado ou com precaução e cinco (2,4%) foram indicações de uso contraindicado.
Sete medicamentos tiveram 100% de indicações não aprovadas pela FDA ou Anvisa, principalmente porque foram prescritas para crianças com menos de 12 anos, cita‐se o cetoprofeno (aprovado pela Anvisa, mas não pela FDA), nimesulida (aprovado pela Anvisa, mas não pela FDA) e piroxicam (não aprovado por ambas agências). A dipirona não está aprovada para uso pela FDA.
Relação com outros estudosNeste estudo a maior prevalência de uso de analgésicos, antipiréticos e anti‐inflamatórios não esteroides sem evidência de benefício ocorreu em razão de prescrições feitas para idades inferiores àquelas permitidas. Vários são os medicamentos que em 2009 tinham seu uso aprovado no Brasil (cetoprofeno, nimesulida e piroxicam) e tinham restrições de uso conforme a idade, em agências reguladoras de outros países.
Ressalta‐se o caso do medicamento nimesulida, nunca aprovado para uso pediátrico e com venda suspensa em vários países (Irlanda, Inglaterra, Austrália, França, Finlândia, Portugal e Espanha)15 devido à possibilidade de lesão hepática, reações dermatológicas e casos fatais de síndrome de Reyes e aprovado inicialmente para uso pediátrico e adulto no Brasil. A aprovação da nimesulida para uso pediátrico no país antes de 2007, sem estudos mais conclusivos sobre segurança nessa população,14 é algo que surpreende e pode se refletir nas prescrições inadequadas desse medicamento ainda encontradas nesta amostra. Após essa data a Anvisa solicita alteração das bulas para incluir: ‘este produto passa a não ser indicado para crianças menores de 12 anos”.
No entanto, ao consultar sites de venda de medicamentos,16 ainda são encontrados, no mercado brasileiro, pelo menos 16 laboratórios que produzem a nimesulida em solução oral nas concentrações de 10mg/ml, 50mg/ml ou 100mg/ml cujas bulas ainda trazem a recomendação posológica para crianças acima de um ano, uma gota por kg de peso, para tratamento da dor e contusão. Não obstante, quando a mesma consulta é feita no site Bulário Eletrônico da Anvisa, apenas quatro laboratórios têm o registro da bula do produto nimesulida na forma farmacêutica solução oral e nessas aparecem os dizeres “uso adulto e pediátrico acima de 12 anos” e “este produto é contraindicado para menores de 12 anos”.17
Essa discrepância de informações pode confundir a classe de prescritores, profissionais de saúde e consumidores e aumentar os riscos ao uso inapropriado desse medicamento em população pediátrica.
A OMS havia se pronunciado duas vezes contra a venda da nimesulida, inicialmente em 2003, e a colocou na categoria de produtos sob farmacovigilância especial. Em 2007 o Emea iniciou uma análise exaustiva dos danos hepáticos produzidos por esse produto, decidiu manter a venda com restrição de uso acima de 12 anos, colocou‐o sob vigilância constante e limitou o uso para no máximo 15 dias consecutivos.18
Com o uso do piroxicam observou‐se uma situação semelhante no Brasil. Até 2009 havia apresentações comerciais, em solução oral/gotas, sem restrição de uso por idade. Atualmente, o piroxicam não é mais encontrado nessa forma farmacêutica e apresentação e atualmente sua indicação se restringe a idades superiores a 12 anos.
Quanto ao cetoprofeno, verifica‐se que ele é vendido no Brasil na formulação pediátrica como um medicamento que apresenta propriedades analgésicas e antipiréticas em doses baixas e propriedades anti‐inflamatórias em doses maiores, indicado para o alívio sintomático da febre e/ou dor em crianças a partir de seis meses. A bula contém orientações para o uso em populações especiais, isto é, crianças menores de seis meses nas quais a segurança e a eficácia de uso ainda não foram estabelecidas.19 A FDA não aprova seu uso em pediatria, mas o considera efetivo em casos de febre (classe IIb, categoria B), osteoartrite (classe IIb, categoria C), dor (classe IIa, categoria B) e artrite reumatoide (classe IIb, categoria C).13
Ufer et al. (2003) confirmam a relação entre uso de medicamentos não aprovados para uso pediátrico e a prevalência de efeitos adversos.1 Wilton et al. (1999) mostraram que 20% das prescrições pediátricas na Suécia continham medicamentos recém‐introduzidos no mercado incluindo percentual de medicamentos com alguma contraindicações para essa faixa etária.20 Nessa realidade clínico‐epidemiológica suspeita‐se que a taxa de medicamentos considerados não apropriados para o uso pediátrico seja maior do que aquela revelada por vários estudos.21,22
Em 10% desta amostra houve prescrição de dois AA ou Aine na mesma receita, para uso intercalado. Indicação essa sem evidência, que aumenta o risco de dano hepático e pode confundir o cuidador sobre os intervalos de administração.23,24 Uma pesquisa feita na Argentina, com 1.600 pediatras, demonstrou que 59% deles fazem a alternância de dois antipiréticos e concluiu que essa prática é mais frequente entre os médicos com menos tempo de profissão.25 O que nos causa estranheza é que alguns protocolos clínicos do Ministério da Saúde brasileiro indicam essa prática, vale citar o tratamento para a dengue. Tendo em vista a incerteza em torno da superioridade ou a segurança dos regimes de combinação de antipiréticos em comparação com a monoterapia, deve‐se continuar a usar ou paracetamol ou ibuprofeno em monoterapia. Diretrizes do Nice (Instituto Nacional de Excelência Clínica) recomendam que paracetamol e ibuprofeno não devam ser rotineiramente administrados em conjunto ou usados de forma alternada. No entanto, se a criança não consegue responder a um desses fármacos, um fármaco opcional poderá ser usado.26
Outro achado interessante nesta amostra se relaciona à dose prescrita. A dipirona, medicamento com maior prevalência de prescrição com dose não apropriada, teve 55,4% das prescrições acima daquelas doses recomendadas ou aprovadas. Esses dados são diferentes daqueles obtidos por Ferreira et al.,27 que encontraram uso de dipirona em doses inferiores aplicadas por vias não indicadas a crianças com menos de um ano. Alves et al.28 observaram que as crianças receberam doses maiores do que as recomendadas pela bula, o que aumenta os riscos de eventos adversos, entre eles a hipotensão.
O cálculo da dose pediátrica ainda é um grande problema em terapêutica. A posologia baseada na idade do paciente nem sempre é a melhor opção, especialmente quando se trata de pacientes lactantes, e pode gerar superdosagens. Pacientes com a mesma idade podem diferir quanto à massa corpórea.29 Além disso, calcular a dose pediátrica baseada no peso corporal do indivíduo também não é indicado, pois se sabe que o processo de maturação infantil ocorre gradualmente e de forma não correspondente ao ganho de estatura do indivíduo.30 Mas ainda faltam estudos com essa faixa etária para estabelecer as doses ideais. Esse problema pode explicar a variação nas doses verificadas nesta amostra.
Pontos fortes e limitações deste estudoEste estudo apresenta os primeiros dados detalhados sobre uso de analgésicos, antipiréticos e anti‐inflamatórios não esteroides em pacientes pediátricos no Brasil. Os pacientes foram incluídos logo após a consulta médica, o que diminui o confundidor memória sobre a indicação referida ou sinais e sintomas da criança. Os pacientes foram identificados durante o ano todo, envolveram as quatro estações climáticas, o que diminuiu possíveis vieses de sazonalidade. Além disso, preocupados com a representatividade da população, 18 locais diferentes foram selecionados, incluindo pacientes atendidos pelo setor público e pelo setor privado.
Foi usado um roteiro de entrevista detalhado com dois entrevistadores treinados e as declarações da entrevista foram coadunadas com os dados contidos nas próprias receitas médicas de maneira cruzada. Talvez a principal limitação deste estudo pudesse ser o tamanho da amostra, mas, com atenção a esse aspecto, optou‐se por análise exploratória descritiva, sem associações entre variáveis. Para a análise dos dados usaram‐se fontes de evidências recomendadas por agências reguladoras e pela Organização Mundial da Saúde (Dynamed, Clinical Evidence, Drugdex® System Thomson Micromedex).12‐14
Implicações práticas e considerações finaisA prescrição deveria se basear na melhor evidência de benefício disponível e nos valores e nas preferências daquele que vai ser tratado.
Atender à ansiedade e aos medos sobre febre dos pais e educá‐los sobre a utilidade imunológica da febre e os riscos associados ao abuso de antipiréticos deveriam continuar a ser uma prioridade.
A necessidade de medidas de intervenção na dispensação de medicamentos, que proporcionem uso racional, com impacto positivo sobre desfechos em saúde, é fundamental. Políticas de registro de medicamentos que considerem a melhor evidência científica disponível poderiam diminuir o aparecimento de medicamentos com indicações de uso duvidosas.
Esses achados mostram que existem diferenças importantes entre a prática clínica em pediatria no uso de AA e Aines e as recomendações baseadas na melhor evidência científica disponível e o uso aprovado por agência de vigilância reguladora.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Ferreira TR, Lopes LC. Analysis of analgesic, antipyretic, and nonsteroidal anti‐inflammatory drug use in pediatric prescriptions. J Pediatr (Rio J). 2016;92:81–7.