Report the incidence, epidemiology, clinical features, death, and vaccination status of patients with whooping cough and perform genotypic characterization of isolates of B. pertussis identified in the state of Paraná, during January 2007 to December 2013.
MethodsCross‐sectional study including 1,209 patients with pertussis. Data were obtained through the Notifiable Diseases Information System (Sistema de Informação de Agravos de Notificação – SINAN) and molecular epidemiology was performed by repetitive sequence‐based polymerase chain reaction (rep‐PCR; DiversiLab®, bioMerieux, France).
ResultsThe incidence of pertussis in the state of Paraná increased sharply from 0.15‐0.76 per 100,000 habitants between 2007‐2010 to 1.7‐4.28 per 100,000 between 2011‐2013. Patients with less than 1 year of age were more stricken (67.5%). Fifty‐nine children (5%) developed pertussis even after receiving three doses and two diphtheria‐tetanus‐pertussis (DTP) boosters vaccine. The most common complications were pneumonia (14.5%), otitis (0.9%), and encephalopathy (0.7%). Isolates of B. pertussis were grouped into two groups (G1 and G2) and eight distinct patterns (G1: P1‐P5 and G2: P6‐P8).
ConclusionThe resurgence of pertussis should stimulate new research to develop vaccines with greater capacity of protection against current clones and also encourage implementation of new strategies for vaccination in order to reduce the risk of disease in infants.
Relatar a incidência, os aspectos epidemiológicos, clínicos, a morte e a vacinação de pacientes com coqueluche e fazer a caracterização genotípica de isolados de Bordetella pertussis identificados no Estado do Paraná, de janeiro de 2007 a dezembro de 2013.
MétodosEstudo transversal, incluindo 1.209 pacientes com coqueluche. Os dados foram obtidos no Sistema de Informação de Agravos de Notificação (Sinan) e a epidemiologia molecular foi feita por PCR baseada em sequências repetitivas (rep‐PCR; DiversiLab®, bioMerieux, France).
ResultadosA incidência de coqueluche no Estado do Paraná aumentou acentuadamente de 0,15‐0,76 por 100.000 habitantes entre 2007‐2010 para 1,7‐4,28 por 100.000 habitantes entre 2011‐2013. Os pacientes com menos de um ano foram os mais afetados (67,5%); 59 crianças (5%) desenvolveram coqueluche mesmo depois de receber três doses da vacina e dois reforços com a vacina tríplice DTP. As complicações mais comuns foram pneumonia (14,5%), otite (0,9%) e encefalopatia (0,7%). Isolados de B. pertussis foram agrupados em dois grupos (G1 e G2) e oito padrões distintos (G1: P1‐P5 e G2: P6‐P8).
ConclusãoO ressurgimento da coqueluche vem para sugerir novas pesquisas com o objetivo se desenvolverem vacinas com maior capacidade de proteção contra os clones atuais e também implantar novas estratégias de vacinação, a fim de reduzir o risco de doenças em lactentes.
A coqueluche, popularmente conhecida como tosse comprida, é uma doença grave do trato respiratório humano, altamente contagiosa, causada pela Bordetella pertussis.1 A doença é caracterizada por acessos incontroláveis de tosse, acompanhados de sibilo inspiratório.2 Crianças e adultos de qualquer idade podem desenvolver a doença. No entanto, cursa com maior gravidade entre lactentes, especialmente até seis meses.3 Apesar da boa cobertura vacinal, estima‐se que ocorram 50 milhões de casos por ano, com aproximadamente 300 mil óbitos anuais, 90% em países em desenvolvimento.1,4
A última década foi surpreendida pelo aumento das taxas de incidência da coqueluche em diversas regiões do mundo. As causas da reemergência dessa doença ainda não estão totalmente esclarecidas. Algumas hipóteses foram levantadas: perda da imunidade pós‐vacinal; implementação de métodos moleculares para o diagnóstico; melhoria do sistema de vigilância epidemiológica; redução da eficácia da vacina; ou, ainda, mudanças genéticas no patógeno.5,6
No Brasil a coqueluche passou a constar na lista de doenças de notificação compulsória em 1975, com a recomendação de investigar todos os surtos da doença. No início da década de 80 foram notificados mais de 40 mil casos anuais e o coeficiente de incidência foi superior a 30/100 mil habitantes. Esse número caiu abruptamente a partir de 1983, com a introdução da vacina DTP no calendário vacinal infantil, e manteve desde então tendência decrescente. Indícios do retorno da coqueluche no Brasil foram evidenciados por meio da detecção de alguns surtos em 2010, seguidos pelo aumento do número de casos em várias capitais brasileiras.7
O monitoramento da circulação da B. pertussis vem sendo implantado nos estados brasileiros, com a criação de serviços‐sentinela e laboratórios capacitados para o isolamento do agente etiológico. As metodologias usadas no diagnóstico laboratorial da coqueluche incluem cultura e RT‐ PCR (Real Time – PCR). O diagnóstico da coqueluche por critério laboratorial foi implantado no Laboratório Central do Estado do Paraná (Lacen‐PR) em 2005. O exame (cultura) inicialmente foi oferecido para três unidades hospitalares sentinelas, duas em Curitiba e outra no município de Londrina. Somente em 2007 ocorreu o primeiro isolamento de B. pertussis, em um contato familiar tossidor, de uma criança com sintomas da doença. Em 2011 o exame foi expandido para todas as Unidades Básicas de Saúde (UBS) e demais hospitais de Curitiba e da Região Metropolitana. Esses serviços receberam capacitações que abordaram o diagnóstico clínico, condutas epidemiológicas e a coleta da amostra biológica. Recentemente, alguns estudos têm descrito o uso da técnica de análise de sequências de DNA repetidas (rep‐PCR; DiversiLab®, bioMerieux, France) para tipagem molecular de microrganismos. Esse método faz uso de sequências oligonucleotídicas iniciadoras complementares de sequências de DNA repetitivas muito conservadas e presentes em numerosas cópias no genoma das bactérias. Possibilita a caracterização genotípica, a diferenciação de clones e a dispersão desses na comunidade.8
O objetivo deste estudo foi descrever a incidência, as características epidemiológicas, clínicas, o número de óbitos e estado vacinal de pacientes com coqueluche e fazer a caracterização genotípica de isolados de B. pertussis circulantes no Estado do Paraná, de janeiro de 2007 a dezembro de 2013.
Materiais e métodosEstudo observacional e transversal, composto de pacientes com diagnóstico confirmado de coqueluche, feito no Estado do Paraná, de janeiro de 2007 a dezembro de 2013. Os casos de coqueluche são notificados no Sistema de Informação de Agravos de Notificação (Sinan) por meio do preenchimento de uma ficha pela fonte notificadora, que fornece dados de localização, identificação, sinais e sintomas clínicos, óbito e estado vacinal dos pacientes.
Os casos de coqueluche foram confirmados por: I. Critério clínico – um indivíduo, independentemente da idade ou do estado vacinal, apresenta tosse de qualquer tipo há 14 dias ou mais associada a dois ou mais dos seguintes sinais e sintomas: tosse paroxística, guincho inspiratório e/ou vômito pós‐tosse; II. Critério laboratorial – todo indivíduo que atenda à definição de caso suspeito de coqueluche e que tenha o isolamento de B. pertussis em cultura ou identificação por RT‐PCR. e III. Critério clínico epidemiológico – todo indivíduo que atenda à definição de caso suspeito e teve contato com caso confirmado de coqueluche por critério laboratorial, no período de transmissibilidade.2 Todos os casos de coqueluche confirmados por pelo menos um dos critérios acima foram incluídos no estudo. As seguintes variáveis epidemiológicas e clínicas foram avaliadas: idade, sexo, sinais e sintomas clínicos, complicações, número de óbitos e estado vacinal. Este estudo foi aprovado pelo comitê de ética e pesquisa do Hospital do Trabalhador/Sesa/PR, CAAE 16584713.6.0000.5225.
Diagnóstico laboratorialAmostras clínicas (secreção nasofaríngea profunda) de pacientes suspeitos de coqueluche foram encaminhadas ao Lacen‐PR em meio de transporte Regan Lowe (RL), suplementado com 10% de sangue de carneiro e cefalexina a 40μg/mL. As amostras foram cultivadas em placas de ágar RL e incubadas a 35°C (±1) em ambiente úmido por 10 dias. Colônias suspeitas de B. pertussis foram identificadas por se desenvolver após o 3° dia de incubação, apresentar a morfologia de cobacilos Gram negativos, ser catalase e oxidase positivos e apresentar identificação bioquímica compatível de acordo com estudos publicados anteriormente.9 Todos os isolados identificados durante o período de estudo formam armazenados em freezer −80°C.
Tipagem Rep‐PCROs isolados de B. pertussis foram tipados por meio da técnica de análise de sequências de DNA repetidas (rep‐PCR; DiversiLab®, bioMerieux, France) para determinar a proximidade genética. Essa técnica analisa regiões específicas do genoma bacteriano que podem ou não estar presentes em determinadas estirpes. Quando presentes são amplificadas e podem ser visualizadas formando bandas sobre o gel virtual formado pelo sistema. As diferenças e semelhanças (presença e/ou intensidade de bandas) entre os isolados permitem a classificação desses em grupos e padrões distintos. Foram considerados pertencentes a um mesmo grupo os isolados que apresentavam similaridade ≥ 90%. Foram considerados padrões únicos (clones) os isolados que apresentaram similaridade ≥ 97% entre si e nenhuma banda diferente.
Análise estatísticaO sistema Sinan fornece dados para o cálculo de indicadores epidemiológicos com o uso do aplicativo Tabwin versão 32.exe (http://www2.datasus.gov.br/DATASUS/index.php?area=060805), que gera relatórios a partir da base Postgres do Sinan NET ou da base DBF das versões NET ou online do Sinan (http://dtr2004.saude.gov.br/sinanweb/novo/relatorios/descricao.pdf). Para o cálculo do coeficiente de incidência anual foi feita a tabulação, no formato Tabwin, do número de casos novos a cada ano (2007 a 2013), divididos pela população do Estado do Paraná. O software DiversiLab, versão 2.1.66 (DiversiLab®, bioMerieux, France), analisa os resultados da genotipagem por meio da criação de uma matriz de proximidade, com o uso do coeficiente de correlação de Pearson para determinar matrizes de distância e criar o dendrograma. Os relatórios foram gerados automaticamente pelo sistema. As variáveis analisadas foram descritas segundo suas frequências.
ResultadosDurante o período analisado foram notificados no Estado do Paraná 3.451 casos de coqueluche. No entanto, apenas 1.209 foram confirmados pelos critérios acima definidos. Foi observado um aumento considerável na incidência dessa doença, que oscilou de entre 0,15 e 0,76/100 mil habitantes entre 2007 e 2010 para 1,7/100 mil em 2011, 3,83/100 mil em 2012 e 4,28/100 mil em 2013; 665 (55%) dos pacientes pertenciam ao sexo feminino. A faixa etária mais acometida foi a de menores de um ano com 816 (67,5%) casos, especialmente crianças com idade inferior a dois meses.
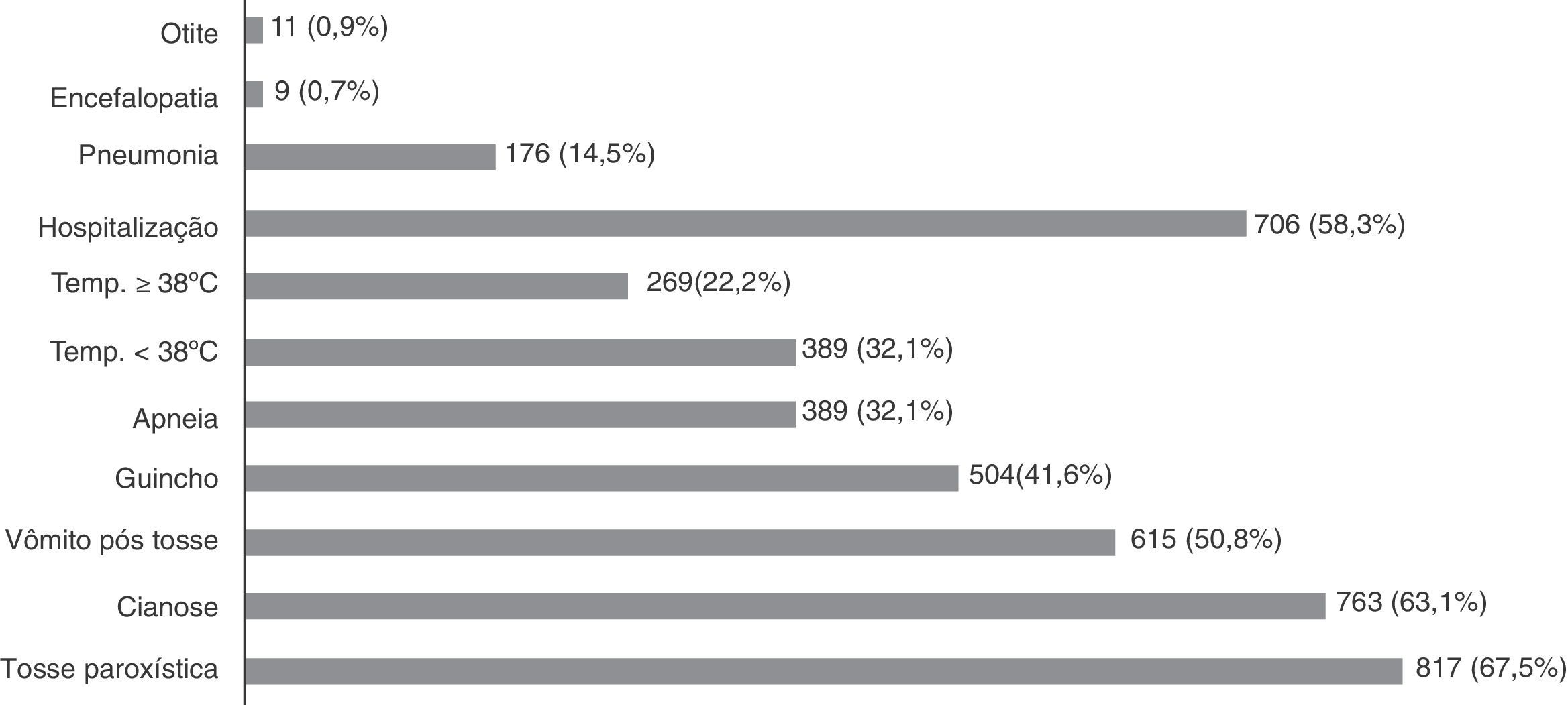
A apresentação clínica da coqueluche pode variar e mais de um sinal/sintoma pode estar presente em um mesmo paciente. Os sinais/sintomas mais frequentes foram a tosse paroxística, presente em 817 (67,5%) pacientes, seguida de cianose 763 (63,1%), vômito pós‐tosse 615 (50,8%), respiração ruidosa (guincho) 504 (41,6%) e apneia 389 (32,1%). Temperatura acima ou igual a 38°C foi encontrada em 269 (22,2%) pacientes e temperatura entre 37 e 38°C foi observada em 389 (32,1%) (fig. 1). Um número expressivo de pacientes necessitou de hospitalização. A principal complicação foi a pneumonia 176 (14,5%). Foram a óbito 19 pacientes, entre esses 11 pertenciam ao sexo masculino, 17 (89,5%) tinham menos de dois meses de idade, um com três meses e outro com 44 anos com diagnóstico prévio de tuberculose.
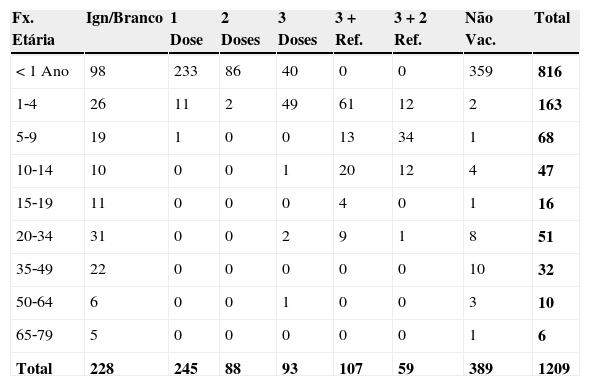
Praticamente a metade dos pacientes com diagnóstico confirmado de coqueluche 592 (49%) já tinha recebido pelo menos uma dose da vacina difteria‐tetânico‐coqueluche (DTP), entre esses 93 (7,7%) haviam recebido três doses da vacina e 59 (5%) haviam completado o calendário vacinal (três doses + dois reforços) (tabela 1).
Casos confirmados de coqueluche por faixa etária e número de doses da vacina DTP no estado durante 2007 a 2013
| Fx. Etária | Ign/Branco | 1 Dose | 2 Doses | 3 Doses | 3 + Ref. | 3 + 2 Ref. | Não Vac. | Total |
|---|---|---|---|---|---|---|---|---|
| < 1 Ano | 98 | 233 | 86 | 40 | 0 | 0 | 359 | 816 |
| 1‐4 | 26 | 11 | 2 | 49 | 61 | 12 | 2 | 163 |
| 5‐9 | 19 | 1 | 0 | 0 | 13 | 34 | 1 | 68 |
| 10‐14 | 10 | 0 | 0 | 1 | 20 | 12 | 4 | 47 |
| 15‐19 | 11 | 0 | 0 | 0 | 4 | 0 | 1 | 16 |
| 20‐34 | 31 | 0 | 0 | 2 | 9 | 1 | 8 | 51 |
| 35‐49 | 22 | 0 | 0 | 0 | 0 | 0 | 10 | 32 |
| 50‐64 | 6 | 0 | 0 | 1 | 0 | 0 | 3 | 10 |
| 65‐79 | 5 | 0 | 0 | 0 | 0 | 0 | 1 | 6 |
| Total | 228 | 245 | 88 | 93 | 107 | 59 | 389 | 1209 |
Fx. Etária, Faixa Etária; Ign/Branco, Ignorado ou em branco; 3 + Ref., 3 doses mais 1 reforço; 3 + 2 Ref., 3 doses mais 2 reforços; Não Vac., Não vacinados.
Dos pacientes com coqueluche 216 (17,9%) tiveram o diagnóstico de coqueluche confirmado pelo critério laboratorial por meio do isolamento da B. pertussis em cultura. Durante o processo de reativação, verificou‐se que somente 45,8% (n = 99) encontravam‐se viáveis. A tipagem molecular (Rep‐PCR) permitiu detectar e diferenciar dois grandes grupos (G1 e G2) e oito padrões (P) (clones) distintos entre os 99 isolados de B. pertussis analisados. O Grupo G1 foi o mais frequente com 74 isolados e o grupo G2 foi formado por 25 isolados. A similaridade encontrada entre os dois grupos foi inferior a 62%. Foi possível diferenciar cinco padrões distintos [P1, P2, P3, P4 e P5] dentro do grupo G1, enquanto que no G2 apenas três padrões foram observados [P6, P7 e P8]. Cada padrão apresentou similaridade ≥ 97% entre si e nenhuma banda diferente. O isolado de B. pertussis detectado em 2007 pertencia ao clone mais frequente (G1:P4). Os isolados que apresentavam os padrões G1: P2, P3, P4 e P5 encontravam‐se em circulação em todos os anos analisados (fig. 2). O padrão G2:P6 foi detectado pela primeira vez em 2009 e os padrões G2:P7 e G2:P8 circularam a partir de 2011 e desde então disseminaram‐se nos anos posteriores. O clone G1:P1 circulou apenas durante 2012.
DiscussãoA coqueluche reemergiu no Estado do Paraná e passou de 16 casos em 2010 para 178 em 2011. Nos anos subsequentes, o número de casos confirmados continuou a crescer, com 400 e 447 casos em 2012 e 2013, respectivamente. Tal fato pode estar associado à presença de múltiplos clones de B. pertussis circulantes.
O Brasil iniciou o controle sistemático da coqueluche em 1983, com a introdução da vacina DTP no calendário básico infantil, na mesma época em que os países desenvolvidos apontavam os primeiros sinais da reemergência da doença.10,11 Em 1990 a cobertura vacinal passou para aproximadamente 70% e a incidência da doença diminuiu de 30 para 10,6/100 mil habitantes. Na última década, a incidência da coqueluche no Brasil se manteve estável e oscilou de 0,72/100 mil habitantes em 2004 para 0,32/100 mil habitantes em 2010. Em 2011 ocorreu um aumento repentino do número de casos confirmados em relação aos cinco anos anteriores que elevou a incidência para 1,2/100 mil habitantes, apesar de mantida a alta cobertura vacinal.12
Os sintomas clássicos da coqueluche são a tosse prolongada (tosse dos 100 dias) e paroxística, acompanhada de respiração ruidosa (guincho inspiratório).4 Em nosso estudo, além da presença dos sintomas clássicos, a cianose foi um achado bastante frequente entre os pacientes. Nicolai et al. relataram que a tosse paroxística é um sintoma altamente específico para o diagnóstico da coqueluche, está presente em 63,2% dos casos e em nenhum paciente com broquiolite por vírus sincicial respiratório (VSR). A taxa de cianose (52,6%) encontrada entre os pacientes com coqueluche foi também superior àquelas encontradas nos pacientes com infecção pelo VSR (10,5%), com significância estatística (p=0,006).13 Na série avaliada por Bayhan et al., 39,3% dos pacientes com coqueluche apresentavam guincho inspiratório e 87,1% tinham cianose.14
A pneumonia foi a principal complicação encontrada entre os pacientes aqui estudados. Essa complicação é a causa mais comum de morte relacionada a coqueluche. Nos EUA e no Canadá a pneumonia esteve presente em 5,2% e 9,4% dos casos, respectivamente.15,16 A B. pertussis desencadeia uma cascata de eventos inflamatórios que incluem a vasoconstrição pulmonar aguda e o aumento da circulação de leucócitos, que comprometem a circulação sanguínea pulmonar, exacerbam a hipoxemia e criam um ciclo vicioso de hipertensão pulmonar.17
Neste estudo, a maior parte dos óbitos ocorreu durante os últimos três anos do estudo e em crianças menores de dois meses. Segundo dados do Sinan, foram notificados no Brasil 15.428 casos de coqueluche em 2011, dos quais 2.248 foram confirmados, com 56 óbitos e letalidade de 2,5%. O número de casos continuou a aumentar em 2012, com 5.416 casos confirmados, 84 óbitos associados à doença e letalidade de 1,6%. Em 2013, o Estado do Paraná foi responsável por 10% dos óbitos registrados no Brasil.12 Na Inglaterra, entre 2001 e 2011 foram registrados 48 óbitos devidos a doença em crianças abaixo de um ano e, dessas, 41 (85,41%) tinham menos de 66 dias de vida.18 Nos EUA em 2012 foram reportados 48.277 casos e 18 (0,04%) óbitos, esse o maior número registrado da doença dos últimos 60 anos nesse país.19 Nota‐se que a letalidade da doença no Brasil excedeu 40 vezes a encontrada nos EUA.
As vacinas disponíveis atualmente são consideradas seguras e imunogênicas. No entanto, conferem proteção com efetividade aproximada de 46% após a 1° dose, 79,6% após a 2° dose, 91,7% após a 3° dose e 96,4% após a 4° dose, com duração aproximada de 10 anos.20,21 Em nosso estudo, 59 (5%) crianças haviam completado o calendário vacinal (três doses + dois reforços) e mesmo assim desenvolveram a doença.
A técnica Rep‐PCR possibilitou discriminar oito clones de B. pertussis distintos (P1 ‐ P8) circulantes no Estado do Paraná. É possível que os clones atuais apresentem variações antigênicas diferentes das encontradas nos clones que circulavam na era pré‐vacinal22,23 ou, ainda, sejam diferentes da cepa usada na produção da vacina. Dessa forma a vacina não apresentaria a efetividade de proteção esperada contra todas as estirpes circulantes. Tem sido sugerido que B. pertussis se adaptou devido à pressão seletiva exercida pela vacina durante os últimos 60 anos, que expressou a toxina pertússica, a pertactina e as fímbrias distintas das encontradas na cepa vacinal. Essas modificações podem explicar em parte a redução da eficácia da vacina e instigam a hipótese de que a imunidade reduzida, induzida pela vacina, possa ser responsável pelo aumento do número de casos da doença em todo o mundo.24
Outro fato é que as atuais estratégias de vacinação, com foco apenas em crianças, parecem insuficientes para evitar as mortes em lactentes jovens. Assim, novas estratégias devem ser analisadas para incluir a vacinação em recém‐nascidos, adolescentes, idosos, profissionais de saúde, profissionais que trabalham com crianças em berçários e creches e grávidas.20,25,26 Enquanto não for possível oferecer doses de reforço para toda a população, é prioritário vacinar pessoas que têm contato direto com os lactentes jovens, principalmente a mãe, assim como manter elevadas as coberturas vacinais em crianças.25
O presente estudo apresenta algumas limitações. É possível que o número de casos de coqueluche esteja subnotificado. A falta de familiaridade com o diagnóstico da coqueluche, explicada pelo longo período em que a doença mantinha‐se sob controle epidemiológico, pode ter influenciado nos índices de incidência da doença. Outro fato que pode ter contribuído é que alguns pacientes apresentam sintomas mais brandos, semelhantes a infecções virais, o que dificulta a suspeição e o diagnóstico. Nesses casos é importante identificar a etiologia da infecção, porém a confirmação de etiologia viral não exclui a possibilidade de coinfenção com B. pertussis.27
Concluímos que a coqueluche é uma doença reemergente em nosso estado, com alvo preferencial em lactentes não imunizados. No entanto, observamos que algumas crianças desenvolveram a doença mesmo tendo o esquema vacinal completo. Estudos avançados sobre a biologia celular e molecular devem ser incentivados para reconhecer mudanças antigênicas nos diferentes clones de B. pertussis circulantes na atualidade e poder oferecer novas vacinas mais efetivas e mais protetoras para a população. O ressurgimento da doença vem suscitar também mudanças urgentes no planejamento de novas estratégias de vacinação, no intuito de reduzir o risco de aquisição da doença e a morbimortalidade relacionada aos lactentes.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Torres RS, Santos TZ, Torres RA, Pereira VV, Fávero LA, Filho OR, et al. Resurgence of pertussis at the age of vaccination: clinical, epidemiological, and molecular aspects. J Pediatr (Rio J). 2015;91:333–8.