The aim of this study was to evaluate the QuickVue® RSV Test Kit (QUIDEL Corp, CA, USA) as a screening tool for respiratory syncytial virus in children with acute respiratory disease in comparison with the indirect immunofluorescence assay as gold standard. In Brazil, rapid antigen detection tests for respiratory syncytial virus are not routinely utilized as a diagnostic tool, except for the diagnosis of dengue and influenza.
MethodsThe authors retrospectively analyzed 486 nasopharyngeal aspirate samples from children under age 5 with acute respiratory infection, between December 2013 and August 2014, the samples were analyzed by IFI and QuickVue® RSV Test kit. Samples with discordant results were analyzed by RT‐qPCR and nucleotide sequencing.
ResultsFrom 313 positive samples by immunofluorescence assays, 282 (90%) were also positive by the rapid antigen detection test, two were positive only by rapid antigen detection test, 33 were positive only by immunofluorescence assays, and 171 were positive by both methods. The 35 samples with discordant results were analyzed by RT‐qPCR; the two samples positive only by rapid antigen detection test and the five positive only by immunofluorescence assays were also positive by RT‐qPCR. There was no relation between the negativity by QuickVue® RSV Test and viral load or specific strain. The QuickVue® RSV Test showed sensitivity of 90%, specificity of 98.8%, PPV of 99.3%, and negative predictive value of 94.6%, with accuracy of 93.2% and agreement κ index of 0.85 in comparison to IFA.
ConclusionsThis study demonstrated that the QuickVue® RSV Test Kit can be effective in early detection of Respiratory syncytial virus in nasopharyngeal aspirate and is reliable for use as a diagnostic tool in pediatrics.
Avaliar o teste QuickVue® RSV Test Kit (QUIDEL Corp, CA, EUA) para o diagnóstico rápido do vírus sincicial respiratório em crianças com doença respiratória aguda, comparandoo com a imunofluorescência indireta como padrão ouro. Visto que, no Brasil, testes rápidos para detecção de antígenos para vírus sincicial respiratório não são rotineiramente utilizados como ferramenta de diagnóstico, exceto para Dengue e Influenza.
MétodosUm total de 486 amostras de aspirado de nasofaringe de crianças menores de 5 anos com doença respiratória aguda, coletadas entre dezembro de 2013 e agosto de 2014, foram analisadas por imunofluorescência e pelo teste QuickVue®. Amostras com resultados discordantes entre os métodos foram submetidas a PCR em tempo real e sequenciamento.
ResultadosDas 313 amostras positivas por IFI, 282 foram positivas no teste rápido (90%), 2 amostras foram positivas apenas no teste rápido (0.6%), 33 apenas na imunofluorescência (10.5%) e 171 foram negativas em ambos os métodos. As 35 amostras com resultados discordantes foram testadas por PCR em tempo real, sendo que duas que foram positivas apenas no teste rápido e 5 apenas na imunofluorescência confirmaram‐se positivas. Não houve relação entre a ausência de positividade no teste QuickVue® com a carga ou com a cepa viral. O teste QuickVue® mostrou sensibilidade de 90.1%, especificidade 98.9%, valor preditivo positivo 99.3%, valor preditivo negativo de 94.6%, acurácia de 93.2% e índice de concordância de 0.85 em comparação à imunofluorescência.
ConclusõesNosso estudo demonstrou que o teste QuickVue® RSV pode ser efetivo na detecção precoce do vírus sincicial respiratório em amostras de aspirado de nasofaringe e é confiável como uma ferramenta de diagnósticos em pediatria.
O vírus sincicial respiratório (VSR) é conhecido como um importante agente infeccioso de infecções do trato respiratório em crianças em todo o mundo.1 A maior parte das crianças é infectada no primeiro ano de vida, porém praticamente todas estarão expostas até os 2 anos.2 Reinfecções são comuns ao longo da vida, dependem do nível de anticorpos neutralizadores no soro, porém complicações em infecções do trato respiratório inferior são mais comuns na infecção primária.3 O VSR é basicamente reproduzido em partes superficiais do trato respiratório até se espalhar pelo epitélio e formar um efeito citopático semelhante a um sincício. O VSR tem dois subgrupos conhecidos, A e B, e pode causar vários quadros clínicos, desde uma gripe comum a bronquiolite e pneumonia, causadas pela necrose dos brônquios e bronquíolos. A Organização Mundial de Saúde (OMS) estima que o VSR infecta 64 milhões de pessoas e causa 160.000 óbitos por ano em todo o mundo.4 A sazonalidade do vírus varia e normalmente é detectada durante todo o ano. Contudo, sabe‐se que a maior incidência ocorre no inverno.
O diagnóstico viral do VSR pode ser atingido por vários métodos, incluindo: cultura de células, ensaios de imunofluorescência (IFI), ensaios imunocromatográficos (testes rápidos de detecção de antígenos: TRDAs) e reação em cadeia da polimerase (PCR), incluindo ensaios de PCR convencionais e em tempo real. Na última década, os métodos moleculares são usados como padrão ouro devido à sua especificidade e capacidade de detecção simultânea de diferentes vírus.5 No Brasil, embora existam no mínimo quatro testes rápidos de detecção de antígenos (TRDAs) disponíveis para a detecção do VSR: BD‐Directigen™EZ‐RSV (Becton, Dickinson and Company®, NJ, EUA); SASTM RSValert (Medivax®, RJ, Brasil), Alere™BinaxNow®RSV (Alere™, EUA) e QuickVue® RSV Test Kit (QUIDEL Corp., CA, EUA), testes rápidos não são usados rotineiramente no país como diagnóstico confiável de infecções virais, como o VSR, com exceção dos testes de HIV e Dengue,6,7 que são amplamente usados.
O teste rápido a ser avaliado neste estudo (QuickVue® RSV Test Kit, Quidel®) fornece resultado em 15 minutos, em comparação com aproximadamente 90 minutos do teste convencional IFI e 2‐3 horas do ensaio imunossorvente ligado a enzima (Elisa).8 Identificar rapidamente o agente etiológico das doenças respiratórias, como bronquite e bronquiolite, é um passo importante em direção à redução do uso de antimicrobianos, principalmente em crianças hospitalizadas,9 e também pode levar ao método mais adequado de isolamento e tratamento.
O Quidel® QuickVue® RSV Test é um imunoensaio com varetas que permite a detecção rápida e qualitativa do antígeno VSR (proteína de fusão viral) diretamente a partir de espécimes de esfregaço de nasofaringe, aspirado de nasofaringe ou lavagem nasal/nasofaríngea de pacientes pediátricos sintomáticos. O teste é destinado ao uso como auxílio no diagnóstico de infecções virais sinciciais respiratórias agudas.
O objetivo deste estudo é avaliar a sensibilidade, especificidade e importância do teste QuickVue® RSV Test Kit (QUIDEL Corp.CA, EUA) como um teste rápido de detecção de antígenos (TRDA) para exame e melhoria do diagnóstico do vírus sincicial respiratório (VSR) em aspirado de nasofaringe em crianças com doença respiratória aguda em comparação com ensaios de imunofluorescência indireta (IFI) para uso em hospitais e clínicas pediátricas.
Material e métodosAnalisamos retroativamente amostras de aspirado de nasofaringe (AN) de 486 crianças – 274 meninos (56,4%) e 212 meninas (43,6%) – com menos de 5 anos com sintomas de infecção respiratória aguda (IRA), incluindo a doença do trato respiratório superior e inferior, entre dezembro de 2013 e agosto de 2014, que apresentavam IRA e foram atendidas no pronto socorro, no ambulatório ou internadas na Pediatria do Hospital Universitário da Universidade de São Paulo (HU‐USP).
As amostras clínicas foram coletadas durante o surto de VSR de 2014 com aspirador nasal. Imediatamente após a coleta, as amostras foram enviadas ao Laboratório Hospitalar da Universidade de São Paulo e examinadas por ensaios de imunofluorescência indireta (IFI) com o kit comercial Light DiagnosticsTM Respiratory Panel Viral Screening and Identification (IFA Chemicon®, Merk Millipore Corp., EUA) de acordo com as instruções do fabricante. Essas amostras foram enviadas ao Laboratório de Virologia Clínica e Molecular no Instituto de Ciências Biomédicas da Universidade de São Paulo, onde foram congeladas por criogenia e armazenadas a ‐80°C até o momento do teste. Todas as amostras foram registradas no Biorrepositório do Laboratório de Virologia e todas as diretrizes de ética para experimentos humanos foram estritamente observadas e aprovadas pelo Comitê de Ética sobre Pesquisa com Seres Humanos da Universidade de São Paulo (USP).
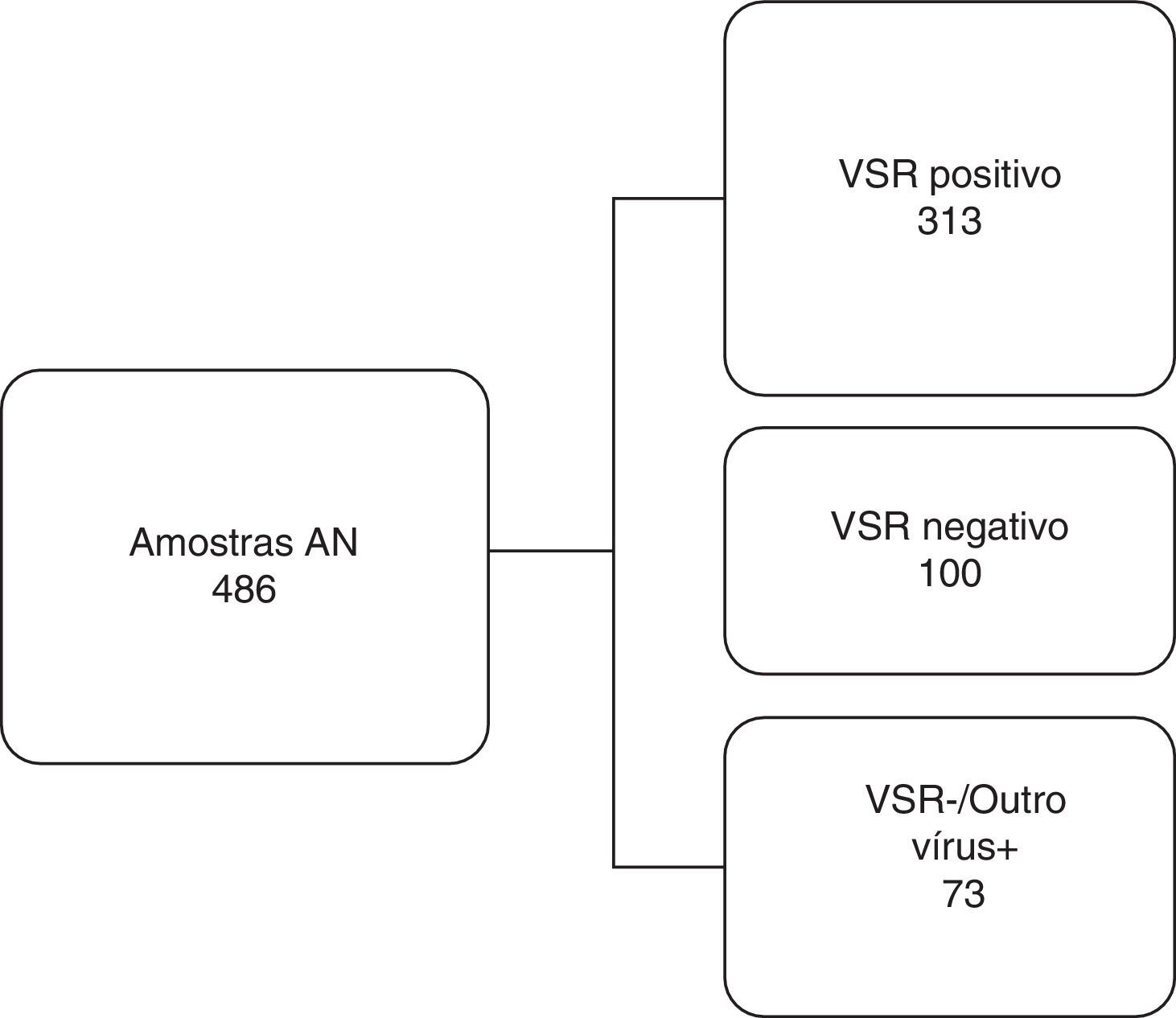
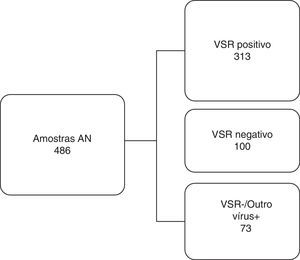
Com base nos resultados da IFI, foram selecionadas 486 amostras de AN distribuídas durante todos os meses da temporada e corresponderam a 50,4% de todas as amostras analisadas. Elas foram classificadas em três grupos distintos conforme mostrado na figura 1. Para reduzir ou eliminar qualquer viés, o ensaio QuickVue® RSV foi feito e analisado em um período cego de teste e os resultados foram comparados com os resultados originais do Kit IFI.
Fluxograma de trabalho. As amostras de aspirado de nasofaringe foram divididas em três grupos diferentes examinados pelo ensaio de imunofluorescência e comparadas com o teste rápido de detecção de antígenos para o vírus sincicial respiratório. VSR, vírus sincicial respiratório; AN, aspirado de nasofaringe;+, positivo; ‐, negativo.
Para confirmar os resultados, as amostras com resultados discrepantes foram testadas posteriormente por PCR da Transcrição Reversa Quantitativa em Tempo Real (regiãoda proteína F) e por PCR tradicional (regiões das proteínas G e F).
As amostras foram extraídas na plataforma Nuclisens® easyMag® (bioMerieux®, MA, EUA) e a PCR em tempo real foi feita em uma instrumentação ABI 7300 com o kit principal de mistura AgPath‐ID One‐Step RT‐PCR (Ambion®, TX, EUA) de acordo com as instruções do fabricante.
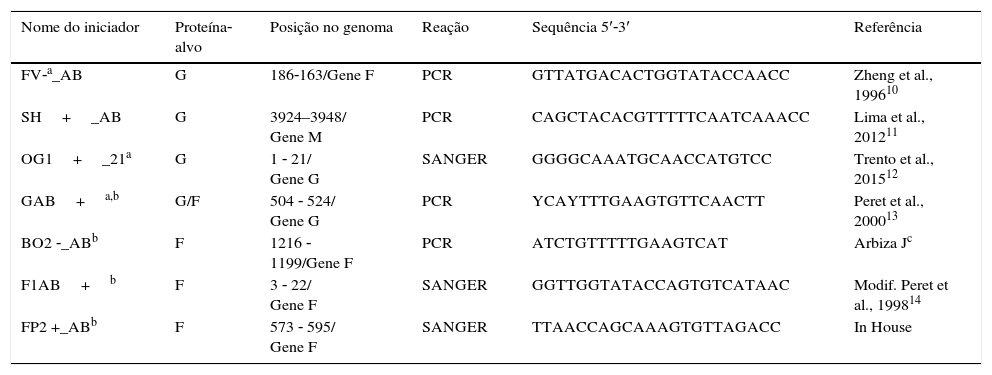
Na PCR tradicional, usamos uma mistura de reação com 10μL de DNA complementar (cDNA), 5μL de reação colchão de PCR com concentração 10X [50mM Tris–HCl (pH 9,0)], 1μL de MgCl2 [50mM KCl, 20mM (NH4)2SO4], 2,5mM de cada desoxirribonucleotídeo fosfatado (dNTP), 10pmol de cada iniciador para VSR (tabela 1), 0,6U de Taq DNA polimerase (taq DNA polimerase platina, Invitrogen, CA, EUA) e Água, resultou em um volume final de 50μL. A amplificação das proteínas G e F foi feita em um termociclador GeneAmp PCR System 9700 (Applied Biosystems, Inc., CA, EUA) de acordo com a seguinte programação: 95°C por 5 minutos, seguido de 40 ciclos de 95°C por 30 segundos, 54°C por 30 segundos, 72°C por 1 minuto e 30 segundos e um último ciclo de 72°C por 7 minutos. Aproximadamente 1.894 produtos de pares de base (bp) do gene G10–12 e 1685 produtos bp do gene F13 foram purificados com um kit comercial (Exosap, GE®Tech, CA, EUA) de acordo com as instruções do fabricante. As reações em sequência do gene G10–13 e do gene F13,14 foram submetidas à separação eletroforética para coleta de dados básicos em um sequenciador de DNA 3130 (Applied Biosystems, Inc., CA, EUA) com um kit de finalizadores com corante fluorescente (Applied Biosystems, Inc.CA, EUA). As sequências obtidas foram editadas com a versão 1.0 do programa de navegador de sequências (Applied Biosystems, Inc., CA, EUA) e alinhadas com o programa Megalign (Lacergene, DNA STAR, Inc., WI, EUA). A filogenia por máxima verossimilhança da proteína G foi estimada com o MEGA 6 (Análiseda Genética Evolutiva Molecular)15,16 com distribuição Gama (TN93+G) para o conjunto de dados RSV_A e o modelo com distribuição gama (HKY+G) para o conjunto de dados VSRHB.17 A árvore filogenética resultante foi traduzida em um cladograma vertical.
Iniciadores usados na PCR tradicional e no sequenciamento das proteínas G e F do VSR
| Nome do iniciador | Proteína‐alvo | Posição no genoma | Reação | Sequência 5′‐3′ | Referência |
|---|---|---|---|---|---|
| FV‐a_AB | G | 186‐163/Gene F | PCR | GTTATGACACTGGTATACCAACC | Zheng et al., 199610 |
| SH+_AB | G | 3924–3948/ Gene M | PCR | CAGCTACACGTTTTTCAATCAAACC | Lima et al., 201211 |
| OG1+_21a | G | 1 ‐ 21/ Gene G | SANGER | GGGGCAAATGCAACCATGTCC | Trento et al., 201512 |
| GAB+a,b | G/F | 504 ‐ 524/ Gene G | PCR | YCAYTTTGAAGTGTTCAACTT | Peret et al., 200013 |
| BO2 ‐_ABb | F | 1216 ‐ 1199/Gene F | PCR | ATCTGTTTTTGAAGTCAT | Arbiza Jc |
| F1AB+b | F | 3 ‐ 22/ Gene F | SANGER | GGTTGGTATACCAGTGTCATAAC | Modif. Peret et al., 199814 |
| FP2 +_ABb | F | 573 ‐ 595/ Gene F | SANGER | TTAACCAGCAAAGTGTTAGACC | In House |
F, Proteína de fusão; G, Glicoproteína; M, Proteína de matriz.
Os critérios usados na avaliação de desempenho do ensaio com QuickVue® RSV foram sensibilidade, especificidade, valores preditivos positivos e negativos e razões de verossimilhança de diagnóstico (DLRs) positivas/negativas.18,19 Consideramos o IFI o padrão ouro nessas análises. As amostras avaliadas como positivas pelo IFI foram consideradas verdadeiros positivos e as amostras avaliadas como negativas pelo IFI foram consideradas verdadeiros negativos. Para uma avaliação precisa da concordância entre os métodos, também foi calculado o índice kappa (κ).
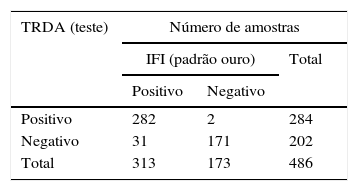
ResultadosTeste rápido de detecção de antígenos (TRDA)Das 313 amostras de AN positivas para VSR pelo IFI, 282 (90%) também foram positivas de acordo com o teste rápido (Quidel® QuickVue RSV Test); assim, o TRDA revelou 31 resultados falso negativos. Todas as 100 amostras de AN positivas para VSR pelo IFI também foram consideradas negativas pelo teste rápido (100%). Das 73 amostras de AN consideradas negativas para VSR, porém positivas para outros vírus respiratórios (adenovírus (AdV) ou vírus da parainfluenza (PIV) 1, 2, 3 ou influenza A e influenza B) pelo IFI, 71 (97,26%) foram confirmadas pelo teste rápido e duas (2,74%) apresentaram resultados divergentes, revelaram dois resultados falso positivos (tabela 2A).
Resultados de VSR positivos e negativos por ensaio de imunofluorescência indireta (IFI) e teste rápido de detecção de antígenos (TRDA) e totalidade de amostras divergentes testadas neste estudo. (A) Resultados do teste rápido de detecção de antígenos comparados com os do IFI. (B) Resultados discrepantes. (C) Comparação dos parâmetros de avaliação do teste rápido, incluindo sensibilidade, especificidade, valor preditivo positivo (VPP), valor preditivo negativo (VPN) e razão de verossimilhança de diagnóstico positivo/negativo (DLR) do QuickVue® RSV Test em comparação com o IFI, usado como padrão ouro
| TRDA (teste) | Número de amostras | ||
|---|---|---|---|
| IFI (padrão ouro) | Total | ||
| Positivo | Negativo | ||
| Positivo | 282 | 2 | 284 |
| Negativo | 31 | 171 | 202 |
| Total | 313 | 173 | 486 |
| Resultados | Número de amostras |
|---|---|
| IFI+, TRDA ‐, qPCR+ | 26 |
| IFI‐, TRDA+, qPCR+ | 2 |
| IFI+, TRDA‐, qPCR‐ | 5 |
| IFI‐, TRDA+, qPCR‐ | 0 |
| Parâmetro | IC de 95% |
|---|---|
| Sensibilidade (%) | 90,1 (86,8‐93,4%) |
| Especificidade (%) | 98,8 (97,2‐100) |
| VPP (%) | 99,3 (98,3‐100%) |
| VPN (%) | 94,6 (79,6‐89,6) |
| DLR positivo | 77,9 (19,6‐309,26) |
| DLR negativo | 0,1 (0,071‐0,14) |
As 33 amostras com resultados discordantes entre os dois métodos foram analisadas por PCR em tempo real (tabela 2B).
Vinte e seis amostras de AN previamente consideradas positivas pelo IFI e negativas pelo teste rápido foram confirmadas positivas para VSR por PCR em tempo real. As duas amostras de AN consideradas negativas pelo IFI e positivas pelo teste rápido eram de fato positivas por PCRq. E as cinco amostras de AN consideradas positivas pelo IFI e negativas pelo teste rápido eram de fato negativas por PCRq. Os valores do ciclo de limiar (Ct) do PCR em tempo real das 26 amostras positivas variou de 14 a 37 ciclos.
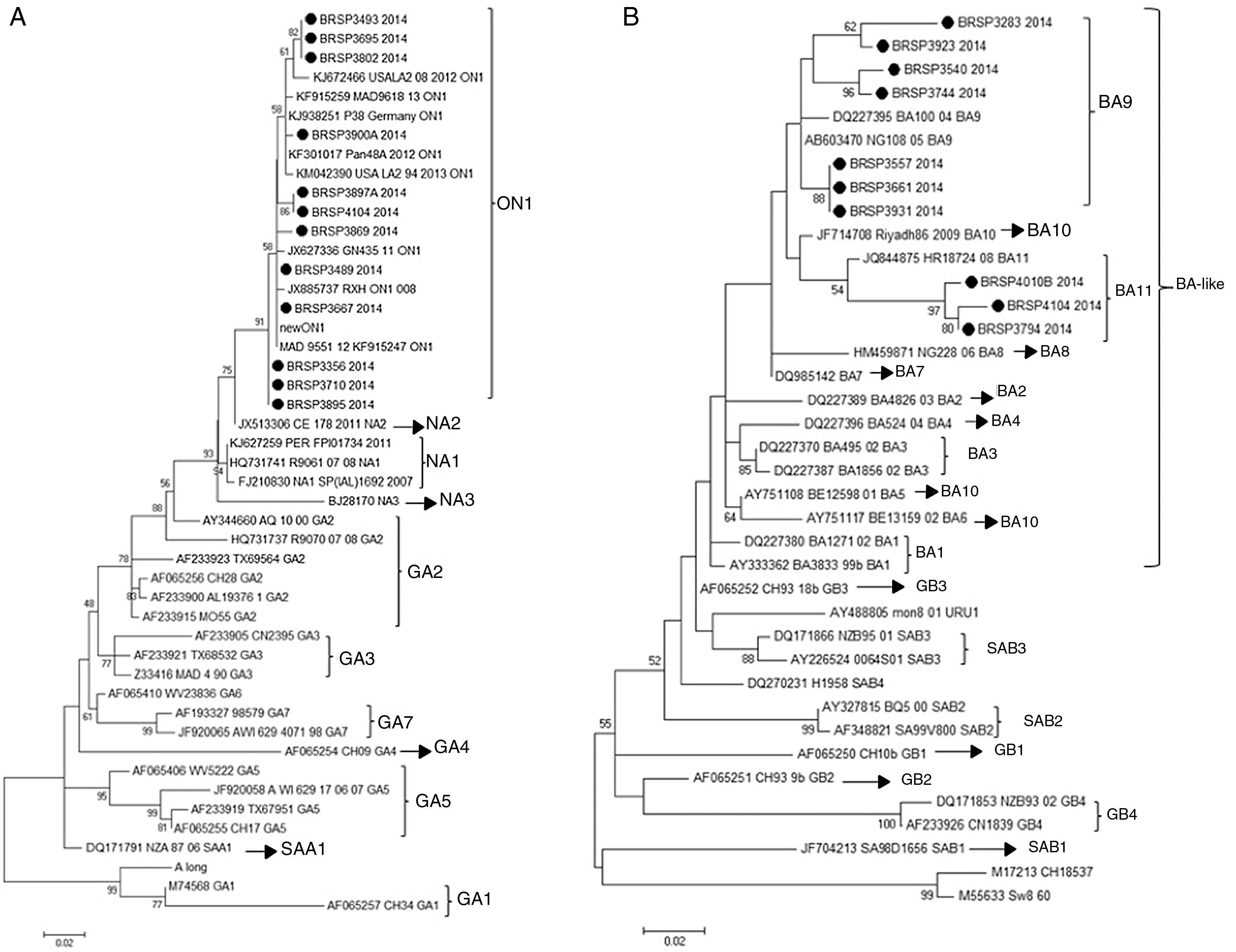
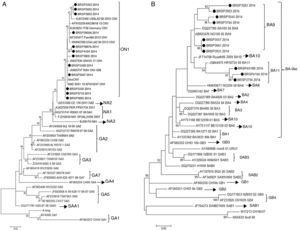
Para entender se as diferenças entre os testes estavam relacionadas a um genótipo específico (VSR_A ou VSR_B) ou a uma variabilidade genética na proteína F do vírus, a proteína G de todas as 26 amostras com resultados divergentes foram sequenciadas e tivemos 22 consensos para análise posterior. Depois do sequenciamento, os resultados mostraram que todas as 12 sequências VSR_A são do genótipo novo ON1 e todas as 10 sequências VSR_B são dos genótipos novos BA11 (3) e BA9 (7) (fig. 2).
Árvore filogenética da máxima verossimilhança do VSRH com base nas sequências do nucleotídeo da proteína G das amostras discrepantes deste trabalho, indicadas como BRSP, e de cepas mundialmente distribuídas obtidas do GenBank. Os números de acesso ao GenBank são apresentados em cada táxon, seguidos pelo nome correspondente da cepa. A(s) árvore(s) inicial(is) da busca heurística foi(ram) obtida(s) com o método de agrupamento de vizinhos a uma matriz de distâncias pareadas estimadas pela abordagem de máxima verossimilhança composta (MCL). As árvores foram desenhadas em escala, com os comprimentos dos troncos mensurados em número de substituições por local. Os números nos nós internos representam as probabilidades bootstrap (5.000 réplicas). Somente valores de bootstrap>50 são apresentados. A) VSRHA. O histórico de evolução foi inferido com o método de máxima verossimilhança com base no modelo de Tamura‐Nei.15,16 A árvore com a maior probabilidade logarítmica (‐1303.6711) é apresentada. B) VSRHB. O histórico de evolução foi inferido com o método de máxima verossimilhança com base no modelo de Hasegawa‐Kishino‐Yano.17 A árvore com a maior probabilidade logarítmica (‐1207.4096) é apresentada. As análises foram feitas no MEGA6.15
Para verificar se a negatividade no TRDA de amostras positivas com alta carga viral estava associada a uma mutação específica na fusão (F) da proteína de VSR, os primeiros 1200 nucleotídeos do gene das 26 amostras com resultados divergentes foram sequenciados e não revelaram uma mutação específica que poderia ser associada à negatividade das amostras no TRDA (dados não apresentados).
Análise estatísticaA feitura do QuickVue® RSV Test em comparação com o IFI está representada na tabela 2C. A acurácia foi de 93,2 (IC de 95%, 91,0%‐95,4%) e a concordância do índice κ entre os métodos foi de 0,85 (IC de 95%, 0,945‐0,796) e foi classificada como quase perfeita20 e p<0,001.
A análise dos resultados discordantes e concordantes entre as metodologias não mostrou relevância (p=0,62, p=0,065 no qui‐quadrado, respectivamente).
DiscussãoO objetivo deste estudo foi provar que o teste rápido é eficiente para detecção de VSR e incentivar seu uso no Brasil, já que é atualmente feito para dengue, gripe e HIV.
A marca registrada da infecção por VSR é a bronquiolite,21 e seu diagnóstico normalmente é feito pelo quadro clínico.22 Embora não recomendada, a prescrição de antibióticos para bronquiolite é uma prática extremamente comum em crianças internadas9,23 e seu uso está associado a um aumento no custo e tempo de internação24 e a um aumento do risco de desenvolvimento de cepas bacterianas resistentes.25 Em casos graves, principalmente nas unidades de terapia intensiva, antibióticos são comumente usados para evitar uma possível infecção bacteriana, apesar de o risco em neonatos saudáveis ser incomum.26 Uma análise sistemática de quatro estudos que envolveram crianças na emergência sugeriu que testes de diagnóstico podem reduzir a prescrição de antibióticos,24 conforme verificado em um estudo com neonatos com menos de 1 ano internados com bronquiolite positivos para VSR pelo IFI, que descreveu uma redução significativa no uso de antibióticos.27 Caso o teste diagnóstico seja positivo, ele pode contribuir para evitar o uso de antibióticos. Em casos duvidosos, embora não graves, o paciente deve ficar em observação.
Como o resultado que usa um teste rápido está disponível em 15 minutos e é feito pelo médico sem a necessidade de equipamentos laboratoriais, o teste rápido seria usado para esse exame, como um ponto de cuidado.
Nesse contexto, nosso trabalho mostrou que o QuickVue® RSV Test é confiável para essa tarefa, como pode ser visto pelos resultados do desempenho em comparação com os ensaios de imunofluorescência indireta (IFI) usados como padrão ouro neste estudo. Todos os parâmetros analisados eram altos (acima de 90%−Sensibilidade de 90%, especificidade de 98,8%, VPP de 99,3% e VPN de 94,6%) e semelhantes aos de outros estudos que compararam o TRDA com IFI como padrão ouro, que variou de 73 a 93% de sensibilidade e 84 a 100% de especificidade.28 Em contrapartida, Leonardi et al.,29 avaliaram quatro ensaios diretos de detecção de antígeno VSR e seus resultados apresentaram apenas 57,5% de sensibilidade para QuickVue®, embora essa diferença possa ser devida à comparação com RT‐qPCR, que tem uma sensibilidade e especificidade maiores do que o IFI.
Além disso, a concordância geral (índice kappa) e a acurácia entre os dois testes foram consideradas boas e a concordância percentual negativa e positiva (173/202 e 284/313, respectivamente) não apresentou diferença significativa (p>0,05). Somente 33 amostras apresentaram resultados divergentes entre os testes, foram analisadas por RT‐qPCR para confirmar os resultados e correlacionar a sensibilidade do teste com baixa carga viral, como visto em Tuttle et al.30 Vinte e seis amostras continuam não resolvidas após essa análise e também não conseguimos explicar as diferenças de carga viral, pois o ciclo de limiar do qPCR variou de 14 a 37. Talvez esses resultados falso negativos possam estar relacionados ao armazenamento de espécimes congelados antes de sua análise.
Depois, para entender se essas diferenças estavam relacionadas a um genótipo específico (RSV_A ou RSV_B) ou a uma variabilidade genética na proteína F do vírus, foram sequenciados os genes G e F. A análise das sequências de G mostrou que elas pertenciam aos genótipos ON1 e BA como inserção (variantes BA11 e BA9). Contudo, outras amostras deste estudo que apresentaram resultados positivos pelo QuickVue® RSV Test foram sequenciadas (dados não apresentados) e pertenciam aos mesmos genótipos, provaram que a negatividade não está relacionada a esses genótipos. Não identificamos mutação no gene F que poderia ser responsável pelos resultados. Nossa abordagem final buscou a inibição causada pelos elementos químicos nas amostras, porém os espécimes falso negativos foram diluídos (1:5 e 1:10) e continuaram negativos.
Concluindo, o QuickVue® RSV Test Kit (Quidel Corp.CA, EUA) apresentou altos valores preditivos e razões de verossimilhança e provou ser eficaz na detecção precoce do vírus sincicial respiratório. Contudo, a depender da melhoria do paciente, recomendamos que o teste seja repetido em caso de negatividade. Portanto, nosso estudo demonstrou que o QuickVue® RSV Test Kit (Quidel Corp.CA, EUA) pode ser eficaz na detecção precoce do vírus sincicial respiratório em espécimes congelados de aspirado da nasofaringe e é adequado para uso como ferramenta de diagnóstico em crianças.
FinanciamentoUniversidade de São Paulo (USP).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosÀ Quidel Corp. por doar os kits do teste rápido de detecção de antígenos, essenciais para o desenvolvimento deste trabalho. A Gustavo Rezende Melo pela análise estatística e ao Sr. José Maria Lopes pelo apoio técnico.
Como citar este artigo: Mesquita FS, Oliveira DB, Crema D, Pinez CM, Colmanetti TC, Thomazelli LM, et al. Rapid antigen detection test for respiratory syncytial virus diagnosis as a diagnostic tool. J Pediatr (Rio J). 2017;93:246–52.
Trabalho desenvolvido na Universidade de São Paulo, Instituto de Ciências Biomédicas II, Departamento de Microbiologia, Laboratório de Virologia Clínica e Molecular, São Paulo, SP, Brasil.