A associação entre doença hepática crônica (DHC) e desnutrição, tanto em adultos como em pacientes pediátricos, é conhecida há muito tempo.1,2 Múltiplos estudos também demonstraram de forma clara que um estado nutricional comprometido pode ser prejudicial ao desfecho desses pacientes, aumenta sua vulnerabilidade a complicações e reduz sua expectativa de vida.3–6
Nas últimas décadas, tem sido sugerido que a perda de massa muscular deve ser considerada como o principal componente da desnutrição na DHC.7 Atualmente a redução da massa muscular é mais bem definida como sarcopenia. A sarcopenia foi inicialmente descrita como um processo fisiológico que ocorre durante o envelhecimento; entretanto, as doenças crônicas podem antecipar consideravelmente esse evento (“sarcopenia secundária”). A definição de sarcopenia inclui tanto a diminuição da massa muscular quanto a redução da função muscular8; no entanto, até o momento, um grande número de estudos se concentrou principalmente na mensuração da massa muscular, desconsiderou a avaliação da função muscular. Esse fato pode estar relacionado à ideia de que a mensuração da massa muscular é mais objetiva e fácil de ser feita do que as avaliações funcionais, se considerarmos que essas avaliações também são mais demoradas. Em pacientes adultos com DHC, considera‐se a área muscular total em L3 em uma tomografia computadorizada (TC) ou ressonância magnética (RM), o padrão‐ouro para o diagnóstico de sarcopenia9 e usado na maioria dos estudos. A TC e a RM geralmente estão disponíveis para esses pacientes para outra indicação clínica (antes do transplante de fígado ou para o estudo de lesões hepáticas focais). Recentemente, a importância de se concentrar na função muscular para confirmar a sarcopenia e a necessidade de fornecer pontos de corte claros (para idade, gênero e etnia) para identificar pacientes com comprometimento muscular foram recomendadas pelo consenso europeu revisado sobre definição e diagnóstico de sarcopenia.8
Diferentes mecanismos podem contribuir para causar sarcopenia na DHC.10 A ingestão calórica e proteica é geralmente menor do que a necessária devido a apetite baixo, dispepsia e prescrição médica errônea; a má absorção pode estar presente devido à hipertensão portal e o metabolismo energético pode estar moderadamente aumentado durante as complicações. Além disso, como os estoques de glicogênio hepático estão esgotados devido à fibrose hepática, o metabolismo energético desses pacientes mostra uma rápida transição para um “padrão de jejum”, o que induz o catabolismo proteico para suprir a gliconeogênese. A síntese de proteínas também fica prejudicada no músculo de pacientes com DHC por diversas razões, tais como níveis baixos de testosterona, principalmente em indivíduos do sexo masculino, disponibilidade reduzida de aminoácidos e hiperamonemia crônica, o que causando aumento dos níveis de miostatina. Por essas razões, os pacientes com doença hepática avançada sofrem uma redução progressiva da massa muscular, o que é claramente evidente, tanto na antropometria (circunferência muscular do braço) quanto na análise de imagens (TC ou RM). Em pacientes adultos com doença hepática avançada, a sarcopenia está associada a complicações dos pacientes, como encefalopatia, infecções ou ascite refratária, é um preditor de mortalidade na lista de espera para transplante de fígado e aumenta o tempo de internação e os custos hospitalares pós‐transplante.9,11
O interesse na sarcopenia em crianças com DHC só foi reconhecido recentemente na literatura pediátrica12 e poucos estudos avaliaram o impacto da sarcopenia nos desfechos clínicos dessa população. Com relação à presença de redução da massa muscular, ela foi medida por absorciometria de raios‐X de dupla energia (DEXA), TC, RM ou análise de impedância bioelétrica (BIA). Todos esses métodos requerem cooperação do paciente para permanecer imóvel durante as medições e isso torna essas técnicas um desafio em bebês e crianças pequenas. Além disso, a exposição à radiação restringe o uso da TC, caso não seja incluída no estadiamento clínico, e a RM, que é livre de radiação, é ainda mais dispendiosa. A DEXA pode representar uma opção útil, porém há controvérsias sobre se a toda massa muscular esquelética do corpo e a massa magra apendicular têm igual desempenho como marcadores da sarcopenia. Finalmente, os dados normativos pareados para idade e sexo nem sempre estão disponíveis em crianças saudáveis e a ausência de critérios diagnósticos uniformes torna‐se o principal obstáculo para estabelecer a presença de sarcopenia em crianças.
A peculiaridade de avaliar a composição corporal em crianças é que elas são indivíduos em crescimento. Isso causa variabilidade entre homens e mulheres e de acordo com a idade da criança. Um evento crucial é o crescimento puberal, que também pode ser retardado pela desnutrição ou pela doença subjacente. Durante a puberdade, sabe‐se que as meninas ganham mais massa gorda, enquanto nos meninos o aumento da massa livre de gordura é predominante. Isso pode obviamente dificultar a avaliação correta da sarcopenia.
Como mencionado anteriormente, a avaliação da função muscular é crucial para a avaliação da sarcopenia, uma vez que a força muscular não está linearmente relacionada à massa muscular. Essa medida, no entanto, está frequentemente ausente também em estudos que avaliam a sarcopenia em crianças.
Testes apropriados de função muscular precisam considerar o desenvolvimento da coordenação ou a estabilidade e a competência em movimentos intencionais em bebês. As escalas de avaliação da função motora, que levam em consideração a força muscular para a avaliação da sarcopenia, não foram desenvolvidas para a primeira infância e, atualmente, não há uma avaliação padronizada da função muscular para o diagnóstico de sarcopenia em pacientes pediátricos jovens. Em crianças mais velhas ou adolescentes, o teste de força usado em adultos também pode ser adotado (teste de força de preensão manual [hand‐grip] ou teste de caminhada de seis minutos); porém, os valores normativos em crianças nem sempre estão disponíveis e as medidas são difíceis de avaliar objetivamente.
Nesta edição do Jornal de Pediatria, Rezende et al.13 relatam dados descritivos de crianças – pacientes pediátricos com DHC – acompanhadas nos ambulatórios de tratamento clínico e de transplantados do Departamento de Gastroenterologia e Hepatologia Pediátrica da Universidade Federal da Bahia (Brasil). Oitenta e cinco pacientes foram incluídos (64,7% do sexo feminino, média de 11,7+3,4 anos, 50% na fase puberal) acometidos por várias doenças hepáticas, a atresia biliar e a hepatite autoimune foram as etiologias mais frequentes. Vinte e oito crianças apresentaram diagnóstico de cirrose, com escore Child‐Pugh A em 82,1%. A sarcopenia foi diagnosticada com base na presença simultânea de massa muscular e insuficiência de força muscular. A massa muscular foi analisada por absorciometria de raios‐X de dupla energia (DEXA) e força muscular pelo teste de força de preensão manual (HG, hand‐grip). Os autores fixaram o ponto de corte para esses parâmetros no valor mediano obtido na população do estudo. O diagnóstico de sarcopenia foi obtido em 40% dos pacientes. A massa muscular foi influenciada pelo sexo (maior no sexo masculino), faixa etária (< 10 vs. > 10 ou<14 vs. > 14 anos), mas não pelo IMC ou outros parâmetros, inclusive o peso corporal.
Este estudo tem uma valorosa participação na exploração do paradigma da sarcopenia em crianças com DHC.
A DHC é uma condição relevante em pacientes pediátricos, que pode ocorrer até mesmo no primeiro ano de vida em algumas doenças genéticas, como a atresia biliar ou a síndrome de Alagille. Esses pacientes podem desenvolver insuficiência hepática e necessitar de transplante hepático precoce e tanto a desnutrição quanto a sarcopenia podem comprometer seu desfecho clínico, como ocorre em pacientes adultos. Apesar disso, poucos estudos foram dedicados a essa questão.
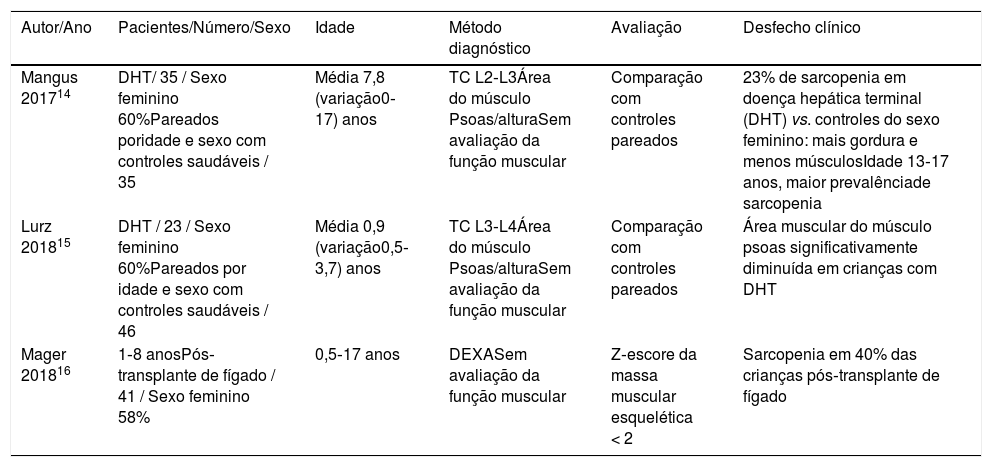
Apenas três estudos retrospectivos foram publicados sobre sarcopenia em crianças, dois em pacientes com DHC e um em pacientes após transplante de fígado14–16 (tabela 1). Todos esses estudos enfatizaram que os parâmetros nutricionais básicos, como IMC ou antropometria, poderiam subestimar a presença de sarcopenia em crianças. Mager et al.16 relataram que a presença de sarcopenia em crianças com transplante de fígado estava associada a alguns desfechos clínicos relevantes (retardo de crescimento, tempo de internação e taxa de re‐hospitalização).
Estudos sobre sarcopenia em pacientes pediátricos com doença hepática crônica
| Autor/Ano | Pacientes/Número/Sexo | Idade | Método diagnóstico | Avaliação | Desfecho clínico |
|---|---|---|---|---|---|
| Mangus 201714 | DHT/ 35 / Sexo feminino 60%Pareados poridade e sexo com controles saudáveis / 35 | Média 7,8 (variação0‐17) anos | TC L2‐L3Área do músculo Psoas/alturaSem avaliação da função muscular | Comparação com controles pareados | 23% de sarcopenia em doença hepática terminal (DHT) vs. controles do sexo feminino: mais gordura e menos músculosIdade 13‐17 anos, maior prevalênciade sarcopenia |
| Lurz 201815 | DHT / 23 / Sexo feminino 60%Pareados por idade e sexo com controles saudáveis / 46 | Média 0,9 (variação0,5‐3,7) anos | TC L3‐L4Área do músculo Psoas/alturaSem avaliação da função muscular | Comparação com controles pareados | Área muscular do músculo psoas significativamente diminuída em crianças com DHT |
| Mager 201816 | 1‐8 anosPós‐transplante de fígado / 41 / Sexo feminino 58% | 0,5‐17 anos | DEXASem avaliação da função muscular | Z‐escore da massa muscular esquelética < 2 | Sarcopenia em 40% das crianças pós‐transplante de fígado |
DHT, doença hepática terminal; TC, tomografia computadorizada; DEXA, raios-X de dupla energia.
O estudo de Rezende et al.13 é o primeiro a examinar tanto a massa muscular quanto a função muscular em crianças com DHC, como recomendado pelo recente consenso do EWGSO (European Working Group on Sarcopenia in Older People).8 Vale ressaltar que, embora os casos dos pacientes incluídos fossem menos graves (cirrose menor do que 30% compensada – a grande maioria de crianças tinha escore Child‐Pugh A e foram acompanhadas como pacientes ambulatoriais), os autores relataram uma prevalência de sarcopenia de até 40%. Esses resultados demonstram as dificuldades de comparar diferentes séries quando os métodos de avaliação e diagnóstico não são padronizados. De fato, o estudo de Rezende et al.13 usou uma comparação interna para o diagnóstico de sarcopenia, de modo que os pacientes foram considerados sarcopênicos quando estavam acima dos valores medianos para músculo esquelético apendicular (MEA) na população recrutada. Isso faz com que diferentes séries possam ter diferentes pontos de corte, o que dificulta a generalização dos resultados. É importante enfatizar que a sarcopenia precisa ser avaliada em crianças com DHC e novas pesquisas são necessárias para melhorar os métodos e critérios diagnósticos, considerando os possíveis fatores de confusão. A boa notícia é que esse processo já começou.
Conflitos de interesseO autor declara não haver conflitos de interesse.