To evaluate the outcome of children with severe acquired aplastic anemia treated with rabbit antithymocyte globulin and cyclosporine as first‐line treatment at this institution.
MethodsRetrospective analysis of 26 pediatric patients with aplastic anemia, treated between 1996 and 2011 with rabbit antithymocyte globulin plus cyclosporine.
ResultsThe overall response rate at six months was 34.6% (9/26), and the cumulative incidence of relapse was 26.5% (95% confidence interval [CI]: 1.4%‐66%) at 5 years. The cumulative incidence of clonal evolution after immunosuppressive therapy was 8.3% (95% CI: 0.001%‐53.7%) at five years with both clonal evolutions in non ‐responders who acquired monosomy 7 karyotype. The overall survival at five years was 73.6% (95% CI: 49.2%‐87.5%).
ConclusionsThe present results confirm the poor response rate with rabbit antithymocyte globulin as first therapy in pediatrics patients, similar to what has been reported for patients of all ages. This confirmation is problematic in Brazil, given the lack of horse antithymocyte globulin in many markets outside the United States.
Avaliar o resultado de crianças com anemia aplástica grave adquirida tratadas com globulina antitimocítica de coelho e ciclosporina como tratamento inicial em nosso instituto.
MétodosAnálise retrospectiva de 26 pacientes pediátricos com anemia aplástica tratados entre 1996 e 2011 com globulina antitimocítica de coelho e ciclosporina.
ResultadosA taxa de resposta geral em seis meses foi de 34,6% (9/26), e a incidência acumulada de recorrência foi de 26,5% (intervalo de confiança [IC] de 95%,1,4%‐66%) em cinco anos. A incidência acumulada de evolução clonal após a terapia imunossupressora foi de 8,3% (IC 95%, 0,001%‐53,7%) em cinco anos, com ambas as evoluções clonais em pacientes sem resposta que adquiriram o cariótipo com monossomia 7. A sobrevida geral em cinco anos foi de 73,6% (IC 95%, 49,2%‐87,5%).
ConclusõesNossos resultados confirmam a baixa taxa de resposta com globulina antitimocítica de coelho como terapia inicial em pacientes pediátricos, da mesma forma como relatado para pacientes de todas as idades. Essa confirmação é problemática em nosso país devido à falta de globulina antitimocítica de cavalo em muitos mercados fora dos Estados Unidos, incluindo o Brasil.
A anemia aplástica grave (AAG) é uma doença hematológica rara caracterizada por pancitopenia e medula óssea hipocelular. Na AAG, os elementos celulares da medula são substituídos por gordura como resultado da destruição imunomediada de células‐tronco e de células progenitoras.1 Até recentemente, considerava‐se que a substituição por gordura era um processo benigno, porém, dados recentes sugerem que essa substituição pode ser um regulador negativo de hematopoiese, contribuindo para a falência da medula.2 A hematopoiese pode ser restabelecida na AAG após transplante de células‐tronco hematopoiéticas (TCTH) ou terapia imunossupressora (IST). Em crianças e jovens, o TCTH é preferível quando um irmão doador histocompatível está disponível e, para todos os outros pacientes, a IST normalmente é empregada como terapia inicial.3–5 A IST padrão ocorre com uma combinação de globulina antitimocítica de cavalo (ATG) e ciclosporina (CsA).6 Os agentes linfocitotóxicos mais potentes, como a ATG de coelho, alemtuzumabe e a ciclofosfamida geraram resultados decepcionantes para AAG sem tratamento prévio devido à falta de eficácia e/ou maior toxicidade.7–10 As taxas de resposta à ATG de cavalo/CsA foram compatíveis nos estudos nos Estados Unidos, na Europa e no Japão e variaram entre 60 e 75%.1,4,11–13 Em geral, as crianças têm maior taxa de resposta hematológica, na faixa de 70 a 80%, ao passo que adultos mais velhos (> 40‐50 anos) relataram taxas de resposta na faixa de 50 a 60%.14–17
A ATG de coelho é fabricada de forma semelhante à de cavalo, porém possui mais propriedades linfocitotóxicas em termos de peso.18,19 As células T humanas derivadas do timo ou de uma linhagem de células T são usadas para tornar um animal sensível, seja cavalo ou coelho, e produzirá anticorpos policlonais com diversos detalhes para as moléculas expressas em células T humanas. Esses soros policlonais são então purificados para administração em humanos. A ATG de coelho foi bem‐sucedida na cura de pacientes com AAG após a falha inicial da ATG de cavalo e no alotransplante renal, e demonstrou ser superior à ATG de cavalo em uma comparação direta.20–22 Contudo, quando aplicadas como terapia inicial, os resultados da ATG de coelho foram inferiores aos da ATG de cavalo em um estudo randomizado.8 Os relatos retrospectivos de acompanhamento confirmaram a menor taxa de resposta em pacientes tratados com ATG de coelho na terapia inicial em comparação à ATG de cavalo.23–26 Contudo, a maioria dos relatos não teve crianças como foco. Neste estudo, relatamos nossos resultados de pacientes pediátricos que receberam a ATG de coelho como terapia inicial de AAG tratada no Instituto da Criança da Universidade de São Paulo.
Pacientes e métodosPacientesForam incluídos na análise os pacientes consecutivos com AAG que receberam ATG de coelho/CsA entre agosto de 1996 e junho de 2011 no Instituto da Criança da Universidade de São Paulo, em São Paulo. Devido à indisponibilidade de ATG de cavalo em nosso instituto e no Brasil desde 2007, a ATG de coelho se tornou a terapia imunossupressora padrão para pacientes com AAG sem um irmão doador HLA idêntico. Todos os pacientes atenderam aos critérios de AAG, conforme definidos por uma celularidade da medula óssea inferior a 30% e pancitopenia grave com pelo menos dois dos seguintes critérios de contagem no sangue periférico: (1) contagem absoluta de neutrófilos (CAN) < 0,5 x 109/L; (2) contagem absoluta de reticulócitos (CAR) < 60 x 109/L; contagem de plaquetas < 20 x 109/L.27 Os critérios de exclusão foram: (1) anomalia citogenética; (2) morfologia da medula óssea compatível com mielodisplasia; e (3) diagnóstico de anemia de Fanconi. A biópsia e a aspiração da medula óssea, incluindo a citogenética, foram realizadas antes de iniciar a terapia. A anemia de Fanconi foi excluída devido à ausência de alterações cromossômicas após a exposição in vitro de linfócitos ao diepoxibutano (teste DEB). Os pacientes foram hospitalizados para administração da ATG de coelho e receberam alta quando o quadro clínico se tornou estável, geralmente em cerca de três semanas. O comitê de ética médica local aprovou este estudo, e os dados foram obtidos de registros relevantes por escrito e computadorizados.
Regime de tratamentoUma dose‐teste inicial intravenosa foi aplicada em todos os pacientes para avaliar a hipersensibilidade alérgica. A ATG de coelho (Timoglobulina®, Genzyme, Cambridge, MA, EUA) foi administrada a uma dose de 5mg/kg/d por via intravenosa por cinco dias consecutivos. Para evitar a doença do soro, foi administrada metilprednisolona a 2mg/kg/d antes da primeira dose de ATG, que foi continuada por dez dias e então reduzida durante os sete dias seguintes. A ciclosporina foi iniciada no sexto dia, a 10mg/kg/d por via oral, em doses divididas a cada 12 horas. A CsA foi administrada durante pelo menos seis meses, ajustada aos níveis de sangue (faixa terapêutica de 150 a 250 ng/mL).
Cuidado de suporteO fator estimulante de colônias de granulócitos (G‐CSF) foi administrado a uma dose de 5μg/kg por via subcutânea do 1° ao 30° dia para manter os neutrófilos acima de 0,5 x 109/L, a fim de evitar infecções. Foi usado itraconazol para evitar infecção fúngica a uma dose de 100mg/d por pelo menos um mês após a ATG de coelho. Outros antibióticos profiláticos não foram administrados rotineiramente.
Foram transfundidos glóbulos vermelhos em pacientes com anemia sintomática ou para manter um nível de hemoglobina superior a 9g/dL. Foram transfundidas plaquetas de forma profilática em todos os pacientes com contagem de plaquetas inferior a 10 x 109/L. As plaquetas foram transfundidas a um limite maior (20 x 109/L) em caso de febre/ou sangramento clínico.
DefiniçõesResposta completa (RC) foi definida como independência de transfusão relacionada à hemoglobina (Hb) > 110g/L, contagem de neutrófilos > 1,5 x 109/L e contagem de plaquetas > 100 x 109/L. Resposta parcial (RP) foi definida como independência de transfusão, porém sem atender aos critérios de contagem do sangue da RC. Todas as remissões tiveram de ser confirmadas por duas contagens do sangue com, no mínimo, quatro semanas de intervalo. A resposta foi avaliada aos 180 dias do tratamento. A recorrência foi indicada pela exigência de transfusão de glóbulos vermelhos e/ou plaquetas após a independência de transfusão ter durado três ou mais meses.
A evolução clonal foi definida como o aparecimento de uma nova desordem clonal em alterações citogenéticas ou morfológicas características no exame da medula óssea.
Análise estatísticaForam utilizadas estatísticas resumidas, incluindo os meios, as proporções e seus desvios‐padrão correspondentes para descrever a idade, o sexo e outras características básicas dos pacientes. Foram usadas as proporções de amostra e seus intervalos de confiança (ICs) de 95% para descrever as taxas de resposta de seis meses de pacientes classificados por fatores de risco distintos. As probabilidades de sobrevida de longo prazo de pacientes com riscos básicos distintos e contínuos foram avaliadas por meio das estimativas de Kaplan‐Meier em pacientes perdidos no acompanhamento contados como censurados. O acompanhamento mediano foi determinado pelo método de censura inversa. Os resultados numéricos foram computadorizados usando o software Prism (GraphPad, CA, EUA).
ResultadosUm total de 26 pacientes com AAG foram tratados com ATG de coelho/CsA. O acompanhamento médio da coorte foi de 4,3 anos (intervalo de 0,02 a 12,2). A idade média foi de 8,1 anos (faixa de 1,6 a 15 anos). A contagem absoluta de neutrófilos foi inferior a 0,2 x 109/L em 14 (53,8%), e inferior a 0,5 x 109/L em 12 (46,2). Em 92,3% dos casos, não houve qualquer evento precipitante aparente (AAG idiopática), e dois pacientes (7,7%) tiveram AAG após hepatite soronegativa. O intervalo entre o diagnóstico e o início do tratamento foi uma média de 75,7 dias (faixa de 7 a 300 dias). Outras características dos pacientes são apresentadas na tabela 1.
Características demográficas e hematológicas
| Características dos pacientes | Número de pacientes (N = 26) |
|---|---|
| Masculino/feminino | 14/12 (53,8% / 46,2%) |
| Idade média no diagnóstico | 8,1 anos (faixa de 1,6 a 15) |
| Causa da anemia aplástica | |
| Idiopática | 24 (92,3%) |
| Relacionada à hepatite | 2 (7,7%) |
| Gravidade da doença no diagnóstico | |
| Muito grave (contagem de neutrófilos < 0,2 x 109/L) | 14 (53,8%) |
| Grave (contagem de neutrófilos < 0,5 x 109/L) | 12 (46,2%) |
| Tempo médio entre o diagnóstico e o início do tratamento | 75,7 dias (faixa de 7 a 300) |
| Resposta ao tratamento em seis meses | |
| Resposta completa | 3 (11,6%) |
| Resposta parcial | 6 (23,0%) |
| Inexistência de resposta | 17 (65,4%) |
| Recorrência | 4 (15,0%) |
| Evolução clonal (monossomia 7) | 2 (7,6%) |
| Resultado | |
| Vivo com independência de transfusão | 16 (61,6%) |
| Vivo com dependência de transfusão | 4 (15,4%) |
| Falecido | 6 (23,0%) |
| Tempo médio de acompanhamento | 4,3 anos (faixa de 0,02 a 12,2) |
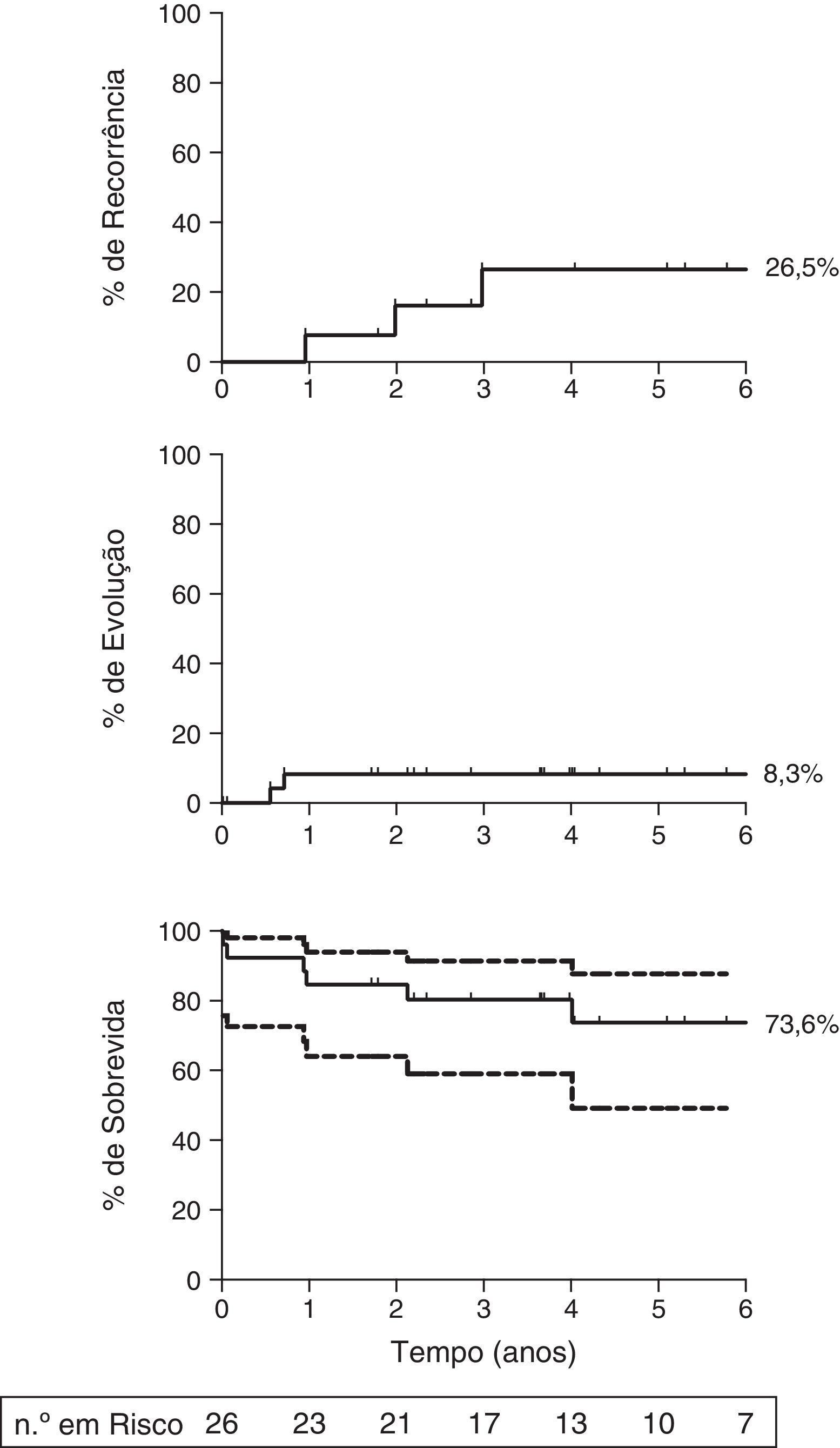
A taxa de resposta geral em seis meses foi de 34,6% [IC 95%, 16%‐53%]. Três pacientes responderam entre seis e 12 meses, resultando em uma taxa de resposta de 46,2% [IC 95%, 27%‐65%] nesse período de tempo. A incidência acumulada de recorrência foi de 26,5% [IC 95%, 1,4%‐66%] em cinco anos (fig. 1, gráfico superior). A incidência acumulada de evolução clonal foi de 8,3% (IC 95%, 0,001‐53,7%; fig. 1, gráfico do meio). As duas evoluções clonais ocorreram em pacientes sem resposta, que adquiriram um cariótipo com monossomia 7 e vieram a óbito devido a complicações infecciosas. A sobrevida geral em cinco anos foi de 73,6% (IC 95%, 49,2%‐87,5%; fig. 1, gráfico inferior). Houve quatro óbitos por complicações da AAG (septicemia) e dois secundários à evolução clonal.
Resultados de longo prazo após a terapia inicial com ATG de coelho. (Superior) A incidência acumulada de recorrência foi de 26,5% [IC 95%, 0,1‐68%] em cinco anos entre os que responderam à ATG de coelho; (Meio) A incidência acumulada de evolução clonal foi de 8,3% [IC 95%, 0,001‐53,7%]; (Inferior) A sobrevida geral em cinco anos foi de 73,6% [IC 95%, 49,2%‐87,5%] entre todos os pacientes. Os pacientes foram censurados no momento de óbito ou no último acompanhamento. O acompanhamento médio de todos os pacientes foi de 4,3 anos. O gráfico foi cortado para seis anos. As linhas pontilhadas no gráfico inferior representam o intervalo de confiança de 95%. O n° em risco é apresentado apenas para a curva de sobrevida de Kaplan‐Meier.
Em geral, as crianças têm resultados mais favoráveis em comparação a pacientes mais velhos com anemia aplástica tratados com IST. As taxas de resposta são maiores em crianças, e a sobrevida geral entre as que tiveram resposta é excelente.17 Embora não tenha sido realizado um estudo randomizado comparando a IST com o TCTH em pacientes pediátricos, a maioria, nessa faixa etária, é submetida a um TCTH relacionado combinado se um irmão histocompatível estiver disponível. Contudo, a IST nessa faixa etária também produz resultados excelentes, conforme relatado pelo Grupo Europeu de Transplante de Sangue e Medula Óssea (EBMT), em que os resultados de sobrevida de IST e TCTH como terapia inicial foram > 90%.28 A maior parte da experiência de IST de AAG é feita com ATG de cavalo, porém, desde 2007, essa formulação não está mais disponível em muitos lugares do mundo, incluindo o Brasil. Assim, a ATG de coelho se tornou a única formulação disponível fora dos Estados Unidos (EUA), sendo utilizada por hematologistas de todo o mundo de forma intercambiável com a ATG de cavalo. Contudo, os resultados de uma grande análise futura e várias outras análises retrospectivas demonstraram que a ATG de coelho era menos eficaz que a ATG de cavalo como terapia inicial de AAG. Em nosso centro, continuamos a usar a ATG de coelho e adotamos uma maior dose de ATG como terapia inicial de crianças que não eram candidatas a transplante para verificar se a resposta seria melhor em comparação às doses habituais.
Nossa experiência com ATG de coelho como terapia inicial em uma pequena coorte pediátrica foi decepcionante. Embora não tenhamos tido um controle histórico, nossos resultados estão muito abaixo da taxa de resposta de 70 a 80% relatada na literatura com ATG de cavalo em crianças menores de 18 anos. Nosso tamanho de amostra relativo (com grandes intervalos de confiança) é uma limitação à nossa análise; não obstante, a taxa de resposta observada em nossa coorte pediátrica é inferior à observada nessa população de pacientes após a terapia com ATG de cavalo. Nossa experiência de taxa de resposta de apenas 34,6% em seis meses é muito semelhante ao grande teste randomizado dos Institutos Nacionais de Saúde e está de acordo com outros estudos retrospectivos.8,24,26 Um pequeno estudo retrospectivo demonstrou taxa de resposta igualmente baixa em crianças, em que apenas 13,3% dos pacientes (2/15) responderam à ATG de coelho.29 Alguns relatórios sugerem que a resposta à ATG de coelho como terapia inicial não é muito diferente do observado com a ATG de cavalo, porém a taxa de resposta à ATG de coelho nessa análise retrospectiva tende a ser inferior ao que foi relatado em outros grandes estudos com esse agente.30,31
Nossos resultados sugerem que a taxa de resposta da ATG de coelho como terapia inicial é baixa em pacientes pediátricos, da mesma forma como relatado para pacientes de todas as idades. A confirmação desta hipótese nessa população de pacientes é logisticamente complexa devido à falta de ATG de cavalo fora do mercado norte‐americano.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Garanito MP, Carneiro JD, Odone Filho V, Scheinberg P. Outcome of children with severe acquired aplastic anemia treated with rabbit antithymocyte globulin and cyclosporine A. J Pediatr (Rio J). 2014;90:523–7.
Trabalho vinculado ao Serviço de Oncologia e Hematologia do Instituto da Criança, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil.




![Resultados de longo prazo após a terapia inicial com ATG de coelho. (Superior) A incidência acumulada de recorrência foi de 26,5% [IC 95%, 0,1‐68%] em cinco anos entre os que responderam à ATG de coelho; (Meio) A incidência acumulada de evolução clonal foi de 8,3% [IC 95%, 0,001‐53,7%]; (Inferior) A sobrevida geral em cinco anos foi de 73,6% [IC 95%, 49,2%‐87,5%] entre todos os pacientes. Os pacientes foram censurados no momento de óbito ou no último acompanhamento. O acompanhamento médio de todos os pacientes foi de 4,3 anos. O gráfico foi cortado para seis anos. As linhas pontilhadas no gráfico inferior representam o intervalo de confiança de 95%. O n° em risco é apresentado apenas para a curva de sobrevida de Kaplan‐Meier. Resultados de longo prazo após a terapia inicial com ATG de coelho. (Superior) A incidência acumulada de recorrência foi de 26,5% [IC 95%, 0,1‐68%] em cinco anos entre os que responderam à ATG de coelho; (Meio) A incidência acumulada de evolução clonal foi de 8,3% [IC 95%, 0,001‐53,7%]; (Inferior) A sobrevida geral em cinco anos foi de 73,6% [IC 95%, 49,2%‐87,5%] entre todos os pacientes. Os pacientes foram censurados no momento de óbito ou no último acompanhamento. O acompanhamento médio de todos os pacientes foi de 4,3 anos. O gráfico foi cortado para seis anos. As linhas pontilhadas no gráfico inferior representam o intervalo de confiança de 95%. O n° em risco é apresentado apenas para a curva de sobrevida de Kaplan‐Meier.](https://static.elsevier.es/multimedia/22555536/0000009000000005/v3_201503201053/S2255553614001050/v3_201503201053/pt/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w90K3EErzaXq47TPDDaeTjoE=)





