This study aimed to evaluate factors associated with upper digestive hemorrhage and primary and secondary endoscopic prophylaxis outcomes in children with extrahepatic portal vein obstruction.
MethodsThis observational and prospective study included 72 children with extrahepatic portal vein obstruction who were followed from 2005 to 2017. Risk factors associated with upper digestive hemorrhage and the results of primary and secondary prophylaxis of these patients were evaluated.
ResultsFifty patients (69.4%) had one or more episodes of bleeding during follow‐up, with a median age at first hemorrhage of 4.81 years. The multivariate analysis showed that medium‐ to large‐caliber esophageal varices were associated with an 18‐fold risk of upper digestive hemorrhage (95% CI: 4.33–74.76; p < 0.0001). Primary prophylaxis was administered to 14 patients, with eradication in 85.7%; however, 14.3% of these patients had hemorrhages during the follow‐up period and 41.7% had a relapse of varices. Secondary prophylaxis was administered to 41 patients. Esophageal varices were eradicated in 90.2% of patients. There were relapse and re‐bleeding of esophageal varices in 45.9% and 34.1% of the children, respectively.
ConclusionPrimary and secondary endoscopic prophylaxes showed high rates of esophageal varix eradication, but with significant relapses. Eradication of esophageal varices cannot definitively prevent recurrent upper digestive hemorrhage, since bleeding from alternate sites can occur. Medium‐ and large‐caliber esophageal varices were associated with upper digestive hemorrhage in patients with extrahepatic portal vein obstruction. To the best of the authors’ knowledge, this study is the first to evaluate bleeding risk factors in children with extrahepatic portal vein obstruction.
Este estudo visou avaliar fatores associados à hemorragia digestiva alta e resultados da profilaxia endoscópica primária e secundária em crianças com obstrução extra‐hepática da veia porta.
MétodosEste estudo observacional e prospectivo incluiu 72 crianças com obstrução extra‐hepática da veia porta acompanhadas de 2005 a 2017. Os fatores de risco associados à hemorragia digestiva alta e os resultados da profilaxia primária e secundária desses pacientes foram avaliados.
ResultadosDos pacientes, 50 (69,4%) apresentaram ≥ 1 episódio de sangramento durante o acompanhamento, com idade média da primeira hemorragia de 4,81 anos. A análise multivariada mostrou que varizes esofágicas de médio a grande calibre estavam associadas a um risco 18 vezes maior de hemorragia digestiva alta (IC de 95% 4,33–74,76; p < 0,0001). Foi administrada profilaxia primária em 14 pacientes, com erradicação em 85,7%; contudo, 14,3% desses pacientes apresentaram hemorragias durante o período de acompanhamento e 41,7% apresentaram recidiva de varizes. Foi administrada profilaxia secundária em 41 pacientes. As varizes esofágicas foram erradicadas em 90,2% dos pacientes. Houve recidiva e novos sangramentos de varizes esofágicas em 45,9% e 34,1% das crianças, respectivamente.
ConclusãoAs profilaxias esofágicas primárias e secundárias apresentaram altas taxas de erradicação de varizes esofágicas, porém com recidivas significativas. A erradicação de varizes esofágicas não pode prevenir de forma definitiva a hemorragia digestiva alta recorrente, pois pode ocorrer sangramento de outros locais. Varizes esofágicas de médio e grande calibre estavam associadas à hemorragia digestiva alta em pacientes com obstrução extra‐hepática da veia porta. No melhor de nosso conhecimento, nosso estudo é o primeiro a avaliar os fatores de risco de sangramento em crianças com obstrução extra‐hepática da veia porta.
A obstrução extra‐hepática da veia porta (OEHVP) é uma doença vascular do fígado, incluindo OEHVPs com e sem envolvimento venoso mesentérico e esplênico intra‐hepático ou superior.1
Esplenomegalia, hiperesplenismo e o desenvolvimento de varizes esofágicas (VE) são as principais manifestações de hipertensão portal (HP) na OEHVP.2 A ruptura das VE resulta em hemorragia digestiva alta (HDA), que ocorre pela primeira vez na idade média de 3,0 a 5,3 anos.3–6 A endoscopia digestiva alta (IDA) com eletroterapia ou ligação varicosa é usada para tratar a HDA e administrar as profilaxias primárias e secundárias.7
O VI Simpósio Satélite Pediátrico de Baveno recomendou que uma cirurgia meso‐porta fosse feita sempre que possível como abordagem primária à OEHVP. Contudo, existem situações anatômicas e técnicas em que a cirurgia não pode ser feita. Quando a derivação meso‐porta não for uma opção viável, a abordagem endoscópica pode ser usada para a profilaxia secundária da HDA. A profilaxia primária, embora amplamente usada em adultos, não é bem estabelecida para crianças com HP. Os principais motivos são: falta de dados sobre o histórico natural do sangramento, dados limitados para definir o padrão endoscópico preditivo do alto risco de sangramento e os relatos limitados de eficácia e segurança da profilaxia endoscópica em crianças.2
A OEHVP normalmente é abordada da perspectiva da HDA, extrapola estudos de adultos com cirrose. É importante estudar pacientes pediátricos para determinar se essas extrapolações são adequadas. Assim, este estudo foi feito para avaliar fatores endoscópicos relacionados à HDA e investigar resultados de profilaxia endoscopia primária e secundária em crianças com OEHVP. No melhor de nosso conhecimento, não há outro estudo que avalie os fatores de risco do sangramento de VE exclusivamente em crianças com OEHVP.
Pacientes e métodosCrianças com OEHVP (≤18 anos no diagnóstico) acompanhadas em um hospital terciário de janeiro de 2005 a dezembro de 2017 foram incluídas no estudo. O protocolo de acompanhamento de HP pediátrica foi estabelecido em 2004 após aprovação do Comitê de Ética em Pesquisa e, a partir daí, foram coletados os dados clínicos laboratoriais e endoscópicos. Desde então, foram incluídos novos adendos e aprovações no Comitê de Ética em Pesquisa. Essa série foi acompanhada durante o cuidado clínico de rotina por 4 principais pesquisadores responsáveis pela clínica ambulatorial e pelo setor de endoscopia pediátrica.
O diagnóstico de OEHVP foi confirmado por meio de ultrassom com Doppler dos vasos hepáticos. A trombocitopenia e a leucopenia foram definidas respectivamente como contagem de plaquetas inferior a 150.000 mm3 e contagem de leucócitos inferior a 3.000 mm3. Nenhum dos pacientes apresentou outras doenças hepáticas.
Para avaliar fatores associados à HDA, todos os 72 foram divididos em dois grupos:
- ‐
Grupo com HDA: primeira EDA foi feita em pacientes com um episódio agudo de HDA;
- ‐
Grupo sem HDA: primeira EDA em pacientes sem HDA.
Os dados clínicos e endoscópicos foram coletados durante episódios agudos de HDA no grupo com HDA. No grupo sem HDA, foram coletados dados da primeira EDA, feita assim que a criança apresentou sinais de HP. As variáveis contínuas foram categorizadas de acordo com seus valores de referência (plaquetas< 150.000 e razão normalizada internacional (RNI) <1,3).8,9 As plaquetas foram classificadas como <50.000 e <100.000, consideradas respectivamente como trombocitopenia grave e moderada.9 Pacientes com dados incompletos sobre a endoscopia inicial foram excluídos da análise.
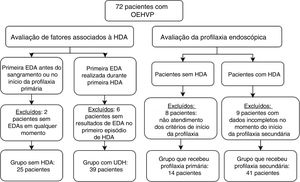
Os dados clínicos e endoscópicos da profilaxia primária e secundária foram coletados para analisar os seguintes parâmetros: duração do acompanhamento, endoscopia, erradicação da VE, número de sessões necessárias para erradicação, recidiva de VE, número de episódios de HDA, presença de varizes gástricas (VG) anteriores e gastropatia da hipertensão portal (GHP) e acometimento de VG e GHP. Os pacientes cujos dados de endoscopias foi impossível recuperar e os pacientes de profilaxia primária sem critérios para iniciá‐la foram excluídos desta análise. A figura 1 apresenta o número de pacientes em cada análise e indica os motivos da exclusão de avaliações específicas.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da instituição (COEP números 254/04, 258/09 e 474/09 e CAAE número 4 60087316.2.0000.5149). Os formulários de consentimento informado e contrato de participação foram obtidos de todos os participantes.
ProtocoloApós manejar a HDA aguda secundária a VE, os pacientes foram encaminhados para um segundo método de profilaxia endoscópica secundária – escleroterapia (ET) ou ligadura elástica das varizes esofágicas (LEVE) – a ser feito após intervalo de duas semanas. As endoscopias do hospital são feitas por três endoscopistas pediátricos experientes e, durante os exames, dois deles sempre estão presentes. As varizes esofágicas foram classificadas de acordo com o sistema de classificação: pequeno calibre (F1): varizes pequenas, não tortuosas; médio calibre (F2): varizes moderadamente aumentadas e tortuosas; grande calibre (F3): varizes marcadamente aumentadas e nodulares.10 A VE com o maior calibre foi usada na classificação.
As VGs foram classificadas como varizes esofagogástricas (VEG) com menor extensão de curvatura (tipo VEG1), varizes esofagogástricas que se estendem até o fundo gástrico (tipo VEG2), varizes do fundo gástrico isoladas (VFG1) ou varizes do fundo gástrico e/ou duodenais (VFG2).11 Manchas vermelhas, GHP e outras lesões na mucosa foram identificados em cada endoscopia.12,13
Durante os períodos de profilaxia primária e secundária, os pacientes foram submetidos a procedimentos endoscópicos a cada três semanas até que as varizes foram erradicadas. Após a erradicação, foram feitas EDAs em intervalos trimestrais nos seis primeiros meses e, então, a cada seis meses e, entre os que se curaram das varizes, uma vez ao ano depois disso. EDAs foram feitas sempre que havia suspeita ou diagnóstico de HDA. A profilaxia primária com LEVE foi recomendada a pacientes com VE de pequeno calibre, manchas vermelhas, varizes de calibre médio ou grande ou varizes que se estendiam à cardia gástrica. Não usamos betabloqueadores na profilaxia em nosso serviço, pois sua eficácia e segurança de uso em crianças com HP não foram estabelecidas.
Definição de termos (variáveis estudadas)Diversos termos são continuamente mencionados neste estudo e representam as variáveis avaliadas na análise. Esses termos são:
- •
Erradicação: todas as varizes visíveis trombosadas por ET, muito finas para serem ligadas com LEVE ou estavam ausentes;
- •
Ressangramento: episódio de HDA após início da profilaxia, com repercussões clínicas que exigem EDA urgente, divididas entre dois períodos:
- •
Recidiva: reemergência das VE que exigem manejo endoscópico em um paciente que apresentou erradicação anteriormente;
- •
Emergência de GHP: acometimento de GHP em um paciente cuja primeira HDA não ocorreu antes da profilaxia;
- •
Emergência de VG: acometimento de varizes do fundo gástrico isoladas em um paciente cuja primeira HDA não ocorreu antes da profilaxia.
A base de dados foi analisada com o SPSS (SPSS Statistics for Windows, version 20.0. NY, USA). Variáveis contínuas sem distribuições normais foram comparadas com o teste não paramétrico U de Mann Whitney. As variáveis contínuas com distribuições normais foram comparadas com o teste t de Student. As variáveis categóricas foram comparadas com o teste qui‐quadrado assintomático de Pearson (quando <20% dos valores esperados estiveram entre 1 e 5) e p teste qui‐quadrado exato de Pearson (quando> 20% dos valores esperados estavam entre 1 e 5). Os resultados foram considerados significativos quando menores que 0,05 (p≤0,05). Quando as variáveis categóricas foram significativas de acordo com os testes qui‐quadrado e as variáveis apresentaram mais de dois padrões, os valores residuais ajustados padronizados foram considerados significativamente diferentes quando os valores residuais foram ≥+1,96 e ≤ ‐1,96.
Para identificar fatores associados à HDA, foi feita uma análise multivariada com o método de regressão logística. Todas as variáveis com p <0,20 na análise univariada foram incluídas na análise multivariada. O modelo de regressão logística foi adaptado de forma que todas as variáveis foram consideradas significativas em 0,20. Variáveis com valores de p mais altos foram descartadas até que o modelo final mostrasse todas as variáveis significativas em 0,05. A medida de associação usada foi o risco relativo (RR), estimado pela razão de chance (RC) e um intervalo de confiança de 95% para variáveis associadas ao primeiro episódio de HDA. A qualidade do ajuste foi avaliada com o teste de Hosmer‐Lemeshow.
ResultadosDos 72 pacientes analisados, 37 (51,4%) eram do sexo masculino. A idade média no momento do primeiro sinal ou sintoma de OEHVP foi 2,65 anos (Q1; Q3: 1,08; 5,02). Esplenomegalia com hiperesplenismo foi a manifestação inicial em 48,6% desses pacientes, seguida de HDA em 43% e dor abdominal em 5,6%. A idade média na época da primeira consulta na unidade foi 4,79 anos (Q1; Q3: 2,38; 8,54). Um paciente faleceu durante o acompanhamento devido a um episódio grave de HDA. A duração média do acompanhamento desses pacientes foi de 8,90±5,60 anos.
A cateterização umbilical, principal fator causal identificado nesses pacientes, ocorreu em 31 (43,1%) deles, seguida de sepse neonatal em 23 (31,9%). Outros fatores de risco identificados foram: trombofilia em 5 pacientes (6,9%), malformações congênitas em 3 (4,2%), infecções abdominais em 3 (4,2%), desidratação em 3 (4,2%) e cirurgia abdominal em 2 (2,8%). Não houve fatores de risco identificados em 30 dos pacientes (41,7%). Houve 19 pacientes (26,4%) com apenas um fator de risco identificado, ao passo que 18 (25%) e 5 (6,9%) apresentaram respectivamente dois e três fatores de risco identificados.
A trombocitopenia persistente foi detectada em 88,9% dos pacientes e 37,5% apresentaram leucopenia. Em 94,4% dos pacientes, VEs foram identificadas durante o acompanhamento. GHP, VG e duodenopatia hipertensiva portal ocorreram em 88,9%, 80,6% e 4,2% dos pacientes, respectivamente.
Para avaliar os fatores de risco associados ao episódio inicial de HDA, os pacientes foram divididos em dois grupos e seus dados foram analisados. Os dados de ambos os grupos são apresentados na tabela 1. Após a conclusão da análise univariada (dados apresentados na tabela 2), VG e VE foram avaliadas na análise de regressão logística multivariada. Após a análise multivariada, a presença de VE de médio e grande calibres foi o único fator associado à HDA com RC de 18 e CI de 95% de 4,33 – 74,76 (p <0,0001).
Comparação de fatores clínicos, endoscópicos e laboratoriais relacionados a episódios de HDA: Grupo com HDA x Grupo sem HDA (n=64)
| Fator | Grupo com HDA (n=39) | Grupo sem HDA (n=25) | p |
|---|---|---|---|
| Sexo, n (%) | |||
| Meninos | 17 (43,6%) | 15 (60%) | 0,200a |
| Meninas | 22 (56,4%) | 10 (40%) | |
| Idade na primeira EDA mediana (Q1; Q3) | 4,4 (2,1; 6,5) | 4,6 (3,1; 9,9) | 0,109b |
| Calibre da VE, n (%) | |||
| Pequeno | 3 (7,7%)c | 15 (60%)d | |
| Médio | 21 (53,8%)d | 7 (28%)c | ≤0,0001a |
| Grande | 15 (38,5%)d | 3 (12%)c | |
| Pequeno | 3 (7,7%) | 15 (60%) | ≤0,0001a |
| Médio/Grande | 36 (92,3%) | 10 (40%) | |
| Manchas vermelhas, n (%) | |||
| Sim | 15 (38,5%) | 6 (24%) | 0,229a |
| Não | 24 (61,5%) | 19 (76%) | |
| Varizes gástricas, n (%) | |||
| Sim | 22 (56,4%) | 5 (20%) | 0,004a |
| Não | 17 (43,6%) | 20 (80%) | |
| GHP, n (%) | |||
| Sim | 12 (30,8%) | 10 (40%) | 0,448a |
| Não | 27 (69,2%) | 15 (60%) | |
| Plaquetas | 113.000 | 118.000 | 0,835b |
| mediana (Q1; Q3) | (78.500; 161.500) | (85.500; 170.000) | |
| RNI mediana (Q1; Q3) | 1,2 (1,1; 1,4) | 1,1 (1,0; 1,4) | 0,393b |
EDA, endoscopia digestiva alta; GHP, gastropatia da hipertensão portal; HDA, hemorragia digestiva alta; n, número; RNI, razão normalizada internacional; VE, varizes esofágicas.
Avaliação dos fatores relacionados ao primeiro episódio de HDA segundo a análise univariada
| Fator | RC | IC DE 95% | p |
|---|---|---|---|
| Sexo feminino | 1,94 | 0,70 – 5,38 | 0,203 |
| Idade na primeira EDA ≤ 5 anos | 1,33 | 0,48 – 3,65 | 0,584 |
| Calibre das VEs – Médio/Grande | 18 | 4,33 – 74,76 | <0,0001 |
| Presença de manchas vermelhas | 1,98 | 0,64 – 6,08 | 0,233 |
| Presença de varizes gástricas | 5,18 | 1,61 – 16,62 | 0,006 |
| Presença de GHP | 0,67 | 0,23 – 1,91 | 0,449 |
| Plaquetas <150.000 | 0,72 | 0,24 – 2,16 | 0,556 |
| Plaquetas <100.000 | 0,81 | 0,26 – 2,53 | 0,720 |
| Plaquetas <50.000 | 1,70 | 0,18 – 16,35 | 0,646 |
| RNI ≥ 1,3 | 0,77 | 0,25 – 2,36 | 0,646 |
EDA, endoscopia digestiva alta; GHP, gastropatia da hipertensão portal; HDA, hemorragia digestiva alta; IC, intervalo de confiança; RC, razão de chance; RNI, razão normalizada internacional; VE, varizes esofágicas.
Dos pacientes, 50 (69,4%) apresentaram no mínimo um episódio de HDA durante o período de acompanhamento. A idade média no momento do primeiro episódio de sangramento foi 4,81 (Q1; Q3: 2,09; 7,34). Foi recomendado que esses pacientes começassem a profilaxia secundária. Nove pacientes foram excluídos da análise de profilaxia secundária devido a dados incompletos da endoscopia. Dos 22 pacientes sem HDA, foi recomendado que 14 começassem a profilaxia primária, de acordo com os critérios já descritos, e estes foram encaminhados para a endoscopia. Os resultados da análise desses dois grupos são apresentados na tabela 3.
Características de pacientes que receberam profilaxia endoscópica primária e secundária (n=55)
| Profilaxia primária (n=14) | Profilaxia secundária (n=41) | |
|---|---|---|
| Sexo, n (%) | ||
| Meninos | 8 (57,1%) | 20 (48,8%) |
| Meninas | 6 (42,9%) | 21 (51,2%) |
| Idade no surgimento dos primeiros sintomas (anos) mediana (Q1; Q3) | 1,6 (0,8; 4,1) | 2,1 (1,1; 4,2) |
| Idade no acometimento da profilaxia (Anos) Mediana (Q1; Q3) | 6,3 (3,6; 14,1) | 5,1 (2,4; 7,3) |
| Método, n (%) | ||
| Ligação | 14 (100%) | 17 (41,5%) |
| Escleroterapia | 0 | 24 (58,5%) |
| Erradicação das VE, n (%) | 12 (85,7%) | 37 (90,2%) |
| Número de sessões necessárias para a erradicação mediana (Q1; Q3) | 3,5 (2,0; 4,0) | 4,0 (3,3; 6,0) |
| mediana (Q1; Q3)Recidiva de VE, n (%) | 5 (41,7%) | 17 (45,9%) |
| mediana (Q1; Q3)Tempo até recidiva (anos) mediana (Q1; Q3) | 1,8 (0,9; 2,6) | 1,7 (0,9; 3,4) |
| Sangramento após o acometimento da profilaxia, n (%) | 2 (14,3%) | 14 (34,1%) |
| Precoce | 2 (100%) | 13 (92,9%) |
| Tardio | 0 | 1 (7,1%) |
| Presença de VG anterior, n (%) | 0 | 11 (26,8%) |
| Desenvolvimento de VG, n (%) | 8 (57,1%) | 16 (53,3%) |
| Presença de GHP anterior, n (%) | 9 (64,3%) | 13 (31,7%) |
| Desenvolvimento de GHP, n (%) | 4 (80%) | 26 (92,9%) |
| Duração do acompanhamento (anos) média±DP | 5,7±3,1 | 9,1±5,8 |
DP, desvio‐padrão; GHP, gastropatia da hipertensão portal; n, número; VE, varizes esofágicas; VG, varizes gástricas.
No grupo de pacientes que receberam profilaxia secundária, os locais do episódio primário de HDA foram: VE em 84,4% de HDA, casos em que a EDA foi feita antes da profilaxia, seguido de VG em 6,7%, e GHP em 2,2%. Após erradicar a VE, o ressangramento ocorreu principalmente no grupo com VG em 47,2% de pacientes, seguida de GHP em 8,3% e VE em 8,3% dos casos de HDA, no qual a EDA foi feita. O local do sangramento não pôde ser identificado na endoscopia em 6,7% dos pacientes antes do acometimento da profilaxia e 36,1% dos pacientes após a erradicação da VE. Após o acometimento de profilaxias secundárias, 78%, 71% e 68% dos pacientes não tiveram novos sangramentos da VE depois de um, cinco e dez anos de acompanhamento, respectivamente. Após a erradicação da VE, 97%, 92%, e 89% das crianças permaneceram sem um sangramento da VE em um, cinco e dez anos de acompanhamento, respectivamente. Após o início da profilaxia primária, 86% dos pacientes não apresentaram novos episódios de sangramento de VE em um, cinco e dez anos de acompanhamento, já que os episódios ocorreram logo após o início da profilaxia.
A respeito de complicações do tratamento endoscópico, quatro crianças desenvolveram estenose esofágica após 4 a 10 sessões, três deles passaram por ET e um foi submetido à LEVE. Foi necessária dilatação mecânica em três casos. Em dois pacientes, as ligaduras elásticas saíram menos de 24 horas depois da LEVE, seguido de episódios de HDA grave.
Dois pacientes precisaram de cirurgia urgente devido a uma HDA grave após o início da profilaxia secundária com escleroterapia. Esse foi considerado uma falha do tratamento endoscópico. Ambos os pacientes foram submetidos a uma desconexão ázigo‐portal, escolhida pelo cirurgião pediátrico para uma emergência de sangramento descontrolado. Nenhum dos pacientes foi submetido a procedimentos de derivação meso‐porta, pois esses não estavam disponíveis em nosso hospital.
DiscussãoEmbora a OEHVP seja a causa primária de HP em crianças, poucos estudos investigaram esse grupo de pacientes. A OEHVP normalmente é abordada da perspectiva da HDA, extrapola estudos de adultos com cirrose. Assim, é importante entender seu histórico natural em pacientes pediátricos para determinar se essas extrapolações são adequadas. No melhor de nosso conhecimento, nosso estudo é o primeiro a avaliar os fatores de risco de sangramento de VE em crianças e adolescentes com OEHVP. Descobrimos que VE de calibres médio e grande conferiam um risco 18 vezes maior de sangramento com HDA em pacientes com OEHVP. As profilaxias endoscópicas levaram a altas taxas de erradicação de VE, porém o número de recaídas foi significativo. A erradicação de VE não pode prevenir definitivamente a HDA recorrente, pois pode ocorrer sangramento em locais alternativos, o que define a necessidade de um acompanhamento adequado.
De acordo com a literatura, em 40‐64% de pacientes pediátricos, a primeira manifestação de OEHVP é HDA. A idade no primeiro episódio de sangramento, segundo relatos, está entre 3 e 5,3 anos.3–6,14 Esses dados foram confirmados neste estudo, reforçam os dados do histórico natural da OEHVP já descritos. Durante o período de acompanhamento, 50 pacientes (69,4%) apresentaram no mínimo um episódio de HDA, o que enfatiza a necessidade de estabelecer uma abordagem adequada.
Os estudos pediátricos de crianças com cirrose são escassos e a maioria analisou pacientes com cirrose secundária a atresia biliar (AB). Em 2010, Duché et al. analisaram 139 crianças com AB e concluíram que os fatores de risco da endoscopia para HDA eram: varizes de grande calibre, manchas vermelhas devido às varizes e extensão das varizes até a cardia.15 Em 2017, os mesmos autores analisaram 1.300 crianças com HP, que foram divididas em dois grupos: um grupo com AB e um grupo com HP de várias etiologias (inclusive 155 OEHVP). Foi concluído que os sinais endoscópicos que indicavam o risco de sangramento eram semelhantes nos dois grupos e incluíram varizes de médio e grande calibre, manchas vermelhas e VG que se estende à cardia. Contudo, não analisaram os pacientes com OEHVP separadamente, foram incluídos em um grupo com várias outras etiologias de HP.16
Os estudos pediátricos que avaliaram os fatores de risco de sangramento em HP analisaram crianças com cirrose, como Wanty et al., em 2013, que estudaram 83 crianças com AB. Sua análise multivariada mostrou que VE de grande calibre, manchas vermelhas e baixos valores de fibrinogênio estavam associados a um risco mais elevado de HDA.17 Pimenta et al. avaliaram 103 crianças com cirrose de diversas causas. Sua análise multivariada mostrou que VG e manchas vermelhas e na VE estavam associadas a HDA.18
Em nossa análise multivariada, VE de calibre médio e grande estavam associadas a um risco aumentado em 18 vezes de sangramento e HDA, semelhante àquele descrito em crianças com cirrose. Apesar do grande intervalo de confiança, a RC foi alta, refletiu um risco considerável de sangramento em pacientes com varizes de calibre médio ou grande. VG estavam associada a HDA na análise univariada, porém perderam a relevância após a análise multivariada. O tamanho da amostra poderá ser um fator limitante na análise de VG. É importante entender esses fatores de risco ao analisar as indicações e a conclusão da profilaxia primária para evitar/reduzir o risco de HDA. Embora a trombocitopenia seja um bom indicador de HP, sua presença não estava associada ao risco de sangramento neste estudo ou em outros estudos em crianças com HP causada por cirrose
A profilaxia endoscópica primária na pediatria é descrita em muitos poucos estudos e é ainda mais rara em estudos de pacientes com OEHVP.19–22 Em 2009, Maksoud‐Filho et al. avaliaram 32 pacientes com OEHVP que receberam profilaxia primária com ET e nenhuma delas apresentou HDA após concluir a terapia de profilaxia.21 Outros estudos19,20,22 que avaliaram crianças com OEHVP e HP concomitantemente secundária a causas intra‐hepáticas relataram taxas erradicação da VE de 90% a 94%. Entre os pacientes submetidos à LEVE, não houve sangramento durante o período de acompanhamento,22 ao passo que os pacientes submetidos à ET apresentaram taxas de sangramento de 24% a 42,3%.19,20
Constatar um número significativo de recidivas de varizes reforça as recomendações do VI Simpósio Satélite Pediátrico de Baveno,2 que incentivam o uso de uma derivação meso‐porta sempre que necessário como abordagem primária à OEHVP. Quando a cirurgia não for possível, a profilaxia endoscópica primária é importante e eficiente para reduzir os episódios de HDA, embora seja necessário um acompanhamento periódico.
A profilaxia endoscópica secundária em crianças com OEHVP está associada a uma alta taxa de erradicação de VE.3,21,23–30 Contudo, as taxas de recidiva de varizes e a necessidade de sessões de repetição estavam ligeiramente acima daquelas relatadas em estudos anteriores de pacientes com OEHVP, variou de 6,6% a 40%.3,24,26–30 A taxa de ressangramento observada neste estudo foi mais alta em comparação às taxas relatadas na literatura, com valores entre 3% e 27,8%.3,21,23–30
A erradicação da VE não garante a ausência de novas HDAs, pois diversos pacientes começaram a apresentar sangramento em outros locais. Em nossa amostra, aproximadamente 90% dos pacientes desenvolveram GHP durante o acompanhamento e 80% apresentaram VG. Com a prevalência cada vez maior de GHP e VG, houve uma mudança no foco da HDA em nosso grupo de pacientes.
Como em outros estudos que avaliaram a OEHVP, uma limitação deste estudo é o tamanho da amostra de pacientes, que limita extrapolações ou conclusões definitivas; contudo, o modelo de estudo de coorte prospectivo estabelece consistência em nossos achados. Outro aspecto que vale a pena discutir como limitação são as características das varizes durante ou próximo ao episódio de sangramento. Devido a mudanças hemodinâmicas causadas principalmente pela perda de sangue, a classificação das veias varicosas poderá ser subestimada, limitar o tipo de estudo feito.
Concluindo, observamos que as VE de médio e grande calibre estavam associadas ao risco de HDA em pacientes com OEHVP, com aumento de 18 vezes no risco de sangramento. Nossos achados seguiram a mesma tendência de estudos em pacientes cirróticos, de forma que o tamanho das varizes era um fator relevante associado ao risco de sangramento. A profilaxia endoscópica apresentou altas taxas de erradicação de VE; contudo, ocorreu um número significativo de recaídas, o que enfatiza a necessidade de acompanhamento de longo prazo. Adicionalmente, a erradicação de VE não pôde garantir a ausência de novos acometimentos de HDA, pois havia um risco mais elevado de sangramento em outros locais. Outros estudos que incluíram número mais alto de pacientes com OEHVP devem desenvolver conclusões confiáveis.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Oliveira AP, Ferreira AR, Fagundes ED, Queiroz TC, Carvalho SD, Neto JA, et al. Endoscopic prophylaxis and factors associated with bleeding in children with extrahepatic portal vein obstruction. J Pediatr (Rio J). 2020;96:755–62.