This study aimed to evaluate the predictive validity of the day‐1 PELOD‐2 and day‐1 “quick” PELOD‐2 (qPELOD‐2) scores for in‐hospital mortality in children with sepsis in a pediatric intensive care unit (PICU) of a developing country.
MethodsThe data of 516 children diagnosed as sepsis were retrospectively analyzed. The children were divided into survival group and non‐survival group, according to the clinical outcome 28 days after admission. Day‐1 PELOD‐2, day‐1 qPELOD‐2, pediatric SOFA (pSOFA), and P‐MODS were collected and scored. Receiver operating characteristic (ROC) curves were plotted, and the efficiency of the day‐1 PELOD‐2, day‐1 qPELOD‐2 score, pSOFA, and P‐MODS for predicting death were evaluated by the area under the ROC curve (AUC).
ResultsThe day‐1 PELOD‐2 score, day‐1 qPELOD‐2 score, pSOFA, and P‐MODS in the non‐survivor group were significantly higher than those in the survivor group. ROC curve analysis showed that the AUCs of the day‐1 PELOD‐2 score, day‐1 qPELOD‐2 score, pSOFA, and P‐MODS for predicting the prognosis of children with sepsis in the PICU were 0.916, 0.802, 0.937, and 0.761, respectively (all p < 0.05).
ConclusionsBoth the day‐1 PELOD‐2 score and day‐1 qPELOD‐2 score were effective and able to assess the prognosis of children with sepsis in a PICU of a developing country. Additionally, the day‐1 PELOD‐2 score was superior to the day‐1 qPELOD‐2 score. Further studies are needed to verify the usefulness of the day‐1 qPELOD‐2 score, particularly outside of the PICU.
A finalidade de nosso estudo foi avaliar a validade preditiva dos escores PELOD‐2 no dia 1 e “quick” PELOD‐2 no dia 1 com relação à mortalidade hospitalar em crianças com sepse em uma UTIP de um país em desenvolvimento.
MétodosForam analisados retrospectivamente os dados de 516 crianças diagnosticadas com sepse. As crianças foram divididas em grupo sobrevida e grupo não sobrevida de acordo com o desfecho clínico de 28 dias após internação. Foram coletadas e pontuadas as variáveis PELOD‐2 no dia 1, qPELOD‐2 no dia 1, pediatric Sequential Organ Failure Assessment (pSOFA) e Pediatric Multiple Organ Dysfunction Score (P‐MODS). A curva da característica de operação do receptor (ROC) foi plotada e a eficiência preditiva do PELOD‐2 no dia 1, o escore qPELOD‐2 no dia 1, pSOFA, P‐MODS com relação a óbito foram avaliados pela área abaixo da curva (AUC) da curva ROC.
ResultadosO escore PELOD‐2 no dia 1, escore qPELOD‐2 no dia 1, pSOFA e P‐MODS no grupo não sobrevida foram significativamente maiores do que os no grupo sobrevida. A análise preditiva da curva ROC mostrou que as AUCs do escore PELOD‐2 no dia 1, escore qPELOD‐2 no dia 1, pSOFA e P‐MODS com relação ao prognóstico de crianças com sepse na UTIP foi 0,916, 0,802, 0,937 e 0,761, respectivamente (todas p < 0,05).
ConclusõesTanto o escore PELOD‐2 no dia 1 e o escore qPELOD‐2 no dia 1 foram válidos e conseguiram avaliar o prognóstico de crianças com sepse em uma UTIP de um país em desenvolvimento. Além disso, o escore PELOD‐2 no dia 1 foi superior ao escore qPELOD‐2 no dia 1. São necessários estudos adicionais para verificar a utilidade do escore qPELOD‐2 no dia 1, principalmente fora da UTIP.
A sepse é uma das principais causas de morte em adultos1 e crianças.2–5 Na última edição do Terceiro Consenso Internacional,6 a Força‐Tarefa para Atualização das Definições de Sepse definiu sepse como uma disfunção orgânica potencialmente fatal que ocorre devido a uma resposta desregulada do hospedeiro à infecção e essa definição despertou discussões acaloradas no campo da medicina voltado ao tratamento de pacientes gravemente enfermos.7 A força‐tarefa do Sepsis 3 propôs o uso do escore Sequential Organ Failure Assessment (SOFA) para pontuar a disfunção orgânica em pacientes adultos com suspeita de infecção. Além disso, a força‐tarefa do Sepsis3 reconheceu que os novos critérios não são destinados a crianças e que os estudos futuros devem considerar a fisiologia específica da idade e a estratificação dos riscos inerentes à idade.
Leclerc et al.8 analisaram de forma secundária a base de dados usada para o desenvolvimento e validação do Pediatric Logistic Organ Dysfunction‐2 (PELOD‐2).9 Os autores concluíram que o escore PELOD‐2 no dia 1 foi altamente preditivo de mortalidade hospitalar entre crianças internadas na Unidade de Terapia Intensiva Pediátrica (UTIP) com suspeita de infecção, o que sugeriu seu uso promissor para padronizar definições e critérios de diagnóstico com relação à sepse pediátrica. Adicionalmente, os autores investigaram o desempenho preditivo de um escore “quick”PELOD‐2 (Escala de Coma de Glasgow < 11, taquicardia e hipotensão sistêmica) (tabela S1), que foi inspirado no escore “quick”SOFA (qSOFA) (atividade mental alterada, taquipneia e hipotensão), e o desempenho preditivo do escore qPELOD‐2 comparado de forma favorável a estudos que validam o escore qSOFA em adultos (área abaixo da curva (AUC), 0.82;IC de 95%, 0.76–0.87).10 A finalidade de nosso estudo foi avaliar a validade preditiva do PELOD‐2 no dia1 e “quick”PELOD‐2 no dia 1 com relação à mortalidade hospitalar em crianças com sepse em uma UTIP de um país em desenvolvimento.
MétodosFoi feito um estudo transversal na Unidade de Terapia Intensiva Pediátrica do primeiro Affiliated Hospital of Guangdong Medical University na cidade de Zhanjiang, Província de Guangdong, China, de 1° de junho de 2016 a 1° de junho de 2018. Foram coletados vários dados retrospectivamente para estimar o escore PELOD‐2 no dia 1, escore qPELOD‐2 no dia 1, pSOFA e Pediatric Multiple Organ Dysfunction Score (P‐MODS). Caso uma variável tenha sido medida mais de uma vez no primeiro dia, o pior valor da variável foi usado para calcular o PELOD‐2 no dia 1, qPELOD‐2 no dia 1, pSOFA e P‐MODS. Sexo, idade, local de infecção, duração da internação na UTIP, tempo total de internação, necessidade de ventilação mecânica, duração do suporte ventilatório e necessidade de drogas vasoativas tiveram de ser registrados em um formulário de coleta de dados designado para o estudo.
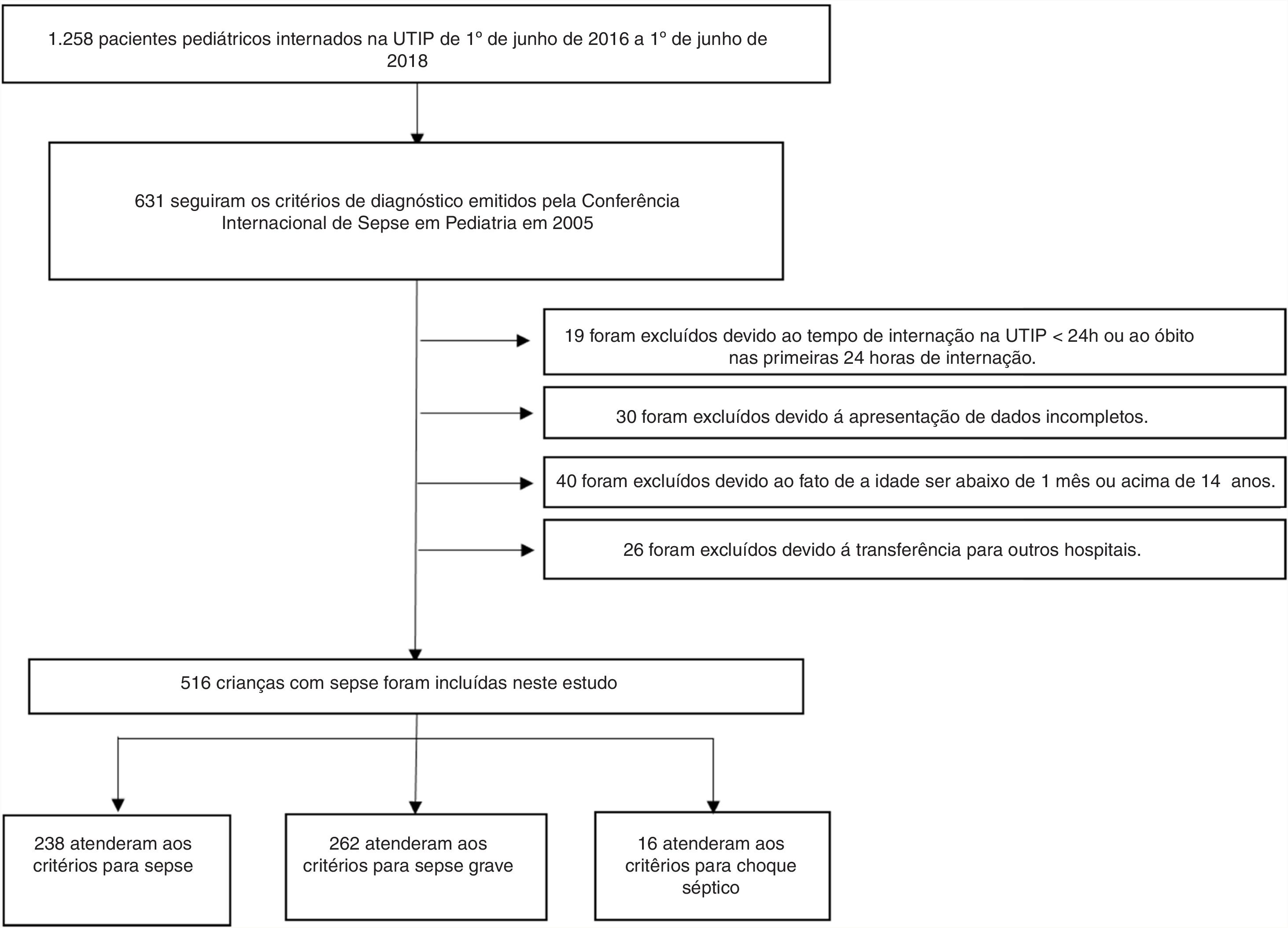
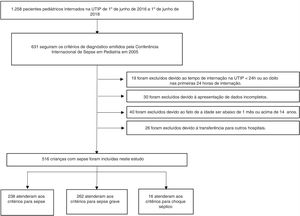
Os critérios de inclusão foram: (1) atendimento dos critérios de diagnóstico da Conferência Internacional de Sepse em Pediatria emitidos em 200511; (2) duração da internação na UTIP ≥ 24h; (3) idade do paciente entre um mês e 14 anos; e (4) disponibilidade dos dados clínicos completos. Os critérios de exclusão foram: (1) duração da internação na UTIP inferior a 24 horas ou óbito nas primeiras 24 horas de internação; (2) idade inferior a um mês ou acima de 14 anos; (3) transferência para outro hospital; ou (4) dados clínicos incompletos (fig. 1).
Este estudo seguiu as normas de ética médica e foi aprovado pelo Comitê de Ética do primeiro Affiliated Hospital of Guangdong Medical University (2018‐027). Além disso, excluímos o consentimento informado devido à natureza observacional do estudo.
Análise estatísticaFoi feita com o software SPSS (IBM SPSS Estatística para Windows, Versão 21.0. NY, EUA) e o software MedCalc (MedCalc Software, versão 15.2.2, Ostend, Bélgica). Os resultados foram expressos como mediana e intervalos interquartis (IQRs) para as variáveis contínuas e como frequências e percentuais para as variáveis categóricas. O teste de Kolmogorov‐Smirnov foi usado para testar a normalidade dos dados qualitativos. Os testes T foram usados para os dados quantitativos normais. O teste U de Mann‐Whitney foi usado para os dados quantitativos anormais. As variáveis categóricas foram comparadas com o teste χ2. Um valor de p < 0,05 bilateral foi considerado estatisticamente significativo.
O desempenho dos escores para discriminar mortalidade hospitalar foi avaliado com a AUC. Foram feitas comparações entre os escores com o método de DeLong12 para comparar as AUCs e o Índice de Melhoria da Discriminação Integrada13 para avaliar a reclassificação de probabilidades preditivas entre sobreviventes e não sobreviventes. O índice de Youden14 foi usado para avaliar os valores de corte ideais dos escores PELOD‐2 e qPELOD‐2 para discriminar a mortalidade hospitalar.
Estimativa do tamanho da amostraO principal índice de avaliação deste estudo foi a AUC da curva ROC. Visamos a avaliar o desempenho dos escores d1PELOD‐2 e d1qPELOD‐2 para discriminar a mortalidade hospitalar. Uma pesquisa relacionada mostrou que as AUCs dos escores d1PELOD‐2 e d1qPELOD‐2 foram 0,91 e 0,82, respectivamente.8 A proporção entre sobreviventes e não sobreviventes foi 37.15 O nível de significância foi 0,05, a eficácia foi 0,8 e a proporção de atribuição entre as amostras foi 50. Como o estudo foi um estudo observacional retrospectivo, a taxa de abandono foi 0%. O tamanho da amostra foi estimado pelo software PASS11.0 e foram necessárias 306 crianças com sepse. Por fim, 516 crianças com sepse internadas na UTIP foram incluídas no estudo.
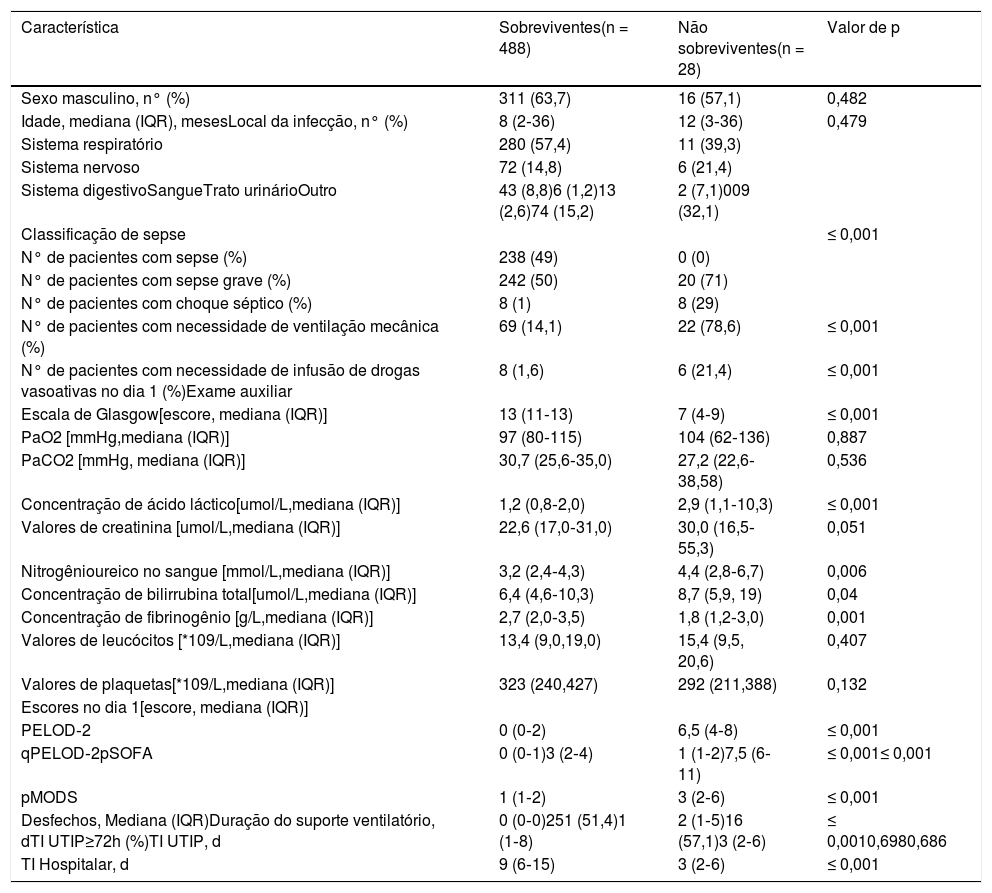
ResultadosAtenderam aos critérios de inclusão 516 pacientes. Entre eles, 238 (46,1%) atenderam aos critérios para sepse, 262 (50,8%) aos critérios para sepse grave e 16 (3,1%) aos critérios para choque séptico. Dos 488 sobreviventes das visitas hospitalares, 311 (63,7%) eram homens e a idade mediana (IQR) foi 8 (2‐36) meses. Dentre os 28 não sobreviventes, 16 (57,1%) eram homens com idade mediana (IQR) de 12 (3‐36) meses. Não houve diferenças significativas no sexo, idade, local de infecção ou duração da internação na UTIP entre os dois grupos (todos p > 0,05). As características demográficas e clínicas dos sobreviventes e não sobreviventes são mostradas na tabela 1.
Características demográficas e clínicas dos sobreviventes e não sobreviventes
| Característica | Sobreviventes(n = 488) | Não sobreviventes(n = 28) | Valor de p |
|---|---|---|---|
| Sexo masculino, n° (%) | 311 (63,7) | 16 (57,1) | 0,482 |
| Idade, mediana (IQR), mesesLocal da infecção, n° (%) | 8 (2‐36) | 12 (3‐36) | 0,479 |
| Sistema respiratório | 280 (57,4) | 11 (39,3) | |
| Sistema nervoso | 72 (14,8) | 6 (21,4) | |
| Sistema digestivoSangueTrato urinárioOutro | 43 (8,8)6 (1,2)13 (2,6)74 (15,2) | 2 (7,1)009 (32,1) | |
| Classificação de sepse | ≤ 0,001 | ||
| N° de pacientes com sepse (%) | 238 (49) | 0 (0) | |
| N° de pacientes com sepse grave (%) | 242 (50) | 20 (71) | |
| N° de pacientes com choque séptico (%) | 8 (1) | 8 (29) | |
| N° de pacientes com necessidade de ventilação mecânica (%) | 69 (14,1) | 22 (78,6) | ≤ 0,001 |
| N° de pacientes com necessidade de infusão de drogas vasoativas no dia 1 (%)Exame auxiliar | 8 (1,6) | 6 (21,4) | ≤ 0,001 |
| Escala de Glasgow[escore, mediana (IQR)] | 13 (11‐13) | 7 (4‐9) | ≤ 0,001 |
| PaO2 [mmHg,mediana (IQR)] | 97 (80‐115) | 104 (62‐136) | 0,887 |
| PaCO2 [mmHg, mediana (IQR)] | 30,7 (25,6‐35,0) | 27,2 (22,6‐38,58) | 0,536 |
| Concentração de ácido láctico[umol/L,mediana (IQR)] | 1,2 (0,8‐2,0) | 2,9 (1,1‐10,3) | ≤ 0,001 |
| Valores de creatinina [umol/L,mediana (IQR)] | 22,6 (17,0‐31,0) | 30,0 (16,5‐55,3) | 0,051 |
| Nitrogênioureico no sangue [mmol/L,mediana (IQR)] | 3,2 (2,4‐4,3) | 4,4 (2,8‐6,7) | 0,006 |
| Concentração de bilirrubina total[umol/L,mediana (IQR)] | 6,4 (4,6‐10,3) | 8,7 (5,9, 19) | 0,04 |
| Concentração de fibrinogênio [g/L,mediana (IQR)] | 2,7 (2,0‐3,5) | 1,8 (1,2‐3,0) | 0,001 |
| Valores de leucócitos [*109/L,mediana (IQR)] | 13,4 (9,0,19,0) | 15,4 (9,5, 20,6) | 0,407 |
| Valores de plaquetas[*109/L,mediana (IQR)] | 323 (240,427) | 292 (211,388) | 0,132 |
| Escores no dia 1[escore, mediana (IQR)] | |||
| PELOD‐2 | 0 (0‐2) | 6,5 (4‐8) | ≤ 0,001 |
| qPELOD‐2pSOFA | 0 (0‐1)3 (2‐4) | 1 (1‐2)7,5 (6‐11) | ≤ 0,001≤ 0,001 |
| pMODS | 1 (1‐2) | 3 (2‐6) | ≤ 0,001 |
| Desfechos, Mediana (IQR)Duração do suporte ventilatório, dTI UTIP≥72h (%)TI UTIP, d | 0 (0‐0)251 (51,4)1 (1‐8) | 2 (1‐5)16 (57,1)3 (2‐6) | ≤ 0,0010,6980,686 |
| TI Hospitalar, d | 9 (6‐15) | 3 (2‐6) | ≤ 0,001 |
IQR, intervalos interquartis; PELOD‐2, Pediatric Logistic Organ Dysfunction Score‐2;
P‐MODS, Pediatric Multiple Organ Dysfunction Score; pSOFA, pediatric Sequential Organ Failure Assessment; qPELOD‐2, quick Pediatric Logistic Organ Dysfunction Score‐2; TI, tempo de internação; UTIP, unidade de terapia intensiva pediátrica.
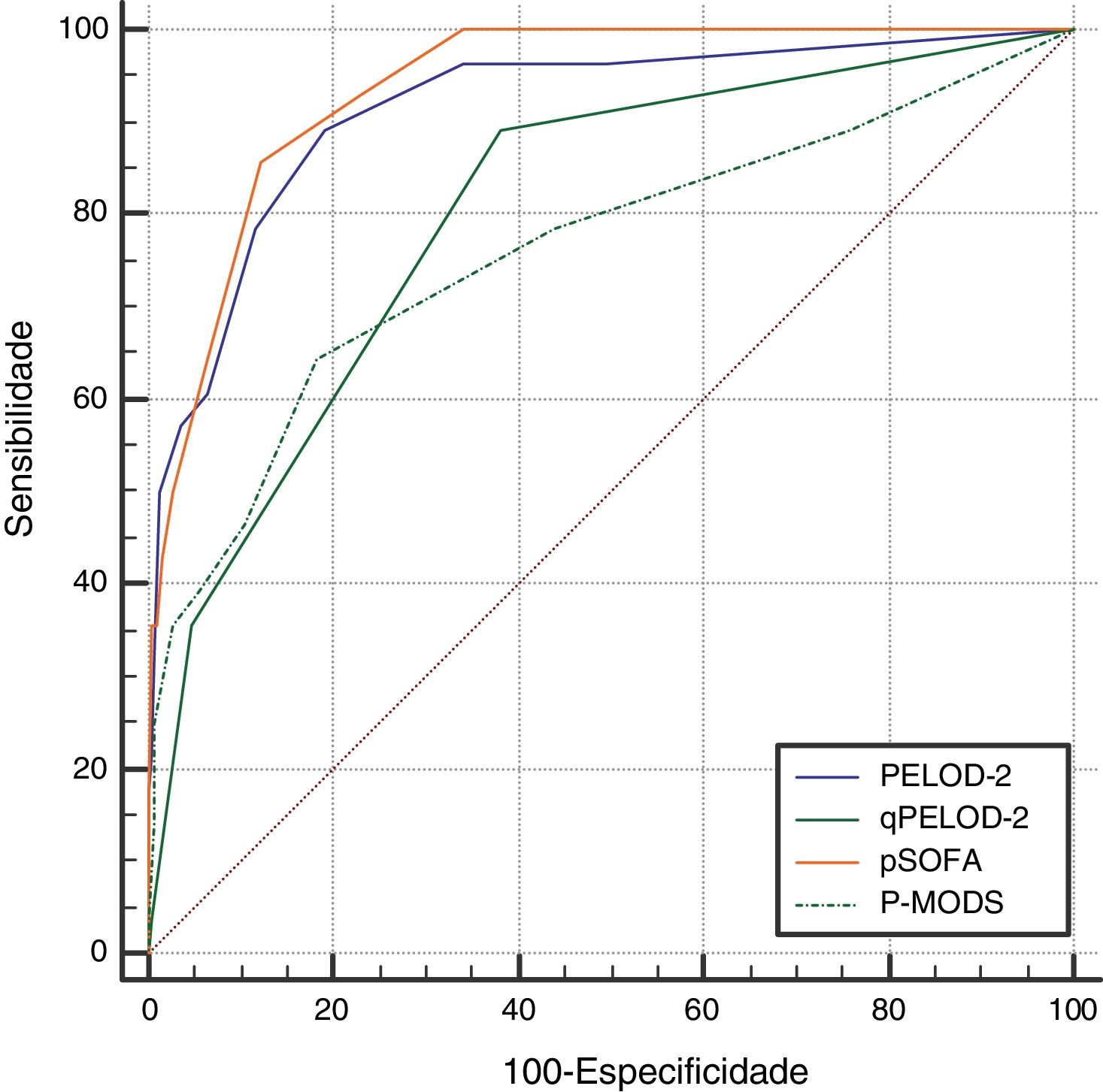
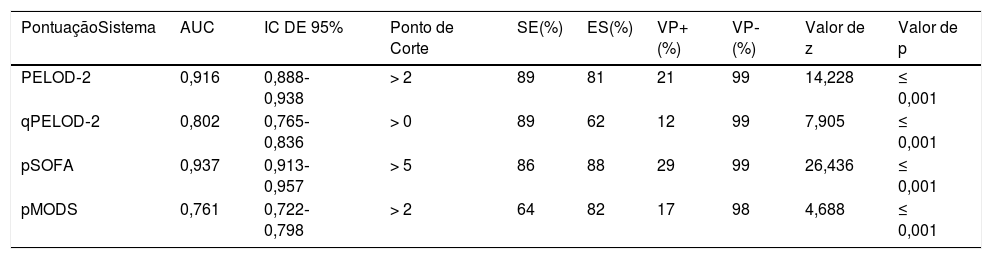
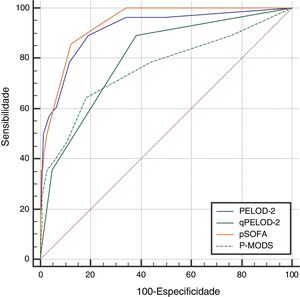
O escore PELOD‐2 no dia 1, o escore qPELOD‐2 no dia 1, pSOFA e P‐MODS no grupo não sobrevida foram significativamente maiores do que os no grupo sobrevida [escore PELOD‐2 no dia 1:6,5 (4‐8) em comparação a 0 (0‐2), escore qPELOD‐2 no dia 1: 1 (1‐2) em comparação a 0 (0‐1), escore pSOFA: 7.5 (6‐11) em comparação a 3 (2‐4), P‐MODS: 3 (2‐6) em comparação a 1 (1‐2), todos p < 0,05] (tabela 1). A análise da curva ROC mostrou que as AUCs do escore PELOD‐2 no dia 1, escore qPELOD‐2 no dia 1, pSOFA e P‐MODS preditivas do prognóstico de crianças com sepse na UTIP foram 0,916 (0,888‐0,938), 0,802 (0,765‐0,836), 0,937 (0,913‐0,957) e 0,761 (0,722‐0,798), respectivamente (todas p < 0,05) (tabela 2; fig. 2). Isso indica que o escore PELOD‐2 no dia 1 mostrou discriminação excelente com relação à mortalidade hospitalar. O ponto de corte ideal para o escore PELOD‐2 para discriminar a mortalidade foi um escore acima de 2 pontos. Não houve diferença significativa na AUC entre o escore PELOD‐2 no dia 1 e pSOFA (p > 0,05). Contudo, houve diferença significativa na AUC do escore PELOD‐2 no dia 1 e o do qPELOD‐2 no dia 1 e do P‐MODS.
Capacidade preditiva dos escores PELOD‐2, qPELOD‐2, pSOFA e P‐MODS com relação à mortalidade hospitalar
| PontuaçãoSistema | AUC | IC DE 95% | Ponto de Corte | SE(%) | ES(%) | VP+(%) | VP‐(%) | Valor de z | Valor de p |
|---|---|---|---|---|---|---|---|---|---|
| PELOD‐2 | 0,916 | 0,888‐0,938 | > 2 | 89 | 81 | 21 | 99 | 14,228 | ≤ 0,001 |
| qPELOD‐2 | 0,802 | 0,765‐0,836 | > 0 | 89 | 62 | 12 | 99 | 7,905 | ≤ 0,001 |
| pSOFA | 0,937 | 0,913‐0,957 | > 5 | 86 | 88 | 29 | 99 | 26,436 | ≤ 0,001 |
| pMODS | 0,761 | 0,722‐0,798 | > 2 | 64 | 82 | 17 | 98 | 4,688 | ≤ 0,001 |
AUC, área abaixo da curva; ES, especificidade; IC de 95%, intervalo de confiança de 95%; PELOD‐2, Pediatric Logistic Organ Dysfunction Score‐2; P‐MODS, Pediatric Multiple Organ Dysfunction Score; pSOFA, pediatric Sequential Organ Failure Assessment; qPELOD‐2, quick Pediatric Logistic Organ Dysfunction Score‐2; SE, sensibilidade; VP‐, valor preditivo negativo; VP+, valor preditivo positivo.
A definição de sepse pediátrica pelo Consenso de 2005 manteve a exigência dos critérios da Síndrome da Resposta Inflamatória Sistêmica (SIRS) e forneceu explicação adicional sobre as definições de falência dos órgãos.11 A validade dos critérios SIRS para identificar e avaliar a gravidade dos pacientes diagnosticados com sepse foi contestada em adultos, devido à falta de sensibilidade e especificidade.10,16 O Sepsis‐3 tem como base o escore SOFA.17 Contudo, o escore SOFA não é adaptado para crianças. Portanto, as definições atuais de sepse pediátrica continuam essencialmente com base no Sepsis2, que não é bom para pesquisa clínica.18 O escore PELOD‐2 foi usado para pontuar a disfunção orgânica em pacientes pediátricos com suspeita de infecção. Vários estudos mostraram que o escore PELOD‐2 apresenta uma excelente discriminação da mortalidade hospitalar.19–22 Nossa pesquisa mostra que o escore PELOD‐2 no dia 1 demonstra excelente discriminação da mortalidade hospitalar em uma UTIP de um país em desenvolvimento, que sugere seu uso promissor na padronização de definições e critérios de diagnóstico da sepse pediátrica. Além disso, o escore qPELOD‐2 no dia 1 apresenta boa validade preditiva da mortalidade hospitalar (AUC, 0,802, IC de 95%, 0,765‐0,836). Nosso estudo indica que tanto o PELOD‐2 quanto o qPELOD‐2 no dia 1 apresentam boa validade preditiva da mortalidade hospitalar em crianças com sepse em uma UTIP de um país em desenvolvimento, raramente relatada.
O escore SOFA foi desenvolvido para avaliar a condição e o prognóstico da doença de um paciente com base no grau de disfunção orgânica. Adicionalmente, a utilidade do escore SOFA já foi validada anteriormente em grandes coortes de pacientes gravemente doentes.10,23,24 Matics e Sanchez‐Pinto propuseram uma versão pediátrica do escore SOFA (pSOFA), desenvolvida ao adaptar o escore SOFA original aos pontos de corte ajustados à idade para os sistemas cardiovascular e renal e ao expandir os critérios respiratórios para incluir substitutos não invasivos da lesão pulmonar.15 Além disso, os autores concluíram que o escore pSOFA máximo apresentou excelente validade preditiva da mortalidade hospitalar (AUC, 0,94,IC de 95%, 0,92‐0,95), porém há necessidade de pesquisa adicional. Em nosso estudo, concluímos que o escore pSOFA (AUC, 0,937, IC de 95%, 0,913–0,957) é válido e consegue avaliar o prognóstico de crianças com sepse em uma UTIP de um país em desenvolvimento, leva à promoção da pSOFA em países em desenvolvimento. Enquanto isso, em nosso estudo, descobrimos que o ponto de corte ideal do escore pSOFA, para diferenciar a mortalidade hospitalar, foi um escore maior do que 5 pontos, diferente do ponto de corte encontrado por Matics e Sanchez‐Pinto em crianças com sepse em uma UTIP de um país desenvolvido. Essa observação exige validação adicional.
Nosso estudo tem diversas limitações. Primeira, como um estudo observacional retrospectivo, não temos dados suficientes para calcular todos os escores diários para avaliar dinamicamente a condição dos pacientes. Segunda, o tamanho relativamente pequeno da amostra pode ter resultado em uma estimativa menos exata da precisão dos escores PELOD‐2 no dia 1 e da qPELOD‐2 no dia 1. Terceira, incluímos apenas crianças internadas na UTIP e, portanto, não consideramos crianças de diferentes fases do tratamento agudo (ambulatorial, emergência e enfermaria do hospital). Essas limitações reduzem a generalização de nossos achados e enfatizam a necessidade de estudos multicêntricos prospectivos futuros.
Os dois escores PELOD‐2 e qPELOD‐2 no dia 1 são válidos e conseguem avaliar o prognóstico de crianças com sepse em uma UTIP de um país em desenvolvimento. Ademais, o escore PELOD‐2 é superior ao escore qPELOD‐2. São necessários estudos adicionais para determinar a utilidade do escore qPELOD‐2, principalmente fora da UTIP.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aprovação do Conselho de Ética e consentimento para participarEste estudo seguiu as normas de ética médica e foi aprovado pelo Comitê de Ética do Affiliated Hospital of Guangdong Medical University (2018‐027). Além disso, excluímos o consentimento informado devido à natureza observacional do estudo.
A todos os médicos, enfermeiros e pacientes do Centro Médico da Criança do Affiliated Hospital of Guangdong Medical University.
Como citar este artigo: Zhong M, Huang Y, Li T, Xiong L, Lin T, Li M, et al. Day‐1 PELOD‐2 and day‐1 “quick” PELOD‐2 scores in children with sepsis in the PICU. J Pediatr (Rio J). 2020;96:638–43.