To verify and describe the main events related to the diagnosis and management of chronic obstructive pulmonary diseases in children (COPDC) and adolescents, considering the interrelated physiopathology, genetic, and environmental characteristics.
SourcesRelevant literature from PubMed was selected and reviewed.
Summary of the findingsCOPDC have an environmental and/or genetic origin and its manifestation has manifold genotypes, phenotypes, and endotypes. Although COPDC has no cure, it can be clinically controlled. Chronic cough is the main symptom and bronchiectasis can be present in several COPDC patients. The management of COPDC is more effective if based on guidelines and when treatment regimen adherence is promoted. Oral and inhaled corticosteroids, bronchodilators, inhaled antibiotics, and treatment of pulmonary exacerbation (PE) are the bases of COPDC management, and should be individualized for each patient.
ConclusionsCorrect diagnosis and knowledge of risk factors and comorbidities are essential in COPDC management. Procedures and drugs used should be based on specific guidelines for each COPDC case. Treatment adherence is critical to obtain the benefits of management. COPDC clinical control must be evaluated by the decrease in PEs, improved quality of life, reduction of pulmonary function loss, and lung structural damage. For most cases of COPDC, monitoring by interdisciplinary teams in specialized reference centers with surveillance strategies and continuous care leads to better outcomes, which must be evaluated by decreasing pulmonary function damage and deterioration, better prognosis, better quality life, and increased life expectancy.
Verificar e descrever os principais eventos relacionados ao diagnóstico e manejo das doenças pulmonares obstrutivas crônicas em crianças (DPOCC) e adolescentes, tendo em vista a fisiopatologia e as características genéticas e ambientais inter‐relacionadas.
Fonte dos dadosRevisão na base de dados Pubmed com seleção de referências relevantes.
Síntese dos dadosAs DPOCC têm origem ambiental e/ou genética e se manifestam com diversos genótipos, fenótipos e endótipos e, embora possam ser controladas, não têm cura. O principal sintoma é a tosse crônica e muitas cursam com bronquiectasia. O manejo tem maior eficácia se baseado em guidelines e se a adesão ao regime terapêutico for estimulada e comprovada. Corticoides orais e inalatórios, broncodilatadores, antibióticos inalados e tratamento das exacerbações pulmonares (EP) são vigas mestras do manejo e devem ser individualizados para cada DPOCC.
ConclusõesNas DPOCC é fundamental o diagnóstico correto, conhecer os fatores de risco e as comorbidades. Os procedimentos e os medicamentos devem ser baseados em guidelines específicos para cada DPOCC. Adesão ao tratamento é fundamental para obter os benefícios do manejo. O controle deve ser avaliado pela diminuição das EP, melhoria na qualidade de vida e redução da evolução da perda da função e do dano estrutural pulmonar. Para a maioria das DPOCC, o acompanhamento por equipes interdisciplinares em centros de referência especializados, com estratégias de vigilância e acolhimento contínuos, conduz a melhores desfechos, que devem ser avaliados pela diminuição da deterioração do dano e da função pulmonar, pelo melhor prognóstico, melhor qualidade de vida e aumento da expectativa de vida.
Doença pulmonar obstrutiva crônica (DPOC) é consagrada na literatura para evidenciar, na maioria das vezes, os danos causados pelo tabagismo em adultos maiores de 40 anos. Sem ter uma relação direta e exclusiva com o tabagismo ativo de longa duração, várias doenças pulmonares obstrutivas crônicas em crianças (DPOCC) e adolescentes cursam com deterioração estrutural e na função pulmonar e causam obstrução persistente (fixa) ou intermitente (temporária) dos fluxos pulmonares, secundários a alterações genéticas e/ou ambientais que causam inflamação e/ou infecção das vias aéreas. Embora a sintomatologia das DPOCC seja muito parecida, elas têm etiologia, morbidade, fisiopatologia, prevalência e prognósticos, genótipos e fenótipos diferentes.1,2
Enquanto algumas DPOCC têm merecido muitos estudos, como é o caso da asma, fibrose cística (FC), sibilância recorrente em lactentes (SRL) e displasia broncopulmonar (DBP), outras são denominadas doenças órfãs e entre elas se incluem discinesia ciliar primária (DCP), bronquiectasia não associada à fibrose cística (BNFC), bronquite plástica (BP) e bronquiolite obliterante (BO).
As DPOCC caracterizam‐se por elevadas prevalências – asma, SRL e DBP – ou baixas – BO, FC, BP, DCP e BNFC; não ser transmissíveis, ter longa duração e progressão lenta, apresentar quadros de exacerbação pulmonar (EP), limitações agudas ou permanentes do fluxo aéreo e prejuízo significativo na qualidade de vida.3 Em todas elas, o principal sintoma pulmonar é a tosse crônica, que traduz as alterações nas vias aéreas, uma vez que nos alvéolos não existem receptores para a tosse. Outra característica é a presença de bronquiectasias em muitas delas.4
A maioria, inclusive uma parcela das várias formas de apresentação da asma, cursa com a inflamação neutrofílica nas vias aéreas, que contribui para evolução progressiva da deterioração do dano e da função pulmonar por liberar: (i) elastase: cliva elastina e causa bronquiectasia, diminui a opsonização e fagocitose, aumenta a secreção, diminui o clearance mucociliar; (ii) DNA: aumenta a viscosidade das secreções; (iii) peróxido de hidrogênio e outros oxidantes: dano tecidual e inativa a α‐1‐antitripsina; (iv) IL‐8 e LTB4: atraem mais neutrófilos.5
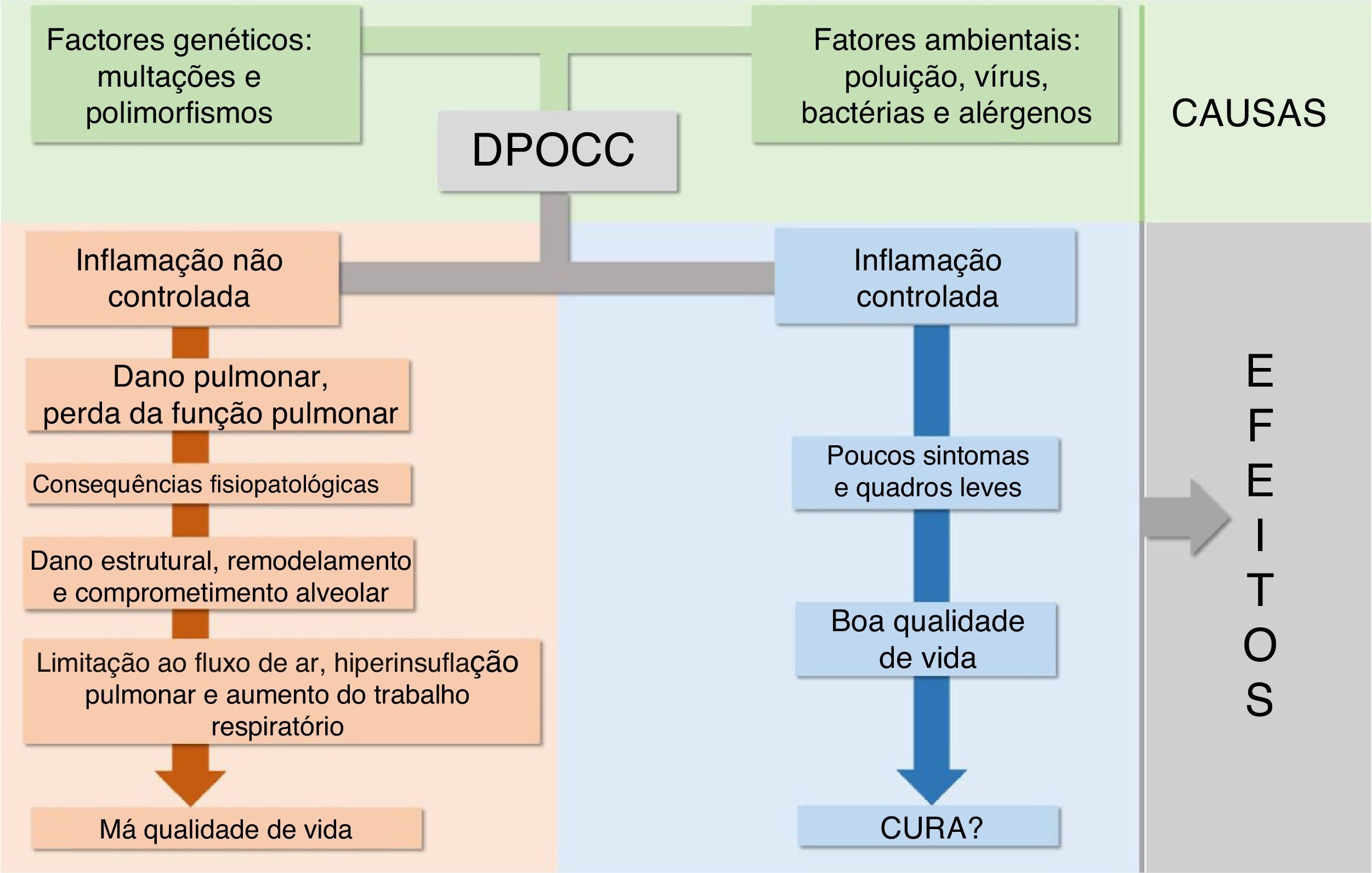
Dois aspectos das DPOCC têm sido exaustivamente estudados: o componente genético e as agressões ambientais que as iniciam ou exacerbam. A maioria das DCPCC cursa com diversos genótipos, fenótipos, endótipos e graus de gravidade, necessita de manejos diferentes e não tem cura.6
Pneumonia, DBP, BO e/ou SRL nos primeiros anos de vida constituem grupo de risco para DPOC em longo prazo e devem ter acompanhamento médico e intervenções para prevenir o impacto potencial sobre sequelas respiratórias em longo prazo.7–9 Em todas as DPOCC quadros de EP são frequentemente desencadeados por infecções virais e/ou bacterianas, poluição e aeroalérgenos. As EP manifestam‐se por insuficiência respiratória aguda de intensidade variável tanto na asma como na e SRL; aumento da tosse e da infecção crônica na FC, DBP, BNFC e DCP. Os sinais e sintomas de EP são mais frequentes e intensos nos períodos noturnos.
Enquanto a maioria das doenças respiratórias agudas pode ser diagnosticada fácil e eficientemente pela história e pelo exame físico, aquelas de caráter crônico podem exigir exames complementares sofisticados. Para obter manejo eficaz, melhor prognóstico e qualidade de vida nas DPOCC, é necessária avaliação contínua e programada, por equipes interdisciplinares de saúde em centros especializados.
Estabelecer protocolos baseados em revisões sistemáticas, metanálises e guidelines permitem obter o controle ou não dos sinais e sintomas da DPOCC. Corticoides orais e inalatórios (CI), mucolíticos, broncodilatadores, antibióticos inalatórios e outros medicamentos devem ser usados de acordo com guidelines específicos para cada DPOCC. Enquanto alguns grupos de medicamentos são muito usados, com maior ou menor grau de evidência científica, como os broncodilatadores e os CI, o emprego de outros, como é o caso dos macrolídeos por tempo prolongado, é mais controverso. O uso desses últimos nas de macrolídeos nas DPOCC tem sido justificado pelo efeito anti‐inflamatório e imunomodulador, na diminuição da produção de muco e inibição da elastase dos neutrófilos, além de atenuar a produção de mediadores pró‐inflamatórios (ex: IL8) e estimular a fagocitose de células em apoptose, como é o caso dos neutrófilos.10–14 Apesar de os macrolídeos demonstrarem eficácia em pacientes com FC e em outras DPOCC e seus efeitos in vitro sejam animadores, o uso em outras DPOCC tem mostrado menor eficácia e necessita de mais estudos.14
O objetivo da presente revisão foi verificar e descrever os principais eventos relacionados ao diagnóstico e manejo das DPOCC, tendo em vista a fisiopatologia e as características genéticas e ambientais inter‐relacionadas.
Fonte dos dadosRevisão nas bases de dados do Pubmed com seleção de referências relevantes. Usaram‐se os descritores (segundo os critérios Mesh) relacionados a cada uma das DPOCs incluídas no estudo: asma, FC, SRL, DBP, DCP, BNFC, BO e BP.
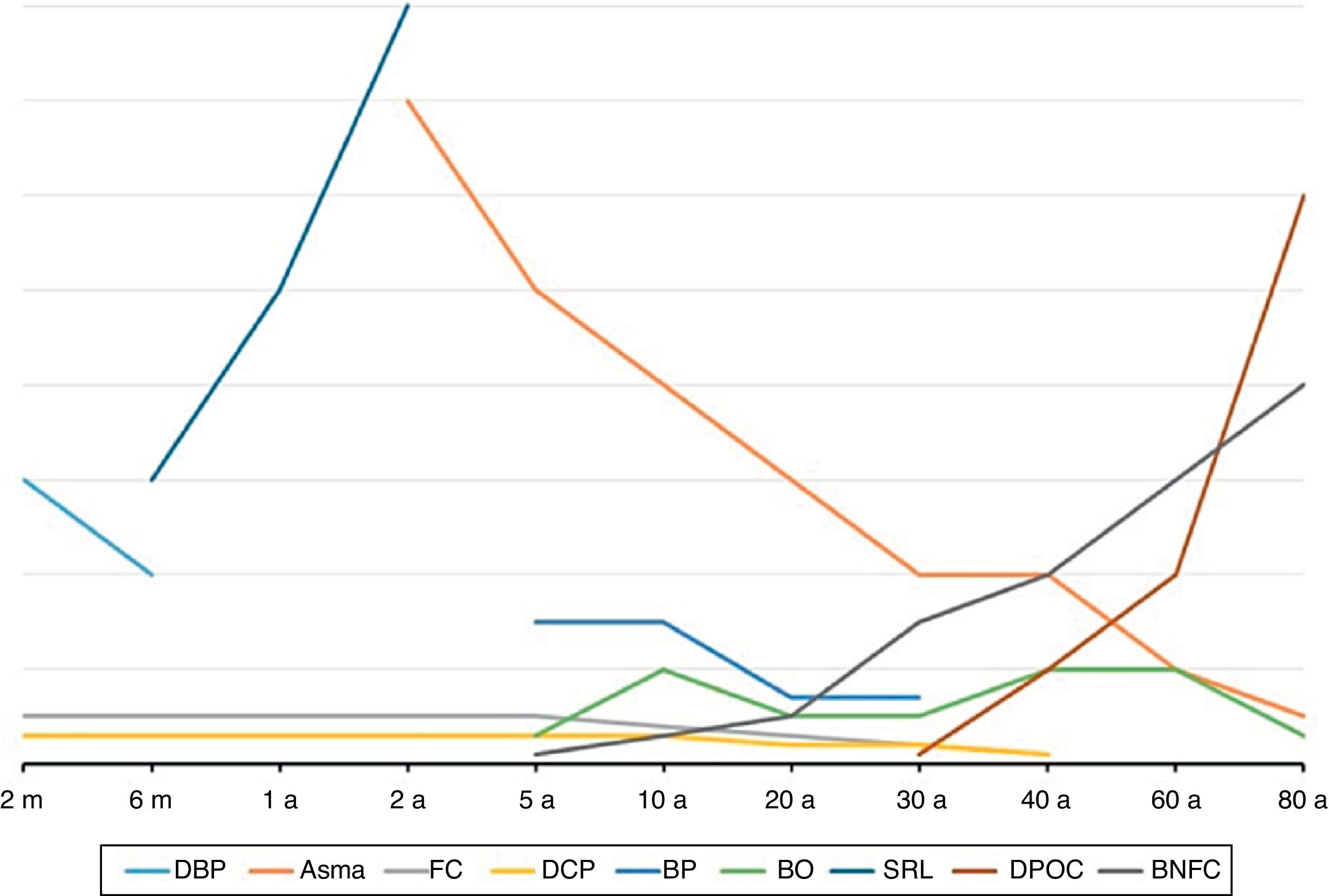
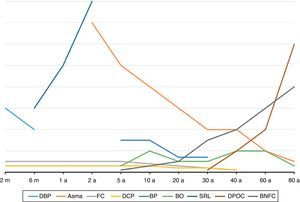
Doenças pulmonares obstrutivas crônicas na infância: uma visão geralA primeira característica importante das DPOCC é que as suas manifestações clínicas e suas prevalências são mais frequentes em determinadas faixas etárias, como pode ser visto na figura 1. A segunda é que interações entre o componente genético e agressões ambientais as iniciam ou exacerbam, como pode ser visto na figura 2. As principais diferenças e semelhanças entre as DPOCC podem ser vistas na tabela 1. A terceira característica das DPOCC é que elas cursam com EP, predominantemente infecciosas (FC), inflamatórias (asma) e mistas (asma e vírus/bactérias).
Idade de início e de maior prevalência das principais doenças pulmonares obstrutivas crônicas em crianças (DPOCC) comparadas com as doenças pulmonares obstrutivas crônicas (DPOC) dos adultos. FC, fibrose cística; SRL, sibilância recorrente em lactentes; DBP, displasia broncopulmonar; DCP, discinesia ciliar primária; BNFC, bronquiectasia não fibrose cística; BP, bronquite plástica; BO, bronquiolite obliterante; m, mês; a, ano.
Principais características clínicas e patofisiológicas das DPOCC versus as DPOC nos adultos
| DPOC características | ASMA | SRL | DBP | BO e BOPI | FC | BP | DCP | BNFC | DPOC clássica dos adultos |
|---|---|---|---|---|---|---|---|---|---|
| Início dos sintomas | Antes dos 5 anos de vida | < 2 anos | Recém‐nascido | < 3 anos | < 2 anos nas formas clássicas | CC:<5 anosAsma:>5 anos | Primeiro ano de vida | Após o segundo ano de vida | Adultos>40 anos |
| Idade de maior prevalência | Infância | 1 a 2 anos | Primeiro ano de vida | Infância e adolescência | Até 30 anos | CC:<5 anosAsma:>5 anos | Infância e adolescência | Infância e adolescência | Após 40 anos |
| Principal marcador clínico | História familiar de asma, atopia pessoal e resposta positiva a BD | Infecção por vírus respiratórios(RSV e RV) | PrematuridadeUso de oxigênio | Vírus | Colonização crônica das vias aéreas por Pseudomonas aeruginosa e insuficiência pancreática | Eliminação de moldes brônquicos a expectoração | Infecções supurativas das vias aéreas altas e baixas | Infecções recorrentes e tosse crônica | Tabagismo, enfisemae fumaça de biomassa |
| Prevalência | Alta(5 a 30%) | Alta(15 a 60%) | Alta 26% em RNMBP | Baixa? | Baixa. Classificada como doença rara. 1:2.500 a 1:10.000 nascidos vivos | Baixa? | Baixa? | Baixa? | 6 a 15,8% da população maior que 40 anos |
| Fundamentos para o diagnóstico | Espirometria, resposta positiva a BD, IgE e TCHI | > 3 episódios de sibilância quando lactente e IPA positivo | Prematuridade e oxigenioterapia, por mais de 28 dias no início da vida | Biópsia pulmonar, TCAR e cintilografia pulmonar de perfusão | TNN com TIR positivo, cloro>60 mEq/L no suor, 2 mutações no gene CFTR | Moldes de vias aéreas expectorados e broncoscopia | Dextrocardia, sinusopatia crônica, pneumonia e IVAS de repetição | TCAR | Tabagismo, enfisema e deficiência de alfa1 antitripsina |
| Genótipo | Numerosos cromossomos e polimorfismos | Numerosos cromossomos e polimorfismos | Pouco conhecido | Pouco conhecido | Autossômica recessiva com alterações no gene CFTR localizado no cromossomo 7.6 classes de mutações. Muitos polimorfismos | Desconhecido | Autossômica recessiva | Depende da etiologia | ‐ |
| Fenótipo | Numerosos | Numerosos | L, M, G | Constritiva proliferativa | Numerosos. Com e sem insuficiência pancreática | Dependendo da etiologia o molde brônquico tem composição diferente | Com e sem dextrocardia | Depende da etiologia | Com e sem asma |
| LBA | Eosinófilos | Neutrófilos e/ou eosinófilos | Neutrófilos | Neutrófilos | Neutrófilos | Mucina e fibrina | Neutrófilos | Neutrófilos | Neutrófilos e macrófagos |
| Marcadores em linfócitos | CD4/CD8 alta | Varia se o LBA é eosinófilo ou neutrófilo | ? | ? | ? | ? | ? | Depende da etiologia | CD8/CD4 alta |
| Mediadores inflamatórios | IL4, IL5, IL9, IL13, TNF‐α, GM‐CSF | Varia se o LBA é eosinófilo ou neutrófilo | TNF‐α, IL‐1, IL‐6, IL‐10 | IL1β, IL6, IL8, TNF‐α, e NFkβ | IL8 | ? | ? | Depende da etiologia | IL8, LTB4, proteases, MMP9, TNF‐α, TGF‐β1 |
| Principais causas de EP | Vírus e aero‐alérgenos | Vírus | Vírus | Vírus | Bactérias gram negativas | InfluenzaH1N1? | Vírus e bactérias | Bactérias e vírus | Vírus e bactérias |
| Resposta a BD | Sim | Pouco conhecido | Desconhecido | Rara | Rara | ? | ? | Não | Baixa |
| Obstrução | Intermitente nos leves e fixa nos graves | Intermitente | Fixa | Fixa | Fixa | Intermitente | Fixa | Fixa | Fixa |
| Sobrevida/Mortalidade | Longa/baixa | Longa/baixa | Depende da gravidade e da idade gestacional | Depende da gravidade | < 40 anos ‐ mutações de classe I a III.> 40 anos ‐ mutações de classe IV–VI. | Baixa/alta | < 40 anos | Depende da idade de início e da etiologia | Depende da gravidade.Mortalidade elevada em idosos |
| Evolução para doença restritiva | Raro | Raro | Raro | Frequente | Frequente | Rara | Frequente | Frequente | Frequente |
| Evolução para transplante pulmonar | Não | Não | Não | Raro | Sim | Não | Sim | Sim | Não |
| Comorbidades | Rinite alérgica, dermatite atopica eDRGE | DRGE | DRGE e prematuridade | Infecção grave por adenovírus | Insuficiência pancreática, depressão, diabetes e osteoporose | CC, asma, doenças linfáticas, ABPA | Azoospermia e rinossinusite crônica | ? | Asma e DRGE |
| Tratamento | CI; SABA; LABA; Montelucaste; Omalizumab | CI; SABA; Montelucaste | CI; SABA;Sildenafil e HPDiuréticos | CI; SABA; LABA; corticoides; oxigênio; brometo de tiotrópio | Mucolíticos; AI; enzimas digestivas, CI; SABA; LABA; corticoides;tiotrópio; oxigênio | Broncoscopia; mucolíticos e antifibrinolíticos | Mucolíticos, AI; CI; SABA; LABA; corticoides e oxigênio | Mucolíticos; AI; CI; SABA; LABA; corticoides; oxigênio; macrolídeos | CI; SABA; LABA; corticoides; Tiotrópio e oxigênio |
| Perspectivas | Intervenções precoces intraútero e nos primeiros anos de vida em populações de risco.Profilaxia contra VSR e RV.Imunomodelação com prebióticos, probióticos e lisados. bacterianos.Prevenção da sensibilização alérgica. | Hipercapnia permissiva e melhoria no atendimento aos RNMBP | Palivizumab; genes e polimorfismos; vacinas antivírus respiratórios | Correções por potencializadores e corretores da proteína CFTR e novos exames para o diagnóstico de formas atípicas | Estudos multicêntricos, registros nacionais | Estudos genéticos e diagnóstico precoce | Profilaxia contra vírus | Evitar o tabagismoControle da asma |
?, desconhecido; ABPA, aspergilose broncopulmonar alérgica; AI, antibióticos inalatórios; BD, broncodilatador; BNFC, bronquiectasias não fibrocísticas; BO, bronquiolite obliterante; BOPI, bronquiolite obliterante pós‐infecciosa; BP, bronquite plástica; CC, cardiopatia congênita; CI, corticoide inalatório; CD4, molécula CD4; CD8, molécula CD8; CFTR, Cystic Fibrosis Transmembrane Regulator; DBP, displasia broncopulmonar; DCP, discinesia ciliar primária; DPOC, doença pulmonar obstrutiva crônica; DRGE, doença por refluxo gastresofágico; EP, exacerbação pulmonar; FC, fibrose cística; GM‐CSF, granulocyte macrophage colony stimulating factor; HP, hipertensão pulmonar; IgE, imunoglobulina E; IL, interleucina; IPA, índice preditivo de asma; IVAS, infecção das vias aéreas superiores; LABA, long‐acting beta agonists – beta agonistas de longa duração; LBA, lavado bronco alveolar; LTB4, Leukotriene B4; L, leve; M, moderada; G, grave; mEq/L, miliequivalentes/litros; MMP, matrix metallopeptidase; NF‐κB, NF‐kappaB; RNMBP, recém‐nascidos de muito baixo peso; RSV, Respiratory Sincitial Virus; RV, rinovírus; SABA, Short‐Acting Beta Agonists – beta agonistas de curta ação; SRL, sibilância recorrente do lactente; TCAR, tomografia computadorizada de alta resolução; TCHI, Testes Cutâneos de Hipersensibilidade Imediata (Prick Test); TGF, Transforming Growth Factor; TIR, tripsinogênio imunorreativo; TNN, triagem neonatal; TNF, Tumor Necrosis Factor; VSR, vírus sincicial respiratório.
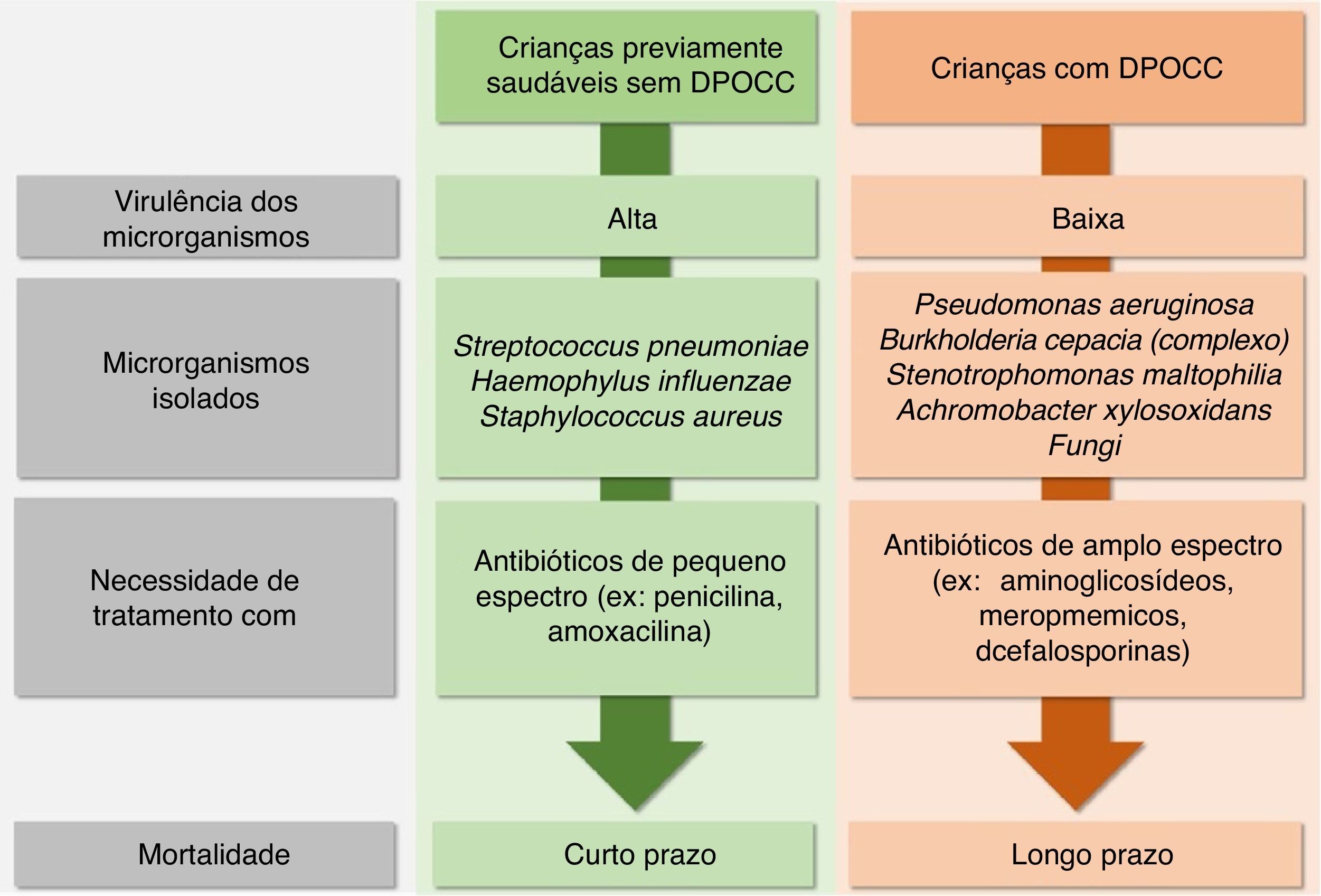
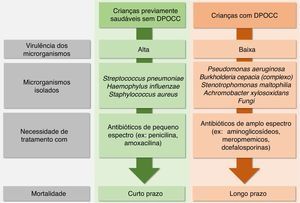
As EP infecciosas por bactérias são diferentes em crianças saudáveis daquelas com DPOCC. O Streptococus pneumoniae, Haemophylus influenzae e Staphylococus aureus, que têm alta virulência, são causas frequentes das pneumonias em indivíduos previamente saudáveis sem DOPCC e exigem tratamento com antibióticos de baixo espectro (ex: penicilina e amoxacilina), porém causam mortalidade em curto prazo. Em contrapartida, muitos pacientes com DPOCC, principalmente aqueles com FC, DCP e BNFC, fazem EP causadas por bactérias de baixa virulência [Pseudomonas aeruginosa (PA), complexo Burkholderia cepacia, Stenotrophomonas maltophilia e Achromobacter xylosoxidans] que causam mortalidade em longo prazo. No entanto, exigem antibióticos de largo espectro, como aminoglicosídeos, meropnêmicos e cefalosporinas de terceira geração (fig. 3).
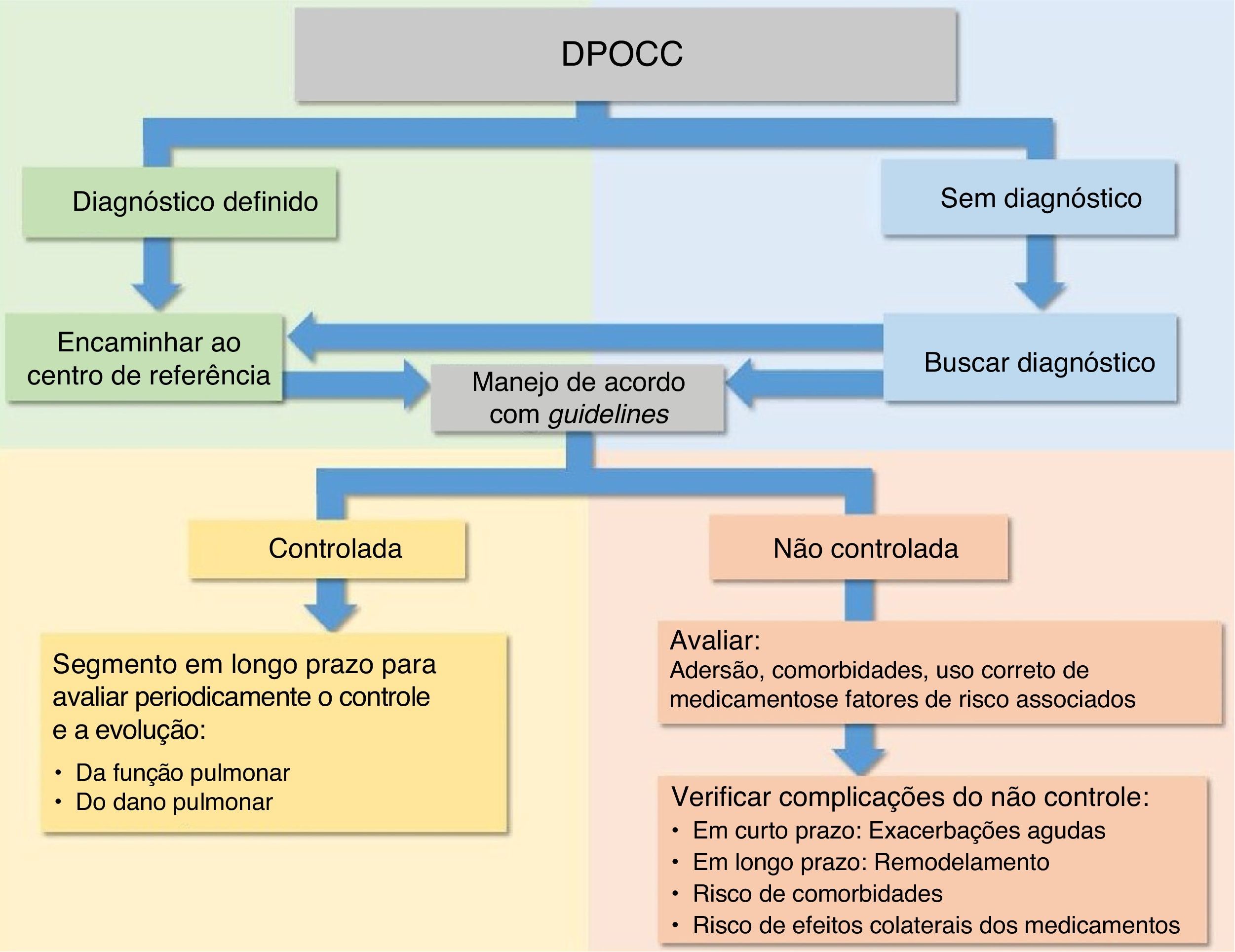
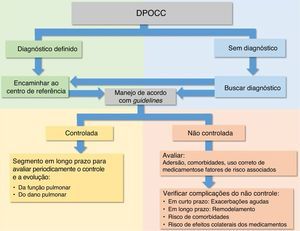
Em decorrência das características das DPOCC, vários guidelines e revisões sistemáticas para o diagnóstico e para o manejo para se obter o controle, com o intuito de evitar a deterioração do dano e da função pulmonar, têm sido propostos tanto para os períodos intercrises quanto para as EP da maioria das DPOCC.6,15–27 (fig. 4)
AsmaParcela dos asmáticos cuja doença se manifestou nos primeiros anos de vida persiste sintomática e evidências sugerem que a gravidade da asma na infância prediz a gravidade da asma na idade adulta.28 Diretrizes e guidelines recentes enfatizam dificuldades para o diagnóstico definitivo de asma em crianças menores de cinco anos nas quais vários fenótipos de DPOCC têm sido identificados. Para crianças maiores de cinco anos o diagnóstico de asma se fundamenta em: (1) história clínica de crises de insuficiência respiratória aguda que melhoram com broncodilatadores de ação curta (SABA); (2) IgE sérica aumentada na ausência de verminose, eosinofilia e testes cutâneos de hipersensibilidade imediata a aeroalérgenos positivos; (3) espirometria e medida da hiperresponsividade brônquica (HRB) com metacolina. O diagnóstico pode ser feito com a presença isolada e/ou a combinação dos itens 1; 1+2; 1+3 e 1+2+3 acima.
Vários fatores têm sido associados com maior risco de desenvolvimento de asma na adolescência, entre os quais podem ser citados: história de alergia pessoal ou familiar, sexo masculino, obesidade, poluição, exposição à fumaça de cigarro, SRL, infecção grave por vírus sincicial respiratório (VSR), pneumonia no primeiro ano de vida, gravidade da SRL, função pulmonar alterada e HRB.8,29‐31 Não existe tratamento específico para asma e é preferível usar o termo manejo para as ferramentas usadas para obter o controle. Os principais objetivos para o manejo ambulatorial são: (i) tornar os sintomas crônicos mínimos ou inexistentes; (ii) diminuir a intensidade e o número das EP; (iii) manter a função pulmonar o mais próximo possível dos níveis normais; (iv) manter níveis normais de atividades diárias, incluindo exercícios físicos; (v) evitar os efeitos adversos de medicamentos antiasmáticos; (vi) evitar a evolução para a limitação irreversível do fluxo aéreo; (vii) prevenir a mortalidade por asma.6,15–20 Os principais medicamentos para controle da asma são os corticosteroides inalatórios (CI).
A seguir estão classificados os quadros clínicos e suas respectivas etapas no tratamento.
Etapas no tratamento da asma(Etapa 1) Indivíduos com asma intermitente, caracterizada por espirometria normal, com períodos intercrises com duração maior do que um mês, sem exacerbações no último ano, devem receber SABA. (Etapa 2) Uso contínuo de CI em baixas doses e SABA de resgate nas crises. (Etapa 3) Uso contínuo de baixas doses de CI+beta agonistas de longa ação (LABA) com SABA para as crises ou CI+formoterol tanto para manutenção quanto para o controle. (Etapa 4) CI+formoterol para manutenção e crises ou doses médias ou altas de CI+LABA e SABA, se necessário. (Etapa 5) Encaminhar para um centro de referência em asma de difícil controle: considerar corticoides orais e anti‐IgE (omalizumab). Considerar corticoide oral nas EP graves e se o paciente teve EP graves anteriores.6,15–20 Os medicamentos e as etapas se modificam para o nível seguinte ou para o nível anterior dependendo do controle ou não da asma. Diminuição de etapas de manejo deve ocorrer se a asma estiver bem controlada por pelo menos três meses.
É fundamental verificar a cada consulta se a asma está ou não controlada do ponto de vista clínico e/ou funcional, com base em seis parâmetros: (i) sinais e sintomas noturnos; (ii) sinais e sintomas diurnos; (iii) sinais e sintomas com exercícios ou limitação nas atividades diárias; (iv) EP; (v) necessidade de medicação de alívio (SABA); (vi) alterações na função pulmonar. Assim, a asma é considerada controlada quando todos os parâmetros estiverem normais; será classificada como parcialmente controlada na presença de um ou dois parâmetros alterados; e, finalmente, asma não controlada quando três ou mais parâmetros estiverem alterados.
A ausência de controle dos sinais e sintomas, exacerbações frequentes, admissão prévia em unidade de tratamento intensivo (UTI), baixos valores de volume expiratório forçado no primeiro segundo (VEF1), exposição à fumaça do tabaco e necessidade de usar medicação em altas dosagens são características associadas com aumento dos riscos de eventos adversos no futuro. Por definição, uma exacerbação em qualquer semana é indicativa de asma não controlada e é indicativa da necessidade de revisão no tratamento de manutenção.16,17
Na condução de pacientes com asma é fundamental: (i) manejo fundamentado em medicina baseada em evidências; (ii) fazer o diagnóstico e se possível o fenótipo (ex: alérgica e não alérgica); (iii) excluir e tratar comorbidades; (iv) verificar e orientar o uso correto dos medicamentos prescritos; (v) orientar, estimular e checar a adesão ao tratamento; (vi) orientar, estimular e checar a profilaxia ambiental; (vii) verificar e orientar sobre os fatores desencadeantes; (viii) educação dos cuidadores do paciente sobre asma e os fatores que a influenciam; (ix) instruções sobre o uso correto dos dispositivos para administração de aerossóis dosimetrados e de pó seco; (x) orientações para o conhecimento sobre quando o controle da asma está se deteriorando e os medicamentos a administrar, quando isso ocorrer; (xi) identificar pacientes não controlados e as causas da falta de controle; (xii) orientar que os medicamentos inalatórios devem ser usados com espaçadores; (xiii) orientar sobre a higienização de espaçadores, os quais devem ser lavados e deixados de molho com detergente neutro; (xiv) não usar LABA em menores de quatro anos; (xv) SABA são os agentes de escolha nas EP; (xvi) CI isoladamente ou em conjuntos com broncodilatadores são a viga mestra no tratamento da asma; (xvii) em menores de seis anos usar medicação inalatória com espaçador e em maiores de seis anos pode‐se usar pó seco; (xviii) avaliar a função pulmonar periodicamente; (xix) orientar para a necessidade de acompanhamento médico em longo prazo; (xx) omalizumab deve ser prescrito em centros de referência no manejo de pacientes com asma de difícil controle.
Sibilância recorrente no lactente (SRL)Existem numerosos fenótipos e fatores de risco (FR) para SRL que causam dificuldades para o diagnóstico de asma e propiciam excesso de investigação de comorbidades.32‐37 Os principais FR são: presença de alergia familiar e/ou pessoal, sensibilização precoce, infecção grave pelo VSR, tabagismo materno na gravidez e geometria desfavorável das vias aéreas. Outros FR implicados: variantes genéticas, excesso de higiene, estilo de vida ocidental, poluição, doença por refluxo gastresofágico (RGE), baixo nível socioeconômico, ambiente urbano, uso de antibióticos, dieta, poucos irmãos, etnia, gênero masculino e hábito de frequentar creches.38
Exposição ao tabagismo materno, intraútero e nos primeiros anos de vida tem contribuído para aumento da incidência e gravidade da asma pediátrica e de adultos, DPOC no adulto, déficits na função pulmonar, hipoplasia pulmonar, infecções do trato respiratório e maior predisposição à síndrome da morte súbita.39‐41 Os vírus respiratórios são os principais FR para iniciar ou exacerbar a SRL e asma: (i) alguns vírus iniciam asma; (ii) quanto mais grave a infecção respiratória, maior a probabilidade de desenvolver asma; (iii) vírus causam EP em crianças e adultos com asma estabelecida.42
O diagnóstico de asma em lactentes é um grande desafio para os clínicos. Para se chegar a um diagnóstico com elevado grau de suspeição, deve‐se buscar a presença de alergia, porque é um preditor de asma persistente Para investigação de DPOCC grave em menores de cinco anos podem ser necessários numerosos exames que incluem tomografia computadorizada de alta resolução (TCAR), avaliação da função pulmonar, avaliação da imunidade celular e humoral, broncoscopia, lavado broncoalveolar, pH‐metria esofágica de 24 horas, biópsia endobrônquica, estudos de mutações, dosagem de sódio e cloro no suor.35 Em contrapartida, para a maioria da SRL nenhuma investigação é necessária, mesmo porque ainda não podemos diferenciar, com certeza, se o curso futuro a SRL será asma persistente ou chiado transitório.43
Alguns índices preditivos de asma (IPA) foram desenvolvidos para identificar crianças com SRL e risco para asma após seis anos (tabela 2).38,44 Alguns autores citam limitações metodológicas e práticas dos IPA e sugerem que eles têm fraca capacidade e sensibilidade para prever asma na idade escolar45,46 e que, apesar de serem ferramentas simples e fáceis de aplicar, não foram suficientemente validados. Segundo esses autores, predizer asma com modelos clínicos simples é praticamente impossível.45,46
| IPA critérios | IPA original1 | IPA modificado38 |
|---|---|---|
| Gerais | IPA convincente: mais de três episódios de sibilância/ano durante os três primeiros anos de vida com um critério maior ou dois menores | A criança deve ter história de quatro ou mais episódios de sibilância. Pelo menos um episódio verificado e confirmado por médico. |
| IPA menos convincente: menos de 3 episódios de sibilância/ano durante os três primeiros anos de vida com um critério maior ou dois menores | ||
| Maiores | História de asma nos paisDermatite atópica | História de asma nos paisDermatite atópica diagnosticada por médicoSensibilização alérgica a um ou mais aeroalérgenos |
| Menores | Rinite alérgica diagnosticada por médicoSibilância não relacionada a resfriadoEosinofilia ≥ 4% | Sensibilização a leite de vaca, ovo ou amendoimSibilância não relacionada a resfriadosEosinofilia ≥ 4% |
IPA, índice preditivo de asma.
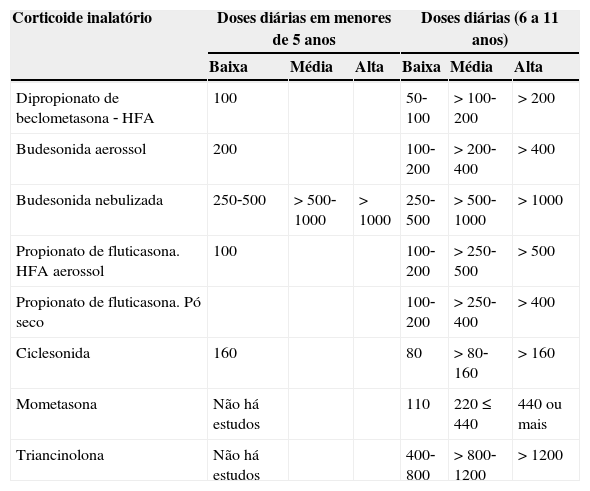
Apesar de a maioria da comunidade científica ser favorável ao emprego dos IPA,47,48 a busca de marcadores clínicos e/ou laboratoriais para o diagnóstico de asma na SRL e crianças menores de cinco anos permanece uma área rica para estudos futuros. Lactentes e pré‐escolares com SRL ou asma têm menos EP e melhoram sintomas e a função pulmonar quando são tratados com CI.49‐51 A dose dos principais CI nas DPOCC é mostrada na tabela 3.
Dose diárias baixas, médias e altas de corticoides inalados (CI) na asma (Global Initiative for Asthma ‐ GINA) e nas DPOCC
| Corticoide inalatório | Doses diárias em menores de 5 anos | Doses diárias (6 a 11 anos) | ||||
|---|---|---|---|---|---|---|
| Baixa | Média | Alta | Baixa | Média | Alta | |
| Dipropionato de beclometasona ‐ HFA | 100 | 50‐100 | > 100‐200 | > 200 | ||
| Budesonida aerossol | 200 | 100‐200 | > 200‐400 | > 400 | ||
| Budesonida nebulizada | 250‐500 | > 500‐1000 | > 1000 | 250‐500 | > 500‐1000 | > 1000 |
| Propionato de fluticasona. HFA aerossol | 100 | 100‐200 | > 250‐500 | > 500 | ||
| Propionato de fluticasona. Pó seco | 100‐200 | > 250‐400 | > 400 | |||
| Ciclesonida | 160 | 80 | > 80‐160 | > 160 | ||
| Mometasona | Não há estudos | 110 | 220 ≤ 440 | 440 ou mais | ||
| Triancinolona | Não há estudos | 400‐800 | > 800‐1200 | > 1200 | ||
BO é uma DPOCC predominantemente neutrofílica com elevados níveis de citocinas pró‐inflamatórias, remodelamento brônquico e fibrose nas pequenas vias aéreas. Quando a etiologia é infecciosa, a BO é denominada pós‐infecciosa (BOPI). Na maioria das vezes a BOPI é causada por infecção anterior causada pelo adenovírus, mas também se observam influenza, sarampo, VSR e Mycoplasma pneumoniae. Os países latino‐americanos apresentam as maiores taxas dessa enfermidade.27,52‐62 Estudos mostram que a função pulmonar se mantém alterada com padrão obstrutivo e aprisionamento de ar durante a infância. Esses pacientes internam frequentemente devido a infecções respiratórias recorrentes. Com o passar dos anos, a melhoria dos pacientes é discreta.54,62
Cinco critérios são fundamentais para o diagnóstico de BOPI: (i) história prévia de bronquiolite viral aguda ou pneumonia viral antes dos três anos; (ii) evidência de obstrução persistente de via aérea após o evento agudo, identificada por exame físico e/ou função pulmonar. Essa obstrução é não responsiva a no mínimo duas semanas de corticoide sistêmico associado ao broncodilatador; (iii) achados radiológicos de obstrução, tais como hiperinsuflação, atelectasias, espessamento brônquico e bronquiectasias; (iv) perfusão em mosaico e aprisionamento aéreo na TCAR; (v) exclusão de outras DPOCC.27,60
Entre as causas de BO podem ser encontradas: drogas, associação com síndrome de Stevens‐Johnson, colagenoses, irradiação, aspiração de corpo estranho ou conteúdo gástrico e reação enxerto versus hospedeiro após transplantes.
O diagnóstico de certeza de BO é feito por exame anatomopatológico de fragmentos obtidos de biópsia pulmonar. A BO classifica‐se em: (i) proliferativa caracterizada por obstrução das vias aéreas por pólipos e/ou tecido de granulação no lúmen dos bronquíolos; (ii) constritiva por inflamação e fibrose peribronquiolar.58 Como a biópsia pulmonar é um exame invasivo, a maioria dos estudos faz o diagnóstico pela clínica e TCAR, espirometria e cintilografia de perfusão com tecnécio. As alterações na TCAR incluem espessamento de parede e a obliteração dos bronquíolos e, com a evolução da doença, podem ser encontradas bronquiectasias, espessamento da parede brônquica, perfusão em mosaico, aprisionamento aéreo, diminuição de volume pulmonar e diminuição do diâmetro de vasos hilares e periféricos.27,59
Não existe tratamento específico para a BO. Oxigenoterapia é fundamental em alguns pacientes, principalmente após alta de UTI por bronquiolite viral aguda (BVA) grave e naqueles pacientes que evoluem com hipoxemia crônica. Medidas de profilaxia de contato com poluentes intra e extradomiciliares, diminuição da exposição ao tabagismo ativo e passivo, vacinação antipneumocócica e contra influenza são importantes etapas para o manejo da BO. No início da doença alguns pacientes podem se beneficiar de corticoterapia sistêmica. Têm sido usados broncodilatadores, antibióticos em exacerbações infecciosas, cirurgia para ressecções de colapsos pulmonares fixos e transplante pulmonar.27
Discinesia ciliar primária (DCP)A DCP é uma DPOCC autossômica recessiva causada por numerosas alterações na estrutura anatômica e funcional dos cílios das vias aéreas e resulta em inflamação e infecção com incidência entre 1:4.000 a 40.000 nascidos vivos. Defeitos de lateralidade de órgãos tórax abdominais ocorrem em cerca de 50% dos pacientes com DCP e a maioria desses tem situs inversus totalis (síndrome de Kartagner).24,63‐66 Deve‐se pensar em DCP em crianças que apresentam: (i) situs inversus totalis ou outras anormalidades de lateralidades de órgãos toraco‐abdominais; (ii) infecções de repetição em vias aéreas superiores (otites, sinusites) e inferiores (pneumonias, abscessos) e doenças crônicas no trato respiratório de etiologia não definida (bronquiectasia, tosse crônica, atelectasia e síndrome do lobo médio); (iii) angústia respiratória neonatal de causa não definida; (iv) diagnóstico de DCP em outros parentes; (v) doenças cardíacas congênitas, principalmente se associadas a heterotaxia e infecções crônicas e de repetição das vias aéreas inferiores e superiores.24,67
As manifestações clínicas e alterações da DCP variam de acordo com a faixa etária:25 no período pré‐natal a ultrassonografia pode revelar ventriculomegalia cerebral fetal leve, heterotaxia e situs inversus totalis (aproximadamente 25% dos indivíduos com situs inversus totalis têm DCP). A prevalência de DCP em pacientes com heterotaxia ainda é desconhecida. No período neonatal 75% dos recém‐nascidos a termo com DCP apresentam desconforto respiratório com necessidade de oxigênio suplementar por dias ou semanas. Alguns apresentam rinorreia contínua, heterotaxia e hidrocefalia. Na infância ocorre tosse crônica produtiva associada à atelectasia e/ou pneumonia recorrente, asma atípica que não responde ao tratamento, bronquiectasia, BNFC, pólipos nasais, rinossinusite crônica, diminuição da audição e otite crônica. Na adolescência e vida adulta chamam atenção bronquiectasias, expectoração muco purulenta crônica, baqueteamento digital, espirometria com padrão ventilatório obstrutivo progressivo ou misto, polipose nasal e halitose, infertilidade em homens (50%) e gravidez tubária em mulheres.
O diagnóstico é baseado na suspeita clínica, nas alterações radiológicas, nos valores dos níveis de óxido nítrico nasal, nos batimentos ciliares por videomicroscopia, nas alterações estruturais dos cílios por microscopia eletrônica e pela detecção mutações. Apenas 50 a 60% dos pacientes portadores de DCP apresentam alguma mutação conhecida.25,68,69 A FC evolui com discinesia ciliar secundária e na DCP é primária. O manejo da doença pulmonar nessas duas enfermidades é praticamente o mesmo.25
Fibrose cística (FC)A FC é uma doença autossômica recessiva causada por mutações no gene CFTR (Cystic Fibrosis Transmembrane Regulator), região 7q31.2, que apresenta mais de duas mil mutações identificadas, divididas em seis classes quanto a produção e função da proteína CFTR. A ausência ou disfunção qualitativa ou quantitativa da CFTR causa alterações fisiopatológicas em vários órgãos. A maior morbimortalidade da FC ocorre pela manifestação do trato respiratório e digestório.70‐73 Hoje em dia sabe‐se que nas mutações de classes I, II e III a doença começa antes dos sintomas, constitui um fator fundamental para intervenções precoces e tratamentos mais agressivos, propicia resultados animadores na diminuição da deterioração do dano e da função pulmonar, com respectivo aumento da sobrevida.70‐73 Disponibilidade de triagem neonatal, teste do suor, triagem de mutações do gene CFTR, medicamentos e possibilidade do uso de corretores, potencializadores e estabilizadores (para algumas mutações) da proteína CFTR são fatos concretos na última década. A consequência é que o aumento da sobrevida desses pacientes está a cada ano maior.73
O dano pulmonar e a diminuição da função pulmonar são progressivos e dependentes da mutação, sexo, polimorfismos, disponibilidade e adesão ao tratamento, início precoce do tratamento, presença de comorbidades e atendimento em centros de referência.74‐76 A fisiopatologia da DPOC na FC pode ser entendida com a sequência de seis eventos (6D): (i) Defeito no gene CFTR; (ii) Disfunção ou ausência da proteína CFTR; (iii) Desidratação do líquido de superfície das vias aéreas; (iv) Defeito de clareamento de bactérias nas vias aéreas; (v) Discinesia ciliar secundária; (vi) Destruição do epitélio das vias aéreas.77
Para o diagnóstico de FC, após a triagem neonatal, devem‐se comprovar alterações no gene e/ou na proteína CFTR. O gene CFTR é estudado pela análise de mutações e polimorfismos. A função e/ou a presença da proteína CFTR podem ser avaliadas nas glândulas sudoríparas (teste do suor, evaporimetria, diferença de potencial e pH), no epitélio nasal, na glândula salivar e no trato digestório.78,79
Diagnosticar ou excluir FC nem sempre é fácil, mesmo após a investigação abrangente, particularmente em adolescentes e adultos com mutações de classes IV, V e VI, que causam formas não clássicas e frequentemente associadas com mutações raras, níveis limítrofes de cloro no suor, início tardio das manifestações clínicas e sintomas atípicos.80
Como a FC afeta muitos órgãos, o seu manejo é complexo. O atendimento necessita de equipes interdisciplinares com vários profissionais de saúde, fisioterapia, exames médicos, visitas frequentes ao hospital e uso de medicamentos diários, repetitivos, por vezes complicados e custosos.81
Pacientes com FC são altamente susceptíveis a infecção pulmonar crônica por PA. A aquisição de PA tem sido muito precoce e tem relação com a deterioração da função pulmonar e pior prognóstico da FC. Portanto, o tratamento intensivo contra PA é crucial no manejo da FC.
Outras bactérias encontradas frequentemente nas vias aéreas dos pacientes com FC e que determinam deterioração do dano e da função pulmonar incluem: S. aureus, H. influenzae, PA, complexo B. cepacia, S. maltophilia e Achromobacter species. Menos frequentemente e com tendência para as fases mais avançadas da doença pulmonar podem ser encontrados Mycobacteria não tuberculosa (MNT), outras bactérias anaeróbicas e fungos.82,83
Antibióticos inalatórios (AI) são fundamentais para o tratamento da infecção pulmonar crônica na FC. O aumento na sobrevida em pacientes com FC nas últimas décadas pode, em parte, ser atribuído ao uso dos AI. Eles têm maior deposição no sítio da infecção e menores riscos de efeitos colaterais sistêmicos do que a terapia parenteral, diminuem as EP, melhoram a qualidade de vida e a espirometria.84,85
Pacientes com FC com infecção pulmonar crônica por PA devem receber terapia anti‐Pseudomonas nebulizada em longo prazo, a não ser se houver contraindicação. Entre os AI, a tobramicina e o colistim estão disponíveis no momento, enquanto o astreonan, o levofloxacin e amicacina lipossomal estarão disponíveis em breve.86 A administração de AI é demorada, é um fardo pesado para os pacientes. Adesão ao tratamento é um desafio significativo.87
O tratamento do primeiro episódio de aquisição, de infecção a infecção crônica e as EP por PA são motivos de debates e controvérsias na literatura.88
Protocolos de erradicação da PA têm mostrado eficácia dos antibióticos no primeiro isolamento; tratamento intensivo com antibióticos intravenosos nas EP e dos AI nos períodos entre as exacerbações.89‐91 É aconselhável à avaliação do dano pulmonar pela TCAR, no máximo a cada dois anos, e avaliação da função pulmonar pela espirometria no mínimo duas vezes por ano.
Para o manejo da doença pulmonar na FC podem ser necessários AI, anti‐inflamatórios, corticoides, mucolíticos e broncodilatadores. Medidas auxiliares mostram benefícios com fisioterapia respiratória, prática de exercícios regulares, evitar a poluição intra e extradomiciliar e o tabagismo ativo e passivo. É fundamental incluir medidas de adesão e a continuidade do tratamento por toda a vida. As visitas ao centro de referência devem ser mensais no primeiro ano e pelo menos quatro vezes por ano até a idade adulta.
A adesão ao manejo da FC varia entre 35 a 75% e é menor na adolescência. Baixa adesão à medicação piora a função pulmonar, aumenta a frequência de EP, causa maior numero de consultas, internações e custos. Portanto, são necessárias intervenções para melhorar a adesão à medicação.81
Muitas associações internacionais têm proposto que o manejo da doença pulmonar na FC seja conduzido por guidelines e diretrizes baseadas em evidências científicas. Dessa maneira, recentes publicações sobre o manejo da DPOC na FC podem ser encontradas e constituem o “estado da arte” para os centros de referências em FC.82,83,91,92
Recentemente avanços no tratamento da FC têm ganhado destaque. Mutações no gene CFTR têm sido amplamente identificadas e a maior prevalência da mutação F508del tem sido destacada. O tratamento para a mutação e/ou classe de mutações específicas tem sido foco nos estudos de novos fármacos. Dois fármacos têm sido usados em estudos considerando a mutação F508del em homozigose e resultados com a associação do ivacaftor (aumenta a abertura do canal de cloro – potencializador) e do lumacafor (aumenta o número de proteína no epitélio – potencializador) apresentam maior aumento do transporte do cloro, se comparados com os valores individualizados das drogas.93
Displasia broncopulmonar (DBP)A DBP é uma DPOCC secundária e associada à prematuridade e aos FR a ela relacionados. Baixo peso ao nascimento, alta fração inspirada de oxigênio, persistência de canal arterial, altos valores de volume hídrico intravenoso, ventilação mecânica com pressões elevadas, susceptibilidade genética e infecções no período neonatal contribuem para a prevalência e gravidade da DBP. A DBP acomete aproximadamente 30% dos recém‐nascidos com peso de nascimento menor do que 1.500 gramas.94,95
Numerosos estudos mostram que grande parte dos recém‐nascidos que desenvolvem DBP cursam com alterações na função pulmonar ao longo da vida.9,96‐101 Como toda DPOCC, a DBP não tem um tratamento específico. Dentro dos avanços para diminuir a mortalidade no período neonatal, nas últimas décadas, seguramente três fatores têm se mostrado eficazes: (i) administração de corticoides para gestantes com gravidez de alto risco; (ii) uso de surfactante para recém‐nascidos prematuros; (iii) estratégias de ventilação menos agressivas.102,103
Também têm sido usados diuréticos (furosemida); broncodilatadores; corticosteroides sistêmicos e CI; vitamina A; metilxantinas (pentoxifylline, cafeína); vasodilatadores pulmonares (sildenafil, óxido nítrico inalado); administração tardia de surfactante; antioxidantes (superóxido dismutase) com diferentes graus de eficácia no manejo da fase aguda e/ou crônica da DBP. Porém, existem evidências discretas das ações benéficas da maioria desses agentes quando usados em curto ou longo prazo no manejo da DBP.102,103
A DBP é associada com elevada incidência de hipertensão arterial pulmonar (HAP). O tratamento com sildenafil tem sido associado com melhoria significativa nos marcadores ecocardiográficos de HAP e redução na necessidade de oxigênio. A medicação é bem tolerada.104
Bronquiectasias relacionadas a outras enfermidades que não a FC (BNFC)Bronquiectasia é uma alteração que acompanha muitas DPOCC. Pode estar associada e complicar a asma, DCP, FC, BO e BNFC e ser consequente ao sarampo, coqueluche, imunodeficiências, aspergilose broncopulmonar alérgica, doença inflamatória do intestino, artrite reumatoide, inalação de corpo estranho, DCP, BO, malformação no trato respiratório (exemplo: fistula traqueoesofágica, malformação adenomatoide cística) e ser resultante de agravos inflamatórios e infecciosos às vias aéreas. A BNFC engloba numerosas etiologias e graus de gravidade e em muitos pacientes não se consegue definir uma causa óbvia.105,106
A doença pulmonar na BNFC é muito semelhante à FC, BO e DCP. O desafio frente a uma criança com BNFC é a busca do diagnóstico. O manejo é muito parecido com a maioria das DPOCC e deve ser pensado caso a caso com o objetivo o conforto do paciente e a resposta clínica.107
Embora alguns estudos duplos cegos randomizados e controlados apresentem que o uso prolongado de macrolídeos, em pacientes com BNFC, melhora a qualidade de vida e diminui as taxas de EP, o papel dos macrolídeos em BNFC permanece pouco claro e não pode ser recomendado de rotina. Até muito recentemente, esses medicamentos eram investigados em estudos pequenos, de curta duração e que não avaliaram resultados clínicos relevantes, como EP e qualidade de vida.
Antibióticos orais em longo prazo não devem ser prescritos rotineiramente. Macrolídeos (ou outros antibióticos) podem ser considerados durante um período limitado, de 12 a 24 meses, principalmente naqueles pacientes com exacerbações frequentes.4,108,109
Bronquite plástica (BP)A BP é uma DPOCC rara de prevalência e etiologia desconhecida, com formação de moldes brônquicos de aspecto gelatinoso ou sólido das grandes vias aéreas e que varia na sua composição com mucinas, fibrina, DNA, eosinófilos, dependendo da etiologia da BP. As doenças que mais se associam com BPO são cardiopatias congênitas e asma. Também tem sido descrito em infecção por vírus influenza, H1N1, doenças linfáticas, aspergilose broncopulmonar alérgica e doença falciforme.109 Embora broncodilatadores, corticoides, antibióticos, mucolíticos, fisioterapia, terapia antifibrinolítica com heparina e uroquinase tenham sido usados, a broncoscopia única ou de repetição é fundamental para o diagnóstico e o tratamento.
Considerações finaisNo manejo das DPOC em crianças são fundamentais as ações do pediatra, que delas deverá suspeitar quando da presença de sinais e sintomas, para o diagnóstico precoce e correto, conhecer os fatores de risco e as comorbidades associadas, avaliar a adesão ao tratamento, o uso correto dos medicamentos prescritos e seus efeitos colaterais baseado em protocolos de manejos bem definidos e de preferência incluídos em guidelines específicos. Os benefícios do manejo devem ser avaliados pela diminuição das exacerbações pulmonares agudas, aumento da qualidade de vida e redução da evolução da perda da função (espirometria, medida da saturação transcutânea de oxigênio, lung clearence index) e do dano pulmonar (TCAR a cada dois anos se necessário). Por isso, a avaliação sequencial, da função e do dano pulmonar deve ser padronizada e contínua, por toda a vida. Para a maioria das DPOC em crianças o acompanhamento em centros de referência especializados, por equipes interdisciplinares, conduz a melhores desfechos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Professor Dr. Paulo Augusto Moreira Camargos pelo incentivo, pelas sugestões e análise do manuscrito. Ao Professor Dr. Fernando Augusto de Lima Marson pelas excelentes contribuições gráficas, pela leitura do texto, pelas sugestões e críticas. À equipe de pneumologia pediátrica da Universidade Estadual de Campinas (Unicamp), pela ajuda constante no manejo das DPOCC há muitos anos: Adyleia Aparecida Dalbo Contrera Toro, Maria Angela Gonçalves de Oliveira Ribeiro, Andressa Peixoto, Milena Baptistela Grotta, Emilia Gonçalves, Maria Cristina Simões Ferreira.
Como citar este artigo: Ribeiro JD, Fischer GB. Chronic obstructive pulmonary diseases in children. J Pediatr (Rio J). 2015;91:S11–25.