To compare the short‐term efficacy of surfactant administration by laryngeal mask airway versus endotracheal tube.
MethodsPreterm infants (28–35 weeks of gestational age), weighing 1kg or more, with respiratory distress syndrome, requiring nasal continuous positive airway pressure, with increased respiratory effort and/or fraction of inspired oxygen (FiO2)≥0.40 to maintain oxygen saturation 91–95%, were randomized to receive surfactant by LMA following nCPAP or by ETT following mechanical ventilation (MV). The primary outcome was a clinical response defined as FiO2≤0.30 three hours after surfactant. Secondary outcomes for LMA group were: need of surfactant retreatment during the first 24h, MV requirement, and presence of surfactant in gastric content.
ResultsForty‐eight patients were randomized; 26 in the LMA group and 22 in the ETT group. Six of 26 patients (23%) in the LMA group and five of 22 patients (22.7%) in the ETT group did not meet the primary outcome (p=0.977). Fourteen (53.8%) of the LMA patients were not intubated nor ventilated; 12 (46.1%) were ventilated: for surfactant failure (23%), for nCPAP failure (11.5%), and for late complications (11.5%). Groups were similar regarding prenatal status, birth conditions, and adverse events. No significant gastric content was found in 61.5% of the LMA patients. Oxygen and second dose surfactant requirements, arterial/alveolar ratio, and morbidities were similar among groups.
ConclusionsSurfactant administration by LMA showed short‐term efficacy, with similar supplementary oxygen need compared to surfactant by ETT, and lower MV requirement. Further studies with larger sample size are necessary to confirm these results.
Comparar a eficácia de curto prazo da administração de surfactante por máscara laríngea em comparação com o tubo endotraqueal.
MétodosNeonatos prematuros (28‐35 semanas de idade gestacional), com 1kg ou mais, com síndrome do desconforto respiratório, que necessitavam de pressão positiva nasal contínua nas vias aéreas, com aumento do esforço respiratório e/ou fração de oxigênio inspirado (FiO2)≥0,40 para manter a saturação de oxigênio 91‐95%, foram randomizados para receber surfactante por ML seguido por nCPAP ou por TE seguido por ventilação mecânica (VM). O resultado clínico primário foi definido como FiO2 ≤ 0,30 três horas após o surfactante. Os resultados secundários do grupo de ML foram: necessidade de segunda dose de surfactante nas primeiras 24 horas, necessidade de VM e presença de surfactante no conteúdo gástrico.
ResultadosForam randomizados 48 pacientes; 26 no grupo de ML e 22 no grupo de TE. Seis dentre os 26 pacientes (23%) do grupo de ML e cinco dentre 22 pacientes (22,7%) do grupo de TE não apresentaram o resultado primário (p=0,977); 14 (53,8%) dos pacientes do grupo de ML não foram intubados nem ventilados; 12 (46,1%) foram submetidos a VM: por falha do surfactante (23%), por falha da nCPAP (11,5%) e por complicações tardias (11,5%). Os grupos foram semelhantes em relação às condições pré‐natais e de nascimento e a ocorrência de eventos adversos. Não foi encontrado conteúdo gástrico significativo em 61,5% dos pacientes do grupo de ML. As necessidades de oxigênio e da segunda dose de surfactante, o índice arterial/alveolar e as morbidades foram semelhantes entre os grupos.
ConclusõesA administração de surfactante por ML mostrou eficácia de curto prazo com necessidade complementar de oxigênio semelhante ao surfactante por TE e menor necessidade de VM. Serão necessários estudos adicionais com tamanho da amostra maior para confirmar esses resultados.
O tratamento com surfactante na prática de neonatologia reduziu substancialmente a mortalidade e melhorou o prognóstico da síndrome do desconforto respiratório (SDR).1,2 Tradicionalmente, o surfactante é fornecido por tubo endotraqueal (TE), contudo a lesão pulmonar sobreposta da ventilação com pressão positiva (VPP) por máscara facial ou por TE seguida da ventilação mecânica (VM) pode prejudicar a função do surfactante, causar uma resposta inflamatória no pulmão e levar a displasia broncopulmonar (DBP).1,3 Na era do suporte respiratório não invasivo, os neonatologistas começaram a buscar novas técnicas que podem possibilitar a pressão positiva nasal contínua nas vias aéreas (nCPAP) e surfactante ao mesmo tempo, sem TE e MV.4–6
A máscara laríngea (ML) é um dispositivo supraglótico destinado a manter uma vedação ao redor da entrada laríngea para VPP em situações de difícil manejo das vias aéreas e prática anestésica.7–9 Para recém‐nascidos, a ML mostrou seu potencial em várias circunstâncias, principalmente na ressuscitação neonatal e na administração de medicamentos.6–10 Poucos estudos observacionais e um pequeno ensaio controlado randomizado (ECR) relataram a administração de surfactante por meio de ML.3,6,10 Até o momento, não há ECR prospectivo publicado que compare a administração de surfactante por ML em comparação a TE e VM.
O objetivo deste estudo foi avaliar se a administração de surfactante por meio de ML seguida de nCPAP tem a mesma eficácia clínica de curto prazo no tratamento da SDR do que o tratamento convencional por TE seguido de VM.
MétodosPacientes e projeto do estudoEste ECR prospectivo em um único centro (CAAE 00160287000‐10 e NCT01173237) foi conduzido na Unidade de Terapia Intensiva Neonatal (UTIN) da Maternidade Unimed‐BH, em Belo Horizonte, Brasil, entre julho de 2011 e maio de 2014. O estudo foi aprovado pelo Comitê de Ética da instituição e foi obtido o consentimento informado dos responsáveis pelo paciente. Os neonatos prematuros foram avaliados para elegibilidade e inscritos para randomização caso tivessem as seguintes características: idade gestacional (IG) no nascimento entre 28‐35 semanas e peso ao nascer ≥ 1kg; < 8 horas de idade; necessidade de nCPAP, pontuação Silverman‐Anderson (SA) superior a quatro e/ou frequência respiratória > 60 bpm e/ou fração de oxigênio inspirado (FiO2) ≥ 0,40 para manter a saturação de oxigênio (SpO2) 91‐95%; diagnóstico clínico de SDR; raios X de tórax normal para SDR.11 Os critérios de exclusão foram: IG > 35 semanas, anomalias congênitas importantes; uso de TE anteriormente; índice de Apgar < 3 aos 5 minutos; corioamnionite; febre e/ou ruptura de membranas > 18 horas.
Randomização e cegagemCom uma tabela de números aleatórios, 60 pacientes foram randomizados para um de dois tipos de tratamento antes da coleta de dados. Os neonatologistas atendentes identificaram os pacientes elegíveis de acordo com os critérios de inclusão e exclusão após avaliação clínica, a caracterização da veia umbilical, raios X de tórax, gasometria arterial e atribuição de tratamento com surfactante. Após a elegibilidade e inscrição, somente o mesmo investigador verificou a randomização sequencial, fez a inserção da ML ou do TE, administrou o surfactante e acompanhou todos os pacientes pelas próximas seis horas. Os responsáveis pela análise de dados não foram cegados para o grupo de tratamento.
ProcedimentosAs condições pré‐natal, perinatal pós‐natal dos pacientes e os achados laboratoriais (sinais vitais, pontuação SA, gasometria arterial, escala de dor neonatal [NIPS]12 e taxa arterial/Alveolar [a/A]) foram registrados antes dos procedimentos. Todos os pacientes receberam a mesma preparação de surfactante (poractant‐α, 120mg/1,5mL) e a mesma dose (200mg/kg), por instilação em bolus nas primeiras oito horas de vida. Os achados de raios X de tórax foram avaliados antes e seis horas após o surfactante.
Os pacientes randomizados para o grupo de TE oral receberam pré‐medicação (remifentanil e midazolam em bolus) e a pontuação de Viby‐Mogensen foi usada para avaliar a qualidade da intubação.13 A colocação do tubo foi verificada por raios X de tórax antes da instilação do surfactante, seguida da VM convencional. Os pacientes foram extubados o mais rapidamente possível (pressão inspiratória inferior a 20 cmH2O, frequência respiratória de 30 ou menos e FiO2 < 0,40).
Os pacientes randomizados para o grupo de ML apresentaram nCPAP de 5‐6 cmH2O e receberam surfactante por meio de ML ProSealTM (Teleflex®, NC,EUA) tamanho único (PLMA, Intavent Orthofix, Maidenhead, Inglaterra), inserido com a técnica comum.7,8 Os conteúdos gástricos foram aspirados e o tubo orogástrico foi removido antes da inserção da ML. Lidocaína gel foi usada ao redor do cuff da ML para lubrificar e prevenir desconforto. Após a inserção, a extremidade proximal do dispositivo de vias aéreas foi conectada a um balão autoinflável para VPP, por um ou dois minutos, tempo suficiente para atingir SpO2 > 88% e frequência cardíaca (FC) > 100 batimentos/min. Em seguida, um fino cateter de silicone tamanho 6‐Francês (encurtado anteriormente para ter aproximadamente 1cm a mais do que o dispositivo de via aérea) foi introduzido por meio de um tubo de ML como um forma de condução para administração do surfactante em dois ou quatro alíquotas, de acordo com a tolerância do paciente e o refluxo do surfactante, seguido de VPP por ML durante um ou dois minutos para obter melhoria da SpO2 e da FC.14 Quando uma dose inteira do surfactante foi administrada, a ML foi removida e a nCPAP foi novamente obtida. Um fino tubo orogástrico de silicone foi substituído após a remoção da ML para medir os conteúdos gástricos. Considerou‐se que qualquer volume gástrico aspirado era surfactante, pois os pacientes não haviam se alimentado antes do procedimento.
Foram registrados eventos adversos cardiorrespiratórios. Logo após os procedimentos, a NIPS foi registrada. Da mesma forma, os sinais cardiorrespiratórios, a pressão nCPAP ou as configurações do ventilador foram monitoradas e registradas logo após os procedimentos e aos cinco, 20, 35 e 60 minutos após o surfactante e, então, a cada 30 minutos até seis horas após isso. A gasometria arterial e a taxa a/A foram obtidas três horas após o surfactante. O suporte respiratório e a FiO2 foram progressivamente reduzidas no grupo de TE nas primeiras seis horas, com base na FC, pressão arterial, esforço respiratório, SpO2 e gasometria arterial. A pressão CPAP dos pacientes de ML foi mantida a 5‐6 cmH2O e a FiO2 foi reduzida de acordo com os mesmos parâmetros cardiorrespiratórios. Após as primeiras seis horas de estudo, os neonatologistas atendentes tomaram decisões para ambos os grupos com relação à necessidade de novo tratamento e/ou VM. Uma segunda dose de surfactante foi administrada de seis a 33 horas após a primeira dose caso qualquer neonato apresentasse: aumento do esforço respiratório, instabilidade hemodinâmica, apneias frequentes (≥ duas/hora), pH < 7,20, pressão arterial parcial de dióxido de carbono (PaCO2) > 65mmHg, pressão arterial parcial de oxigênio (PaO2) < 50mmHg, SpO2 < 91%, FiO2 ≥ 0,50.11 Os pacientes no grupo de ML receberam uma segunda dose por TE após a VM.
ResultadosA FiO2 ≤ 0,30 três horas após o surfactante foi nosso resultado primário, pois a redução da necessidade de oxigênio resulta da resposta do surfactante conforme a troca de gases melhora. Os resultados também tiveram como base os protocolos de terapia atuais e os critérios de baixo limiar do fabricante para novo tratamento, que indicam uma administração de surfactante adicional quando a necessidade de FiO2 for > 0,30 após a primeira dose.15,16 O tamanho da amostra foi calculado como 30 pacientes por grupo para obter um poder de 85% na detecção de diferenças significativas (alfa = 0,05) na FiO2 entre os grupos.17 Adicionalmente, foi feita uma análise intermediária quando 48 pacientes foram inscritos e randomizados. Essa análise mostrou que ambos os grupos eram equivalentes. Portanto, devido a motivos éticos, optamos por interromper o estudo, já que nosso resultado primário foi atingido com 26 pacientes no grupo de ML. De fato, uma análise post‐hoc mostrou que 20 pacientes em cada grupo foram o suficiente para detectar uma diferença mínima da FiO2 entre os grupos tão pequena quanto 8% (acima ou mesmo abaixo; bicaudal) para um erro beta de 20% e um erro alfa de 5%.17 Os resultados secundários do grupo de ML foram: necessidade de segunda dose de surfactante em até 24 horas de vida, necessidade de VM a qualquer momento e volume gástrico residual após administração do surfactante > 1,5mL. Esse ponto de corte para o volume gástrico foi definido pois esse volume foi mais do que a metade da dose em um paciente de 1kg. Para ambos os grupos, os outros resultados secundários foram: número de doses de surfactante, eventos cardiorrespiratórios durantes os procedimentos, mortalidade, duração do oxigênio, nCPAP, VM e internação, a incidência de hemorragia intraventricular (IVH), pneumotórax, displasia broncopulmonar (DBP), retinopatia da prematuridade (ROP) e sepse precoce e/ou de início tardio.
A falha do tratamento com surfactante por ML foi diagnosticada quando uma segunda dose foi indicada e administrada por TE a qualquer momento. Nesse caso, como pouco surfactante deve ter sido enviado para os pulmões pela ML, o modelo do estudo estabeleceu, para a segurança dos pacientes e maior chance de resposta, que a segunda dose fosse administrada por TE. A falha da CPAP foi diagnosticada em pacientes do grupo de ML tratados para a SDR quando não precisaram de novo tratamento com surfactante, de acordo com os achados radiológicos e da gasometria, porém VM foi indicada devido à piora respiratória.
Análise estatísticaOs dados foram armazenados em uma planilha do Microsoft Excel (Microsoft®, WA, EUA) e analisados com Minitab, versão 16 (Minitab®, PA, EUA). Para variáveis categóricas, foi usado o teste qui‐quadrado ou teste exato de Fisher. Para variáveis quantitativas, o teste de Ryan‐Joiner foi usado para verificar a normalidade dos dados, seguido do teste paramétrico t de Student ou não paramétrico de Mann‐Whitney.17 Em todos os testes estatísticos, foi estabelecido o nível de relevância a p (p < 0,05).
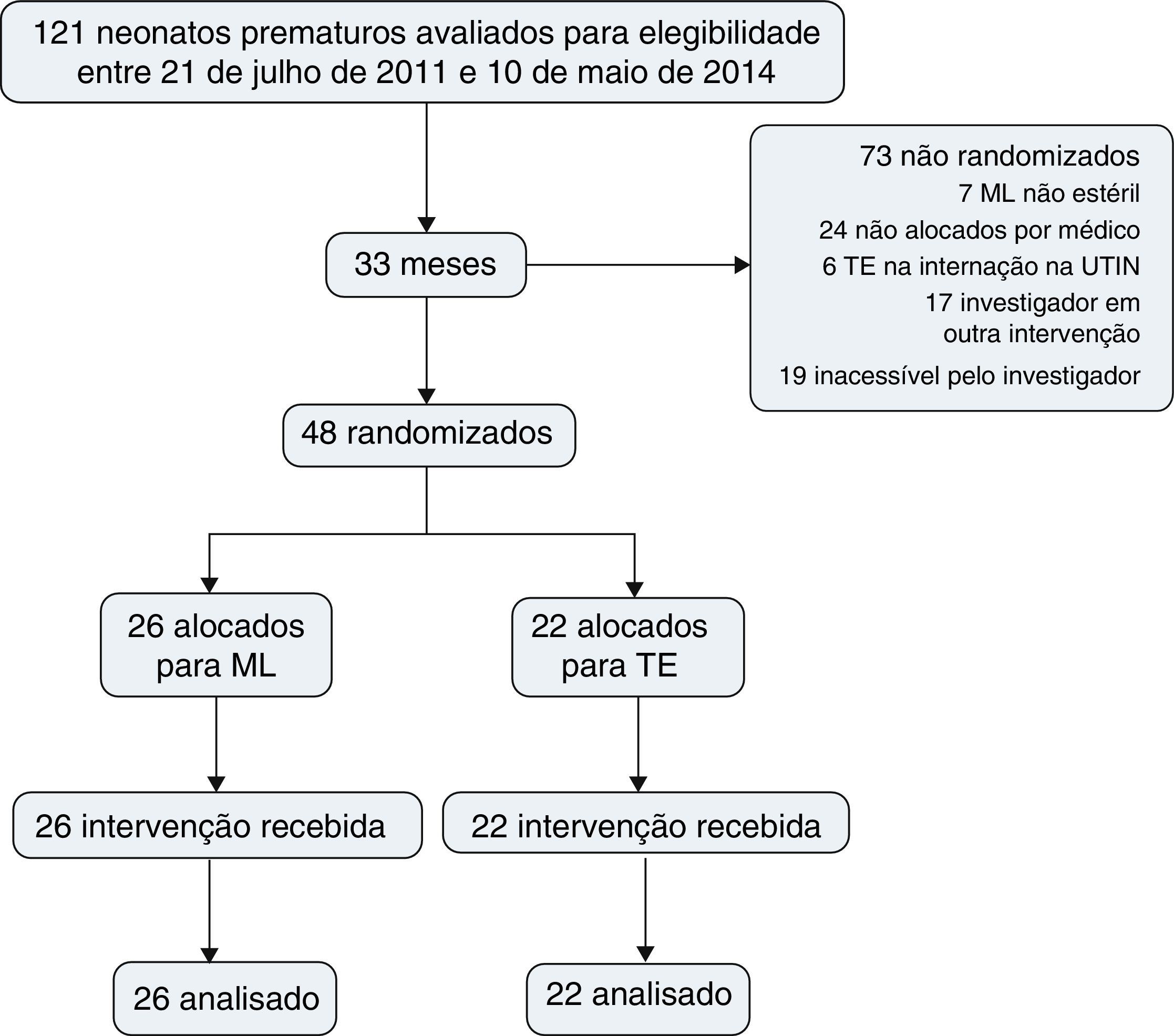
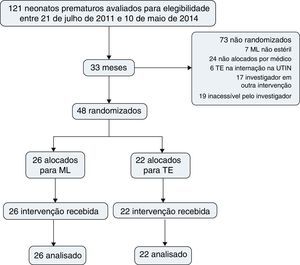
ResultadosDurante o período do estudo, 121 neonatos prematuros nasceram e foram avaliados para elegibilidade. O tratamento com surfactante da SDR foi indicado para todos esses pacientes na nCPAP; 48 pacientes foram randomizados, 26 para inserção de ML e nCPAP e 22 para TE e VM; 73 não foram randomizados (fig. 1).
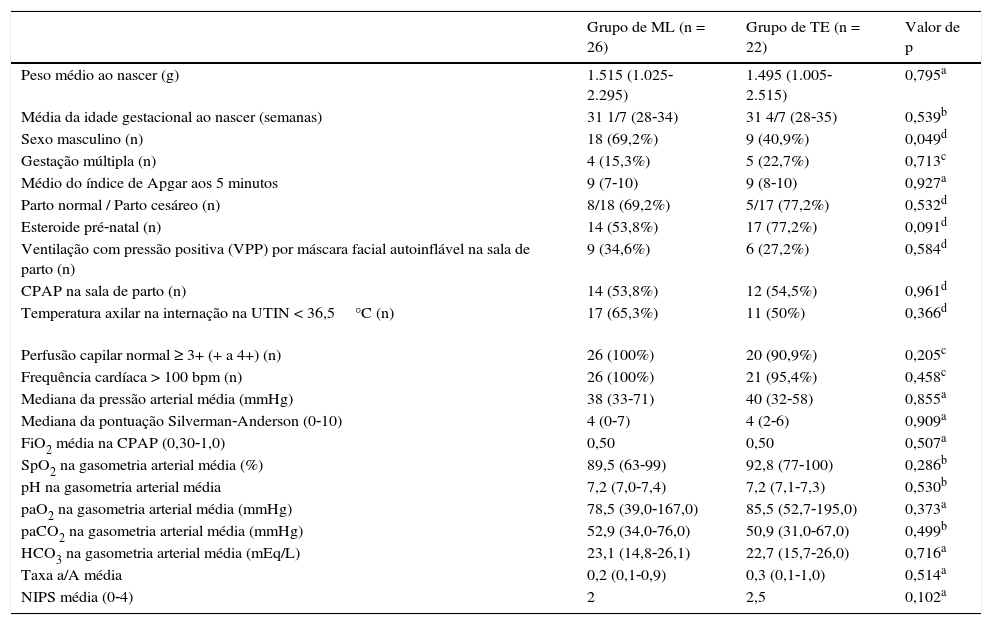
A tabela 1 apresenta as características demográficas e clínicas no nascimento, dor, dados sobre suporte cardiovascular e respiratório antes da inserção da ML ou TE, que não foram significativamente diferentes.
Características demográficas e clínicas no nascimento dos pacientes dos grupos de ML e TE. Dor, dados sobre suporte cardiovascular e respiratório antes da inserção da ML ou da intubação endotraqueal
| Grupo de ML (n = 26) | Grupo de TE (n = 22) | Valor de p | |
|---|---|---|---|
| Peso médio ao nascer (g) | 1.515 (1.025‐2.295) | 1.495 (1.005‐2.515) | 0,795a |
| Média da idade gestacional ao nascer (semanas) | 31 1/7 (28‐34) | 31 4/7 (28‐35) | 0,539b |
| Sexo masculino (n) | 18 (69,2%) | 9 (40,9%) | 0,049d |
| Gestação múltipla (n) | 4 (15,3%) | 5 (22,7%) | 0,713c |
| Médio do índice de Apgar aos 5 minutos | 9 (7‐10) | 9 (8‐10) | 0,927a |
| Parto normal / Parto cesáreo (n) | 8/18 (69,2%) | 5/17 (77,2%) | 0,532d |
| Esteroide pré‐natal (n) | 14 (53,8%) | 17 (77,2%) | 0,091d |
| Ventilação com pressão positiva (VPP) por máscara facial autoinflável na sala de parto (n) | 9 (34,6%) | 6 (27,2%) | 0,584d |
| CPAP na sala de parto (n) | 14 (53,8%) | 12 (54,5%) | 0,961d |
| Temperatura axilar na internação na UTIN < 36,5°C (n) | 17 (65,3%) | 11 (50%) | 0,366d |
| Perfusão capilar normal ≥ 3+ (+ a 4+) (n) | 26 (100%) | 20 (90,9%) | 0,205c |
| Frequência cardíaca > 100 bpm (n) | 26 (100%) | 21 (95,4%) | 0,458c |
| Mediana da pressão arterial média (mmHg) | 38 (33‐71) | 40 (32‐58) | 0,855a |
| Mediana da pontuação Silverman‐Anderson (0‐10) | 4 (0‐7) | 4 (2‐6) | 0,909a |
| FiO2 média na CPAP (0,30‐1,0) | 0,50 | 0,50 | 0,507a |
| SpO2 na gasometria arterial média (%) | 89,5 (63‐99) | 92,8 (77‐100) | 0,286b |
| pH na gasometria arterial média | 7,2 (7,0‐7,4) | 7,2 (7,1‐7,3) | 0,530b |
| paO2 na gasometria arterial média (mmHg) | 78,5 (39,0‐167,0) | 85,5 (52,7‐195,0) | 0,373a |
| paCO2 na gasometria arterial média (mmHg) | 52,9 (34,0‐76,0) | 50,9 (31,0‐67,0) | 0,499b |
| HCO3 na gasometria arterial média (mEq/L) | 23,1 (14,8‐26,1) | 22,7 (15,7‐26,0) | 0,716a |
| Taxa a/A média | 0,2 (0,1‐0,9) | 0,3 (0,1‐1,0) | 0,514a |
| NIPS média (0‐4) | 2 | 2,5 | 0,102a |
bpm, batimentos por minuto; CPAP, pressão positiva contínua nas vias aéreas; FiO2, fração de oxigênio inspirado; HCO3, bicarbonato; ML, máscara laríngea; NIPS, Escala de Dor Neonatal; paCO2, pressão arterial parcial de dióxido de carbono; paO2, pressão arterial parcial de oxigênio; SpO2, saturação de oxigênio; taxa a/A, taxa arterial/Alveolar; TE, tubo endotraqueal; UTIN, Unidade de Terapia Intensiva Neonatal.
Logo após a remoção da ML e do laringoscópio, a avaliação da NIPS mostrou uma pontuação significativamente menor para os pacientes intubados que haviam acabado de receber pré‐medicação (p = 0,0001). Não houve evento adverso grave associado à inserção do TE ou da ML e à administração do surfactante. Durante os processos, os pacientes de ambos os grupos apresentaram eventos cardiovasculares transitórios iguais (FC < 100 batimentos/minuto e/ou SpO2 < 80%) tratados por meio de VPP com recuperação imediata (p = 0,594).
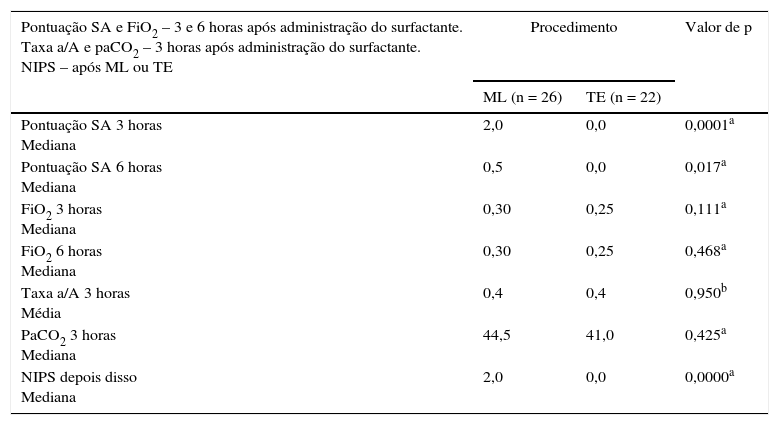
O esforço respiratório medido pela pontuação SA três e seis horas após o surfactante foi significativamente maior nos pacientes do grupo de ML, porém a taxa a/A, FiO2 em nCPAP ou VM e os valores da PaCO2 foram equivalentes em ambos os grupos (tabela 2).
Pontuação Silverman‐Anderson e FiO2 três e seis horas após administração de surfactante em pacientes dos grupos de ML e TE taxa a/A e paCO2 três horas após a administração de surfactante em ambos os grupos; NIPS após inserção da ML e intubação endotraqueal
| Pontuação SA e FiO2 – 3 e 6 horas após administração do surfactante. Taxa a/A e paCO2 – 3 horas após administração do surfactante. NIPS – após ML ou TE | Procedimento | Valor de p | |
|---|---|---|---|
| ML (n = 26) | TE (n = 22) | ||
| Pontuação SA 3 horas Mediana | 2,0 | 0,0 | 0,0001a |
| Pontuação SA 6 horas Mediana | 0,5 | 0,0 | 0,017a |
| FiO2 3 horas Mediana | 0,30 | 0,25 | 0,111a |
| FiO2 6 horas Mediana | 0,30 | 0,25 | 0,468a |
| Taxa a/A 3 horas Média | 0,4 | 0,4 | 0,950b |
| PaCO2 3 horas Mediana | 44,5 | 41,0 | 0,425a |
| NIPS depois disso Mediana | 2,0 | 0,0 | 0,0000a |
FiO2, fração de oxigênio inspirado; ML, máscara laríngea; NIPS, escala de dor neonatal; PaCO2, pressão arterial parcial de dióxido de carbono; pontuação AS, pontuação Silverman‐Anderson; taxa a/A, taxa arterial/Alveolar; TE, tubo endotraqueal.
Dos 48 pacientes, 11 (22,0%) não apresentaram o resultado primário: a FiO2 foi > 0,30 três horas após o surfactante; seis (23,0%) no grupo de ML em comparação com cinco (22,7%) no grupo de TE. Dez dos 48 pacientes (20,8%) receberam uma segunda dose de surfactante: seis (23%) tratados anteriormente por ML e quatro (18,1%) por TE (tabela 3). Quatro pacientes no grupo de ML receberam uma segunda dose de surfactante no primeiro dia de vida, seis a 12 horas após a primeira, dois receberam novo tratamento durante o segundo dia de vida, pois foram intubados posteriormente, devido ao aumento no esforço respiratório.
Resultado primário e número de doses de surfactante em pacientes prematuros diagnosticados com SDR dos grupos de ML e TE
| Variável | Procedimento | Valor de p | |
|---|---|---|---|
| ML (n = 26) | TE (n = 22) | ||
| FiO2 ≤ 0,30 (Sim/Não) | 20 / 6 (IC 0,11‐0,42) | 17 / 5 (IC 0,10‐0,43) | 0,977a |
| Número do tratamento com surfactante (um/dois) | 20 / 6 | 18 / 4 | 0,735b |
FiO2, fração de oxigênio inspirado; IC, intervalo de confiança; ML, máscara laríngea; SDR: síndrome do desconforto respiratório agudo; TE, tubo endotraqueal.
Com relação aos seis pacientes no grupo de ML que não apresentaram o resultado primário, três receberam novo tratamento até 12 horas de idade, apesar de, devido ao esforço respiratório progressivo sem novo tratamento, ter sido feita intubação em dois deles. Um paciente nunca foi intubado nem submetido a tubulação e continuou na nCPAP.
Dentre 20 pacientes no grupo de ML que apresentaram o resultado primário, sete (35%) foram intubados depois disso: três para novo tratamento (um antes e dois após 24 horas de vida); os quatro restantes foram intubados devido ao esforço respiratório ou apneia e sepse após 24 horas.
Em geral, 12 (46,1%) dos pacientes no grupo de ML foram intubados e submetidos a ventilação mecanicamente, porém apenas seis pacientes (23%) apresentaram falha no tratamento, necessitaram de outra dose de surfactante. A falha na CPAP foi caracterizada em três pacientes (11,5%) que necessitaram VM sem novo tratamento; outros três pacientes (11,5%) foram intubados devido a complicações posteriores (derrame pleural e sepse). Além disso, 14 pacientes no grupo de ML (53,8%) nunca foram intubados ou submetidos a ventilação, independentemente do peso ao nascer.
O conteúdo gástrico residual foi medido em 23 dos 26 pacientes do grupo de ML e foram verificados conteúdos gástricos > 1,5mL em quatro. Apenas um paciente com conteúdo gástrico de 3mL necessitou de TE.
A duração da VM foi significativamente maior nos pacientes do grupo de ML que foram intubados, em comparação com o grupo de TE (p = 0,043). Apenas um paciente do grupo de ML (3,8%) apresentou grau III de hemorragia intraventricular (IVH) e pneumotórax posterior. Em ambos os grupos, oito pacientes apresentaram grau I de IVH e 11 apresentaram grau I de ROP. Dois pacientes do grupo de TE morreram (4,1%) de sepse. Não houve diferença entre os grupos com relação à duração do oxigênio complementar e internação, mortalidade, a incidência de displasia broncopulmonar (DBP) e sepse precoce ou tardia.
DiscussãoDesde 1994, tem‐se pesquisado uma abordagem mais suave à VM no tratamento da SDR. Inicialmente, foi introduzida a estratégia Insure (Intubação‐Surfactante‐Extubação), porém ela exige laringoscopia, TE e VPP.18 Vários ensaios clínicos demonstraram que a Insure não reduziu as taxas de mortalidade ou DBP e não foi superior à nCPAP precoce.4 Além disso, a experiência de ser entubado não é agradável e é dolorosa, os efeitos adversos da laringoscopia e do TE incluem laringoespasmo, broncoespasmo, hipóxia, bradicardia, hipertensão pulmonar e sistêmica, aumento da pressão intracraniana e aumento do risco de IVH. O uso de pré‐medicação pode atenuar esses efeitos, porém pode causar depressão respiratória e atraso na extubação.18–21 Em 2010, a Academia Americana de Pediatria recomendou que a pré‐medicação fosse usada para todas as intubações em neonatos, exceto durante a ressuscitação.21
Em 2004, Kattwinkel et al. descreveram um método de instilação de surfactante na nasofaringe logo após o nascimento. Contudo, nenhum ECR mostrou sua eficácia.22 Göpel et al. e Kanmaz et al. demonstraram a eficácia do uso de surfactantes na respiração espontânea de neonatos prematuros por meio de um cateter fino.2,23,24 Pode ser uma opção para o Insure, porém o método ainda exige laringoscopia, normalmente sem anestesia.1 Um pequeno ECR por Attridge et al. em 2013 mostrou uma redução abrupta nas exigências de oxigênio complementar após surfactante por meio de ML, em comparação com o grupo de controle na nCPAP sem surfactante.3 Recentemente, Pinheiro et al., em um ensaio não cego, compararam (com uma amostra semelhante à nossa) um tratamento com surfactante não tão precoce nem tão tardio (quatro a 48 horas de vida) por ML após atropina à estratégia Insure após atropina e morfina. Eles encontraram uma taxa substancialmente maior de falha precoce (até uma hora de tratamento) para evitar ventilação mecânica no grupo de Insure. Isso sugere que a depressão respiratória foi responsável pela superioridade da estratégia de ML. A participação foi encerrada, pois havia importantes diferenças entre os grupos.25
Nosso estudo comparou um tratamento menos invasivo com surfactante para SDR (primeiras oito horas) por ML ao tratamento convencional. Mostramos que o surfactante por ML apresentou a mesma eficácia clínica de curto prazo do tratamento por TE, pois seguido da necessidade de oxigênio complementar semelhante, e menor necessidade de VM. Buscávamos um método eficiente, seguro e menos invasivo para o tratamento da SDR que evitasse pré‐medicação, laringoscopia, TE e VM. Devido aos efeitos adversos da laringoscopia e TE, os autores não compararam a ML com a Insure. Comparamos um novo método menos invasivo de administração de surfactante com o método invasivo mundial validado e ético de tratamento da SDR.
Como não foi possível cegar os procedimentos para evitar o viés metodológico da randomização, apenas um investigador teve acesso à randomização sequencial após a inscrição. Para impedir viés de diferentes habilidades individuais e para padronizar as técnicas, o mesmo investigador foi o único responsável pela inserção da ML e por todos os procedimentos e coleta de dados durante as primeiras seis horas após o surfactante. A perda observada de 60,3% dos pacientes elegíveis foi atribuída à resistência inicial ou má informação da equipe atendente sobre a metodologia, que dependeu apenas da disponibilidade de um investigador. Nosso tamanho da amostra seria maior, principalmente caso o modelo do estudo tivesse possibilitado que os neonatologistas atendentes também fossem responsáveis pelos procedimentos e pelas intervenções.
A inserção da ML pareceu fácil e segura, conforme descrita anteriormente. Além disso, Attridge et al. e Trevisanuto não encontraram eventos adversos graves associados à administração de surfactante por ML.3,7 Medicamentos sedativos e analgésicos também não foram necessários para a inserção da ML em estudos observacionais feitos por Trevisanuto et al. e Brimacombe ou no ensaio de Attrigde.3,6,10 Apesar de terem ocorrido certa bradicardia e dessaturação transitórias durante a inserção da ML e/ou da instilação do surfactante, consideramos os sintomas semelhantes àqueles frequentemente encontrados no tratamento por TE, como os de Attridge et al.3,7,26 Pinheiro et al. também não encontraram efeitos adversos relacionados à inserção da ML, porém usaram um agente vagolítico antes do procedimento.25
Em nosso estudo, a maior pontuação SA três e seis horas após o surfactante por ML sugeriu resposta clínica mais lenta, o que pode ser devido às menores concentrações nos pulmões. Contudo, a redução do esforço respiratório encontrada no grupo de controle também pode ser devida a um efeito residual da pré‐medicação.
No ensaio de Coin, > 50% dos neonatos prematuros não passaram no teste de CPAP nos três primeiros dias de vida. Nos ensaios clínicos de Curpap e Support, 48,5% e 67,1% respectivamente foram intubados para receber surfactante.1,2,11,15,16,27–29 Mesmo que com pacientes menos imaturos, encontramos falha na nCPAP em 11,5% e falha do surfactante em 23% dos pacientes no grupo de ML. Esses resultados respiratórios podem ter sido associados a uma menor quantidade de surfactante nos pulmões ou talvez a uma SDR mais grave.
A resposta do surfactante é clinicamente mensurável, com relação à ventilação (pCO2), oxigenação (SpO2 e taxa a/A) e necessidade de oxigênio complementar (FiO2). Durante as primeiras seis horas após administração de surfactante, o objetivo do investigador em ambos os grupos foi monitorar o suporte respiratório e de oxigênio para reduzi‐los para atingir FiO2 ≤ 0,3 e SpO2 91‐95% com redução do esforço respiratório progressivo, até três horas após o surfactante. Outros autores também observaram as respostas de oxigenação e FiO2 nos grupos de tratamento por meio de ML e Insure25 ou pacientes tratados por ML e grupos sem uso de surfactante na nCPAP.3
Considerando a frequência e o volume de conteúdo gástrico medidos após a administração de surfactante por meio de ML, as necessidades de oxigênio e os resultados clínicos, parece que valores suficientes do medicamento chegaram aos pulmões. Brimacombe estimou que pelo menos metade do surfactante por ML chegou aos pulmões.10 Attridge et al. forneceram uma evidência objetiva de que o surfactante administrado por ML chega aos pulmões, pois ele resultou em uma diminuição imediata da necessidade e FiO2.3 Pinheiro et al. também encontraram pequenas quantidades de aspirado gástrico pós‐surfactante.25
A manutenção da VM foi significativamente maior no grupo de ML, principalmente devido aos resultados de quatro pacientes; três apresentaram SDR grande e um sepse. Talvez, quando o surfactante administrado por ML não chegou aos pulmões de forma suficiente, a melhoria na ventilação/oxigenação tenha sido tardia, com impacto sobre a gravidade da doença e a duração da VM.
Nosso tamanho da amostra não foi grande o suficiente para obter uma conclusão definitiva sobre as morbidades e os resultados secundários. Uma grande limitação da chegada do surfactante por ML é que o menor dispositivo disponível é muito grande para bebês que provavelmente têm a SDR, menos de 1kg e 28 semanas no nascimento.6,10 As limitações do estudo foram: um único centro, IG variável e faixa de peso ao nascer, um investigador responsável por todos os procedimentos, ausência de cegagem na análise de dados, falta de um protocolo específico para surfactante pós‐ML e de acompanhamento após alta da UTIN.
Neste estudo, os grupos de tratamento foram estatisticamente equivalentes em suas necessidades de oxigênio complementar três horas após o surfactante; 14 neonatos (53,8%) do grupo de ML nunca foram intubados ou submetidos a ventilação. O manejo de neonatos após tratamento com surfactante por ML exigirá maiores amostras multicêntricas e uma “curva de aprendizado” com relação a características desconhecidas, como população‐alvo, melhor momento de tratamento, método de instilação e dose de surfactante necessidade de analgesia e resultados respiratórios e radiológicos especiais.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Barbosa RF, Simões e Silva AC, Silva YP. A randomized controlled trial of the laryngeal mask airway for surfactant administration in neonates. J Pediatr (Rio J). 2017;93:343–50.
Estudo feito na Universidade Federal de Minas Gerais (UFMG), Faculdade de Medicina, Belo Horizonte, MG, Brasil.