Evaluate the association between inflammatory process, adiposity, and vitamins A, D, and E in adolescents, according to gender.
MethodsCross‐sectional study with adolescents aged 12–19 years old of both genders attending public schools in Recife. A questionnaire was used to collect data on socioeconomic level, lifestyle, and food intake of adolescents. Then, an anthropometric evaluation and a blood sampling were performed to analyze serum concentrations of α‐1‐acid glycoprotein, retinol, β‐carotene, α‐tocopherol, and 25‐hydroxy‐vitamin D.
ResultsThe levels of α‐1‐acid glycoprotein were higher for abdominal obesity in both genders. Male adolescents with insufficient serum α‐tocopherol levels had low levels of α‐1‐acid glycoprotein (p=0.03) and an increased risk of 25‐hydroxy‐vitamin D and β‐carotene deficiency in relation to total and abdominal fat; female adolescents had an increased risk of insufficient β‐carotene with abdominal obesity (PR: 1.33; 95% CI: 1.2–1.5).
ConclusionAbdominal adiposity implies a higher risk of inflammation and causes different changes to the levels of fat‐soluble vitamins according to gender.
Avaliar a associação entre processo inflamatório, adiposidade e as vitaminas A, D e E em adolescentes, segundo o sexo.
MétodosEstudo transversal com adolescentes de 12 a 19 anos de ambos os sexos de escolas públicas de Recife. Foi utilizado um questionário para coleta de dados socioeconômicos, de estilo de vida e de consumo alimentar dos adolescentes. Em seguida, realizou-se a avalição antropométrica e coleta de sangue para análise das concentrações séricas de α‐1‐glicoproteína ácida, retinol, β‐caroteno, α‐tocoferol e 25‐hidroxivitamina D.
ResultadosOs níveis de α‐1‐glicoproteína ácida foram maiores na obesidade abdominal de ambos os sexos. Os meninos com níveis séricos insuficientes de α‐tocoferol expressaram níveis reduzidos de α‐1‐glicoproteína ácida (p = 0,03) e apresentaram um maior risco de deficiência de 25‐hidroxivitamina D e β‐caroteno na adiposidade total e abdominal, enquanto as meninas mostraram maior risco de insuficiência de β‐caroteno com a obesidade abdominal (RP 1,33; IC 95% 1,2‐1,5).
ConclusãoA adiposidade abdominal reflete maior risco de inflamação e causa alterações distintas nas concentrações das vitaminas lipossolúveis, de acordo com o sexo.
A obesidade tem sido considerada a mais importante desordem nutricional1 e denominada como epidemia global devido à elevada ocorrência entre crianças, adolescentes e adultos jovens nos últimos anos.2 O excesso de peso está implicado em uma ampla variedade de problemas de saúde decorrentes do aumento da proporção de gordura corporal e distúrbios associados ao aumento da carga mecânica do tecido adiposo.3
Evidências sugerem que na obesidade pode ocorrer diminuição da concentração das vitaminas lipossolúveis no plasma devido a uma menor ingestão desses nutrientes e/ou maior deposição no tecido adiposo, que, por serem solúveis em gorduras, se depositam nos adipócitos e, assim, diminuem a biodisponibilidade em indivíduos com excesso de adiposidade.4 Além disso, as proteínas carreadoras das vitaminas se comportariam como proteínas negativas da fase aguda da inflamação,5 diminuiriam assim sua disponibilidade no plasma durante processo inflamatório crônico existente na obesidade.
Tem sido observado que crianças e adolescentes obesos apresentam um maior risco de baixas concentrações de vitaminas lipossolúveis quando comparados com crianças e adolescentes com peso adequado.6,7 Considerando que as recomendações nutricionais atuais não levam em conta a biodisponibilidade das vitaminas lipossolúveis na presença da inflamação metabólica associada à obesidade, um estado crônico de inadequação desses micronutrientes pode colocar os adolescentes com excesso de peso num risco de desordem nutricional. Assim, o presente estudo tem o objetivo de avaliar a associação entre processo inflamatório, adiposidade e as vitaminas A, D e E em adolescentes, segundo o sexo.
MetodologiaDesenho do estudo e casuísticaEstudo transversal que envolveu adolescentes de 12 a 19 anos, de ambos os sexos, de março a abril de 2013, aninhados em uma coorte prospectiva feita entre 2007‐2013, com adolescentes recrutados de forma aleatória, por um processo de amostragem em polietapas, nas escolas públicas do Recife, Nordeste do Brasil. Foram excluídos os adolescentes que faziam uso farmacológico de vitamina A, D, E ou polivitamínicos, nos últimos três meses.
O tamanho amostral baseou‐se em uma prevalência estimada (p) de deficiência de a‐tocoferol de 25%, um erro amostral (d) de 5,5%, um nível de 95% de confiança (z) e um efeito do desenho (c) de 2,1, considerando que a seleção da amostra foi por conglomerado. Com o uso da fórmula n=(z2 x p x q x c) / d2, corrigida para população finita, resultou em uma amostra mínima de 370 indivíduos. Para corrigir eventuais perdas foi acrescido um percentual de 11% [100/(100‐11)]. A amostra final trabalhada foi de 411 adolescentes escolares.
Métodos e técnicas de avaliaçãoA aplicação do questionário de consumo alimentar de pesquisa, a coleta de sangue e das medidas antropométricas foram feitas por técnicos treinados e orientados sobre os procedimentos e a rotina de desenvolvimento do estudo.
Variáveis dietéticasO consumo alimentar foi avaliado por um questionário de frequência alimentar para adolescentes (QFAA) semiquantitativo, desenvolvido e validado por Slater et al.,8 com adaptações para alimentos de uso comum na região. A análise foi feita pelo programa DietSys software versão 4.01 (National Cancer Institute, Bethesda, MD, USA). Os resultados do consumo de vitamina A, D e E foram comparados com os valores da Dietary Reference Intakes (DRIs) propostos pelo Institute of Medicine9,10 e classificados segundo a EAR. Foi considerado consumo adequado de vitamina A para meninos:>630 mcg/dia (9‐13 anos),>485mg/dia (14‐18 anos); vitamina A para meninas:>625mg/dia (9‐13 anos),>500 mcg/dia (14‐18 anos); vitamina E>12mg/dia; vitamina D>10 mcg/dia.
Variáveis antropométricasAs medidas de peso e altura foram feitas segundo técnica original recomendada por Lohman et al.11 e a CC (circunferência da cintura) foi obtida segundo critérios de Taylor et al.12 O diagnóstico nutricional dos adolescentes foi definido de acordo com curvas de IMC da OMS.13 Na classificação do estado nutricional dos escolares foram usados os indicadores índice de massa corporal para idade (IMC/I) e altura para idade (A/I) expresso em escore Z. Para o indicador A/I consideraram‐se: baixa estatura:<Escore ‐2; estatura adequada: ≥ Escore ‐2 e ≤ Escore+2 e alta estatura:<Escore+2. Para o IMC/idade consideraram‐se: baixo peso:<. Escore – 2,0; eutrofia: ≥ Escore Z ‐2 e ≤ 1; sobrepeso:>Escore Z+1 e ≤+2; Obesidade:>Escore Z+2.12 Os indivíduos com sobrepeso foram agrupados aos obesos e classificados na categoria de excesso de peso. O diagnóstico de excesso de peso foi obtido quando esse foi maior do que+1DP. No diagnóstico da obesidade abdominal o ponto de corte para classificação da CC foi de Taylor et al.12 e para a relação cintura/estatura (RCE) foi o preconizado segundo Li et al.14
Variáveis bioquímicasAs análises bioquímicas foram feitas após coleta de 10mL de sangue, após jejum de 10 a 12 horas. Os frascos foram acondicionados e transportados para o processamento das amostras no laboratório de análises clínicas Lapac, onde foram analisadas as concentrações de α‐1‐glicoproteina ácida e 25‐hidroxivitamina D (25(OH)D). Uma alíquota do soro (2mL) foi congelada e posteriormente enviada ao Centro de Investigação em Micronutrientes (Cimicron), da Universidade Federal da Paraíba (UFPB), para determinação das concentrações séricas de retinol, β‐caroteno e α‐tocoferol.
α‐1‐glicoproteina ácidaA α‐1‐glicoproteína ácida (AGA) foi quantificada por imunoturbidimetria com o uso de reagentes, calibradores e controles Roche, em sistema automatizado Cobas mira (Roche). A presença de inflamação foi definida como valor acima de 0,9g/L.
Retinol, β‐caroteno e α‐tocoferolA quantificação dos níveis de retinol, β‐caroteno e α‐tocoferol sérico seguiu o procedimento técnico descrito por Erhardt et al.15 Usaram‐se os pontos de corte recomendados pela OMS para os níveis de retinol, considerou‐se a deficiência de retinol quando<0,70μmol/L. Para o α‐tocoferol, usou‐se como referência ≥ 12μmol/L,16 enquanto os valores de β‐caroteno foram considerados adequados>0,9μmol/L.17
25‐hidroxivitamina DA 25(OH)D foi dosada pelo método de cromatografia líquida de alta eficiência (HPLC). A insuficiência de 25(OH) foi definida como<72,5 nmol/L.18
Análise dos dadosOs dados foram digitados com dupla entrada e verificados com o Validate, módulo do programa Epi‐Info, versão 6.0 [WHO/CDC, Atlanta, GE] para checar a consistência no processo de digitação. A análise estatística dos dados foi feita com o auxílio do programa Statistical Package for Social Sciences – SPSS versão 13.0 (SPSS Inc., Chicago, IL).
As variáveis contínuas foram testadas quanto à normalidade da distribuição pelo teste de Kolmogorov‐Smirnov (para avaliar a simetria da curva da distribuição das variáveis). Os dados das variáveis de distribuição normal foram expressos na forma de média e desvio‐padrão. As variáveis com distribuição não gaussiana foram apresentadas sob a forma de medianas e dos respectivos intervalos interquartílicos (IQ). Na descrição das proporções, a distribuição binomial foi aproximada à distribuição normal pelo intervalo de confiança de 95%.
Na análise univariada a força da associação foi avaliada pela razão de prevalência e respectivos intervalos de confianças e pelo teste do qui‐quadrado de Pearson. Para comparação entre dados contínuos de amostras independentes foi usado o teste t de Student ou seu equivalente não paramétrico, o teste U de Mann‐Whitney. Em todos os testes estatísticos foi usado o nível de significância de 5% para rejeição da hipótese de nulidade.
Aspectos éticosO estudo foi aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos do Hospital Universitário Lauro Wanderley da Universidade Federal da Paraíba (Registro CEP/HULW n° 723/10), pautado pelas normas éticas para pesquisa que envolve seres humanos, constantes na resolução vigente na época, 196/96 do Conselho Nacional de Saúde. Os adolescentes e seus responsáveis foram previamente informados dos objetivos da pesquisa, bem como dos métodos a serem adotados. Mediante o seu consentimento, o responsável assinou um termo de consentimento livre e esclarecido.
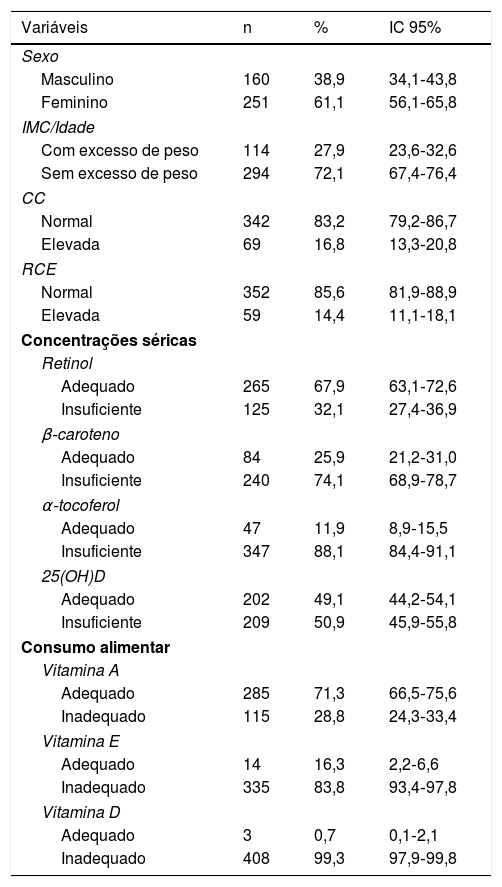
ResultadosParticiparam do estudo 411 adolescentes com mediana de 15 anos (IQ:14‐16). De acordo com IMC/Idade, observou‐se que 27,9% tinham excesso de peso, 17,4% (n=71) com sobrepeso e 10,5% (n=43) obesidade. Quando avaliada a adiposidade abdominal, 16,8% e 14,4% apresentavam CC e RCE elevadas, respectivamente. No tocante aos níveis séricos das vitaminas lipossolúveis, a maioria apresentava baixas concentrações de retinol, α‐tocoferol, β‐caroteno e 25(OH)D. Valores inadequados também foram observados ao avaliar o consumo alimentar das vitaminas A, D e E, conforme visualizado na tabela 1.
Características dos adolescentes escolares do Recife, Nordeste do Brasil, 2013
| Variáveis | n | % | IC 95% |
|---|---|---|---|
| Sexo | |||
| Masculino | 160 | 38,9 | 34,1‐43,8 |
| Feminino | 251 | 61,1 | 56,1‐65,8 |
| IMC/Idade | |||
| Com excesso de peso | 114 | 27,9 | 23,6‐32,6 |
| Sem excesso de peso | 294 | 72,1 | 67,4‐76,4 |
| CC | |||
| Normal | 342 | 83,2 | 79,2‐86,7 |
| Elevada | 69 | 16,8 | 13,3‐20,8 |
| RCE | |||
| Normal | 352 | 85,6 | 81,9‐88,9 |
| Elevada | 59 | 14,4 | 11,1‐18,1 |
| Concentrações séricas | |||
| Retinol | |||
| Adequado | 265 | 67,9 | 63,1‐72,6 |
| Insuficiente | 125 | 32,1 | 27,4‐36,9 |
| β‐caroteno | |||
| Adequado | 84 | 25,9 | 21,2‐31,0 |
| Insuficiente | 240 | 74,1 | 68,9‐78,7 |
| α‐tocoferol | |||
| Adequado | 47 | 11,9 | 8,9‐15,5 |
| Insuficiente | 347 | 88,1 | 84,4‐91,1 |
| 25(OH)D | |||
| Adequado | 202 | 49,1 | 44,2‐54,1 |
| Insuficiente | 209 | 50,9 | 45,9‐55,8 |
| Consumo alimentar | |||
| Vitamina A | |||
| Adequado | 285 | 71,3 | 66,5‐75,6 |
| Inadequado | 115 | 28,8 | 24,3‐33,4 |
| Vitamina E | |||
| Adequado | 14 | 16,3 | 2,2‐6,6 |
| Inadequado | 335 | 83,8 | 93,4‐97,8 |
| Vitamina D | |||
| Adequado | 3 | 0,7 | 0,1‐2,1 |
| Inadequado | 408 | 99,3 | 97,9‐99,8 |
CC, circunferência da cintura; IC, Intervalo de Confiança; IMC, índice de massa corporal.
25(OH)D, 25 Hidroxi‐vitamina D, Retinol sérico adequado>0,7μmol/L, β‐caroteno adequado:>0,9μmol/L; α‐tocoferol adequado>12μmol/L; 25(OH)D adequado:>72,4 nmol/L. Consumo alimentar adequado (EAR) de vitamina A meninos:>630 mcg/dia (9‐13 anos),>485mg/dia (14‐18 anos), vitamina A para meninas:>625mg/dia (9‐13 anos),>500 mcg/dia (14‐18 anos); vitamina E>12mg/dia; vitamina D>10 mcg/dia.
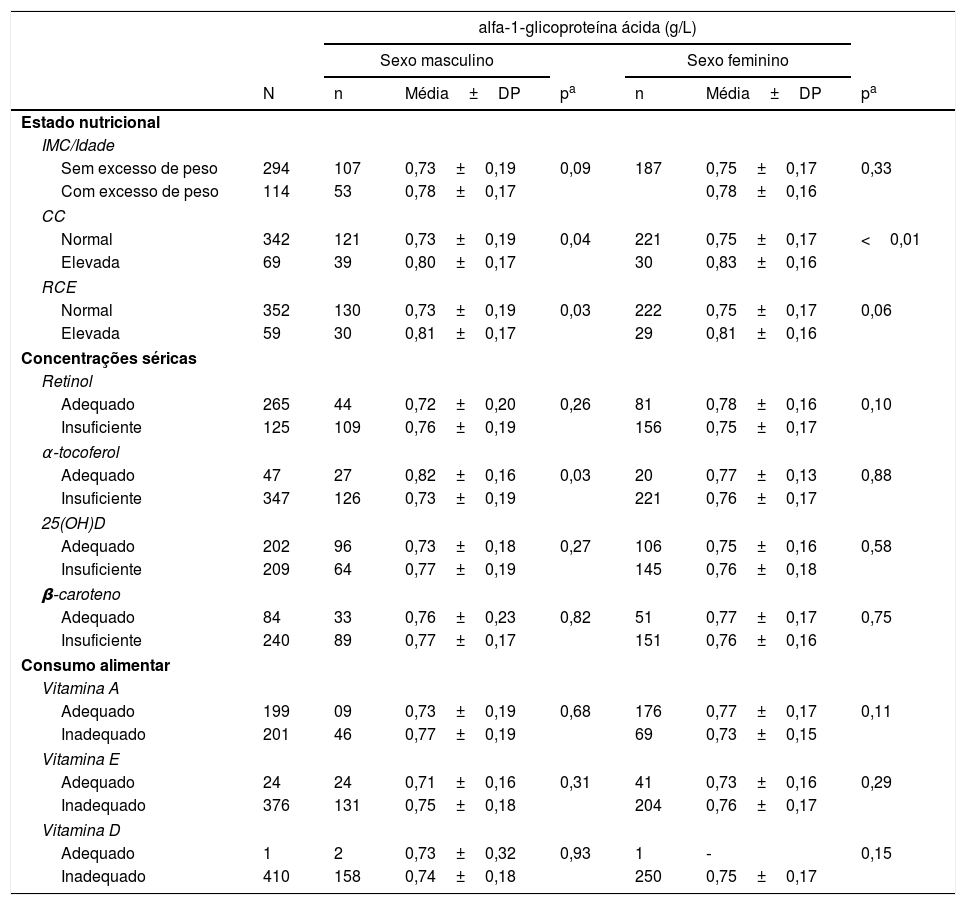
No que tange ao processo inflamatório, a AGA não apresentou alteração nos níveis séricos com o aumento da adiposidade total, porém mostrou‐se aumentada quando os adolescentes do sexo masculino foram classificados com obesidade abdominal pela CC (p=0,04) e RCE (p=0,03), enquanto as meninas tiveram suas concentrações aumentadas somente com a CC elevada (p<0,01) (tabela 2). Em relação às concentrações das vitaminas, a AGA apresentou redução em seus níveis na presença de quantidades insuficientes de α‐tocoferol sérico nos adolescentes de sexo masculino (p=0,03). No tocante à ingestão alimentar, a AGA não apresentou diferença significativa com variações do consumo das vitaminas lipossolúveis.
Valores séricos de alfa‐1‐glicoproteína ácida segundo estado nutricional, concentrações séricas e consumo alimentar das vitaminas lipossolúveis em adolescentes escolares do Recife, Nordeste do Brasil, 2013
| alfa‐1‐glicoproteína ácida (g/L) | |||||||
|---|---|---|---|---|---|---|---|
| Sexo masculino | Sexo feminino | ||||||
| N | n | Média±DP | pa | n | Média±DP | pa | |
| Estado nutricional | |||||||
| IMC/Idade | |||||||
| Sem excesso de peso | 294 | 107 | 0,73±0,19 | 0,09 | 187 | 0,75±0,17 | 0,33 |
| Com excesso de peso | 114 | 53 | 0,78±0,17 | 0,78±0,16 | |||
| CC | |||||||
| Normal | 342 | 121 | 0,73±0,19 | 0,04 | 221 | 0,75±0,17 | <0,01 |
| Elevada | 69 | 39 | 0,80±0,17 | 30 | 0,83±0,16 | ||
| RCE | |||||||
| Normal | 352 | 130 | 0,73±0,19 | 0,03 | 222 | 0,75±0,17 | 0,06 |
| Elevada | 59 | 30 | 0,81±0,17 | 29 | 0,81±0,16 | ||
| Concentrações séricas | |||||||
| Retinol | |||||||
| Adequado | 265 | 44 | 0,72±0,20 | 0,26 | 81 | 0,78±0,16 | 0,10 |
| Insuficiente | 125 | 109 | 0,76±0,19 | 156 | 0,75±0,17 | ||
| α‐tocoferol | |||||||
| Adequado | 47 | 27 | 0,82±0,16 | 0,03 | 20 | 0,77±0,13 | 0,88 |
| Insuficiente | 347 | 126 | 0,73±0,19 | 221 | 0,76±0,17 | ||
| 25(OH)D | |||||||
| Adequado | 202 | 96 | 0,73±0,18 | 0,27 | 106 | 0,75±0,16 | 0,58 |
| Insuficiente | 209 | 64 | 0,77±0,19 | 145 | 0,76±0,18 | ||
| β‐caroteno | |||||||
| Adequado | 84 | 33 | 0,76±0,23 | 0,82 | 51 | 0,77±0,17 | 0,75 |
| Insuficiente | 240 | 89 | 0,77±0,17 | 151 | 0,76±0,16 | ||
| Consumo alimentar | |||||||
| Vitamina A | |||||||
| Adequado | 199 | 09 | 0,73±0,19 | 0,68 | 176 | 0,77±0,17 | 0,11 |
| Inadequado | 201 | 46 | 0,77±0,19 | 69 | 0,73±0,15 | ||
| Vitamina E | |||||||
| Adequado | 24 | 24 | 0,71±0,16 | 0,31 | 41 | 0,73±0,16 | 0,29 |
| Inadequado | 376 | 131 | 0,75±0,18 | 204 | 0,76±0,17 | ||
| Vitamina D | |||||||
| Adequado | 1 | 2 | 0,73±0,32 | 0,93 | 1 | ‐ | 0,15 |
| Inadequado | 410 | 158 | 0,74±0,18 | 250 | 0,75±0,17 | ||
CC, circunferência da cintura; IMC, Índice de massa corporal; RCE, Relação cintura/estatura.
Retinol sérico adequado>0,7μmol/L, β‐caroteno adequado:>0,9μmol/L; α‐tocoferol adequado>12μmol/L; 25(OH)D adequado:>72,4 nmol/L.
Consumo alimentar adequado (EAR) de vitamina A meninos:>630 mcg/dia (9‐13 anos),>485mg/dia (14‐18 anos), vitamina A para meninas:>625mg/dia (9‐13 anos),>500 mcg/dia (14‐18 anos); vitamina E>12mg/dia; vitamina D>10 mcg/dia.
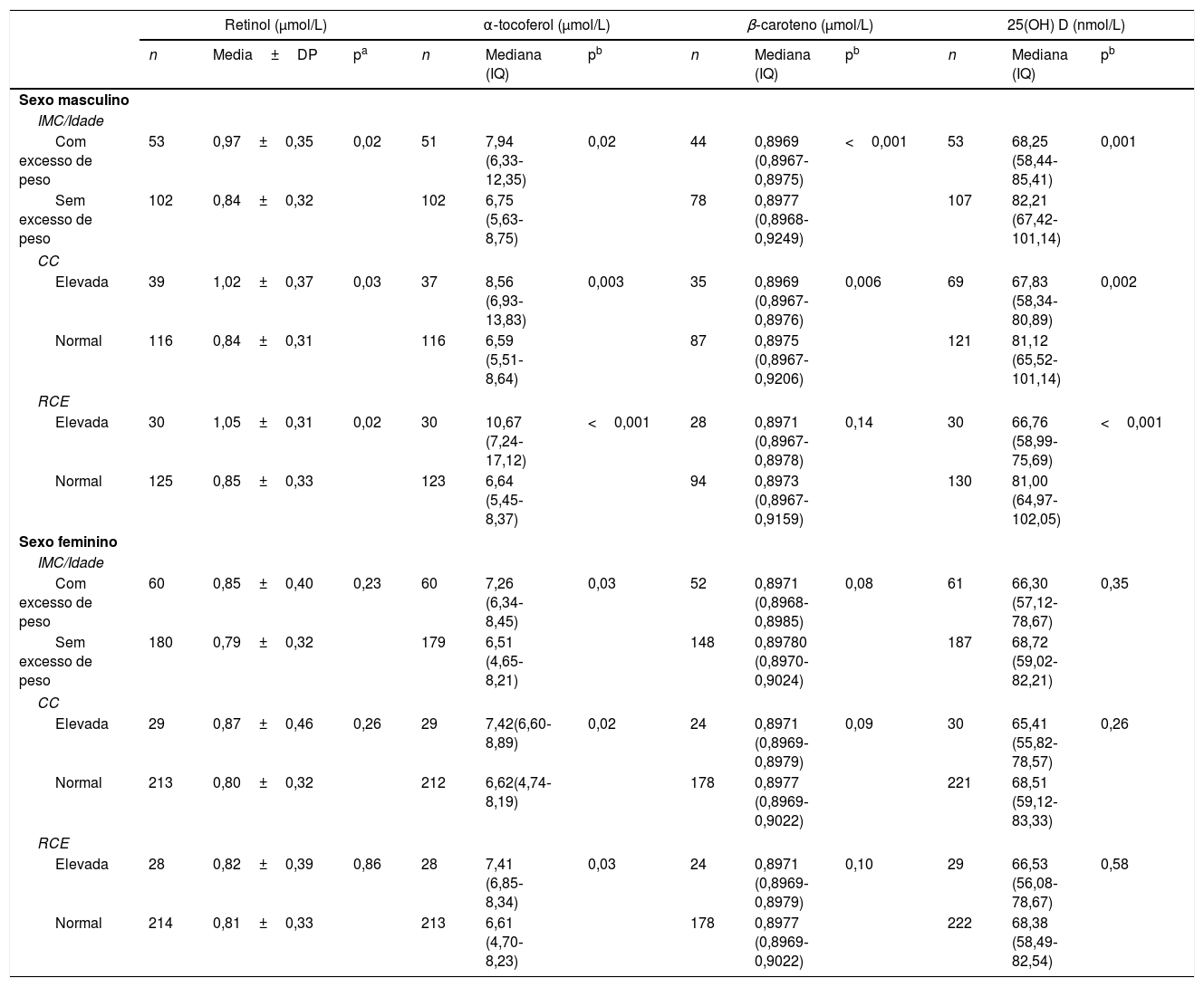
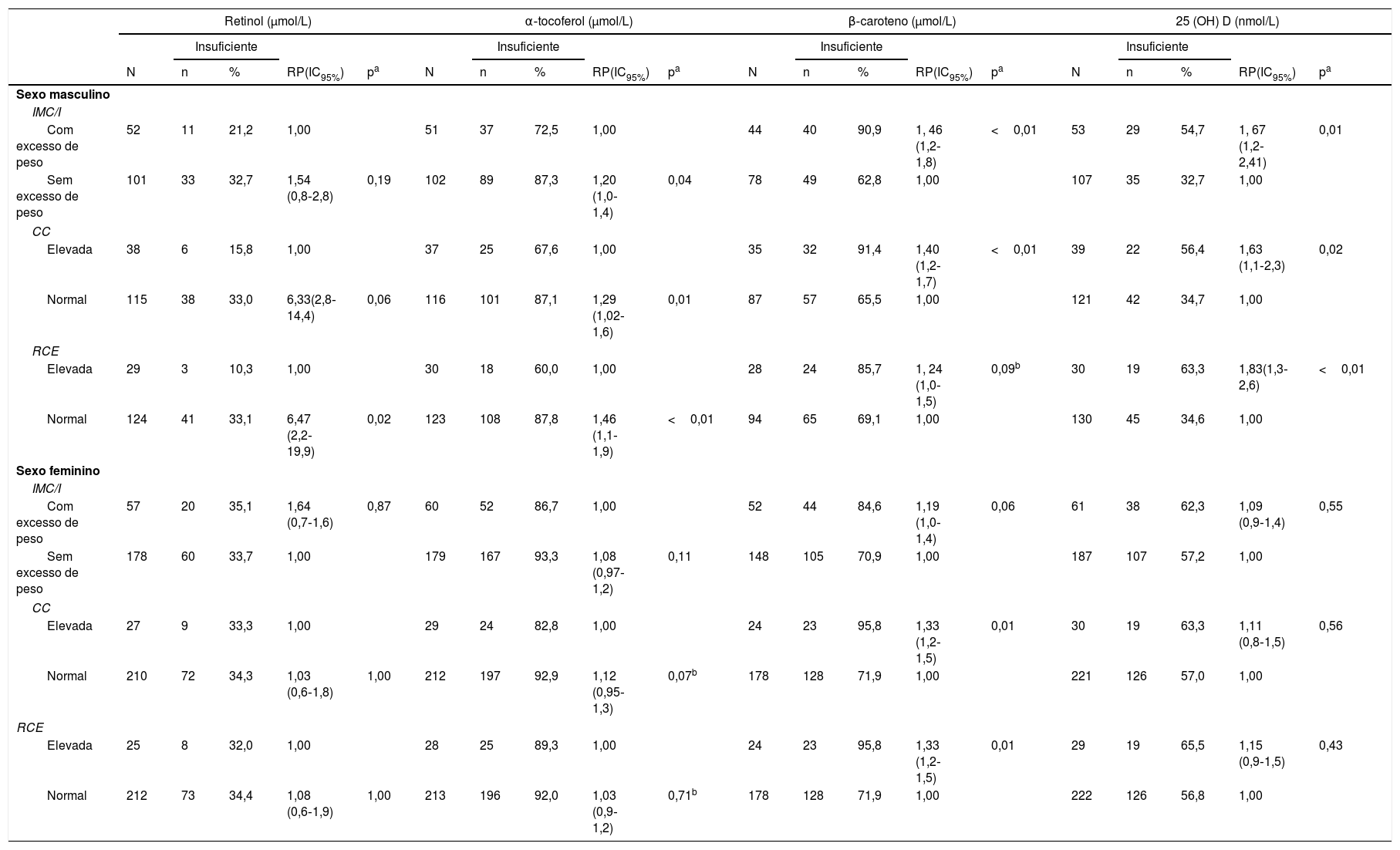
Ao avaliar as concentrações de vitaminas lipossolúveis segundo o estado nutricional, verificou‐se que os meninos apresentaram elevação nas concentrações de retinol e α‐tocoferol com o aumento da adiposidade, enquanto o β‐caroteno e a 25(OH)D tiveram suas concentrações sanguíneas reduzidas. Já em relação ao sexo feminino, apenas o α‐tocoferol teve suas concentrações significativamente mais elevadas com a maior adiposidade, conforme observado na tabela 3. Quando avaliada a associação do tipo de adiposidade com as concentrações das vitaminas, verificou‐se que os meninos apresentaram um maior risco de deficiência de 25(OH)D e β‐caroteno na adiposidade total e abdominal. No entanto, quando a adiposidade estava ausente, eles apresentaram risco de déficit de retinol e α‐tocoferol (tabela 4). As meninas, entretanto, demonstraram apenas risco de insuficiência de β‐caroteno quando CC (RP=1,33) e RCE (RP=1,33) estavam elevadas.
Valores séricos de retinol, α‐tocoferol, β‐caroteno e 25 hidroxi‐vitamina D, segundo índice de massa corporal, circunferência da cintura e relação cintura/estatura de adolescentes escolares do Recife, Nordeste do Brasil, 2013
| Retinol (μmol/L) | α‐tocoferol (μmol/L) | β‐caroteno (μmol/L) | 25(OH) D (nmol/L) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| n | Media±DP | pa | n | Mediana (IQ) | pb | n | Mediana (IQ) | pb | n | Mediana (IQ) | pb | |
| Sexo masculino | ||||||||||||
| IMC/Idade | ||||||||||||
| Com excesso de peso | 53 | 0,97±0,35 | 0,02 | 51 | 7,94 (6,33‐12,35) | 0,02 | 44 | 0,8969 (0,8967‐0,8975) | <0,001 | 53 | 68,25 (58,44‐85,41) | 0,001 |
| Sem excesso de peso | 102 | 0,84±0,32 | 102 | 6,75 (5,63‐8,75) | 78 | 0,8977 (0,8968‐0,9249) | 107 | 82,21 (67,42‐101,14) | ||||
| CC | ||||||||||||
| Elevada | 39 | 1,02±0,37 | 0,03 | 37 | 8,56 (6,93‐13,83) | 0,003 | 35 | 0,8969 (0,8967‐0,8976) | 0,006 | 69 | 67,83 (58,34‐80,89) | 0,002 |
| Normal | 116 | 0,84±0,31 | 116 | 6,59 (5,51‐8,64) | 87 | 0,8975 (0,8967‐0,9206) | 121 | 81,12 (65,52‐101,14) | ||||
| RCE | ||||||||||||
| Elevada | 30 | 1,05±0,31 | 0,02 | 30 | 10,67 (7,24‐17,12) | <0,001 | 28 | 0,8971 (0,8967‐0,8978) | 0,14 | 30 | 66,76 (58,99‐75,69) | <0,001 |
| Normal | 125 | 0,85±0,33 | 123 | 6,64 (5,45‐8,37) | 94 | 0,8973 (0,8967‐0,9159) | 130 | 81,00 (64,97‐102,05) | ||||
| Sexo feminino | ||||||||||||
| IMC/Idade | ||||||||||||
| Com excesso de peso | 60 | 0,85±0,40 | 0,23 | 60 | 7,26 (6,34‐8,45) | 0,03 | 52 | 0,8971 (0,8968‐0,8985) | 0,08 | 61 | 66,30 (57,12‐78,67) | 0,35 |
| Sem excesso de peso | 180 | 0,79±0,32 | 179 | 6,51 (4,65‐8,21) | 148 | 0,89780 (0,8970‐0,9024) | 187 | 68,72 (59,02‐82,21) | ||||
| CC | ||||||||||||
| Elevada | 29 | 0,87±0,46 | 0,26 | 29 | 7,42(6,60‐8,89) | 0,02 | 24 | 0,8971 (0,8969‐0,8979) | 0,09 | 30 | 65,41 (55,82‐78,57) | 0,26 |
| Normal | 213 | 0,80±0,32 | 212 | 6,62(4,74‐8,19) | 178 | 0,8977 (0,8969‐0,9022) | 221 | 68,51 (59,12‐83,33) | ||||
| RCE | ||||||||||||
| Elevada | 28 | 0,82±0,39 | 0,86 | 28 | 7,41 (6,85‐8,34) | 0,03 | 24 | 0,8971 (0,8969‐0,8979) | 0,10 | 29 | 66,53 (56,08‐78,67) | 0,58 |
| Normal | 214 | 0,81±0,33 | 213 | 6,61 (4,70‐8,23) | 178 | 0,8977 (0,8969‐0,9022) | 222 | 68,38 (58,49‐82,54) | ||||
CC, circunferência da cintura; DP, desvio padrão; IMC, índice de massa corporal; IQ, intervalo interquatílico; RCE, Relação cintura/estatura.
Fatores associados à inadequação sérica de retinol, α‐tocoferol, β‐caroteno e 25 hidroxi‐vitamina D em adolescentes escolares do Recife, Nordeste do Brasil, 2013
| Retinol (μmol/L) | α‐tocoferol (μmol/L) | β‐caroteno (μmol/L) | 25 (OH) D (nmol/L) | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Insuficiente | Insuficiente | Insuficiente | Insuficiente | |||||||||||||||||
| N | n | % | RP(IC95%) | pa | N | n | % | RP(IC95%) | pa | N | n | % | RP(IC95%) | pa | N | n | % | RP(IC95%) | pa | |
| Sexo masculino | ||||||||||||||||||||
| IMC/I | ||||||||||||||||||||
| Com excesso de peso | 52 | 11 | 21,2 | 1,00 | 51 | 37 | 72,5 | 1,00 | 44 | 40 | 90,9 | 1, 46 (1,2‐1,8) | <0,01 | 53 | 29 | 54,7 | 1, 67 (1,2‐2,41) | 0,01 | ||
| Sem excesso de peso | 101 | 33 | 32,7 | 1,54 (0,8‐2,8) | 0,19 | 102 | 89 | 87,3 | 1,20 (1,0‐1,4) | 0,04 | 78 | 49 | 62,8 | 1,00 | 107 | 35 | 32,7 | 1,00 | ||
| CC | ||||||||||||||||||||
| Elevada | 38 | 6 | 15,8 | 1,00 | 37 | 25 | 67,6 | 1,00 | 35 | 32 | 91,4 | 1,40 (1,2‐1,7) | <0,01 | 39 | 22 | 56,4 | 1,63 (1,1‐2,3) | 0,02 | ||
| Normal | 115 | 38 | 33,0 | 6,33(2,8‐14,4) | 0,06 | 116 | 101 | 87,1 | 1,29 (1,02‐1,6) | 0,01 | 87 | 57 | 65,5 | 1,00 | 121 | 42 | 34,7 | 1,00 | ||
| RCE | ||||||||||||||||||||
| Elevada | 29 | 3 | 10,3 | 1,00 | 30 | 18 | 60,0 | 1,00 | 28 | 24 | 85,7 | 1, 24 (1,0‐1,5) | 0,09b | 30 | 19 | 63,3 | 1,83(1,3‐2,6) | <0,01 | ||
| Normal | 124 | 41 | 33,1 | 6,47 (2,2‐19,9) | 0,02 | 123 | 108 | 87,8 | 1,46 (1,1‐1,9) | <0,01 | 94 | 65 | 69,1 | 1,00 | 130 | 45 | 34,6 | 1,00 | ||
| Sexo feminino | ||||||||||||||||||||
| IMC/I | ||||||||||||||||||||
| Com excesso de peso | 57 | 20 | 35,1 | 1,64 (0,7‐1,6) | 0,87 | 60 | 52 | 86,7 | 1,00 | 52 | 44 | 84,6 | 1,19 (1,0‐1,4) | 0,06 | 61 | 38 | 62,3 | 1,09 (0,9‐1,4) | 0,55 | |
| Sem excesso de peso | 178 | 60 | 33,7 | 1,00 | 179 | 167 | 93,3 | 1,08 (0,97‐1,2) | 0,11 | 148 | 105 | 70,9 | 1,00 | 187 | 107 | 57,2 | 1,00 | |||
| CC | ||||||||||||||||||||
| Elevada | 27 | 9 | 33,3 | 1,00 | 29 | 24 | 82,8 | 1,00 | 24 | 23 | 95,8 | 1,33 (1,2‐1,5) | 0,01 | 30 | 19 | 63,3 | 1,11 (0,8‐1,5) | 0,56 | ||
| Normal | 210 | 72 | 34,3 | 1,03 (0,6‐1,8) | 1,00 | 212 | 197 | 92,9 | 1,12 (0,95‐1,3) | 0,07b | 178 | 128 | 71,9 | 1,00 | 221 | 126 | 57,0 | 1,00 | ||
| RCE | ||||||||||||||||||||
| Elevada | 25 | 8 | 32,0 | 1,00 | 28 | 25 | 89,3 | 1,00 | 24 | 23 | 95,8 | 1,33 (1,2‐1,5) | 0,01 | 29 | 19 | 65,5 | 1,15 (0,9‐1,5) | 0,43 | ||
| Normal | 212 | 73 | 34,4 | 1,08 (0,6‐1,9) | 1,00 | 213 | 196 | 92,0 | 1,03 (0,9‐1,2) | 0,71b | 178 | 128 | 71,9 | 1,00 | 222 | 126 | 56,8 | 1,00 | ||
CC, circunferência da cintura; IC, intervalo de confiança; IMC, índice de massa corporal; RCE, Relação cintura/estatura; RP, razão de prevalência.
Retinol sérico adequado>0,7μmol/L, β‐caroteno adequado:>0,9μmol/L; α‐tocoferol adequado>12μmol/L; 25(OH)D adequado:>72,4 nmol/L.
A elevada prevalência de excesso de peso entre os adolescentes reflete a magnitude do problema nessa faixa etária. Apesar de a gordura corporal estar relacionada com algumas complicações metabólicas, várias consequências da obesidade são fortemente mais associadas com a quantidade de gordura abdominal19 e essa deposição representa um papel‐chave e talvez indutor do risco para a saúde daqueles com sobrepeso e obesidade.20 Postula‐se que o indivíduo obeso apresenta uma inflamação persistente do tecido adiposo e as citocinas pró‐inflamatórias associadas com o acúmulo de tecido adiposo explicariam o desenvolvimento das patologias relacionadas à obesidade.21
Na avaliação entre inflamação e adiposidade observou‐se que o AGA apresentou maiores concentrações apenas na presença de obesidade abdominal de ambos os sexos, não foi observada diferença na adiposidade total. Achados discordantes na literatura, visto que há relatos de AGA elevada nos adolescentes com sobrepeso e obesidade, segundo o IMC.22 Alfadda et al.23 observaram que a expressão do RNAm da AGA estaria correlacionada com a expressão de TNF‐α e adiponectina do tecido adiposo subcutâneo, enquanto que no tecido adiposo visceral essa expressão encontra‐se correlacionada com o TNF‐α, IL‐6 e adiponectina, o que demonstra maior expressão da AGA com a deposição de gordura abdominal. Essa associação poderia justificar em parte nossos achados, visto que, talvez, o maior indutor para elevação da AGA seriam as citocinas inflamatórias liberadas pelo tecido adiposo visceral. Somado a isso, quando se usa apenas o IMC para classificar obesidade, o diagnóstico pode ser falho, pois esse não é sensível para predizer a área de deposição de gordura, nem se o aumento da massa corporal consiste em maior quantidade de músculo ou de gordura.
Na presença de inflamação, a literatura demonstra que as concentrações de retinol,24 vitamina E25 e vitamina D6 apresentam‐se significativamente menores. As concentrações plasmáticas de micronutrientes são, pelo menos em parte, mediadas por citocinas pró‐inflamatórias que suprimem a produção hepática de muitas proteínas transportadoras, aumentam a permeabilidade capilar e promovem sequestro de alguns micronutrientes para o fígado e outros órgãos.26
Em nosso estudo não foi possível avaliar as vitaminas segundo a presença do processo inflamatório, pois nenhum dos adolescentes avaliados apresentava inflamação segundo ponto de corte estabelecido para AGA. No entanto, ao avaliar a concentração média da AGA segundo status das vitaminas, foi observado que os adolescentes do sexo masculino com as maiores concentrações de AGA apresentavam valores de α‐tocoferol adequado. Segundo relatos citados anteriormente, seria esperado encontrar relação inversa entre inflamação e α‐tocoferol. Entretanto, Ulatowski et al.27 referem que o estresse oxidativo pode aumentar a expressão do gene da proteína de transferência do α‐tocoferol (α‐TTP), pois como essa vitamina é o maior antioxidante lipossolúvel, o aumento da distribuição da vitamina E iria prevenir maiores danos oxidativos.
Quando avaliadas as concentrações das vitaminas no excesso de peso segundo sexo, os meninos com obesidade abdominal apresentaram aumento de retinol e α‐tocoferol, enquanto o β‐caroteno e 25(OH) estavam reduzidos. Já nas meninas, apenas o α‐tocoferol teve seus níveis aumentados na adiposidade central. Esses resultados demonstram que o aumento da adiposidade abdominal poderia exercer influência distinta nas concentrações das vitaminas de acordo com o sexo, possivelmente devido às variações existentes na ação dos hormônios sobre os efeitos da inflamação mediada pela obesidade.
Na tentativa de elucidar a relação entre excesso de adiposidade, sexo, inflamação e sinalização endócrina, Bloor e Symonds,28 através de uma revisão da literatura, descrevem que na obesidade há um aumento das citocinas pró‐inflamatórias e posterior ativação do eixo hipotálamo‐pituitária‐adrenal (HPA), que aumenta o cortisol, e esse contribui para o aumento da deposição de tecido adiposo visceral no sexo masculino. No sexo feminino também ocorre aumento de adiposidade central, entretanto existe uma transição gradual, com diminuição da deposição de tecido adiposo subcutâneo em membros inferiores e superiores para o desenvolvimento central da adiposidade, o que confere ao sexo feminino proteção ao processo inflamatório, pois impede que o depósito visceral atue como um sinalizador aumentado de estresse no HPA.
Assim, os meninos estariam mais propensos ao acúmulo de triglicerídeo nos adipócitos em região central, o que acarreta hipertrofia e aumento da produção e secreção de adipocinas na circulação, visto que a expressão gênica das adipocinas está positivamente correlacionada com o tamanho do adipócito.29 Como consequência da inflamação, haveria inicialmente uma maior mobilização das vitaminas antioxidantes na tentativa de combater o estresse oxidativo, o que poderia justificar a elevação do retinol e α‐tocoferol. Já o betacaroteno, além de apresentar função antioxidante, também seria desviado para a conversão em vitamina A no fígado, e provavelmente teria suas concentrações reduzidas no processo inflamatório. Essa demanda aumentada do betacaroteno poderia explicar o maior risco de inadequação de betacaroteno encontrado nos adolescentes de ambos os sexos com obesidade abdominal.
A 25(OH)D, diferentemente, pode ter suas concentrações reduzidas pelo maior armazenamento no tecido adiposo.4 Além disso, há relatos de que as concentrações plasmáticas de 25(OH)D apresentam‐se associados de forma independente com a PCR (proteína C reativa) e albumina,30 ou seja, na presença de inflamação sistêmica as proteínas negativas de fase aguda, como a albumina, estão reduzidas, o que diminuiria o transporte dessa vitamina na corrente sanguínea.
A abordagem dos estudos em adolescentes encontrados na literatura demonstra ausência na associação das concentrações de vitaminas lipossolúveis com processo inflamatório. No entanto, Duncan et al.,31 ao avaliar os coeficientes de correlação de PCR, em comparação com diversos micronutrientes (inclusive vitamina A, D e E) no plasma de indivíduos adultos, constataram uma fraca correlação. Isso indica que a associação é altamente variável de paciente para paciente e sugere que a interpretação para deficiência de micronutrientes plasmáticos só deve ser feita quando a presença de inflamação for excluída.
Com isso, o presente estudo demonstrou que o excesso de peso entre os adolescentes pode colocar esses indivíduos em risco de inflamação metabólica quando o acúmulo de gordura ocorrer em região abdominal. Além disso, o aumento da adiposidade abdominal cursou com alterações distintas nas concentrações séricas das vitaminas lipossolúveis de acordo com o sexo. Apesar de não ter verificado relação direta entre inflamação e as vitaminas avaliadas, sugere‐se que na interpretação bioquímica das vitaminas lipossolúveis sejam considerados fatores como obesidade e inflamação, para evitar um risco de má interpretação desses dados. No entanto, mais estudos são necessários para melhor compreensão dos mecanismos envolvidos entre o processo inflamatório crônico existente na obesidade e o comportamento das vitaminas lipossolúveis, suas rotas metabólicas e o modo de ação nesse processo considerando a diferença entre os sexos.
No que se refere às limitações no estudo, por se tratar de um estudo transversal, não foi possível garantir relações causais e variáveis de confusão podem ter afetado as associações relatadas. Somado a isso, foi usado apenas um marcador bioquímico para monitorar a presença de inflamação, a AGA, que, apesar de ser considerado um marcador inflamatório de maior validade clínica, pode não apresentar maior poder de descriminação diagnóstica em situações inflamatórias especificas.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) (processo n.473387/2010‐2) e Ministério de Ciência e Tecnologia (convênio IMIP/MCT processo 01.0265.00/2005).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Paes‐Silva RP, Gadelha PC, Lemos MC, Castro CM, Arruda IK, Diniz AS. Adiposity, inflammation and fat‐soluble vitamins in adolescents. J Pediatr (Rio J). 2019;95:575–83.