To measure the prevalence of vitamin D deficiency (through the 25‐hydroxyvitamin D metabolite) in pediatric patients using antiepileptic drugs.
Source of dataMeta‐analysis of studies identified through search in the PubMed, Embase, LILACS, and Cochrane Library databases, on February 19, 2019.
Summary of dataA total of 748 articles were identified, 29 of which were relevant to the objectives of this study. The prevalence of vitamin D deficiency found was 0.32 (95% CI=0.25 ‐ 0.41; I2=92%, p<0.01). In the subgroup analyses, the most significant results were observed in the group of patients using cytochrome P450‐inducing antiepileptic drugs, with a prevalence of 0.33 (95% CI=0.21 ‐ 0.47; I2=86%, p<0.01) and, considering the study design, in the subgroup of cohort studies, with a prevalence of 0.52 (95% CI=0.40 ‐ 0.64; I2=76%, p<0.01).
ConclusionsTaking into account the deleterious effects of vitamin D deficiency on the bone health of individuals using antiepileptic drugs, it is suggested to include in their care 25‐hydroxyvitamin D monitoring, cholecalciferol supplementation, and treatment of the deficiency, when present.
Mensurar a prevalência de deficiência de vitamina D (através do metabólito 25‐hidroxivitamina D) em pacientes pediátricos em uso de fármacos antiepilépticos.
Fonte dos dadosMetanálise de estudos identificados por meio de pesquisa nas bases de dados Pubmed, Embase, LILACS e Cochrane em 19 de fevereiro de 2019.
Síntese dos dadosForam identificados 748 artigos, dos quais 29 mostraram‐se relevantes aos objetivos deste estudo. A prevalência de deficiência de vitamina D encontrada foi de 0,32 (IC 95%=0,25–0,41) (I2=92%, p<0,01). Nas análises por subgrupos, os resultados mais expressivos foram observados no grupo de pacientes em uso de fármacos antiepilépticos indutores do citocromo P450, que apresentou prevalência de 0,33 (IC 95%=0,21–0,47) (I2=86%, p <0,01). Considerou‐se o delineamento dos estudos, no subgrupo de estudos de coorte, com prevalência de 0,52 (IC 95%=0,40–0,64) (I2=76%, p <0,01).
ConclusõesLevando‐se em consideração os efeitos deletérios da deficiência de vitamina D na saúde óssea dos sujeitos em uso de fármacos antiepilépticos, sugere‐se incluir em seu atendimento, o monitoramento de 25‐hidroxivitamina D, suplementação com colecalciferol e tratamento de deficiência quando existente.
A prevalência de epilepsia na faixa etária pediátrica em países em desenvolvimento pode chegar a 10 casos a cada 1.000 crianças.1 O tratamento com fármacos antiepilépticos é necessário por longo período na maioria dos pacientes2 e está associado a vários efeitos adversos, tais como hiperplasia gengival, distúrbios gastrointestinais, osteoporose, osteomalácia, toxicidade da medula óssea, teratogenicidade, hepatotoxicidade, nefrotoxicidade e disfunções endócrina, neurológica, psiquiátrica e dermatológica.3
Em relação à deficiência de vitamina D, estudo de base populacional estima uma prevalência de 15% na população geral pediátrica, dados referentes aos Estados Unidos.4 Considerando‐se os sujeitos em uso de fármacos antiepilépticos, existem evidências que sustentam uma prevalência superior a 70% na população pediátrica.5 A doença subclínica é caracterizada por anormalidades bioquímicas (níveis séricos de cálcio e 25‐hidrovitamina D reduzidos e de paratormônio elevado), redução na densidade mineral óssea e alteração nos achados de biópsia óssea.6,7 Em um estudo feito com membros do diretório da American Academy of Neurology, foi constatado que cerca de 40% dos neurologistas pediátricos pesquisam de forma rotineira a doença mineral óssea, 40% prescrevem cálcio e vitamina D aos pacientes que já têm a doença instalada e apenas 9% prescrevem profilaticamente cálcio e vitamina D aos sujeitos que fazem uso de fármacos antiepilépticos.7
A associação entre o uso de fármaco antiepiléptico e doença mineral óssea foi primeiramente reportada em 1960.8 Desde então, diversos estudos têm sido feitos no intuito de se compreender o efeito dos fármacos antiepilépticos no metabolismo ósseo, os fatores que corroboram a doença óssea no sujeito com epilepsia e a real necessidade de tratamento e prevenção nesses pacientes.9–12
Levando‐se em consideração a classificação dos fármacos antiepilépticos em indutores e não indutores do sistema enzimático do citocromo P450 (CYP450), alguns estudos apoiam a ideia de que o uso de fármacos indutores está relacionado a maiores índices de deficiência de vitamina D,12,13 visto que podem acelerar o metabolismo hepático da vitamina D, com consequente redução do seu nível sérico.5
A atual metanálise visa a mensurar a prevalência de deficiência de vitamina D (mensurada através de 25‐hidroxivitamina D) em pacientes pediátricos que fazem uso de fármaco antiepiléptico, bem como verificar a prevalência de deficiência em subgrupos, considerando delineamento do estudo, fármacos antiepilépticos usados e pacientes que apresentam exclusivamente epilepsia (sem deficiência motora).
MétodosA pesquisa bibliográfica, a seleção dos estudos a partir de título e resumo e a extração dos dados foram feitas de forma independente por dois revisores treinados. Um autor sênior foi acionado em casos de divergência. Na existência de artigos duplicados, considerou‐se apenas um deles. O relato desta metanálise seguiu as recomendações propostas para Metanálises de Estudos Observacionais em Epidemiologia (MOOSE)14 e está registrado na Plataforma Prospero sob o número CRD42020143322.
Estratégia de buscaOs estudos foram identificados por meio de pesquisa nas bases de dados Pubmed, Embase, Lilacs e Cochrane Library feita em 19 de fevereiro de 2019. Para a busca, foi usado o termo “fármaco antiepiléptico” em combinação com “vitamina D”, através de vocabulários estruturados Medical Subject Headings (MeSH) para Pubmed, Emtree para Embase e Descritores em Ciências da Saúde (DeCS) para Lilacs. Os termos usados nas buscas e o número de artigos encontrados por base de dados podem ser visualizados na tabela S1 do material suplementar.
Critérios de elegibilidadeOs critérios de inclusão foram os seguintes: estudos publicados em língua portuguesa, inglesa ou espanhola, publicados em qualquer data e que avaliassem pacientes até 18 anos que estivessem em uso de fármaco antiepiléptico. Foram excluídos os dados relativos a pacientes que recebessem suplementação de vitamina D ou medicações que atuam no metabolismo dessa vitamina (ex: glicocorticoide), que apresentassem diagnóstico de comorbidade que altera o metabolismo da vitamina D (ex: doença renal, hepática, gastrointestinal ou endócrina), estudos de revisão e trabalhos com dados incompletos ou não publicados na íntegra.
Coleta de dadosDepois de examinar título, resumo e texto completo dos estudos segundo os critérios de elegibilidade, os dados de interesse foram coletados com um formulário‐padrão. Foram coletadas as seguintes informações: autores, local, delineamento, ano de publicação, idade média, concentração de 25‐hidroxitamina D caracterizada como deficiência, prevalência de deficiência de vitamina D (mensurada através de 25‐hidroxivitamina D), número de pacientes que apresentavam exclusivamente epilepsia (sem deficiência motora), fármacos antiepilépticos usados e seu tempo mínimo de uso. Os fármacos antiepilépticos foram categorizados conforme seu efeito no sistema CYP450 em indutores (carbamazepina, fenobarbital, fenitoína, topiramato, oxcarbazepina e primidona), não indutores (ácido valproico e clobazam) ou não metabolizados por esse sistema (levetiracetam, gabapentina, etosuximida, vigabatrina e zonizamida).15,16 O tipo de estudo foi registrado conforme interpretação dos dados pelos pesquisadores. A escolha de selecionar pacientes com epilepsia isoladamente foi porque a deficiência motora é considerada um fator independente para deficiência de 25‐hidroxivitamina D.8
Análise estatísticaOs estudos foram agrupados em metanálise. As variáveis dicotômicas foram expressas como proporções (percentagem) e as variáveis contínuas, como média e desvio‐padrão. A medida de sumário da prevalência de deficiência de vitamina D foi computada como a proporção (e respectivo intervalo de confiança de 95%) de pacientes com deficiência sobre a amostra total, ponderada pelo peso do estudo, usou‐se o modelo de efeitos randômicos. O teste de inconsistência (I2) foi usado para avaliar a heterogeneidade entre os estudos. Valor p <0,05 foi considerado como estatisticamente significativo. A análise estatística foi feita com o pacote “meta” do programa R 3.5.1.
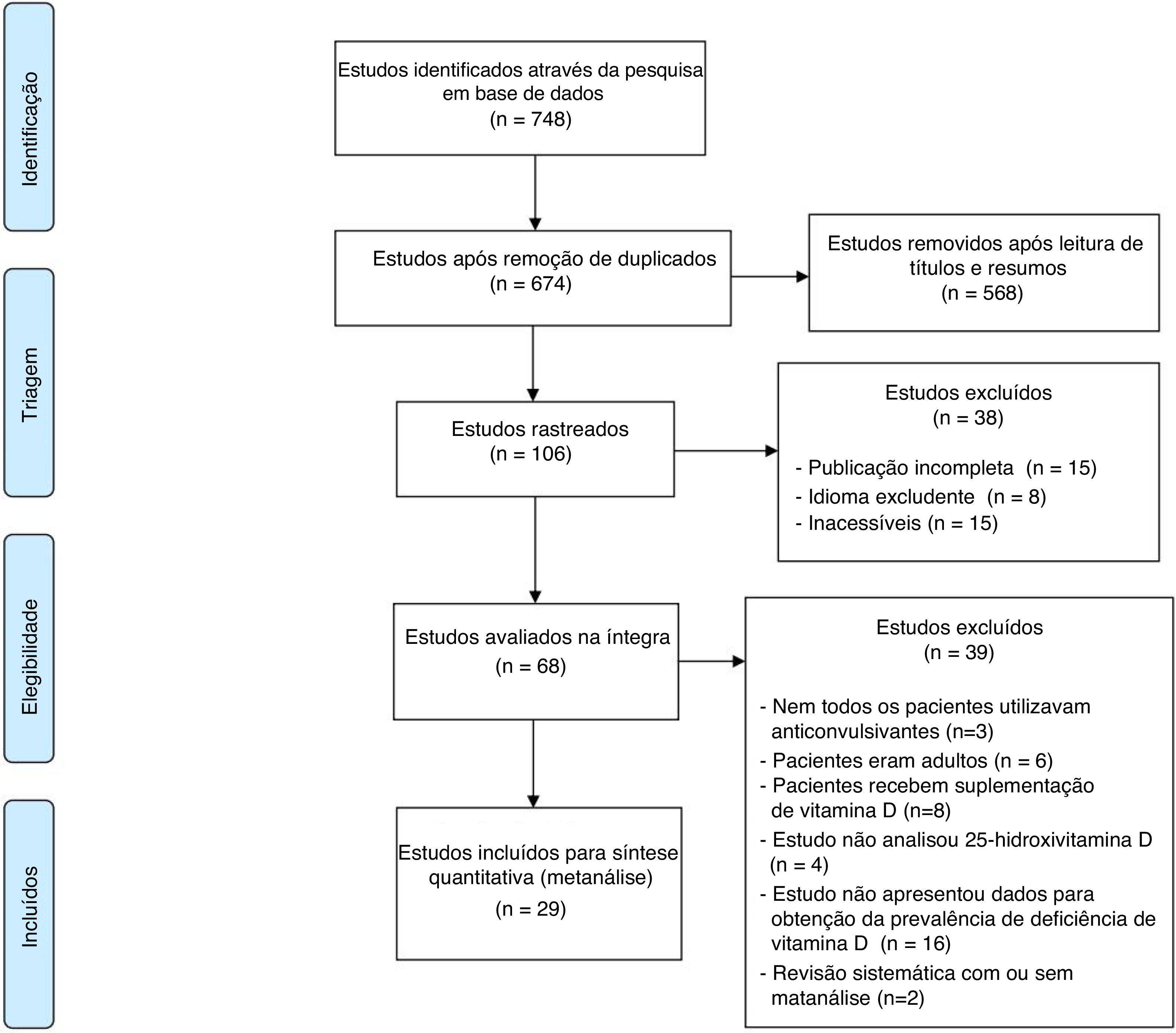
ResultadosO fluxograma com os resultados da pesquisa e detalhes da seleção pode ser visualizado na figura 1.17 Durante a busca, foram encontrados 748 artigos, dos quais 29 mostraram‐se relevantes aos objetivos desse estudo (tabela 1).18–39 Foram incluídas 2.368 crianças.
Fluxograma com os resultados da pesquisa e detalhes da seleção.
Adaptado de Moher et al.17
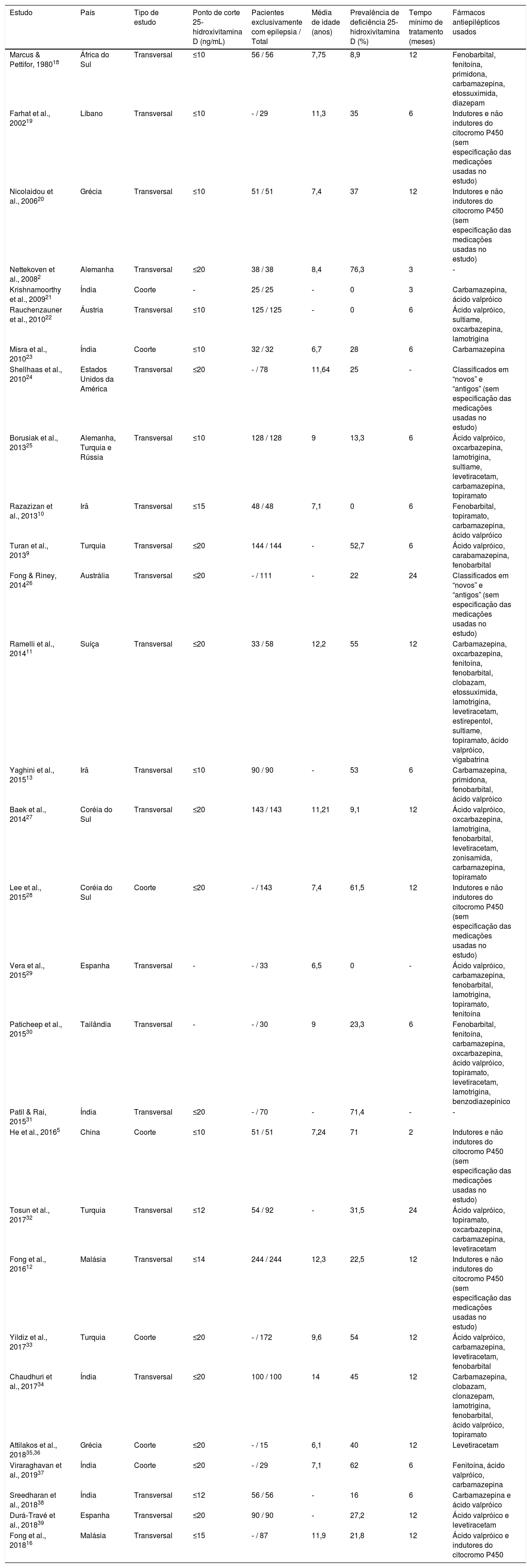
Características dos estudos incluídos na análise final
| Estudo | País | Tipo de estudo | Ponto de corte 25‐hidroxivitamina D (ng/mL) | Pacientes exclusivamente com epilepsia / Total | Média de idade (anos) | Prevalência de deficiência 25‐hidroxivitamina D (%) | Tempo mínimo de tratamento (meses) | Fármacos antiepilépticos usados |
|---|---|---|---|---|---|---|---|---|
| Marcus & Pettifor, 198018 | África do Sul | Transversal | ≤10 | 56 / 56 | 7,75 | 8,9 | 12 | Fenobarbital, fenitoína, primidona, carbamazepina, etossuximida, diazepam |
| Farhat et al., 200219 | Líbano | Transversal | ≤10 | ‐ / 29 | 11,3 | 35 | 6 | Indutores e não indutores do citocromo P450 (sem especificação das medicações usadas no estudo) |
| Nicolaidou et al., 200620 | Grécia | Transversal | ≤10 | 51 / 51 | 7,4 | 37 | 12 | Indutores e não indutores do citocromo P450 (sem especificação das medicações usadas no estudo) |
| Nettekoven et al., 20082 | Alemanha | Transversal | ≤20 | 38 / 38 | 8,4 | 76,3 | 3 | ‐ |
| Krishnamoorthy et al., 200921 | Índia | Coorte | ‐ | 25 / 25 | ‐ | 0 | 3 | Carbamazepina, ácido valpróico |
| Rauchenzauner et al., 201022 | Áustria | Transversal | ≤10 | 125 / 125 | ‐ | 0 | 6 | Ácido valpróico, sultiame, oxcarbazepina, lamotrigina |
| Misra et al., 201023 | Índia | Coorte | ≤10 | 32 / 32 | 6,7 | 28 | 6 | Carbamazepina |
| Shellhaas et al., 201024 | Estados Unidos da América | Transversal | ≤20 | ‐ / 78 | 11,64 | 25 | ‐ | Classificados em “novos” e “antigos” (sem especificação das medicações usadas no estudo) |
| Borusiak et al., 201325 | Alemanha, Turquia e Rússia | Transversal | ≤10 | 128 / 128 | 9 | 13,3 | 6 | Ácido valpróico, oxcarbazepina, lamotrigina, sultiame, levetiracetam, carbamazepina, topiramato |
| Razazizan et al., 201310 | Irã | Transversal | ≤15 | 48 / 48 | 7,1 | 0 | 6 | Fenobarbital, topiramato, carbamazepina, ácido valpróico |
| Turan et al., 20139 | Turquia | Transversal | ≤20 | 144 / 144 | ‐ | 52,7 | 6 | Ácido valpróico, carabamazepina, fenobarbital |
| Fong & Riney, 201426 | Austrália | Transversal | ≤20 | ‐ / 111 | ‐ | 22 | 24 | Classificados em “novos” e “antigos” (sem especificação das medicações usadas no estudo) |
| Ramelli et al., 201411 | Suíça | Transversal | ≤20 | 33 / 58 | 12,2 | 55 | 12 | Carbamazepina, oxcarbazepina, fenitoína, fenobarbital, clobazam, etossuximida, lamotrigina, levetiracetam, estirepentol, sultiame, topiramato, ácido valpróico, vigabatrina |
| Yaghini et al., 201513 | Irã | Transversal | ≤10 | 90 / 90 | ‐ | 53 | 6 | Carbamazepina, primidona, fenobarbital, ácido valpróico |
| Baek et al., 201427 | Coréia do Sul | Transversal | ≤20 | 143 / 143 | 11,21 | 9,1 | 12 | Ácido valpróico, oxcarbazepina, lamotrigina, fenobarbital, levetiracetam, zonisamida, carbamazepina, topiramato |
| Lee et al., 201528 | Coréia do Sul | Coorte | ≤20 | ‐ / 143 | 7,4 | 61,5 | 12 | Indutores e não indutores do citocromo P450 (sem especificação das medicações usadas no estudo) |
| Vera et al., 201529 | Espanha | Transversal | ‐ | ‐ / 33 | 6,5 | 0 | ‐ | Ácido valpróico, carbamazepina, fenobarbital, lamotrigina, topiramato, fenitoína |
| Paticheep et al., 201530 | Tailândia | Transversal | ‐ | ‐ / 30 | 9 | 23,3 | 6 | Fenobarbital, fenitoína, carbamazepina, oxcarbazepina, ácido valpróico, topiramato, levetiracetam, lamotrigina, benzodiazepinico |
| Patil & Rai, 201531 | Índia | Transversal | ≤20 | ‐ / 70 | ‐ | 71,4 | ‐ | ‐ |
| He et al., 20165 | China | Coorte | ≤10 | 51 / 51 | 7,24 | 71 | 2 | Indutores e não indutores do citocromo P450 (sem especificação das medicações usadas no estudo) |
| Tosun et al., 201732 | Turquia | Transversal | ≤12 | 54 / 92 | ‐ | 31,5 | 24 | Ácido valpróico, topiramato, oxcarbazepina, carbamazepina, levetiracetam |
| Fong et al., 201612 | Malásia | Transversal | ≤14 | 244 / 244 | 12,3 | 22,5 | 12 | Indutores e não indutores do citocromo P450 (sem especificação das medicações usadas no estudo) |
| Yildiz et al., 201733 | Turquia | Coorte | ≤20 | ‐ / 172 | 9,6 | 54 | 12 | Ácido valpróico, carbamazepina, levetiracetam, fenobarbital |
| Chaudhuri et al., 201734 | Índia | Transversal | ≤20 | 100 / 100 | 14 | 45 | 12 | Carbamazepina, clobazam, clonazepam, lamotrigina, fenobarbital, ácido valpróico, topiramato |
| Attilakos et al., 201835,36 | Grécia | Coorte | ≤20 | ‐ / 15 | 6,1 | 40 | 12 | Levetiracetam |
| Viraraghavan et al., 201937 | Índia | Coorte | ≤20 | ‐ / 29 | 7,1 | 62 | 6 | Fenitoína, ácido valpróico, carbamazepina |
| Sreedharan et al., 201838 | Índia | Transversal | ≤12 | 56 / 56 | ‐ | 16 | 6 | Carbamazepina e ácido valpróico |
| Durá‐Travé et al., 201839 | Espanha | Transversal | ≤20 | 90 / 90 | ‐ | 27,2 | 12 | Ácido valpróico e levetiracetam |
| Fong et al., 201816 | Malásia | Transversal | ≤15 | ‐ / 87 | 11,9 | 21,8 | 12 | Ácido valpróico e indutores do citocromo P450 |
Os estudos foram feitos em 17 países diferentes, em sua grande maioria no hemisfério norte. Turquia e Índia foram os países onde mais houve publicações. Em relação ao ponto de corte usado para definir deficiência de 25‐hidroxivitamina D, houve variação de 10 a 20 ng/mL, o valor de 20 ng/mL foi o mais frequentemente encontrado (13 estudos).
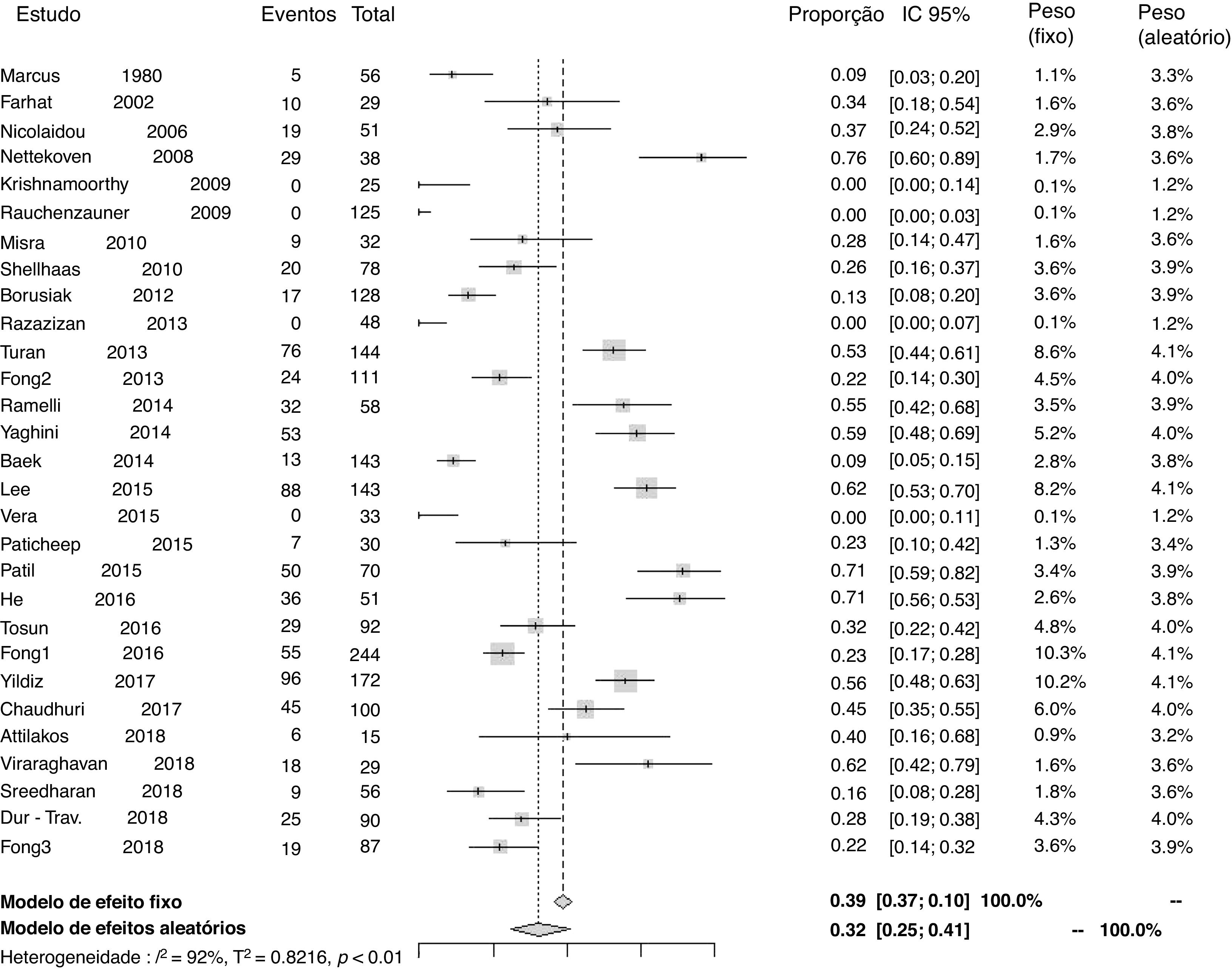
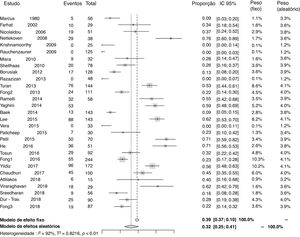
Prevalência de deficiência de 25‐hidroxivitamina DVinte e nove estudos reportaram dados para o cálculo de prevalência de deficiência de 25‐hidroxivitamina D. A proporção de pacientes em uso de fármaco antiepiléptico que desenvolveu deficiência em relação ao total de pacientes foi de 0,32 (IC 95%=0,25–0,41) (I2=92%, p <0,01) (fig. 2). Análise através de funnel plot demonstrou viés de publicação.
Prevalência de deficiência de 25‐hidroxivitamina D por subgruposA prevalência de deficiência de 25‐hidroxivitamina D foi analisada por subgrupos, conforme o tipo de estudo (transversal e coorte), consideraram‐se os pacientes exclusivamente com epilepsia (sem comprometimento motor) e segundo o tipo de fármaco antiepiléptico usado (indutores do CYP450, não indutores do CYP450 ou não metabolizados por essa via). Os resultados foram os seguintes: na amostra de estudos transversais (22 artigos), 0,28 (IC 95%=0,21–0,37) (I2=92%, p <0,01); na amostra de estudos de coorte (sete artigos), 0,52 (IC 95%=0,40–0,64) (I2=76%, p <0,01); na análise de pacientes que apresentam exclusivamente epilepsia, 0,29 (IC 95%=0,20–0,40) (I2=92%, p <0,01); no grupo de pacientes em uso de fármacos antiepilépticos indutores do CYP450, 0,33 (IC 95%=0,21–0,47) (I2=86%, p <0,01); no grupo de pacientes em uso de fármacos antiepilépticos não indutores do CYP450, 0,24 (IC 95%=0,15–0,36) (I2=82%, p <0,01); no grupo de pacientes em uso de outros fármacos antiepilépticos, os quais não apresentam efeito relacionado ao metabolismo hepático através do CYP450, 0,25 (IC 95%=0,11–0,46) (I2=64%, p <0,01). Também foi feita análise da prevalência, desconsideraram‐se os quatro estudos que apresentavam zero pacientes com deficiência de 25‐hidroxivitamina D.10,21,22,29 Nela, a proporção de pacientes que desenvolveu deficiência de 25‐hidroxivitamina D em relação ao total de pacientes foi de 0,37 (IC 95%=0,29–0,45) (I2=92%, p <0,01). Funnel plots mostraram viés de publicação nas análises por subgrupos.
DiscussãoEsta metanálise sumarizou os dados de 29 estudos que analisaram deficiência de 25‐hidroxivitamina D em pacientes pediátricos em uso de fármaco antiepiléptico, englobaram‐se 2.368 pacientes. Aproximadamente 760 apresentavam deficiência de vitamina D no momento da avaliação – prevalência de 32%. Esse resultado é consistente com o que a literatura médica tem mostrado há algumas décadas, de que o uso de fármaco antiepiléptico pode implicar deficiência 25‐hidroxivitamina D e consequente pioria na saúde óssea de pacientes com epilepsia.8,40
Sabe‐se que exposição solar e dieta são alguns dos principais fatores envolvidos no metabolismo e concentração plasmática de 25‐hidroxivitamina D. Dessa maneira, é esperado encontrar uma maior prevalência de deficiência de 25‐hidroxivitamina D em países localizados em latitudes maiores41 e em locais com alimentação pobre em vitamina D2 e D3.42 Levando‐se em consideração que a Turquia foi o país que mais gerou estudos para esta revisão, buscou‐se encontrar referência para valor de 25‐hidroxivitamina D naquela população. Hocaoglu‐emre et al.43 avaliaram uma amostra de 640 crianças residentes em Istambul (Turquia) e encontraram valor médio de 25‐hidroxivitamina D de 25,95 ng/mL e prevalência de deficiência de 5,6%, consideraram‐se valores menores do que 12 ng/mL. Essa informação sugere que a prevalência encontrada nesta metanálise realmente possa estar relacionada ao uso de fármaco antiepiléptico.
Condições que determinam prejuízo motor, como a paralisia cerebral, também estão associadas à doença óssea de forma independente.8 Com o intuito de excluir possível fator de confusão, fez‐se metanálise do subgrupo de pacientes que apresentam exclusivamente epilepsia, ou seja, que não apresentam deficiência motora. Diferentemente do que alguns estudos na literatura mostraram previamente,28,32 a análise do subgrupo não mostrou diferença na prevalência de deficiência de 25‐hidroxivitamina D em relação àquela feita para a amostra total de estudos. O fato de que a maior parte dos pacientes incluídos na análise total apresentava epilepsia isoladamente contribuiu para esse achado.
Outro fator relatado como risco para deficiência de 25‐hidroxivitamina D e pioria da saúde óssea nesses pacientes é o uso de fármacos antiepilépticos indutores do metabolismo hepático através do CYP450.5,12,13 Dessa forma, fez‐se também avaliação da prevalência de deficiência de vitamina D conforme subgrupos relacionados ao perfil dos fármacos antiepilépticos usados. O subgrupo de pacientes que usou fármacos antiepilépticos indutores apresentou prevalência de 25‐hidroxivitamina D maior (33%) em relação ao subgrupo que fez uso de fármacos antiepilépticos não indutores (24%) e ao subgrupo que fez uso de fármacos antiepilépticos não metabolizados através desse sistema (25%). Os fármacos antiepilépticos também podem ser divididos entre indutores potentes (fenobarbital, fenitoína e carbamazepina) ou fracos (topiramato em doses acima de 200mg/dia e oxcarbazepina).44 Entretanto, essa subanálise não foi feita neste estudo. Provavelmente, para cada fármaco antiepiléptico exista mais de um mecanismo responsável por seu efeito no metabolismo ósseo,45 bem como para cada sujeito ocorra uma resposta individual ao fármaco antiepiléptico usado, determinada geneticamente.46
Considerando‐se o delineamento dos artigos incluídos, todos eram estudos observacionais. Sabe‐se que as metanálises de estudos observacionais apresentam características particulares em função de vieses inerentes e diferentes delineamentos dos estudos.14 Na tentativa de tornar a análise mais homogênea, foram feitas subanálises conforme o tipo de estudo. Na análise dos estudos de coorte observou‐se prevalência de deficiência de 25‐hidroxivitamina D de 52% e heterogeneidade pouco menor entre os estudos em comparação com a análise dos estudos transversais, que manteve valores semelhantes aos observados na avaliação na amostra total de estudos.
Em relação à análise da prevalência de 25‐hidroxivitamina D e sem se considerarem‐se os estudos que apresentaram zero paciente com deficiência de 25‐hidroxivitamina D, observou‐se que não houve diferença no valor relacionado à heterogeneidade quando comparado à amostra total. As possíveis explicações encontradas para a inexistência de pacientes com deficiência nesses estudos foram as seguintes: Rauchenzauner et al.22 incluíram apenas pacientes em monoterapia com fármacos antiepilépticos não indutores enzimáticos ou minimamente indutores enzimáticos; Krishnamoorthy et al.21 e Vera et al.29 não expuseram o ponto de corte usado para deficiência de 25‐hidroxivitamina D e seus estudos têm um tamanho amostral pequeno; e, finalmente, Razazizan et al.10 caracterizaram sua amostra como pacientes em monoterapia, que apresentavam atividade física normal e eram adequadamente expostos ao sol.
Por fim, ressalta‐se que a principal inovação desta pesquisa foi o desfecho usado. Metanálises anteriores usaram desfecho de densidade mineral óssea ou consideraram a variação de 25‐hidroxivitamina D com o uso do fármaco antiepiléptico que, apesar de ser uma informação significativa, nem sempre resulta em significado clínico.8,47,48
LimitaçõesEntende‐se que esta metanálise apresenta algumas limitações. Os estudos apresentam metodologias diferentes para aferir esse metabólito. Na análise do desfecho principal não existe uma uniformidade entre os estudos na definição do ponto de corte para deficiência de 25‐hidroxivitamina D nos. Sem dúvida esses fatores estão envolvidos na elevada heterogeneidade observada em praticamente todas as análises, inclusive por subgrupos. Os artigos também carecem de dados relacionados ao tipo de epilepsia, causa da epilepsia, história familiar de osteoporose e prática de atividade física. Tendo em vista que as alterações no metabolismo da vitamina D relacionadas ao uso de fármacos antiepilépticos parecem ter uma etiologia multifatorial,8 todos estes dados são possíveis fatores de confusão na análise.
Não foram feitas subanálises conforme classificação dos fármacos antiepilépticos em potentes ou fracos indutores do citocromo P450. Dessa forma, fármacos como fenobarbital, fenitoína e carbamazepina poderiam estar relacionados a valores ainda mais expressivos de deficiência de vitamina D do que os determinados nesta metanálise.
Embora tenham sido incluídos somente artigos em língua portuguesa, espanhola e inglesa, por conveniência dos pesquisadores, o impacto foi mínimo, pois somente oito estudos foram excluídos em função desse critério.
ConclusãoA deficiência de vitamina D e a doença óssea são situações clínicas negligenciadas no contexto de uso prolongado de fármacos antiepilépticos na infância. Observa‐se que apesar de existir um embasamento fisiopatológico consistente para as alterações no metabolismo de 25‐hidroxivitamina D em função do uso da medicação, os dados evidenciados nesta metanálise não apontam de forma confiável a existência de deficiência relacionada. Entretanto, por se tratar de uma doença multifatorial e complexa, acredita‐se que ainda são necessários esforços em direção ao melhor entendimento de possíveis fatores relacionados no processo, bem como à uniformização de parâmetro de avaliação de deficiência de vitamina D nos estudos.
Levando‐se em consideração os efeitos deletérios da deficiência de vitamina D na saúde óssea e, consequentemente, na qualidade de vida desses sujeitos, sugere‐se incluir em seu atendimento o monitoramento de 25‐hidroxivitamina D, suplementação com colecalciferol e tratamento de deficiência de 25‐hidroxivitamina D quando existente. Essa conduta vai ao encontro do princípio de não se tratar apenas crises epilépticas, e sim pacientes com epilepsia, que por vezes apresentam deficiência motora, são pouco expostos à luz solar e não consomem ingesta diária suficiente em vitaminas D2 e D3. Sugere‐se também considerar os pacientes em uso de fármacos antiepilépticos indutores do citocromo P450 como grupo de maior risco para desenvolver deficiência de vitamina D.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
☆ Como citar este artigo: Junges C, Machado TD, Nunes Filho PR, Riesgo R, Mello ED. Vitamin D deficiency in pediatric patients using antiepileptic drugs: systematic review with meta‐analysis. J Pediatr (Rio J). 2020;96:547–56.
Estudo vinculado à Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil.