The aim of this review was to address advances in management and treatment of acute viral bronchiolitis in infants.
SourcesA systematic review search was made including all articles published in English between 2010 and 2017, and available in the electronic databases PubMed and Cochrane Central Register of Controlled Trials (CENTRAL) and specialized register of the Acute Respiratory Infections Group (Cochrane review group). The following MESH terms in English were included, using different Boolean operators for the search strategy: “bronchiolitis, viral,” “diagnosis,” “epidemiology,” “etiology,” “therapy,” “virology,” “prevention and control,” “respiratory syncytial virus, human.” Additional filters were used.
Summary of findingsFew effective interventions are recommended for the management of RSV bronchiolitis in young infants. The main goal is to ensure an adequate oxygen supplementation and fluid balance whenever deemed necessary. Hypertonic saline nebulization is helpful only for hospitalized infants. Numerous antiviral drugs and specific vaccines for RSV are under evaluation and foretell advances in disease management in the near future.
ConclusionA number of promising new technologies are advancing in the field. Until new interventions became feasible, early detection and modification of preventable risk factors is essential to improve outcomes.
Abordar avanços no manejo e no tratamento de bronquiolite viral aguda em neonatos.
FontesUma pesquisa de análise sistemática foi feita e incluiu todos os artigos publicados em inglês entre 2010 e 2017 e disponíveis nas bases de dados eletrônicas PubMed, no Registro Central de Ensaios Controlados (Central) da Cochrane e no registro especializado do Grupo de Infecções Respiratórias Agudas (grupo de revisão Cochrane). Os seguintes termos MESH em inglês foram incluídos na abordagem com diferentes operadores booleanos para a estratégia de pesquisa: “bronquiolite, viral”, “diagnóstico”, “epidemiologia”, “etiologia”, “terapia”, “virologia”, “prevenção e controle”, “vírus sincicial respiratório, humano”. Foram usados filtros adicionais.
Resumo dos achadosPoucas intervenções efetivas são recomendadas para o manejo da bronquiolite por VSR em neonatos jovens. O principal objetivo é garantir uma suplementação de oxigênio adequada e equilíbrio de fluidos sempre que considerado necessário. A nebulização de solução salina hipertônica ajuda apenas em casos de neonatos hospitalizados. Vários medicamentos antivirais e vacinas específicas contra VSR estão em fase de avaliação e predizem avanços no manejo da doença no futuro próximo.
ConclusãoVárias novas tecnologias promissoras avançam no campo. Até que as novas intervenções se tornem viáveis, a detecção precoce e a modificação de fatores de risco de prevenção são fundamentais para melhorar os resultados.
A bronquiolite por vírus sincicial respiratório (VSR) é a causa mais frequente de infecção do trato respiratório inferior (ITRI) e internação em neonatos jovens em todo o mundo.1,2 A doença foi associada a até 199.000 óbitos por ano em crianças com menos de cinco anos (U5) e aproximadamente um milhão de internações anualmente;1–4 99% desses óbitos ocorrem em países em desenvolvimento.1 Em países industrializados, os óbitos por VSR não são frequentes e estão associados a doenças pulmonares crônicas, doenças neuromusculares, doença cardíaca, síndrome de Down e nascimento prematuro.5 Até os dois anos, mais de 95% das crianças foram infectadas pelo vírus.6
A bronquiolite aguda por VSR é uma doença sazonal, que normalmente começa entre o outono e a primavera, com seu pico no inverno. Os trópicos são a exceção e não há sazonalidade específica nessas regiões, apesar da associação hipotética de algumas epidemias à estação das chuvas.2 A infecção por VSR normalmente é leve e começa com sintomas do trato respiratório superior, assemelha‐se a um resfriado comum.7,8 Depois de alguns dias, a doença passará a afetar os bronquíolos distais em alguns pacientes, com sinais clínicos de taquipneia, pieira, crepitações, roncos e retração torácica.7,9 Aproximadamente 1 a 3% das crianças infectadas desenvolvem dificuldades de alimentação, apneia ou não conseguem manter a saturação de oxigênio adequada (SpO2), o que exige internação hospitalar para terapia de apoio.2,4,10 Poucos neonatos, principalmente aqueles com comorbidades, avançarão para insuficiência respiratória ou óbito.1,2,5 Diversos estudos sugerem uma associação entre bronquiolite grave por VSR e pieira recorrente, que desaparece ao término da primeira década de vida.11–13 Com maior frequência do que a VSR, os rinovírus, quando associados à sensibilização atópica no início da vida, são associados à asma.14 O custo total das internações devido a bronquiolite nos Estados Unidos em 2009 foi próximo de dois bilhões de dólares. Apesar de as tendências nas taxas de internação nos Estados Unidos terem caído entre 2000 e 2009, os custos aumentaram devido ao aumento do uso de terapia intensiva em pacientes de alto risco.15 Porém, apesar de sua alta morbidez, despesas econômicas com relação às taxas de mortalidade em países em desenvolvimento e associação da VSR com sequelas pulmonares transitórias (por exemplo: pieira recorrente), o tratamento de ITRI por VSR ainda é sintomático e tem lacunas significativas. Ademais, mais de 50 anos após sua descoberta, nenhuma vacina licenciada contra VSR está disponível. O palivizumabe, um anticorpo monoclonal humanizado (mAb) efetivo contra a proteína de fusão (F) do VSR, está disponível para neonatos prematuros, com displasia broncopulmonar (DBP) e com cardiopatia congênita cianótica.16 Apesar de o palivizumabe reduzir significativamente a ITRI por VSR grave, o medicamento é caro e exige diversas doses, limita seu uso em países industrializados e em desenvolvimento. Assim, vacinas e tratamentos seguros e baratos são extremamente necessários para diminuir o impacto do VSR em crianças.
FontesUma pesquisa de análise sistemática foi feita e incluiu todos os artigos publicados em inglês entre 2010 e 2017, disponíveis nas bases de dados eletrônicas PubMed, no Registro Central de Ensaios Controlados (Central) da Cochrane e no registro especializado do Grupo de Infecções Respiratórias Agudas (grupo de revisão Cochrane). Relatórios de diretrizes recentes também foram pesquisados. Os seguintes termos MESH em inglês foram incluídos na abordagem com diferentes operadores booleanos para a estratégia de pesquisa da Pubmed: “bronquiolite, viral”, “diagnóstico”, “epidemiologia”, “etiologia”, “terapia”, “virologia”, “prevenção e controle”, “vírus sincicial respiratório, humano”. Foram usados filtros adicionais: idades entre um e 23 meses e metodologia de estudo (ensaio clínico, estudo comparativo, ensaio clínico controlado, diretriz, metanálise, diretriz de prática, ensaio clínico controlado e randomizado e análises sistemáticas). Além disso, buscamos estudos na biblioteca Cochrane, após registro especializado no “Grupo de Infecções Respiratórias Agudas”, tópico “saúde da criança”, “pulmão e vias aéreas, infecções respiratórias: bronquiolite e vírus sincicial respiratório”. Os termos MESH da pesquisa no Central foram “vírus sincicial respiratório, humano” e “bronquiolite, viral”.
Uma busca foi feita em ClinicalTrials.gov para encontrar novas vacinas, anticorpos e tecnologias antivirais contra infecção por VSR. Para esse fim, foram incluídos termos em inglês como “infecções por vírus sincicial respiratório”, filtrados pelo status do estudo (ativo, em recrutamento, ainda não recrutados, período de inscrição), critérios de elegibilidade (crianças e grávidas adultas), tipo de estudo intervencionista e fase do estudo (1 a 3).
Resumo dos achadosDiagnóstico e monitoramentoNão há escore amplamente validado para a gravidade da ITRI por VSR. Um exame físico abrangente é essencial para a avaliação inicial dos pacientes. Evidências de alimentação ou ingestão de fluidos inadequada, histórico de apneia, letargia ou insuficiência respiratória moderada a grave (dilatação nasal, taquipneia, roncos, retrações ou cianose) e/ou uma saturação de oxigênio (SaO2) ≤ 92% no ar ambiente (os pontos de corte para saturação de oxigênio aceitável variam por país), garantia de internação, de preferência em um hospital com nível de atendimento secundário.8,17
A patogênese da insuficiência respiratória aguda na bronquiolite por VSR é caracterizada por obstrução das pequenas vias aéreas, maior resistência das vias aéreas, atelectasia alveolar, fadiga muscular e hipoxemia devido à incompatibilidade entre ventilação e perfusão.18 Portanto, a internação na unidade de terapia intensiva pediátrica (UTIP) deve ser considerada em pacientes que apresentam sinais clínicos de exaustão, marcadores de insuficiência respiratória aguda (definidos como PaO2/FiO2 ≤ 300 mmHg) ou sinais de apneia.2,8,17,18
Saturação de oxigênioUma das principais preocupações durante a ITRI por VSR grave é o fornecimento de oxigênio inadequado para os tecidos (hipoxemia).8 O conteúdo do oxigênio arterial distribuído por meio dos tecidos pode ser medido com saturação de oxigênio arterial (SaO2), que representa uma razão entre a concentração de oxi‐hemoglobina e a concentração total de hemoglobina.8 A ferramenta mais amplamente usada para avaliar a SaO2 é a oximetria de pulso (SpO2), pois é uma técnica não invasiva.8 Apesar de seu uso frequente, a SpO2 é reconhecida por apresentar uma variabilidade de ± 2%.8,17,19 O monitoramento da saturação de oxigênio não é recomendado em pacientes ambulatoriais, cujos estados clínico e de alimentação são adequados, porque essa intervenção possivelmente induziria internações hospitalares desnecessárias. Como os critérios de corte da SpO2 tendem a diferir entre estudos e entre diretrizes de prática clínica, uma boa avaliação clínica é importante no processo de decisão.8,19 A Academia Americana de Pediatria (AAP) recomenda uma SpO2 de 90% como limite para a administração de oxigênio suplementar.19 Na ausência de evidências claras sobre os níveis de SpO2 para predizer a progressão da bronquiolite, o Comitê do Instituto Nacional para a Saúde e Excelência Clínica (NICE) determinou uma SpO2 de 92% como ponto de corte da suplementação.8 Outros fatores, inclusive uma avaliação clínica abrangente e uma avaliação de condições de vida e fatores de risco social, também devem contribuir para o processo de tomada de decisões.
O teste de gás no sangue normalmente não é indicado para pacientes hospitalizados e não ajuda no manejo habitual da bronquiolite viral. A exceção é para pacientes com sinais de exaustão respiratória, apneia e incapacidade de manter uma SpO2 adequada apesar do oxigênio suplementar.8
Teste etiológicoO diagnóstico etiológico é comum durante a prática clínica em hospitais e é a norma em estudos epidemiológicos.20 Embora terapias específicas de vírus ainda não estejam disponíveis, a identificação do vírus poderá ajudar a diminuir o uso de antibióticos.17 A reação em cadeia de proteína (PCRq) em tempo real é o padrão de base para o diagnóstico, embora seu custo, principalmente em países em desenvolvimento, diminua seu uso rotineiro.17,19,21 A imunofluorescência é mais barata, com sensibilidade muito boa ao VSR em especial, porém dependente do operador.17 Apesar de não haver motivo justificado para obtenção de hemoculturas ou contagens de leucócitos em pacientes com bronquiolite aguda, a infecção bacteriana deve ser investigada naqueles com sinais de sepse ou pneumonia.2,19 A sepse bacteriana em neonatos jovens com bronquiolite viral, principalmente episódios desencadeados por cocos gram‐positivos, tem sido associada a um maior risco de óbito em países em desenvolvimento.2 O raios X do tórax poderia ser considerado em pacientes com insuficiência respiratória prejudicial.8,19,22
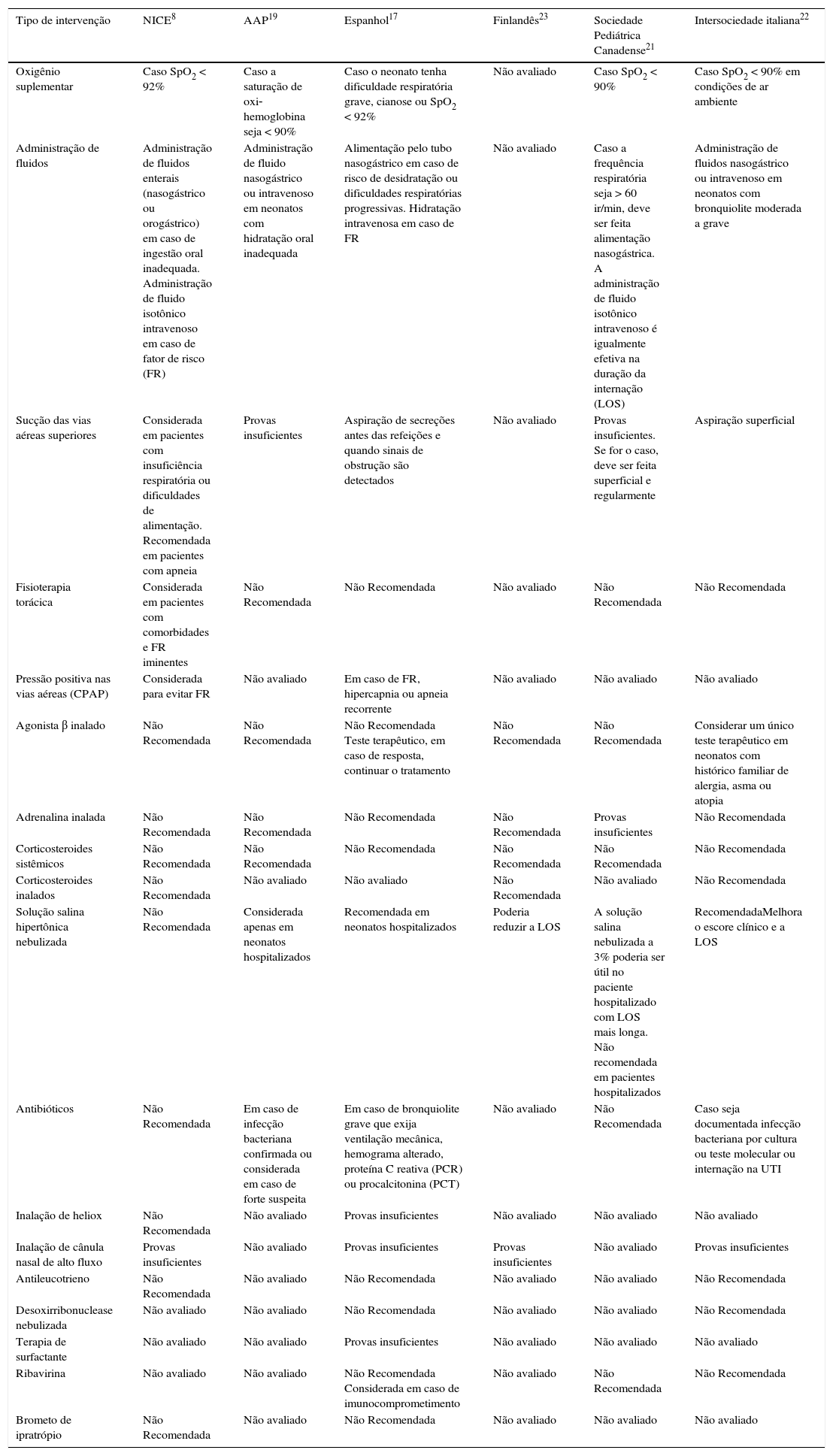
Manejo sugeridoApoio respiratórioSeis diretrizes e dez análises sistemáticas de bases de dados da Cochrane foram analisadas para resumir o manejo recomendado na bronquiolite viral aguda (tabela 1).8,19,21–34 No geral, poucas intervenções de tratamento são sugeridas para a bronquiolite e o principal objetivo durante a infecção aguda é atingir um equilíbrio de fluidos adequado e níveis de saturação de oxigênio normais (tabela 1). Neonatos com bronquiolite viral apresentam maior produção de muco, detritos epiteliais que invadem o lúmen bronquiolar, edema peribronquiolar e infiltração de leucócitos. Além disso, pequenas vias aéreas e sacos alveolares em desenvolvimento são mais propensos a colapsar, geram um desequilíbrio na ventilação/perfusão que normalmente leva a hipoxemia e, em estágios avançados, hipercapnia.18 Portanto, quando a SpO2 está abaixo de 90‐92%, o oxigênio suplementar poderia ser administrado para aumentar os níveis de oxi‐hemoglobina.8,17 Diversos dispositivos para suplementação de oxigênio estão disponíveis, inclusive cânula nasal, máscara facial e, em casos graves, tubo endotraqueal. A cânula nasal de alto fluxo (CNAF) permite o fornecimento de maiores fluxos de oxigênio umidificado e também pode proporcionar alguma pressão positiva nas vias aéreas, melhora a taxa de ventilação/perfusão. Apesar desses possíveis benefícios, a CNAF não foi superior à suplementação de oxigênio padrão quando o principal resultado foi o tempo de suplementação de oxigênio on/off, o tempo para descarregar e a duração da internação.31 A pressão positiva contínua nas vias aéreas (CPAP) é uma modalidade de ventilação mecânica não invasiva que melhora a resistência das vias aéreas, diminui o impacto da atelectasia ao distender o diâmetro do lúmen bronquial/bronquiolar. Os pacientes com piora na bronquiolite aguda ou bronquiolite aguda grave, apesar da suplementação de oxigênio, poderão ser beneficiados pela CPAP.17
Recomendações de manejo da bronquiolite com base em diretrizes
| Tipo de intervenção | NICE8 | AAP19 | Espanhol17 | Finlandês23 | Sociedade Pediátrica Canadense21 | Intersociedade italiana22 |
|---|---|---|---|---|---|---|
| Oxigênio suplementar | Caso SpO2 < 92% | Caso a saturação de oxi‐hemoglobina seja < 90% | Caso o neonato tenha dificuldade respiratória grave, cianose ou SpO2 < 92% | Não avaliado | Caso SpO2 < 90% | Caso SpO2 < 90% em condições de ar ambiente |
| Administração de fluidos | Administração de fluidos enterais (nasogástrico ou orogástrico) em caso de ingestão oral inadequada. Administração de fluido isotônico intravenoso em caso de fator de risco (FR) | Administração de fluido nasogástrico ou intravenoso em neonatos com hidratação oral inadequada | Alimentação pelo tubo nasogástrico em caso de risco de desidratação ou dificuldades respiratórias progressivas. Hidratação intravenosa em caso de FR | Não avaliado | Caso a frequência respiratória seja > 60 ir/min, deve ser feita alimentação nasogástrica. A administração de fluido isotônico intravenoso é igualmente efetiva na duração da internação (LOS) | Administração de fluidos nasogástrico ou intravenoso em neonatos com bronquiolite moderada a grave |
| Sucção das vias aéreas superiores | Considerada em pacientes com insuficiência respiratória ou dificuldades de alimentação. Recomendada em pacientes com apneia | Provas insuficientes | Aspiração de secreções antes das refeições e quando sinais de obstrução são detectados | Não avaliado | Provas insuficientes. Se for o caso, deve ser feita superficial e regularmente | Aspiração superficial |
| Fisioterapia torácica | Considerada em pacientes com comorbidades e FR iminentes | Não Recomendada | Não Recomendada | Não avaliado | Não Recomendada | Não Recomendada |
| Pressão positiva nas vias aéreas (CPAP) | Considerada para evitar FR | Não avaliado | Em caso de FR, hipercapnia ou apneia recorrente | Não avaliado | Não avaliado | Não avaliado |
| Agonista β inalado | Não Recomendada | Não Recomendada | Não Recomendada Teste terapêutico, em caso de resposta, continuar o tratamento | Não Recomendada | Não Recomendada | Considerar um único teste terapêutico em neonatos com histórico familiar de alergia, asma ou atopia |
| Adrenalina inalada | Não Recomendada | Não Recomendada | Não Recomendada | Não Recomendada | Provas insuficientes | Não Recomendada |
| Corticosteroides sistêmicos | Não Recomendada | Não Recomendada | Não Recomendada | Não Recomendada | Não Recomendada | Não Recomendada |
| Corticosteroides inalados | Não Recomendada | Não avaliado | Não avaliado | Não Recomendada | Não avaliado | Não Recomendada |
| Solução salina hipertônica nebulizada | Não Recomendada | Considerada apenas em neonatos hospitalizados | Recomendada em neonatos hospitalizados | Poderia reduzir a LOS | A solução salina nebulizada a 3% poderia ser útil no paciente hospitalizado com LOS mais longa. Não recomendada em pacientes hospitalizados | RecomendadaMelhora o escore clínico e a LOS |
| Antibióticos | Não Recomendada | Em caso de infecção bacteriana confirmada ou considerada em caso de forte suspeita | Em caso de bronquiolite grave que exija ventilação mecânica, hemograma alterado, proteína C reativa (PCR) ou procalcitonina (PCT) | Não avaliado | Não Recomendada | Caso seja documentada infecção bacteriana por cultura ou teste molecular ou internação na UTI |
| Inalação de heliox | Não Recomendada | Não avaliado | Provas insuficientes | Não avaliado | Não avaliado | Não avaliado |
| Inalação de cânula nasal de alto fluxo | Provas insuficientes | Não avaliado | Provas insuficientes | Provas insuficientes | Não avaliado | Provas insuficientes |
| Antileucotrieno | Não Recomendada | Não avaliado | Não Recomendada | Não avaliado | Não avaliado | Não Recomendada |
| Desoxirribonuclease nebulizada | Não avaliado | Não avaliado | Não Recomendada | Não avaliado | Não avaliado | Não Recomendada |
| Terapia de surfactante | Não avaliado | Não avaliado | Provas insuficientes | Não avaliado | Não avaliado | Não avaliado |
| Ribavirina | Não avaliado | Não avaliado | Não Recomendada Considerada em caso de imunocomprometimento | Não avaliado | Não Recomendada | Não Recomendada |
| Brometo de ipratrópio | Não Recomendada | Não avaliado | Não Recomendada | Não avaliado | Não avaliado | Não avaliado |
AAP, Academia Americana de Pediatria; CPAP, pressão positiva contínua nas vias aéreas; FR, fator de risco; NICE, Comitê do Instituto Nacional para a Saúde e Excelência Clínica; PCR, proteína C reativa; PCT, procalcitonina; SpO2, saturação de oxigênio; UTI, unidade de terapia intensiva.
A manutenção de uma boa hidratação oral e a amamentação são medidas centrais no manejo da bronquiolite. Contudo, caso um neonato hospitalizado não possa receber alimentação via oral devido à alta frequência respiratória (> 60 respirações/minuto), um tubo nasogástrico pode ser colocado para restabelecer a alimentação adequada e a hidratação.8,17,19,21,22 Apesar de a administração de fluidos isotônicos intravenosos não parecer melhor do que a hidratação nasogástrica, ela é usada em pacientes internados na UTIP, naqueles com sinais clínicos de exaustão e nos intolerantes à alimentação via tubo nasogástrico.8,17,19,21,22
Broncodilatadores e esteroides inaladosNenhuma evidência comprova a administração de corticosteroides sistêmicos e/ou agonista β inalado e/ou epinefrina no tratamento de pacientes hospitalizados com bronquiolite viral.8,17,19,21–24 Contudo, as diretrizes espanholas e italianas consideram que o agonista β inalado poderia ser testado uma vez no início do tratamento, principalmente caso um paciente tenha um histórico pessoal ou familiar de atopia, asma ou eczema.17,22 Poucos estudos sugeriram um possível benefício quando a epinefrina foi usada em crianças em um ambiente de pronto socorro, o que reduz o risco de internação hospitalar.24 Ainda assim, o impacto clínico observado é muito pequeno e o tempo de internação e os dias com suplementação de oxigênio dos pacientes não são afetados de forma significativa.
Solução salina hipertônicaA solução salina hipertônica nebulizada tem propriedades osmóticas e mostrou‐se efetiva em pacientes com doença pulmonar obstrutiva crônica (DPOC) e fibrose cística.35 Essa intervenção aumenta o espaço livre das vias aéreas, por meio da redução do edema das vias aéreas, da produção de muco e da reidratação do líquido da superfície das vias áereas.36 Estudos recentes e análises sistemáticas sugerem que a solução salina hipertônica nebulizada poderá ser benéfica apenas para neonatos já internados, porém seu impacto em internações de prevenção é fraco.17,19,21–23
AntibióticosO uso inadequado de antibióticos em pacientes com bronquiolite viral normalmente é observado na prática clínica. Apesar de às vezes ser difícil separar, segundo critérios clínicos e radiológicos, infecções virais de infecções bacterianas, neonatos com ITRI por VSR são apenas excepcionalmente coinfectados e precisam de antibióticos.8,17,19 Crianças que avançam para infecção grave com insuficiência respiratória são internadas em uma UTIP e provavelmente receberão antibióticos empíricos para coinfecções bacterianas.2,17,19,22,37,38
Novas perspectivas de tratamentoNão existem tratamentos efetivos e acessíveis para a bronquiolite por VSR até o momento. Ensaios clínicos experimentais recentes em adultos apresentaram resultados encorajadores com novos candidatos antivirais. Em dois estudos separados sofisticados, a administração de formulações inibidoras de fusão e análogas de nucleosídeo melhorou os sintomas respiratórios em comparação com o placebo.39,40 Contudo, nesses estudos iniciais controlados, os medicamentos foram administrados simultaneamente à inoculação experimental. Assim, eles agiram contra o VSR antes de quaisquer sinais e sintomas observáveis. Ainda não está claro se um benefício semelhante será observado nos neonatos quando o tratamento for iniciado dias depois, quando da apresentação no hospital.
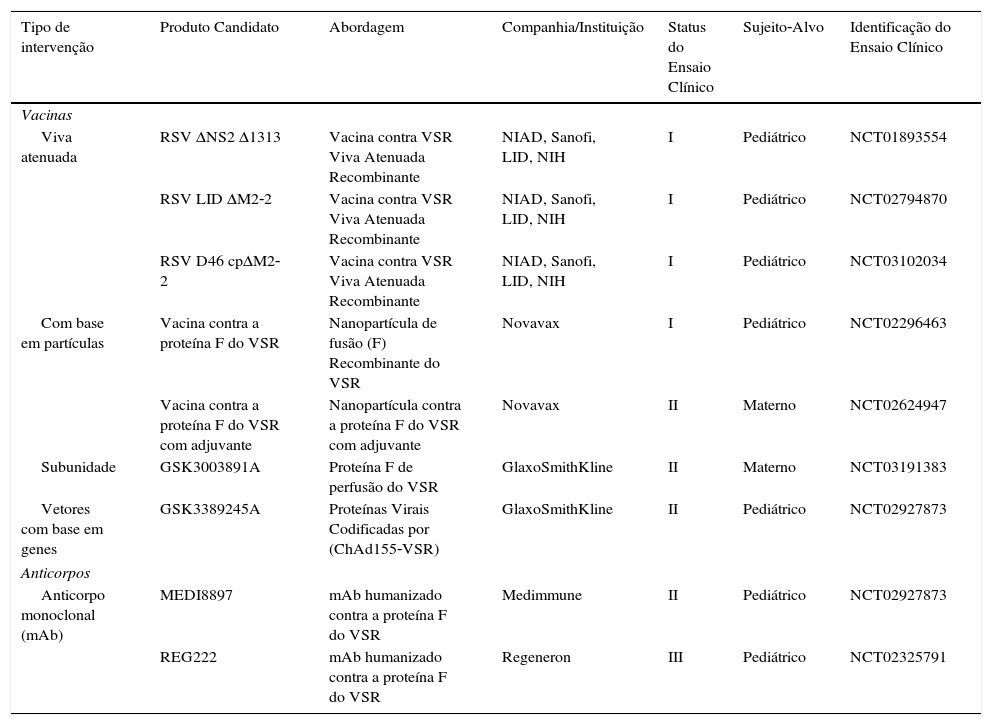
A administração de palivizumabe em grupos de risco específicos é limitada por seu alto custo em muitos países de renda baixa e média.16 Consequentemente, a prevenção da ITRI por VSR é uma prioridade de saúde pública e as iniciativas globais envidaram vários esforços para expandir o campo (tabela 2).
Novas vacinas e anticorpos atuais
| Tipo de intervenção | Produto Candidato | Abordagem | Companhia/Instituição | Status do Ensaio Clínico | Sujeito‐Alvo | Identificação do Ensaio Clínico |
|---|---|---|---|---|---|---|
| Vacinas | ||||||
| Viva atenuada | RSV ΔNS2 Δ1313 | Vacina contra VSR Viva Atenuada Recombinante | NIAD, Sanofi, LID, NIH | I | Pediátrico | NCT01893554 |
| RSV LID ΔM2‐2 | Vacina contra VSR Viva Atenuada Recombinante | NIAD, Sanofi, LID, NIH | I | Pediátrico | NCT02794870 | |
| RSV D46 cpΔM2‐2 | Vacina contra VSR Viva Atenuada Recombinante | NIAD, Sanofi, LID, NIH | I | Pediátrico | NCT03102034 | |
| Com base em partículas | Vacina contra a proteína F do VSR | Nanopartícula de fusão (F) Recombinante do VSR | Novavax | I | Pediátrico | NCT02296463 |
| Vacina contra a proteína F do VSR com adjuvante | Nanopartícula contra a proteína F do VSR com adjuvante | Novavax | II | Materno | NCT02624947 | |
| Subunidade | GSK3003891A | Proteína F de perfusão do VSR | GlaxoSmithKline | II | Materno | NCT03191383 |
| Vetores com base em genes | GSK3389245A | Proteínas Virais Codificadas por (ChAd155‐VSR) | GlaxoSmithKline | II | Pediátrico | NCT02927873 |
| Anticorpos | ||||||
| Anticorpo monoclonal (mAb) | MEDI8897 | mAb humanizado contra a proteína F do VSR | Medimmune | II | Pediátrico | NCT02927873 |
| REG222 | mAb humanizado contra a proteína F do VSR | Regeneron | III | Pediátrico | NCT02325791 | |
VSR, Vírus Sincicial Respiratório.
O desenvolvimento de vacinas contra VSR é desafiador. O histórico de infecção respiratória agravada pelo vírus sincicial respiratório (ERD), a necessidade de imunização no início da vida e a possível interferência de anticorpos maternais naturais complicam as estratégias de imunização.41 Uma vacina adequada deve, de preferência, produzir anticorpos protetores em neonatos com menos de dois meses, que representam o grupo em maior risco de internação.1–3 Seis formulações diferentes de possíveis vacinas contra VSR estão sendo testadas em estudos preventivos e estudos clínicos: viva atenuada ou quimérica, totalmente desativada, com base em partículas, subunidade, ácido nucleico e vetores com base em genes (tabela 2).42 Além disso, a proteção passiva por meio da administração de anticorpos monoclonais de meia vida prolongada no início da vida apresenta uma opção atrativa em fase de avaliação.43
Apesar de o palivizumabe reduzir em 55% as infecções por VSR graves, sua administração é incômoda e o medicamento é caro.16,43 Assim, seu uso está restrito a populações que apresentam alto risco de infecção grave.16 Um novo anticorpo monoclonal contra a conformação pré‐fusão da proteína F do VSR (MEDI8897) tem meia‐vida estendida e potência mais elevada (permite uma única dose intramuscular) e constitui uma opção de potencial atrativo para o futuro.43,44 Outras formulações semelhantes também estão em fase de avaliação.45
Outras perspectivasEmbora várias das estratégias destacadas acima estejam em fase de avaliação, é importante modificar fatores de risco para proteger neonatos jovens. Por exemplo, a amamentação pode reduzir significativamente as internações devido a infecções respiratórias. Comprovado pela grande maioria das crianças, seu efeito benéfico contra a ITRI é mais notável em meninas prematuras.46,47 Assim, incentivar a amamentação é uma atividade de saúde pública fundamental. O leite materno é uma intervenção genuína, barata, de excelente eficácia para todos os neonatos e também deve complementar o palivizumabe em neonatos de alto risco.47
Outras intervenções na dieta e nos hábitos associadas à ITRI grave incluem alta ingestão de carboidratos ou álcool durante o último trimestre de gravidez.4,48 Reduzir o consumo de álcool e a exposição à fumaça de cigarro durante e após a gravidez será benéfico não apenas para o bebê, mas também para a saúde materna.
Outros estudos sugerem que a heterozigosidade do gene TLR4 (Asp299Gly, rs4986790) e hábitos urbanos poderão explicar uma resposta fraca ao palivizumabe em neonatos prematuros e causar ITRI por VSR grave em um subgrupo de nascidos a termo na comunidade.49,50 Ainda deve ser investigado se esses neonatos responderão adequadamente aos anticorpos monoclonais (mAbs) da nova geração e à imunidade transplacentária.
ConclusãoA bronquiolite por VSR é a principal causa de internação infantil em todo o mundo e uma importante causa de morte em países em desenvolvimento.1 Várias novas tecnologias promissoras avançam no campo. Até que as novas intervenções se tornem viáveis, a detecção precoce e a modificação de fatores de risco de prevenção são fundamentais para melhorar os resultados. Pediatras, famílias e autoridades de saúde pública devem contribuir com esses esforços por meio de ações individuais (por exemplo: para de fumar) e abordagem de fatores de risco de infecção grave modificáveis, ao mesmo tempo em que fornecem o melhor tratamento médico possível.
Conflitos de interesseMTC declara não haver conflitos de interesse, FPP atuou em conselhos consultivos na Pfizer, Janssen, Novavax, Bavarian Nordic e Sanofi e RTS foi palestrante para a Abbvie.
Como citar este artigo: Caballero MT, Polack FP, Stein RT. Viral bronchiolitis in young infants: new perspectives for management and treatment. J Pediatr (Rio J). 2017;93:75–83.