Intimins are protein adhesins of enteropathogenic Escherichia coli (EPEC) and enterohemorrhagic E. coli (EHEC) capable of inducing attachment and effacement lesions in enterocytes. Anti‐intimin antibodies are important for the protection from EPEC and EHEC infections because these antibodies inhibit bacterial adhesion and impair the initial step of the pathogenesis. We studied the transfer of maternal anti‐intimin antibodies from healthy Brazilian mothers to their newborns through the placenta and colostrum.
MethodsSerum immunoglobulin G (IgG) and secretory immunoglobulin A antibodies against conserved (cons) and variable regions of intimins α (vα), β (vβ), and γ (vγ) were analyzed using an enzyme linked‐immunosorbent assay in the blood and colostrum from 45 healthy women as well as cord blood serum samples from their newborns.
ResultsThe concentrations of antibodies reactive with vα intimin were significantly lower than those of anti‐vγ and anti‐cons antibodies in the colostrum samples. IgG serum antibodies reactive with all the subtypes of intimins were transferred to the newborns, but the concentrations of anti‐cons serum antibodies were significantly higher in mothers and newborns than concentrations of antibodies against variable regions. The patterns of IgG transfer from mothers to newborns were similar for all anti‐intimin antibodies. These values are similar to the percentage transference of total IgG.
ConclusionsAnti‐intimin antibodies are transferred from mothers to newborns through the placenta, and reinforce the protection provided by breastfeeding against diarrheagenic E. coli infections.
As intiminas são adesinas proteicas de Escherichia coli enteropatogênicas (EPEC) e enterro‐hemorrágicas (EHEC) capazes de induzir as lesões attaching and effacing nos enterócitos. Anticorpos anti‐intiminas são importantes para a proteção contra infecções por EPEC e EHEC porque esses anticorpos inibem a adesão bacteriana e impedem o passo inicial do mecanismo patogênico dessas bactérias. Nós estudamos a transferência de anticorpos maternos anti‐intiminas de mães brasileiras saudáveis para os seus recém‐nascidos através da placenta e do colostro.
MétodosAnticorpos séricos da classe IgG e secretórios da classe IgA (SIgA) reativos com as porções conservada (cons) e variáveis das intiminas α (vα), β (vβ) e γ (vγ) foram analisados pelo teste de ELISA no sangue e no colostro de 45 parturientes saudáveis e no sangue de cordão umbilical dos seus respectivos recém‐nascidos.
ResultadosAs concentrações de anticorpos reativos com intimina vα foram significativamente mais baixas que as dos anticorpos anti‐vγ e anti‐cons nas amostras de colostro. Anticorpos IgG séricos reativos com todas as intiminas foram transferidos para os recém‐nascidos, mas as concentrações de anti‐cons foram significativamente mais altas tanto nas mães como nos recém‐nascidos do que os anticorpos reativos com as regiões variáveis das intiminas. O padrão de transferência de IgG das mães para os recém‐nascidos foi muito semelhante para todos os anticorpos anti‐intiminas. Os valores de porcentagem de transferência foram semelhantes à transferência de IgG total.
ConclusõesAnticorpos anti‐intimina são transferidos das mães para os recém‐nascidos pela placenta e corroboram a proteção contra infecções por Escherichia coli diarreiogênicas (DEC) conferida pelo aleitamento materno.
No mundo em desenvolvimento, a morbidez e a mortalidade relacionadas a diarreia bacteriana pediátrica são, em grande parte, atribuídas à categoria diarreiogênica de Escherichia coli (DEC). Os recém‐nascidos e neonatos de até um ano são especialmente vulneráveis à diarreia causada por DEC quando não foram amamentados.1
Estudos epidemiológicos entre crianças brasileiras revelaram a presença de cepas de DEC nas fezes não apenas de crianças com diarreia, mas também de crianças saudáveis. As formas típicas (tEPEC) e atípicas (aEPEC) de E. coli enteropatogênica são detectadas entre esses isolados de crianças em áreas rurais e regiões metropolitanas.2,3 A E. coli enteri‐hemorrágica (EHEC) é um patógeno entérico que está genética e fenotipicamente associado à EPEC, porém é distinguível por sua produção de toxinas. Os dois tipos de cepas de bactérias produzem lesões attaching and effacing (A/E) na mucosa intestinal, resultam em contato íntimo das bactérias com a célula hospedeira. Esse fenômeno leva à fosforilação de proteínas, destruição da membrana celular e expressão de genes bacterianos, agrupados em uma ilha genômica denominada Locus of Enterocyte Effacement (LEE).1 Uma das proteínas mais importantes codificadas pela LEE é a intimina, uma proteína de membrana externa de 94kDa envolvida na adesão íntima às células bacterianas. A molécula de intimina é composta de 939 resíduos de aminoácidos (aa) e tem duas regiões funcionais: a porção N‐terminal, que é altamente conservada e inserida na membrana externa bacteriana, e a porção C‐terminal 280 aa, que é variável e seus polimorfismos determinam os vários subtipos de intiminas.4,5 Foram descritos pelo menos 27 subtipos de intimina, porém apenas poucos parecem causar doença em humanos. A prevalência dos subtipos de intiminas varia entre tEPEC, aEPEC e EHEC, em diferentes regiões geográficas e períodos, conforme mostrado por estudos epidemiológicos. As intiminas α, β e γ estavam entre os subtipos de intiminas prevalentes no Brasil no início de 2000.1,6–8
Alguns estudos identificaram anticorpos anti‐intiminas no soro de crianças e adultos infectados por EPEC ou EHEC.9,10 Identificamos anticorpos anti‐intiminas no soro de adultos e crianças saudáveis,11–13 bem como no colostro de mães brasileiras saudáveis.14–18 Achados semelhantes foram descritos com relação a mulheres americanas e mexicanas.19 Entretanto, ainda não foi descrita a transferência de subtipos de anticorpos maternos reativos a intimina para recém‐nascidos por meio da placenta.
Os anticorpos do colostro inibem a adesão bacteriana às células HEp‐2 in vitro e os mesmos anticorpos anti‐EPEC foram encontrados nas fezes de recém‐nascidos amamentados com o colostro de suas mães,15 apontaram para um possível mecanismo por meio do qual a amamentação confere proteção aos recém‐nascidos contra infecções causadas por EPEC e EHEC.14,16,17 Além disso, os anticorpos anti‐intiminas secretores e séricos parecem inibir a adesão bacteriana a células cultivadas e proteger contra infecção,15,17,20–22 assim a transferência de anticorpos anti‐intiminas pode proteger o feto e o recém‐nascido contra infecção. No presente estudo, investigamos a presença de anticorpos anti‐intiminas no soro e no colostro de mães saudáveis e no cordão umbilical de seus recém‐nascidos com o uso de proteínas purificadas obtidas de bactérias recombinantes que expressam as porções conservadas (cons) e variáveis das intiminas α (vα), β (vβ) e γ (vγ).4 Ao medir simultaneamente as concentrações desses anticorpos nas amostras de soro obtidas das mães e bebês, avaliamos também sua possível transferência placentária.
Material e métodosAmostras biológicas de seres humanosO protocolo deste estudo foi aprovado pelo Comitê de Ética do Hospital Israelita Albert Einstein (HIAE) e da Universidade de São Paulo, Brasil (número CEP 06/434); todos os procedimentos foram feitos de acordo com a declaração de Helsinque de 1964 e foi obtido o consentimento informado por escrito de todas as mães participantes.
As amostras foram obtidas no HIAE, hospital privado que atende famílias de nível socioeconômico médio/alto, de julho a outubro de 2006. Soro, colostro e plasma sanguíneo de cordão umbilical foram obtidos de 45 mães saudáveis e de seus recém‐nascidos saudáveis, que corresponderam a 37 partos cesáreos. Os critérios de inclusão foram: mães saudáveis, sem quaisquer patologias registradas durante a gravidez ou trabalho de parto e com resultados negativos nos testes de sorologia para HIV, HTLV I/II, hepatite B e C, doença de Chagas, sífilis, toxoplasmose e citomegalovírus. Sangue materno e de cordão umbilical foi obtido imediatamente após o parto e foram coletadas amostras de colostro até 72 horas após o parto. Todas as mães tinham entre 22 e 36 anos (idade média 31,2), a gama total de imunoglobulina G (IgG) no soro foi de 508,8‐1389,1mg/dL (média de 800,3mg/dL). As mães estavam todas bem nutridas, eram predominantemente primíparas, com nível de escolaridade e situação socioeconômica médios/altos, viviam em boas condições sanitárias na cidade de São Paulo. Os recém‐nascidos estavam saudáveis, com peso adequado para a idade gestacional, 37 a 41 semanas (média de 38 semanas), pesavam entre 2.630 e 39.45g (média de 3.298g).
Um grupo de controle de colostro foi preparado com quantidades iguais de 20 amostras coletadas de mulheres saudáveis e um grupo de controle de soro foi preparado com quantidades iguais de 100 amostras de sangue coletadas de doadores adultos saudáveis. A concentração total de imunoglobulina A secretora (SIgA) do grupo de colostro foi determinada por um ensaio imunossorvente ligado à enzima (ELISA) com um padrão comercial (Sigma, EUA). Um grupo de soro com uma concentração conhecida de imunoglobulina G (IgG) foi usado como padrão. Amostras com baixas e altas concentrações de anticorpos foram incluídas em cada placa de ELISA como um controle interno do ensaio.
AntígenosAs intiminas purificadas foram obtidas de culturas de bactérias recombinantes com expressão, cada, das porções conservadas e variáveis de intiminas α, β e γ, conforme descrito anteriormente.18 Resumidamente, as bactérias recombinantes de E.coli M15 transformadas com plasmídeos pFLvα, pFLvβ, pFLvγ ou pFLcons foram analisadas por reação em cadeia da polimerase (PCR) para confirmar a presença da inserção após clonagem do vetor plasmídico. Os fragmentos do gene eae que codifica a intimina foram sequenciados para comparação com as cepas padrão registradas no GenBank. A expressão da proteína foi induzida pela cultura das bactérias com isopropil‐β‐D‐tiogalactopiranósido, seguida de extração em uma prensa francesa e centrifugação. As proteínas foram finalmente purificadas por cromatografia de adsorção por íons metálicos imobilizados (Ni) (Qiagen, EUA) e os produtos foram analisados por eletroforese em gel de poliacrilamida de dodecilsulfato de sódio.
Anticorpos anti‐intiminasAs concentrações séricas anti‐intiminas de IgG e IgA secretora (SIgA) foram determinadas por ELISA com base na técnica de Fomsgaard.23 As concentrações de anticorpos anti‐intiminas específicos foram determinadas em comparação às concentrações de IgG e IgA totais, conforme descrito.18 Para padronização, metade de uma placa de ELISA de 96 poços de microtitulação recebeu anti‐IgG como anticorpo de captura (2,5μg/mL) e a outra metade recebeu cada uma das intiminas purificadas obtidas de bactérias recombinantes que expressam cons, vα, vβ e vγ4 à mesma concentração (2.5μg/mL) e foram acrescentadas diluições séricas adequadas do grupo de controle de soro (com concentração total conhecida de IgG determinada por nefelometria) nos dois lados da placa. O ensaio foi desenvolvido com um conjugado anti‐IgG. Foram determinados os valores de densidade óptica e a concentração de anticorpos anti‐intiminas foi determinada com a comparação da curva padrão de IgG total. Esse procedimento padrão também foi feito para SIgA em um grupo de colostro. Então, as amostras individuais de soro e colostro em diluições séricas que iniciaram a partir de 1:10 foram analisadas nas placas de ELISA que receberam intiminas recombinantes e o grupo de soro e colostro foi usado para criar a curva padrão. Amostras com baixas e altas concentrações de anticorpos foram incluídas em cada placa como um controle interno. As concentrações de IgG total nas amostras de soro materno e cordão umbilical foram medidas por um ensaio imunoturbidimétrico (Abbott Diagnostics, EUA). Os percentuais de transferência placentária dos anticorpos IgG total específicos para intiminas foram determinados em cada ensaio como segue:
Análise estatísticaTodos os resultados foram submetidos a análise estatística, inclusive análises descritivas com gráficos de caixas, análise de variância (Anova) paramétrica com teste de comparação múltipla e teste de correlação de Spearman, em nível de confiança de 95%, com o software GraphPad Prism (Graph Pad Software Inc., EUA).
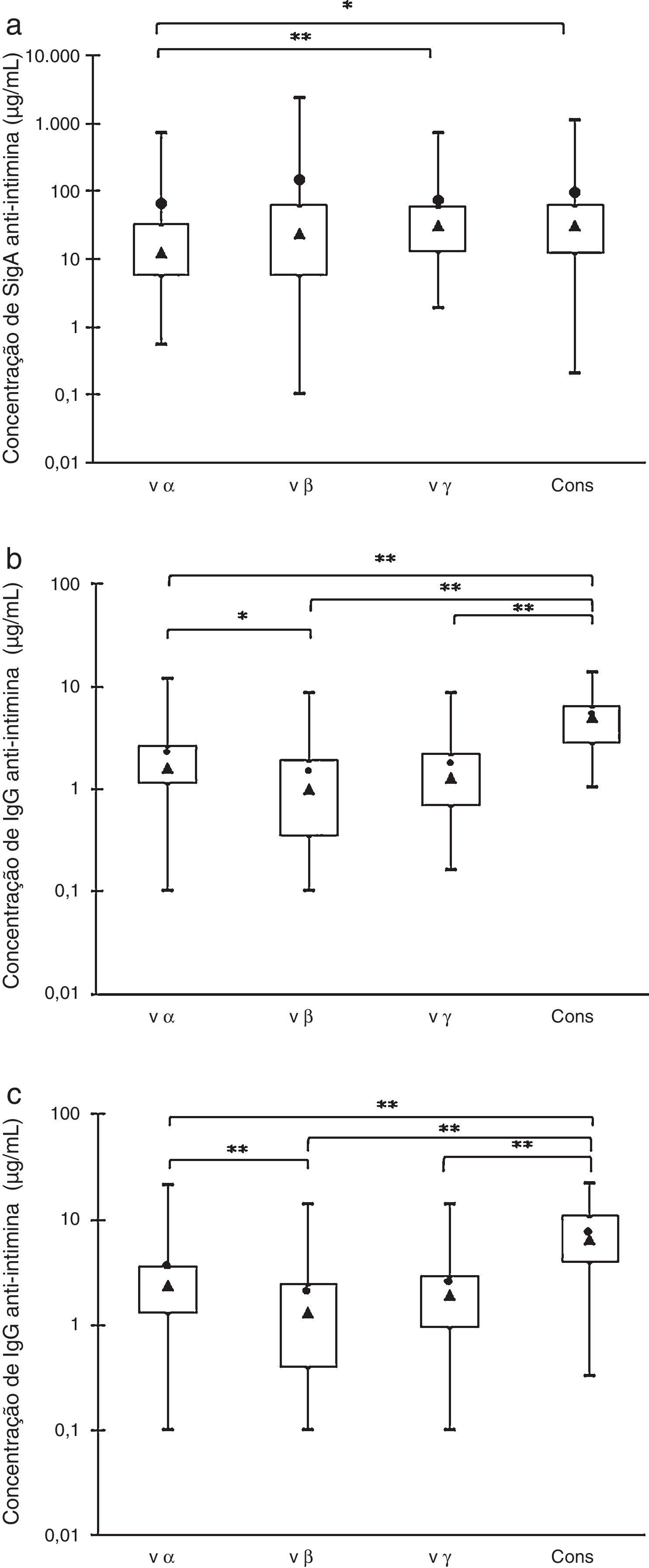
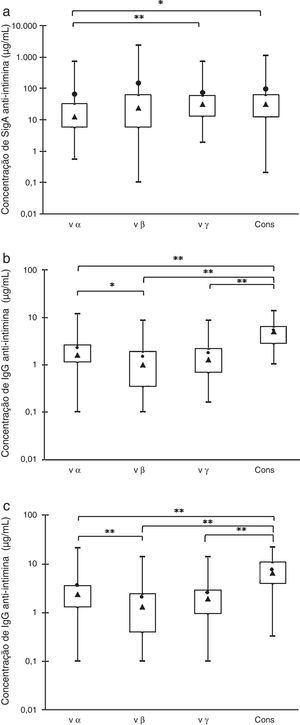
ResultadosA figura 1 mostra as concentrações de anticorpos reativos aos quatro antígenos recombinados purificados (cons, vα, vβ e vγ) presentes nas 45 amostras de colostro, 45 amostras de soro materno e 45 amostras de soro de cordão umbilical de seus respectivos recém‐nascidos. O gráfico de caixas mostra os valores máximos e mínimos, percentis de 25% e 75%, medianas e médias.
Distribuições das amostras em caixa por suas concentrações de anti‐intimina: valores máximos e mínimos (linhas superiores e inferiores fora da caixa, respectivamente), média (●) e mediana (▴), quartis de 75% e 25% (linhas superiores e inferiores da caixa, respectivamente). (a) Anticorpos SIgA em amostras de colostro. (b) Anticorpos IgG em amostras de soro materno. (c) Anticorpos IgG em amostras de soro de recém‐nascidos. Diferenças significativas * p<0,05, ** p<0,01.
As análises das amostras de colostro pelo teste de Friedman para comparações múltiplas mostraram que as concentrações de anticorpos IgA anti‐vα foram significativamente menores do que as de antivγ e anticons, porém não houve diferenças estatisticamente significativas nos outros pares de valores (fig. 1A). As concentrações de anticorpos IgA variaram amplamente e as médias acima das medianas indicaram que não se tratou se de uma distribuição normal.
A comparação de IgG específica revelou que a concentração de anti‐cons foi significativamente maior em comparação com outros subtipos nas amostras de soro das mães e dos recém‐nascidos. Os níveis de anticorpos antivα foram maiores do que os de antivβ, porém não houve diferenças significativas entre esses dois subtipos e anticorpos antivγ (fig. 1B e C). Esses resultados foram confirmados pela análise de distribuição de frequência (dados não mostrados).
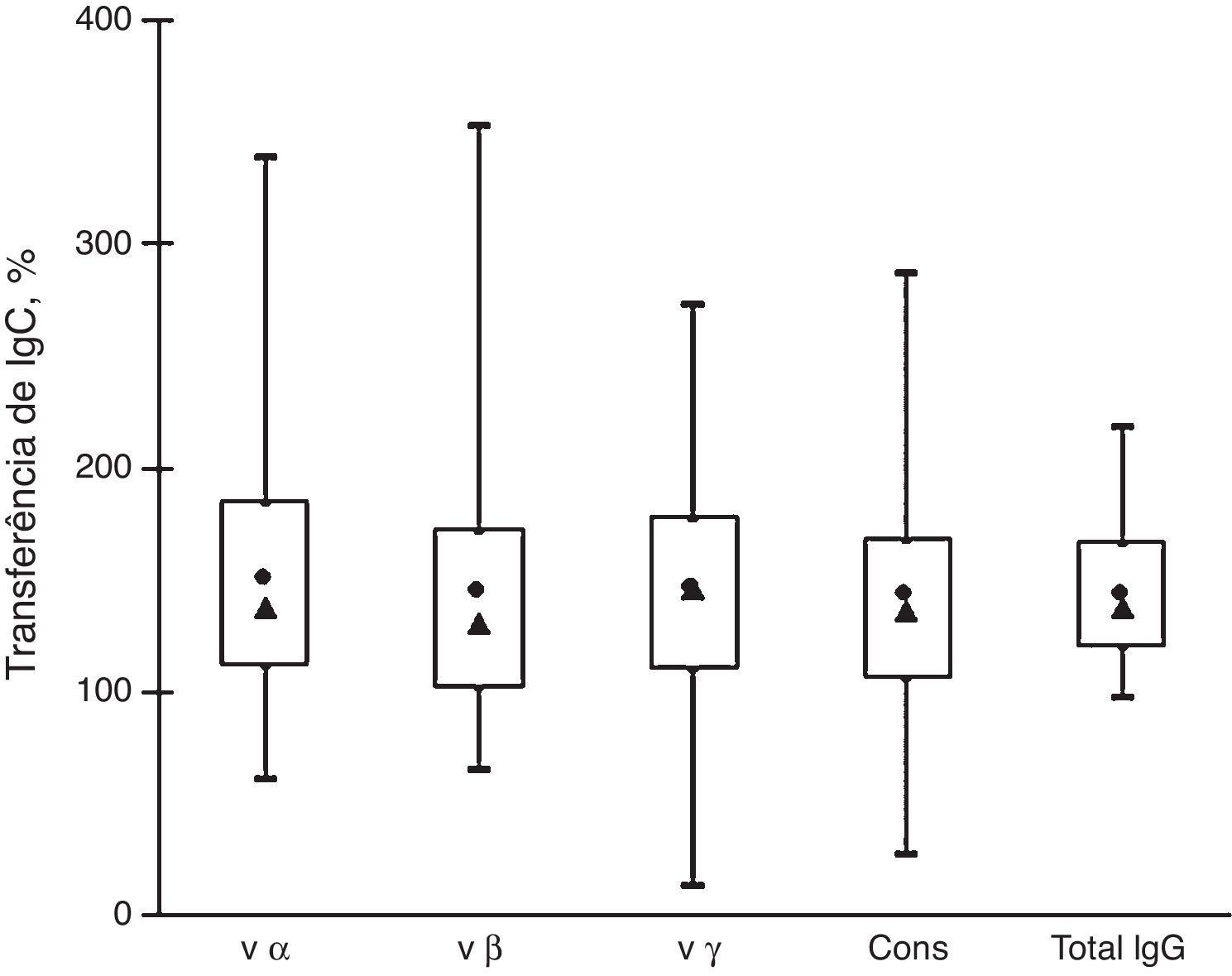
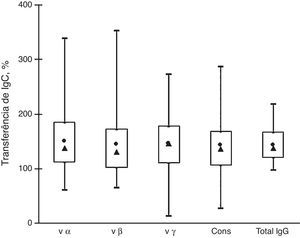
A figura 2 mostra que a transferência de IgG de mães para recém‐nascidos foi muito semelhante a todos os subtipos de anticorpos analisados. O percentual médio de transferência de anticorpos anti‐intimina variou de 142% a 149% e as medianas variaram de 130% a 146%. Esses valores são semelhantes ao percentual de transferência de IgG total (média=143%, mediana=137%). Não houve diferenças significativas entre os percentuais de transferência de anticorpos reativos a vários subtipos de intiminas.
Transferência de anticorpos IgG anti‐intimina e IgG total de mães para recém‐nascidos. Distribuição de amostras em caixa por seus percentuais de transferência de anti‐vα, anti‐vβ, anti‐vγ e anti‐cons e transferência de IgG total: valores máximos e mínimos (linhas superiores e inferiores fora da caixa, respectivamente), média (●) e mediana (▴), quartis de 25% e (linhas superiores e inferiores da caixa, respectivamente).
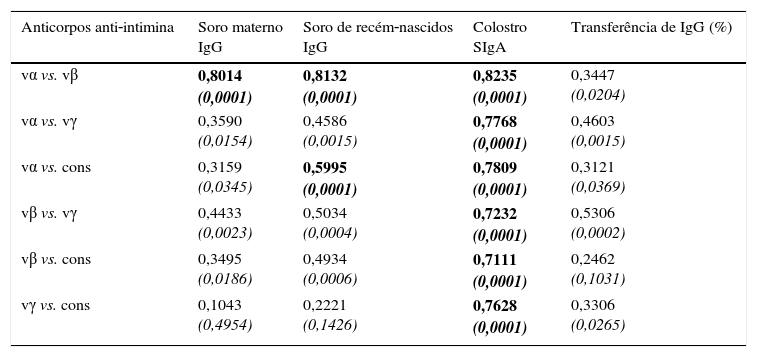
A tabela 1 mostra os resultados dos testes de correlação de Spearman. Nas amostras de soro materno, houve uma correlação significativa entre os anticorpos antivα e antivβ (p<0,0001). Não houve correlação estatisticamente significativa entre vγ e cons. O mesmo padrão de correlação foi observado nas amostras de soro dos recém‐nascidos. Os coeficientes de correlação foram altos em todos os pares analisados para verificação das amostras de colostro.
Coeficientes de correlação das concentrações de anticorpos anti‐intimina nas amostras de soro (IgG) e colostro (SIgA) e percentual de transferência de IgG de mãe para recém‐nascido, em pares de tipos de intimina
| Anticorpos anti‐intimina | Soro materno IgG | Soro de recém‐nascidos IgG | Colostro SIgA | Transferência de IgG (%) |
|---|---|---|---|---|
| vα vs. vβ | 0,8014 (0,0001) | 0,8132 (0,0001) | 0,8235 (0,0001) | 0,3447 (0,0204) |
| vα vs. vγ | 0,3590 (0,0154) | 0,4586 (0,0015) | 0,7768 (0,0001) | 0,4603 (0,0015) |
| vα vs. cons | 0,3159 (0,0345) | 0,5995 (0,0001) | 0,7809 (0,0001) | 0,3121 (0,0369) |
| vβ vs. vγ | 0,4433 (0,0023) | 0,5034 (0,0004) | 0,7232 (0,0001) | 0,5306 (0,0002) |
| vβ vs. cons | 0,3495 (0,0186) | 0,4934 (0,0006) | 0,7111 (0,0001) | 0,2462 (0,1031) |
| vγ vs. cons | 0,1043 (0,4954) | 0,2221 (0,1426) | 0,7628 (0,0001) | 0,3306 (0,0265) |
vα, porção variável de intimina α; vβ, porção variável de intimina β; vγ, porção variável de intimina γ.
Os coeficientes foram determinados pelo teste de correlação de Spearman, nível de confiança de 95% (valores de p em itálico), p<0,0001 destacado em negrito.
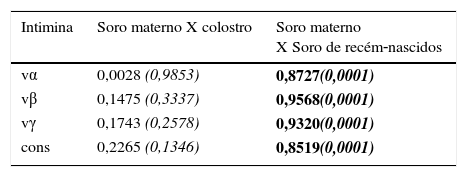
A tabela 2 mostra coeficientes de correlação significativos para todos os tipos de intimina entre as amostras de soro materno e dos recém‐nascidos, assim a transferência de anticorpos de mães para recém‐nascidos foi igualmente eficiente para todos os subtipos de intimina. Foram vistos coeficientes de baixa correlação entre os anticorpos IgG sérica e SIgA do colostro, pois a geração de anticorpos IgG sérica e IgA secretora ocorre por meio de mecanismos independentes.
Coeficientes de correlação de concentrações de anticorpos anti‐intiminas entre as amostras de soro (IgG) materno e colostro (SIgA) e entre as amostras de soro materno e de cordão umbilical (IgG)
| Intimina | Soro materno X colostro | Soro materno X Soro de recém‐nascidos |
|---|---|---|
| vα | 0,0028 (0,9853) | 0,8727(0,0001) |
| vβ | 0,1475 (0,3337) | 0,9568(0,0001) |
| vγ | 0,1743 (0,2578) | 0,9320(0,0001) |
| cons | 0,2265 (0,1346) | 0,8519(0,0001) |
cons, porção conservada de intimina; vα, porção variável de intimina α; vß, porção variável de intimina ß; vγ, porção variável de intimina γ.
Os coeficientes foram determinados pelo teste de correlação de Spearman, nível de confiança de 95% (valores de p em itálico), p<0,0001 destacado em negrito.
Neste estudo, fornecemos uma comprovação da transferência placentária e colostral de anticorpos anti‐EPEC e anti‐EHEC para recém‐nascidos; esses anticorpos provavelmente conferem proteção para os neonatos contra diarreia causada por esses patógenos. Os anticorpos anti‐intimina podem inibir a adesão bacteriana às células epiteliais e essa capacidade foi mostrada pelos anticorpos SIgA presentes no colostro e leite humano e nos anticorpos do soro de humanos e animais imunizados.13–17,22,24 Com base nisso, as intiminas foram propostas como uma possível candidata a vacina contra infeção por EPEC e EHEC.20,21
Foram encontrados anticorpos nas porções conservadas e variáveis de intiminas α, β e γ em todas as amostras de soro e colostro analisadas, provavelmente devido à ampla prevalência de EPEC em nossa população. Este estudo foi feito com amostras coletadas de mães de níveis socioeconômicos médios/altos. Demonstramos achados semelhantes quando analisamos amostras coletadas de mães de níveis socioeconômicos mais baixos e que moram em áreas com saneamento precário. Isso sugere que a prevalência da EPEC depende da situação socioeconômica ou das condições de higiene dos pacientes.11,12,16,18 Achados semelhantes foram relatados por Araujo et al. com relação à detecção de DEC em amostras fecais de crianças de áreas urbanas pobres e crianças atendidas em serviços médicos privadas de alto nível socioeconômico.25
Crianças saudáveis brasileiras desenvolveram anticorpos reativos a fatores associados à virulência da EPEC, como intiminas.11 No fim do primeiro ano de vida, esses neonatos mostram repertórios de anticorpos anti‐EPEC no soro e na saliva equivalentes aos de adultos saudáveis na mesma população. As intiminas α, β e γ são compartilhadas por cepas de EPEC (típicas ou atípicas) e EHEC e estão presentes em DEC encontrada em animais domésticos e agrícolas que podem ter contato próximo com pessoas. Isso sugere que a intimina é um antígeno comum presente de forma ubíqua na população brasileira.26
Os subtipos de anticorpos anti‐intiminas encontrados nas amostras analisadas neste estudo podem inibir a adesão bacteriana, pois essa porção da molécula das intiminas é responsável pelas interações com as células hospedeiras, destaca um papel na proteção contra as bactérias.22
A análise estatística da IgG detectada nas amostras de soro materno e de recém‐nascidos revelou que as concentrações de anticorpos na porção conservada de intimina foram maiores em comparação com os anticorpos nas porções variáveis dos subtipos α, β e γ. A região conservada é comum em todos os subtipos e, portanto, é razoável esperar que todas as pessoas desenvolvam esses anticorpos, independentemente do subtipo específico de intimina presente nas bactérias em contato. Resultados semelhantes foram observados por Zapata‐Quintanilla et al.18 em suas análises de amostras de soro de adultos saudáveis (doadores de sangue). Contudo, esse perfil foi diferente em amostras de colostro, nas quais a concentração de anticorpos reativos a vβ, vγ, e cons foi semelhante, porém a concentração de anticorpos anti‐vα foi menor do que a de antivγ e anticons. Esse padrão não foi visto por Zapata‐Quintanilla et al.,18 que encontraram menores níveis de anti‐vγ. Essa discrepância também pode ser atribuível à variação nos repertórios de anticorpos entre as mães, pois as amostras foram coletadas de doadores com diferentes características no estudo de Zapata‐Quintanilla e no nosso: o nível socioeconômico (hospital público em comparação com hospital privado, respectivamente), idade (média de 24,6 em comparação com 31,2 anos), tipo de parto (24,4% em comparação com 82% de casos de parto cesáreo) e período de coleta de amostras (setembro de 1997 a fevereiro de 1998 em comparação com julho a outubro de 2006). Os estudos epidemiológicos indicaram que a prevalência de intimina γ aumentou com o surgimento de aEPEC nos últimos anos.1,3,6–8,25
As intiminas são frequentemente encontradas em bactérias isoladas não apenas em pacientes com diarreia, mas também em pessoas saudáveis e animais domésticos.1,6,7,26 A intimina α foi detectada em cepas de tEPEC e aEPEC. A intimina β está associada a tEPEC e aEPEC, bem como a EHEC, ao passo que a intimina γ é encontrada em aEPEC e EHEC. O isolamento dessas cepas de bactérias no Brasil pode explicar a presença desses anticorpos nas amostras de soro e colostro. Apesar da baixa incidência de infecção por EHEC entre adultos brasileiros, os anticorpos anti‐intimina γ estão presentes e mostram uma correlação positiva com os anticorpos reativos a outros subtipos de intiminas. O aumento nas frequências de cepas de aEPEC no meio ambiente pode ser responsável pela presença de anticorpos anti‐intimina γ entre brasileiros saudáveis. Estudos recentes mostram subtipos de intiminas β e γ na indução da diarreia em humanos e o subtipo β parece ser significativamente mais frequente em casos de doenças em comparação com portadores saudáveis.8
Há uma correlação significativa entre a concentração de anticorpos IgG anti‐intimina α e β no soro materno e no soro de recém‐nascidos, que pode ser devido a uma reação cruzada entre os anticorpos IgG com vistas a essas intiminas. De fato, as sequências genéticas das porções variáveis dessas intiminas têm uma homologia de 65%,18 que explica a presença de anticorpos de reação cruzada. Portanto, esse fenômeno mostra que independentemente do subtipo de intimina candidato a vacina, esse subtipo pode aumentar anticorpos específicos, mas também pode induzir anticorpos de reação cruzada direcionados ao outro subtipo.
As concentrações de anticorpos SIgA reativos a todos os tipos de intiminas presentes nas amostras de colostro mostraram coeficientes de correlação significativos, sugeriram que há certo grau de reação cruzada entre esses anticorpos. Essa situação pode ser explicada pela homologia elevada entre as moléculas de intimina e pela menor especificidade de anticorpos SIgA no colostro em comparação com a IgG no soro. Contudo, as maiores concentrações de anticorpos anti‐intimina nas amostras de colostro em comparação com as amostras de soro corroboram o papel essencial da amamentação na proteção de neonatos contra infecção por DEC. Em humanos, os anticorpos SIgA no leite não são absorvidos de forma significativa pela mucosa do bebê amamentado, mas agem como defesa local. Em um estudo anterior, mostramos, por meio de imunotransferência, a mesma reatividade dos anticorpos SIgA anti‐EPEC nas amostras de colostro que a reatividade de anticorpos anti‐EPEC nas fezes dos respectivos bebês. Além disso, os anticorpos SIgA isolados de colostro por cromatografia de afinidade inibem a adesão da EPEC às células HEp‐2.15
Nossos resultados indicam que diferentes anticorpos anti‐intimina são transferidos de mães para recém‐nascidos com igual eficiência por meio da placenta. Esses resultados sustentam a ideia de que, nesse caso, a transferência materna‐fetal não é influenciada pela especificidade do anticorpo. Neste estudo, os percentuais de transferência dos anticorpos anti‐intimina são equivalentes ao percentual de transferência de IgG total, que é ∼140%. Achados semelhantes foram relatados por outros autores.27,28
Apesar de haver uma alta frequência de casos isolados de DEC no Brasil, as cepas de EHEC não são tão comuns quanto em outros países. Podemos supor que, além das características ambientais, como clima e hábitos alimentares, as pessoas podem desenvolver imunidade contra EHEC resultante de contato com outras cepas (por exemplo, DEC). Alguns estudos revelaram a presença de anticorpos reativos a vários sorotipos de lipopolissacarídeos (LPS), como O111, O55, O157 e O26, em amostras de soro e colostro de brasileiras saudáveis.12,13 Outros estudos mostraram a transferência maternal‐fetal de anticorpos IgG reativos a O111, O16 e O6 LPS associados a sepse neonatal, bem como O157.29,30 Esses antígenos LPS são comumente encontrados em diferentes patótipos de E.coli que são agentes de doenças intestinais ou sistêmicas. Como um todo, essas observações e este trabalho nos permitem concluir que a proteção contra EHEC pode ser conferida por contato com EPEC ou outras cepas de E. coli.
Nossos resultados confirmam que os anticorpos maternos reativos a intiminas são transferidos para os recém‐nascidos por meio da placenta e que a presença que altas concentrações desses anticorpos no colostro corroboram o fator de proteção da amamentação.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp – 03/13250‐3).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A todas as mães por seu consentimento com relação à doação das amostras. À Maternidade, ao Banco de Leite e ao Laboratório de Criopreservação do Hospital Israelita Albert Einstein por sua ajuda com a coleta de amostras; à Divisão de Diagnósticos da Abbott no Brasil pela doação do Kit imunoturbidimétrico para análise de IgG; à Dra. Lucy B. Zapata‐Quintanilla pela ajuda nos experimentos, a Rosana Prisco pela análise estatística e à Dra. Yanira Riffo Vasquez pela revisão do manuscrito e pelas sugestões valiosas (Instituto de Ciências Farmacêuticas, King's College, Londres, Inglaterra).
Como citar este artigo: Altman SP, Tino‐De‐Franco M, Carbonare CB, Palmeira P, Carbonare SB. Placental and colostral transfer of antibodies reactive with enteropathogenic Escherichia coli intimins α, β, or γ. J Pediatr (Rio J). 2017;93:568–75.
Trabalho associado ao Instituto Butantã, São Paulo, SP, Brasil.