To determine the prevalence of congenital hypothyroidism in children with filter paper TSH levels (f‐TSH) between 5 and 10μUI/mL in the neonatal screening.
MethodsThis was a retrospective study including children screened from 2003 to 2010, with f‐TSH between 5 and 10μIU/mL, who were followed‐up during the first two years of life when there was no serum TSH normalization. The diagnosis of congenital hypothyroidism was defined as serum TSH ≥10μIU/mL and start of levothyroxine treatment up to 2 years of age.
ResultsOf the 380,741 live births, 3,713 (1.04%) had f‐TSH between 5 and 10μIU /mL and, of these, 339 (9.13%) had congenital hypothyroidism. Of these, 76.11% of the cases were diagnosed in the first three months of life and 7.96% between 1 and 2 years of age.
ConclusionThe study showed that 9.13% of the children with f‐TSH between 5 and 10μIU/mL developed hypothyroidism and that in approximately one‐quarter of them, the diagnosis was confirmed only after the third month of life. Based on these findings, the authors suggest the use of a 5μIU/mL cutoff for f‐TSH and long‐term follow‐up of infants whose serum TSH has not normalized to rule out congenital hypothyroidism.
Determinar a prevalência de hipotireoidismo congênito em crianças com TSH em papel filtro (TSH‐f) entre 5 e 10μUI/mL na triagem neonatal.
MétodosEstudo retrospectivo que incluiu crianças triadas de 2003 a 2010, com TSH‐f entre 5 e 10μUI/mL, acompanhadas nos dois primeiros anos de vida quando não houve normalização do TSH sérico. O diagnóstico de hipotireoidismo congênito foi definido como TSH sérico igual ou superior a 10μUI/mL e início de tratamento com levotiroxina até os dois anos.
ResultadosDos 380.741 nascidos vivos triados, 3.713 (1,04%) apresentaram TSH‐f entre 5 e 10μUI/mL e, desses, 339 (9,13%) tinham hipotireoidismo congênito. Desses, 76,11% dos casos foram diagnosticados nos primeiros três meses de vida e 7,96% entre um e dois anos.
ConclusãoO estudo mostra que 9,13% das crianças com TSH‐f entre 5 e 10μUI/mL desenvolveram hipotireoidismo e que em cerca de um quarto delas o diagnóstico só se confirmou após o terceiro mês de vida. Com base nesses achados, sugere‐se, para descartar o hipotireoidismo congênito, o uso do ponto de corte de TSH‐f de 5μUI/mL e o acompanhamento em longo prazo dos lactentes cujo TSH sérico não tenha se normalizado.
O hipotireoidismo congênito (HC), por ser o distúrbio endócrino congênito mais frequente e uma das principais causas de deficiência intelectual evitável com diagnóstico precoce e tratamento adequado, foi uma das primeiras doenças rastreadas nos programas de triagem neonatal (TNN).1–4
A incidência do HC, antes da criação dos programas de TNN, era estimada em 1:6.500,5 mas, logo após o início da triagem, aumentou para 1:3.000 a 1:4.000 nascidos vivos (NV).6 Nos últimos anos, relata‐se uma nova elevação da incidência do HC em diversas partes do mundo, varia de 1:1.030 a 1:2.679 NV.7–10 Esse fato provavelmente está associado ao aumento da sobrevida de recém‐nascidos (RN) prematuros,4,7 a fatores ambientais11 e étnicos7 e, também, à redução dos valores de corte do hormônio tireoestimulante (TSH) no papel filtro (TSH‐f) nos programas de TNN.4,12
Inicialmente, se adotavam valores de corte de TSH‐f mais altos para evitar reconvocações e custos excessivos, com a justificativa de que as formas leves de HC não teriam consequências para o desenvolvimento neurológico.4 Entretanto, alguns autores sugerem que não há estudos suficientes que comprovem essa hipótese4 e o Consenso Europeu de Hipotireoidismo Congênito de 2014 destaca, como objetivo primordial da TNN, a detecção de todos os casos de HC primário.1
Nos últimos anos, vários serviços de triagem optaram por baixar o valor de corte do TSH‐f com o intuito de reduzir o número de casos de hipotireoidismo não diagnosticado.4,13–17
Com essa redução, vários programas relataram aumento do número de crianças com HC diagnosticadas pela TNN4,13–17 embora tenha havido também elevação do número de crianças com suspeita de HC e, portanto, maior taxa de reconvocação.4,15,16,18
A Triagem Neonatal da Universidade Estadual de Campinas (Unicamp) usa, desde 2001, o ponto de corte de 5μUI/mL para o TSH‐f e faz acompanhamento clínico e laboratorial durante pelo menos os primeiros dois anos de vida de todas as crianças cujo TSH sérico não se normaliza.
Diante desse contexto, o objetivo do presente estudo foi determinar a prevalência de HC em crianças com TSH‐f entre 5 e 10μUI/mL na TNN.
MétodosEstratégia de triagem neonatal para hipotireoidismo congênitoO Serviço de Referência em Triagem Neonatal (SRTN) da Unicamp atualmente é responsável pela triagem neonatal, pelo diagnóstico e cuidado integral das crianças dos Departamentos Regionais de Saúde VII (Campinas) e XIV (São João da Boa Vista), regiões com aproximadamente 5.000 nascimentos por mês.
Desde sua criação, o SRTN da Unicamp conta com uma mesma equipe no atendimento e acompanhamento dos casos, as investigações laboratoriais e de imagem sempre são feitas em serviços do complexo hospitalar da Unicamp.
O SRTN da Unicamp usa o valor de corte de TSH‐f de 5μUI/mL em amostra de sangue total seco em papel filtro, equivalente a 11μUI/mL em soro, e as análises são feitas por fluorimetria por tempo resolvido (AutoDELFIA ‐ Perkin Elmer Life Sciences, MA, EUA).
O SRTN da Unicamp usa o seguinte protocolo para o diagnóstico e tratamento de HC: crianças com TSH‐f superior a 5μUI/mL ou menor ou igual a 0,01μUI/mL são convocadas para dosagem sérica de TSH e tiroxina livre (T4L). Se o TSH e T4L séricos forem normais, recebem alta. Crianças com valores de TSH sérico superior aos valores de referência para a idade, mas inferiores a 10μUI/mL, são acompanhadas clínica e laboratorialmente no SRTN da Unicamp nos primeiros dois anos de vida ou até a normalização do exame.
Aquelas que apresentam TSH sérico maior ou igual a 10μUI/mL são encaminhadas para acompanhamento no Ambulatório de Triagem Neonatal de Hipotireoidismo Congênito do Hospital de Clínicas da Unicamp, onde são avaliadas individualmente, e aquelas que mantêm TSH acima de 10μUI/mL ou apresentam T4L inferior a 0,9 ng/dL recebem o diagnóstico de HC e iniciam tratamento com levotiroxina sódica (L‐T4).
As coletas de TSH e T4L em soro são feitas de acordo com as normas técnicas do Laboratório de Patologia Clínica da Unicamp, as análises são feitas por eletroquimioluminescência, com valores de referência de TSH e T4L de, respectivamente, 0,41 a 4,5μUI/mL e 0,9 a 1,8 ng/dL.
Desenho do estudoFez‐se um estudo retrospectivo com avaliação da base de dados do SRTN‐Unicamp para obtenção do número de NV triados de abril de 2003 a setembro de 2009. Foram selecionadas as crianças com TSH‐f entre 5 e 10μUI/mL em amostra coletada no primeiro mês de vida.
Considerou‐se HC primário quando, em qualquer momento nos primeiros dois anos de vida, a criança apresentou TSH sérico maior ou igual a 10μUI/mL, independentemente da concentração de T4L, e recebeu tratamento com L‐T4.
Obtiveram‐se dos prontuários das crianças com HC e TSH‐f entre 5 e 10μUI/mL as seguintes informações: valor de TSH‐f; idade na coleta da TNN; sexo; TSH e T4L inicial, confirmatório e de início de tratamento e idade no início do tratamento.
Para o estudo, foram consideradas as seguintes definições de valores de TSH e de T4L séricos: exame inicial (o primeiro exame coletado após o TSH‐f); exame confirmatório (o primeiro exame cujo TSH sérico foi igual ou superior a 10μUI/mL que cada criança apresentou) e exame de início de tratamento (o último exame coletado antes da introdução da medicação).
Análise estatísticaOs dados foram processados com o programa SPSS (SPSS Inc., versão 16.0, Chicago, IL, EUA). Os resultados das variáveis qualitativas são apresentados como frequências absoluta e relativa.
Para as dosagens de TSH e T4L determinaram‐se os valores da mediana, mínimo, máximo, range (amplitude total) e amplitude interquartil (AIQ). Na avaliação das concentrações de TSH optou‐se pelo uso das medianas para evitar os problemas do limite superior (>100μUI/mL) de alguns resultados.
Os resultados das variáveis quantitativas são expressos como média ± desvio‐padrão ou mediana (amplitude interquartil).
Determinou‐se a prevalência de HC a partir dos dados do grupo de estudo com o respectivo intervalo de confiança (IC) de 95%. Para comparação em relação ao sexo usou‐se o teste de Mann‐Whitney. Em todas as análises considerou‐se como significativo quando p < 0,05.
Aspectos éticosEste projeto foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Ciências Médicas da Unicamp.
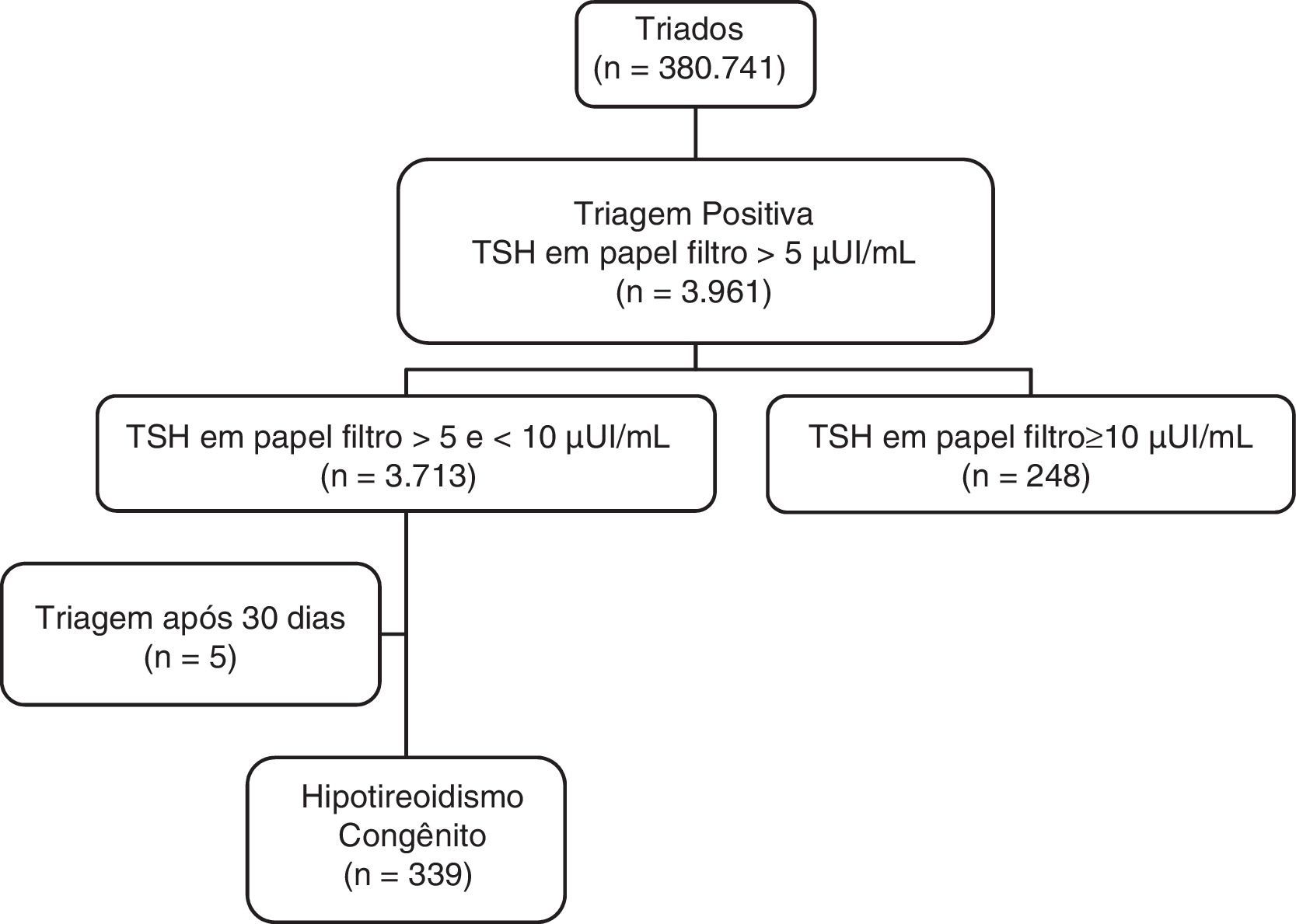
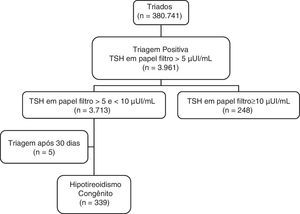
ResultadosDe abril de 2003 a setembro de 2009, 380.741 NV foram triados para HC pelo SRTN da Unicamp. Foram detectados 3.961 neonatos convocados para complementar a investigação, resultou uma frequência de reconvocação de 1,04% [IC95%: 1,01‐1,07]. Desses, 248 (6,26%) apresentaram TSH‐f igual ou superior a 10μUI/mL e 3.713 (93,74%) apresentaram TSH‐f entre 5 e 10μUI/mL (fig. 1). Com o valor de corte de 10μUI/mL, a taxa de reconvocação teria sido de 0,07% [IC95%: 0,06‐0,08].
Após acompanhamento clínico e laboratorial das 3.713 crianças com TSH‐f entre 5 e 10μUI/mL, 339 [206 do sexo masculino, 133 do feminino] tiveram diagnóstico de HC e iniciaram a reposição hormonal com L‐T4, o que corresponde a uma prevalência de HC nesse grupo de 9,13% [IC95% 8,2‐10,1] (fig. 1).
A média e a mediana de idade na coleta do TSH‐f foram, respectivamente, 5 ± 4 dias de vida e 3(4) dias de vida e da coleta do exame sérico inicial foram, respectivamente, 24 ± 14 dv e 20(13) dv. O exame confirmatório foi coletado com idade média de 77 ± 121 dv e mediana de 28(48) dv.
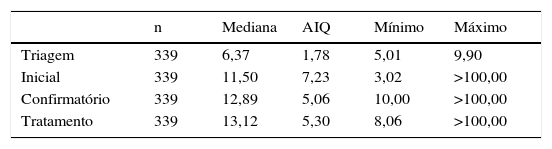
Conforme apresentado na tabela 1, apesar de valores limítrofes do TSH‐f na TNN (5,01 a 9,90μUI/mL), os valores de TSH na avaliação inicial apresentaram grande variação no grupo estudado (3,02 a superior a 100,00μUI/mL). O TSH inicial de 113 crianças foi inferior a 10μUI/mL, com mediana 7,00(2,75) μUI/mL. O TSH confirmatório desse grupo variou de 10,00 a superior a 100,00μUI/mL, com mediana 11,50(2,14) μUI/mL. Os demais 226 casos tiveram TSH inicial maior ou igual a 10μUI/mL, 190 desses tiveram o tratamento iniciado imediatamente e os demais 36, todos com TSH inicial abaixo de 30μUI/mL e T4L normal ou elevado, foram mantidos sem medicação nesse primeiro momento, com introdução posterior da reposição hormonal devido à persistência da elevação do TSH.
TSHa na triagem neonatal e nos exames inicial, confirmatório e de início do tratamento
| n | Mediana | AIQ | Mínimo | Máximo | |
|---|---|---|---|---|---|
| Triagem | 339 | 6,37 | 1,78 | 5,01 | 9,90 |
| Inicial | 339 | 11,50 | 7,23 | 3,02 | >100,00 |
| Confirmatório | 339 | 12,89 | 5,06 | 10,00 | >100,00 |
| Tratamento | 339 | 13,12 | 5,30 | 8,06 | >100,00 |
n, número de casos; AIQ, amplitude interquartil.
Os valores de TSH sérico confirmatório e de início de tratamento também apresentaram variação importante (tabela 1), 63 (18,58%) crianças apresentaram TSH de início de tratamento superior a 20μUI/mL.
Não foram observadas diferenças em relação ao sexo nos valores de TSH‐f (p = 0,073), inicial (p = 0,777), confirmatório (p = 0,376) e de início do tratamento (p = 0,843).
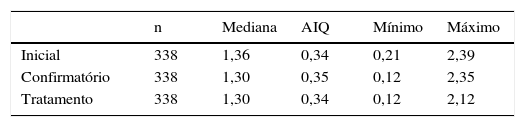
É interessante notar que 15 das 339 crianças tinham T4L abaixo dos valores de referência na primeira avaliação, 14 apresentavam valores de TSH superiores a 15μUI/mL e apenas uma, com valor de TSH de 6,06μUI/mL na primeira coleta, evoluiu com elevação de TSH acima de 10μUI/mL nas coletas subsequentes. Quanto à última avaliação laboratorial feita antes do início da terapia, 17 das 339 tinham o T4L abaixo do valor de referência enquanto o TSH variou de 10μUI/mL a superior a 100μUI/mL, 13 desses valores eram superiores a 20μUI/mL (tabela 2).
T4La nos exames inicial, confirmatório e de início do tratamento
| n | Mediana | AIQ | Mínimo | Máximo | |
|---|---|---|---|---|---|
| Inicial | 338 | 1,36 | 0,34 | 0,21 | 2,39 |
| Confirmatório | 338 | 1,30 | 0,35 | 0,12 | 2,35 |
| Tratamento | 338 | 1,30 | 0,34 | 0,12 | 2,12 |
AIQ, amplitude interquartil; n, número de casos.
Não foram observadas diferenças em relação ao sexo nos valores de T4L inicial (p = 0,318), confirmatório (p = 0,706) e de início do tratamento (p = 0,542).
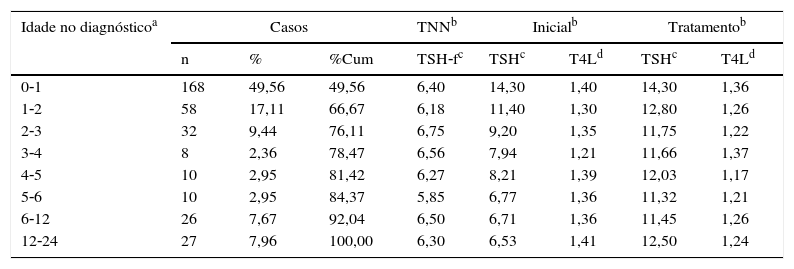
O diagnóstico foi confirmado entre 2 e 695 dv, com média de 94 ± 143 dv e mediana de 32(68), 76,11% das crianças com HC tiveram seu diagnóstico confirmado antes dos três meses de idade. Entretanto, 23,89% dos casos que futuramente receberiam o diagnóstico de HC apresentavam valores de TSH acima do limite superior da normalidade, porém sem indicação de tratamento, e permaneceram em seguimento com coletas periódicas de TSH e T4L, foram definidos como hipotireoidianos entre três e 24 meses de idade. Entre essas crianças com HC, 7,96% tiveram o diagnóstico confirmado entre um e dois anos de idade (tabela 3).
Função tireoidiana segundo a faixa de idade no diagnóstico
| Idade no diagnósticoa | Casos | TNNb | Inicialb | Tratamentob | ||||
|---|---|---|---|---|---|---|---|---|
| n | % | %Cum | TSH‐fc | TSHc | T4Ld | TSHc | T4Ld | |
| 0‐1 | 168 | 49,56 | 49,56 | 6,40 | 14,30 | 1,40 | 14,30 | 1,36 |
| 1‐2 | 58 | 17,11 | 66,67 | 6,18 | 11,40 | 1,30 | 12,80 | 1,26 |
| 2‐3 | 32 | 9,44 | 76,11 | 6,75 | 9,20 | 1,35 | 11,75 | 1,22 |
| 3‐4 | 8 | 2,36 | 78,47 | 6,56 | 7,94 | 1,21 | 11,66 | 1,37 |
| 4‐5 | 10 | 2,95 | 81,42 | 6,27 | 8,21 | 1,39 | 12,03 | 1,17 |
| 5‐6 | 10 | 2,95 | 84,37 | 5,85 | 6,77 | 1,36 | 11,32 | 1,21 |
| 6‐12 | 26 | 7,67 | 92,04 | 6,50 | 6,71 | 1,36 | 11,45 | 1,26 |
| 12‐24 | 27 | 7,96 | 100,00 | 6,30 | 6,53 | 1,41 | 12,50 | 1,24 |
n, número de casos; TNN, triagem neonatal; %Cum, frequência relativa acumulada.
Trata‐se de um estudo com casuística expressiva, a partir da experiência de um serviço, entre poucos no Brasil,14,19,20 que usa um valor de corte de TSH‐f inferior ao da maioria dos programas de TNN.
O uso de menor valor de corte do TSH‐f na amostra analisada resultou em um aumento de 14,8 vezes da taxa de reconvocação, que seria 0,07% com o ponto de corte de 10μUI/mL e foi 1,04% com o valor de 5μUI/mL. Outro SRTN do Brasil apresentou taxa de reconvocação semelhante, 1,08%, adotou‐se o valor de corte de 4,5μUI/mL,14 enquanto Korada et al.,13 com valor de corte de 6μUI/L, relataram taxa de reconvocação de 0,23%. Esses dados sugerem não haver relação direta entre os valores de corte usados na TNN para HC e as taxas de reconvocação, assim como concluiu Loeber21 através da análise da TNN de 37 países da Europa em 2004.
O uso de pontos de corte mais baixos, com consequente aumento do número de crianças reconvocadas, leva a custos mais elevados com a TNN, além de gerar ansiedade para pais e parentes de crianças sadias.18 Durante o período de estudo, crianças com TSH‐f entre 5 e 10μUI/mL foram submetidas a ao menos uma coleta de sangue venoso para avaliação da função tireoidiana e, após seguimento, cerca de 90% delas foram definidas como casos falsos positivos.
Entretanto, na avaliação desses seis anos de TNN com o valor de corte de TSH‐f de 5μUI/mL, foram diagnosticadas 339 crianças com HC que não seriam detectadas com o ponto de corte de 10μUI/mL.
Outros programas de TNN também detectaram casos adicionais de HC com a redução do valor de corte, como observado no estudo de Barone et al.14 em que 63% dos 475 casos de HC encontrados apresentavam TSH‐f entre 4,5 e 9,5μUI/L e no de Korada et al.13 que confirmaram dois casos de HC dentre as 67 crianças a termo com TSH‐f entre 6 e 10μUI/L. Um dos SRTN do Estado de São Paulo, que reduziu o valor de corte de TSH‐f entre 2005 e 2008, também detectou seis casos de HC entre as 1.181 crianças com TSH‐f inicial entre 5 e 10μUI/mL.20 Recentemente, Jones et al.17 observaram, entre os 304 casos de HC diagnosticados, 26 crianças com TSH‐f entre 8 e 10μUI/L na TNN.
Dessa forma, neste estudo, assim como em outros4,13–17 demonstrou‐se que crianças com HC podem não ser detectadas com os pontos de corte mais altos usados habitualmente, esses casos adicionais justificam, em nossa opinião e na de outros autores, a redução no valor de corte de TSH‐f.4,13
A análise da função tireoidiana desse grupo mostrou que foram detectadas crianças com TSH sérico superior a 20μUI/mL, ou T4L abaixo do valor de referência, situação em que o tratamento imediato é preconizado.1
Ainda não é claro na literatura se pacientes com elevações discretas do TSH estão sob risco de alterações do desempenho cognitivo.4,5,8,22 Sugere‐se que casos de distúrbios neurológicos que resultam em diminuição do aproveitamento escolar estejam relacionados a formas leves de HC não detectadas pela TNN, devido a valores de corte de TSH‐f elevados.4,23 Estudo recente demonstrou que crianças com TSH‐f entre os percentis 75 e 99,95 são mais propensas a ter baixo rendimento escolar quando comparadas com aquelas com TSH‐f abaixo do percentil 75.24 Portanto, muitos defendem a tese de que, até que haja evidência de que não há risco de deficiência intelectual sem o uso de L‐T4, o tratamento desses casos é preferível.4,25
Embora a maior parte do grupo tenha recebido o diagnóstico de HC e iniciado o tratamento precocemente, muitas crianças que permaneceram em seguimento em decorrência da não normalização dos valores de TSH se mostraram hipotireoidianas posteriormente, entre três meses e dois anos de idade.
Um fator possivelmente envolvido na confirmação tardia do HC é a amamentação, uma vez que o leite materno pode ser uma fonte exógena de T4, algumas vezes até mascara sinais clínicos de HC.26,27 Existe a chance de que, dada a habitual recomendação do aleitamento materno exclusivo até o sexto mês, algumas crianças com HC leve possam ter apresentado elevação mais pronunciada do TSH após o desmame ou redução do aleitamento materno. Outra possibilidade é serem decorrentes de defeitos de síntese que frequentemente demoram algum tempo para que o hipotireoidismo se defina, como já relatado.28
Os resultados deste estudo mostram que o uso do valor de corte de TSH‐f de 5μUI/mL na TNN permite a detecção de casos adicionais de HC e muitas dessas crianças somente tiveram o diagnóstico confirmado mais tardiamente. Considerando‐se que, entre os diversos países e, até mesmo dentro de um mesmo país, não há uniformidade nos critérios diagnósticos e de seguimento, mais estudos são necessários para fornecer evidências para definição de um valor de corte ideal para o TSH‐f e para estabelecimento de protocolos de diagnóstico e tratamento mais específicos.1,4,29 Baseados nos achados deste estudo, sugerimos o uso do valor de corte de 5μUI/mL e o acompanhamento em longo prazo dessas crianças com o objetivo de detectar todos os casos de HC.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aos pacientes e suas famílias que fizeram parte do estudo. Aos funcionários do Ambulatório de Pediatria do Hospital de Clínicas da Unicamp e do Serviço de Referência em Triagem Neonatal da Unicamp, em especial à bióloga Carmen Sílvia Gabetta, responsável técnica do laboratório do Serviço de Referência em Triagem Neonatal da Unicamp.
Como citar este artigo: Christensen‐Adad FC, Mendes‐dos‐Santos CT, Goto MM, Sewaybricker LE, D'Souza‐Li LF, Guerra‐Junior G, et al. Neonatal screening: 9% of children with filter paper thyroid‐stimulating hormone levels between 5 and 10 μIU/mL have congenital hypothyroidism. J Pediatr (Rio J). 2017;93:649–54.