To describe the role of intravenous magnesium sulfate (MgSO4) as therapy for acute severe asthma in the pediatric emergency department (ED).
SourcePublications were searched in the PubMed and Cochrane databases using the following keywords: magnesium AND asthma AND children AND clinical trial. A total of 53 publications were retrieved using this criteria. References of relevant articles were also screened. The authors included the summary of relevant publications where intravenous magnesium sulfate was studied in children (age <18 years) with acute asthma. The NAEPP and Global Initiative for Asthma expert panel guidelines were also reviewed.
Summary of the dataThere is a large variability in the ED practices on the intravenous administration of MgSO4 for severe asthma. The pharmacokinetics of MgSO4 is often not taken into account with a consequent impact in its pharmacodynamics properties. The cumulative evidence points to the effectiveness of intravenous MgSO4 in preventing hospitalization, if utilized in a timely manner and at an appropriate dosage (50–75mg/kg). For every five children treated in the ED, one hospital admission could be prevented. Another administration modality is a high‐dose continuous magnesium sulfate infusion (HDMI) as 50mg/kg/h/4h (200mg/kg/4h). The early utilization of HDMI for non‐infectious mediated asthma may be superior to a MgSO4 bolus in avoiding admissions and expediting discharges from the ED. HDMI appears to be cost‐effective if applied early to a selected population. Intravenous MgSO4 has a similar safety profile than other asthma therapies.
ConclusionsTreatment with intravenous MgSO4 reduces the odds of hospital admissions. The use of intravenous MgSO4 in the emergency room was not associated with significant side effects or harm. The authors emphasize the role of MgSO4 as an adjunctive therapy, while corticosteroids and beta agonist remain the primary acute therapeutic agents.
Descrever o papel do sulfato de magnésio intravenoso (MgSO4) como terapia para asma grave aguda em serviço de emergência pediátrica (SE).
FonteAs publicações foram pesquisadas nos bancos de dados PubMed e Cochrane com as seguintes palavras‐chave: magnésio E asma E crianças E ensaio clínico. Foram encontradas 53 publicações. As referências de artigos relevantes também foram examinadas. Incluímos o resumo de publicações relevantes quando o sulfato de magnésio intravenoso foi estudado em crianças (idade<18 anos) com asma aguda. Revisamos também as diretrizes do Programa Nacional para a Educação e Prevenção da Asma (NAEPP) e do painel de especialistas da Iniciativa Global para Asma.
Resumo dos dadosHá uma grande variabilidade nas práticas do SE na administração intravenosa do MgSO4 para asma grave. A farmacocinética do MgSO4 normalmente não leva em conta um impacto posterior em suas propriedades farmacodinâmicas. A comprovação cumulativa aponta para a eficácia do MgSO4 intravenoso na prevenção da internação, se usado quando necessário e em uma dosagem adequada (50‐75mg/kg). Uma internação hospitalar pode ser evitada para cada cinco crianças tratadas no SE. Outra modalidade de administração é a infusão prolongada de alta dose de sulfato de magnésio (HDMI) a 50mg/kg/hora/4 horas (200mg/kg/4 horas). O uso precoce da HDMI, para asma não infecciosa mediada, pode ser superior a um MgSO4 em bólus para evitar internações e antecipar as altas do SE. A HDMI parece ter bom custo‐benefício se aplicada precocemente em uma população selecionada. O MgSO4 intravenoso tem um perfil de segurança semelhante a outras terapias de asma.
ConclusõesO tratamento com MgSO4 intravenoso reduz as chances de internações hospitalares. O uso de MgSO4 intravenoso no pronto socorro não é associado a efeitos colaterais ou danos significativos. Enfatizamos o papel do MgSO4 como uma terapia adjuvante, ao passo que os corticosteroides e as beta‐agonistas continuam os agentes terapêuticos agudos primários.
A asma é uma obstrução reversível difusa das vias aéreas inferiores causada por inflamações das vias aéreas e edema, espasmo do músculo liso brônquico e entupimento por muco. O efeito composto leva a obstrução do fluxo de ar expiratório.1 A asma pode ser fatal e deve ser tratada prontamente. A asma grave normalmente é definida como ausência de melhoria após duas horas de tratamento convencional no serviço de emergência (SE) e comumente presente com hipoxemia moderada. A presença de hipoxemia deve ser avaliada de forma não invasiva com oxímetro de pulso. Gases no sangue, estudos sorológicos ou radiológicos não são necessários para definir ou determinar sua gravidade.
Perspectiva sobre um problema de saúdeA asma é a principal causa de doença crônica em crianças, 19‐24% das crianças no Brasil têm sido diagnosticadas com asma em algum momento de suas vidas.2 Ela é a terceira causa de internações entre crianças abaixo de 15 anos. A asma grave é uma das doenças graves reversíveis mais comuns vistas no SE.1,2 Apesar de a mortalidade relacionada à asma ter apresentado possível melhoria, 1/3 dos óbitos ocorreu antes do atendimento médico.3 O manejo no SE para reverter as progressões com relação à insuficiência respiratória deve ser estruturado e agressivo, pois a ventilação mecânica invasiva é repleta de muitas complicações e taxa de mortalidade elevada.4 Devido à enorme demanda por cuidados de saúde relacionados à asma, todos os manejos médicos precisam ser examinados com relação a seu custo‐benefício.
FisiopatologiaA asma envolve uma cascata inflamatória complexa. Há uma ativação mediada por antígenos de células epiteliais e infiltração das vias aéreas por células circulantes que liberam transmissores solúveis que intensificam a cascata inflamatória. A resposta imediata é broncoespasmo (contração do músculo liso). A liberação contínua de mediadores inflamatórios leva a edema nas vias aéreas, lesão mucosa e descamação da camada protetora do epitélio. O desnudamento das vias aéreas reduz a produção de muco normal, expõe os nervos terminais a estimulação colinérgica excessiva e aumenta a contração do músculo liso.5
A progressão dessa fisiopatologia resulta em heterogeneidade pulmonar generalizada com broncoconstrição grave. As áreas pulmonares com entupimento por muco e atelectasia alteram áreas de hiperinflação devido a aprisionamento de ar. Os efeitos combinados dos processos mencionados levam a incompatibilidade de ventilação/perfusão (incompatibilidade V/P) com a expressão clínica de hipoxemia. O aprisionamento de ar coloca o diafragma em uma posição de desvantagem, perde sua área de aposição, produz um esforço ineficaz. A carga de trabalho respiratório aumenta drasticamente e são observadas retrações inspiratórias subesternais que progridem para um padrão paradoxal de respiração toracoabdominal. Em casos graves, o débito cardíaco é comprometido por uma combinação de desidratação, aumento da pressão venosa pulmonar, cria uma diminuição dinâmica no retorno venoso para o átrio direito e uma mudança do septo interventricular, interfere na pré‐carga do ventrículo esquerdo.
Apresentação clínicaA maioria das exacerbações de asma grave ocorre após exposição a desencadeadores alérgicos ou em um ambiente de infecção viral do trato respiratório superior. A maior parte das crianças apresenta tosse, pieira, fase expiratória prolongada e aumento do trabalho respiratório em condições hipoxêmicas leves e desidratação. O grau de pieira não está muito correlacionado à gravidade da doença. Os sistemas clínicos de classificação da asma, como o escore de Woods, não têm granularidade, porém são úteis para o acompanhamento da evolução de cada paciente.6 Esse e outros escores clínicos expressam as variáveis categóricas (leve/moderada/grave) como um número.1–3 Essa descrição facilita a tendência de acuidade em um único paciente, porém qualquer análise estatística desses resultados deve ser feita como variável categórica. O pico de fluxo expiratório (PFE), em pacientes cooperativos previamente treinados, fornece uma avaliação mais granular. Contudo, trata‐se de uma técnica que depende de esforços e difícil de ser usada em estado de insuficiência respiratória, a menos que os investigadores sejam treinados para fazer o teste de espirometria.7 A presença de pulso paradoxal (Pulsus paradoxus) denota a presença de gravidade, porém é difícil avaliá‐lo repetidamente em um SE lotado.
Manejo inicial no SEÉ necessário manejo inicial em um SE organizado e resoluto devido aos fatos compostos de que a asma grave: a) é uma condição com alta incidência, b) tem um potencial de reversibilidade, c) apresenta o risco de progressão para insuficiência respiratória e d) o SE precisa administrar judiciosamente a internação hospitalar. O principal objetivo é estabilizar os pacientes e identificar rapidamente aqueles nos quais o processo não é rapidamente reversível ou correm alto risco de deterioração.
Os tratamentos iniciais incluem: oxigênio, fluidos intravenosos, corticoides intravenosos ou orais, nebulização repetida ou contínua de um agonista adrenérgico ß2 (ou seja, salbutamol), um anticolinérgico muscarínico nebulizador (ou seja, ipratrópio) e MgSO4 intravenoso tardio.
A ausência de melhoria com relação ao regime mencionado, avaliado como persistência da insuficiência respiratória após exame clínico, é definida como asma grave ou “estado de mal asmático”.
Os beta‐agonistas subcutâneos ou intravenosos e as metilxantinas não são usados rotineiramente como principal terapia nos Estados Unidos. Contudo, um estudo feito em Porto Alegre, que avaliou os efeitos do salbutamol intravenoso no SE, constatou uma redução nas exigências de nebulização de agonistas adrenérgicos ß2 após internação hospitalar dos pacientes.8 Esse trabalho estudou apenas as mudanças na frequência respiratória e não observou mudanças em outros achados clínicos. Ele também não mostra se o monitoramento dos sinais vitais foi feito de forma cega. O heliox pode melhorar a entrega de aerolização dos agonistas adrenérgicos ß2 para as vias respiratórias inferiores, porém trata‐se de uma terapia cara, não parece oferecer um benefício consistente e significativo9,10 e precisam ser feitos estudos sobre o custo‐benefício nesse aspecto. O suporte com pressão positiva bifásica nas vias aéreas (BIPAP) no SE parece estabilizar os pacientes com estado de mal asmático antes da internação hospitalar; os dados acumulados (duas publicações) são raros para recomendar essa terapia como padrão.11,12
Por outro lado, o uso de MgSO4 intravenoso surgiu como uma estratégia comprovada para reduzir as internações hospitalares. Os diferentes regimes na administração do MgSO4 e sua contribuição para o manejo da asma grave são o principal objetivo desta análise.
Mecanismo de ação do MgSO4 e cinéticaO mecanismo de ação principal do MgSO4 intravenoso é considerado secundário às suas propriedades espasmolíticas. O magnésio (Mg) sérico suprafisiológico não ligado no sangue, diretamente relacionado a Mg ionizado, produz um bloqueio transitório dos canais de cálcio com receptor de N‐metil‐D‐aspartato com relaxamento muscular posterior. O bloqueio da entrada de cálcio (Ca) no músculo liso das vias aéreas interfere na contratação do músculo liso, induz broncodilatação.13–15 Apesar de outros mecanismos que modulam a reação inflamatória, como atenuação da explosão respiratória de neutrófilos, terem efeitos beneficiários punitivos, seu grau de contribuição para o manejo terapêutico da asma aguda é menos claro.16 O íon Mg++, por meio de seus efeitos sobre o Ca, também inibe a liberação de acetilcolina dos terminais dos nervos motores, inibe a liberação de histamina dos mastócitos e reduz a produção de muco nas glândulas secretoras.17
O MgSO4 intravenoso tem rápido início de ação e, da mesma forma, rápida eliminação renal. Isso apresenta uma mudança terapêutica e uma oportunidade. Atingir efeitos espasmolíticos sustentados é difícil, pois a reabsorção tubular renal do Mg está na capacidade máxima com níveis séricos normais e a liberação renal aumenta linearmente com maiores concentrações.18 Portanto, o nível sérico máximo durante a terapia depende mais da taxa de infusão, e não da dosagem total ou duração da infusão. Em crianças, um estudo retrospectivo escreveu que o volume de distribuição do MgSO4 foi 0,3 L/kg com meia‐vida de 2‐2,7 horas.19 Normalmente, a dosagem de MgSO4 intravenoso em bólus tem sido limitada a 2.000mg, independentemente do tamanho e da função renal do paciente. Essa prática é contraditória em termos farmacocinéticos e afeta suas propriedades farmacodinâmicas.
Experiência do MgSO4 intravenoso em crianças com asmaO MgSO4 é barato, tem efeitos adversos mínimos nas dosagens indicadas e está amplamente disponível. O início da ação do MgSO4 intravenoso é rápido (em minutos), uma necessidade em serviços de emergência. Desde sua descrição original em 1936, a dosagem ideal do MgSO4 intravenoso em bólus não foi estabelecida, o que levou ao uso de uma ampla variação na dosagem de 25 a > 100mg/kg.18–22 Os estudos multicêntricos não conseguiram mostrar uma redução coerente nas internações hospitalares ou liberação antecipada.23‐25 Esses resultados incoerentes podem, em parte, decorrer: a) da não consideração da farmacocinética do MgSO4, b) da não conceitualização do MgSO4 como uma terapia sensível ao tempo, c) dos desafios inerentes das “variáveis de resultado” mencionadas com relação à asma ou d) das populações participantes com processo infeccioso atual nos quais já há estímulos de broncoconstrição e dano nas vias áreas.
Alguns estudos clínicos destacam uma necessidade de regimes com dosagens mais altas.22,26 Ciarallo et al. relataram resultados positivos em dois ensaios clínicos separados por um período de quatro anos, nos quais ele aumentou a dosagem de 25mg/kg para 40mg/kg, administrada por 20 minutos.22 Um estudo farmacocinético retrospectivo que envolveu 54 crianças sugere a necessidade de 50‐75mg/kg em bólus para atingir o nível de Mg próximo a 4mg/dL (1,64 mmol/L).19 Devi et al., na Índia, inscreveram 47 crianças e usaram 100mg/kg por 35 minutos, com coadministração de aminofilina intravenosa. Os resultados mostram uma melhoria nos escores clínicos e do PFE e a exibição gráfica indica efeitos benéficos no início da oxigenação nas primeiras horas e continuidade por 10‐12 horas.27 Contudo, a coadministração de aminofilina nesse estudo cria dúvidas sobre se foi a ação exclusiva do MgSO4 que levou a esse efeito.
O início imediato da terapia pode estar correlacionado à sua eficácia. Um estudo feito na Argentina constatou que a administração antecipada no SE foi associada a um número menor de pacientes, exigiu, mais tarde, ventilação mecânica em uma UTI pediátrica.25 Vale salientar que os indivíduos no grupo de controle eram mais novos e neonatos com bronquiolite podem ter sido incluídos. Um grande ensaio clínico randomizado com 100 pacientes na Índia, que usou um escore clínico de gravidade da asma, parece mostrar a superioridade do MgSO4 em bólus antecipadamente para infusões de terbutalina ou aminofilina;20 vale salientar que muitos desses pacientes eram muito novos e não foi identificada asma infecciosa.
Outro ensaio randomizado em um SE brasileiro demonstrou a superioridade do MgSO4 intravenoso em relação ao placebo com efeitos quase idênticos em relação ao salbutamol intravenoso, ao mesmo tempo em que usou variáveis substitutas da eficácia em pacientes submetidos a internação posterior.8 Uma metanálise anterior conduzida por Cheuk et al. Que examinou cinco ensaios que compararam MgSO4 a placebo parece demonstrar sua eficácia na prevenção da internação.28 Uma metanálise mais recente e mais rigorosa que envolveu três ensaios (115 crianças) concluiu que a redução estimada real na internação é entre 86% e 26% devido a seu amplo intervalo de confiança (razão de chances de 0,32, IC de 95%, 0,14‐0,74). Contudo, um número necessário ao tratamento (NNT) de cinco pode ser atribuído ao uso de MgSO4 intravenoso no SE para evitar internação hospitalar.29 A necessidade posterior de retorno ao pronto socorro após alta não foi bem documentada.
Um estudo com 47 crianças relata redução no tempo de permanência de 5,3 horas nos pacientes internados.28 Essa é uma variável indescritível, pois, uma vez que o paciente é internado, a alta pode não depender exclusivamente da doença do paciente, porém, em vez disso, da disponibilidade de equipe médica, do horário do dia e do fato de serem fins de semana.
Infusão contínua com alta dosagem de MgSO4 (HDMI)A maior parte do Mg no soro está ligada a albumina, ao passo que o Mg ionizado (IoMg), a forma livre, é a forma farmacologicamente ativa na asma. O IoMg constitui 55% do Mg extracelular; contudo, a proporção de Mg/IoMg é adversamente alterada na asma e em pacientes gravemente doentes.24,25,27 Estudos em animais indicam que as concentrações de IoMg ≥ 1 mmol/L devem produzir relaxamento do músculo liso.15
Esses e outros fatores nos levam a estudar a infusão contínua com alta dosagem de MgSO4 (HDMI) em crianças na configuração de asma grave e estado de mal asmático. O HDMI foi usado em pacientes com hipertensão pulmonar, lesão cerebral, hemorragia subaracnoide e extensivamente na pré‐eclâmpsia.30‐33 Nesses cenários, a estratégia é manter um nível terapêutico compatível para compensar a rápida eliminação do MgSO4. Essa abordagem foi raramente usada na asma.28,34 A literatura de obstetrícia e ginecologia usa a infusão de MgSO4 na prevenção e no tratamento das convulsões na eclampsia, a intoxicação pode ser facilmente identificada através da avaliação clínica, da diurese materna e dos reflexos patelares. Isso normalmente representa Mg no soro de 4,8‐8,4mg/dL com IoMg de 0,9‐1,6 mmol/L).15,35,36 Um estudo retrospectivo de Glover et al. do uso contínuo de MgSO4 intravenoso em crianças tentou avaliar a segurança, porém tinha muitas variáveis de confusão. Eles descreveram um grupo heterogêneo com uma grande variação na dosagem e na duração do regime, 35,3 ± 12,7mg/kg em bólus, infusão de 21,6 ± 6mg/kg/hora por 93,8h ± 89,2h sem efeitos colaterais significativos.26
Analisamos retrospectivamente nossa própria prática com HDMI na configuração de estado de mal asmático dentro dos limites da unidade de terapia intensiva pediátrica (UTIP).37 Os regimes de HDMI consistiram em bólus inicial com base no peso: 50mg/kg (> 30kg) ou 75mg/kg (≤ 30kg) por 30‐45 minutos, seguido de infusão contínua de 50mg/kg/hora por quatro horas. Os níveis de magnésio no soro foram 4,4 ± 0,8mg/dL e 0,95 ± 0,2 mmol/L de IoMg ao término da infusão. Isso dentro de nosso intervalo‐alvo. Em 12 pacientes, obtivemos os níveis de troponina e eletrocardiogramas e ambos foram normais.37
Em um estudo prospectivo posterior, determinamos a farmacocinética, o volume de distribuição (VD) da HDMI de 0,4 ± 0,13 L/kg, a liberação de 1,58 ± 0,24mL/kg/min e a segurança, os níveis documentados de IoMg associados ao relaxamento do músculo liso e a ausência de efeitos colaterais significativos.38 Contudo, esse regime foi farmacologicamente preciso, porém complexo, e levou a erros no manejo. Após tentar vários regimes, escolhemos um regime simplificado de 50mg/kg/hora por quatro horas. Em um estudo posterior, comparamos o regime inicial e o simplificado, que demonstraram níveis séricos semelhantes.39
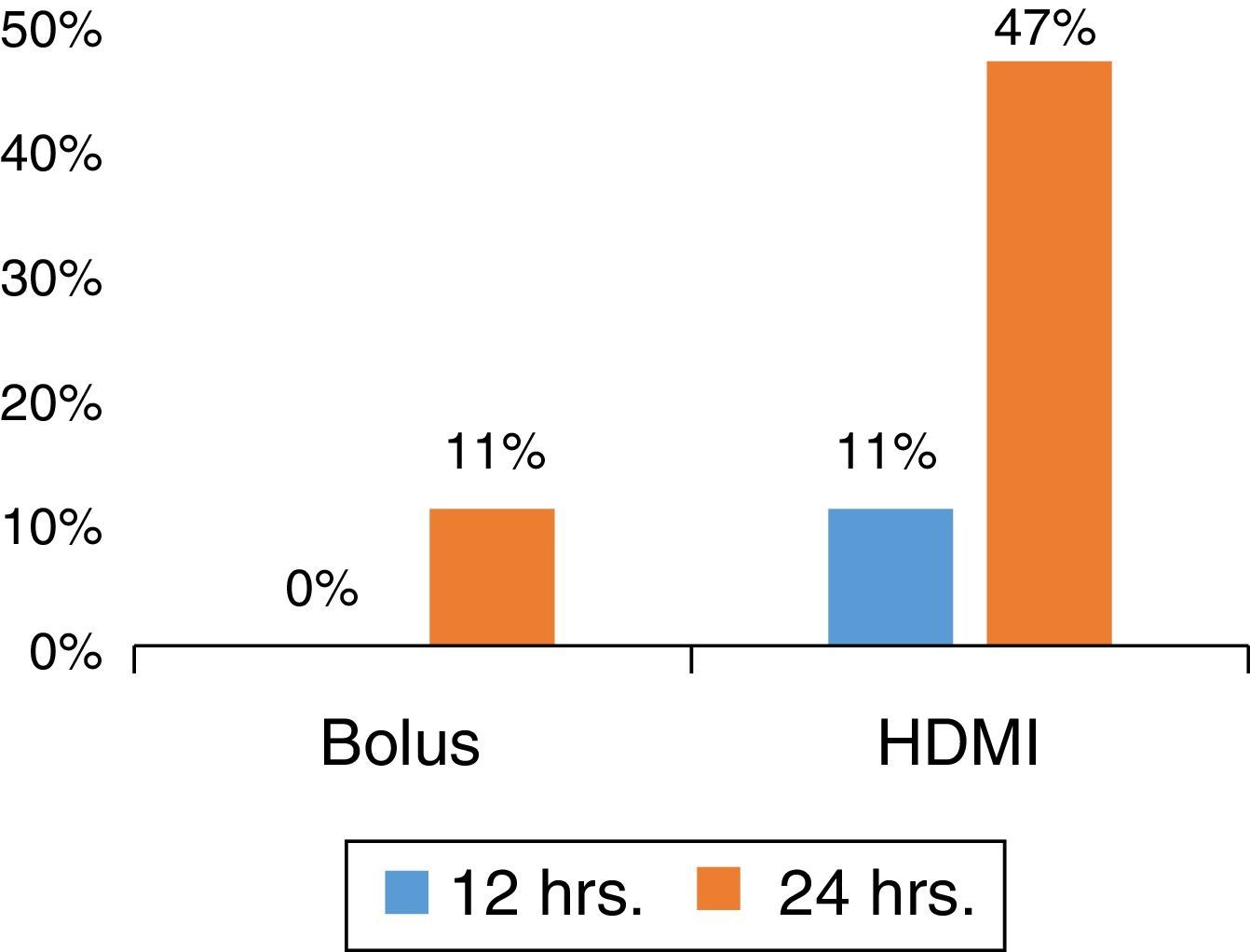
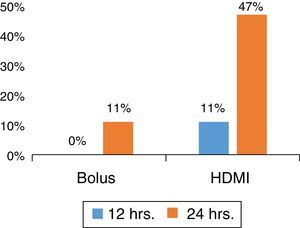
HDMI de MgSO4 em comparação com MgSO4 em bólusEm um estudo prospectivo randomizado sobre asma grave em um SE, com pacientes sem comorbidade subjacente ou etiologia infecciosa, determinamos que a HDMI foi superior a MgSO4 em bólus (Figura 1) na redução do tempo de permanência no SE, ao mesmo tempo em que reduziu o custo.40
Os pacientes foram randomizados para receber 50mg/kg de MgSO4 intravenoso em bólus (por uma hora) ou grupo de HDMI (50/mg/kg/hora por quatro horas) diluído em solução fisiológica a 0,9% em uma concentração de 10mg/mL. O grupo de HDMI apresentou menor tempo de permanência (HDMI 34 ± 19h, bólus 48 ± 19h, p = 0,031; IC de 95% 1,3‐26,5). Ademais, ao tempo de 24 horas, 9/19 (47%) dos pacientes no grupo de HDMI receberam alta hospitalar em comparação com 2/21 (10%) no grupo em bólus (p = 0,012) com redução de risco absoluto (RRA) de 37% (IC de 95% 11‐63). A HDMI foi superior a bólus como um tratamento complementar antecipado, com NNT de 3 (IC de 95% 1,6‐9,5) para facilitar a alta ao tempo de 24 horas do SE.39 A análise intermediária ao tempo de 12 e 36 horas mostrou as mesmas tendências, favoreceu o grupo de HDMI, e 2/3 dos pacientes receberam alta ao tempo de 36 horas, p = 0,009 (RRA de 42%, IC de 95% 14‐70%; NNT de 3, IC de 95% 1,4‐7,3). A incorporação da HDMI no manejo da asma no SE nessa instituição apresentou bom custo‐benefício.39
Efeitos colaterais e possíveis desafiosO enfraquecimento muscular induzido por MgSO4, com o risco consequente de insuficiência respiratória, e a possível vasodilatação, com hipotensão posterior, são preocupantes no contexto de asma.41,42 Apesar de muitos estudos anteriores terem mostrado efeitos adversos mínimos ou não terem mostrado efeitos adversos, o medo desses efeitos colaterais é generalizado. Efeitos colaterais insignificantes foram descritos em 16% dos pacientes: calor epigástrico, formigamento, dormência e dor no local da infusão; todos eles apareceram dentro de cinco minutos do início e desaparecem logo após.27 Deve‐se salientar que esse estudo parece ter usado 100mg/kg em bólus por 35 minutos.27 Schuh et al. constataram um comportamento contraditório em uma pesquisa on‐line de médicos em SEs. Apesar de mais de 80% dos respondedores terem concordado que havia dados para corroborar o uso de MgSO4, ele foi usado em menos de 20% do tempo; 24% dos médicos pesquisados lembraram ter observado pelo menos um episódio de hipotensão que exigiu intervenção e 23% dos médicos tinham preocupações acerca de seus efeitos colaterais. Uma pesquisa on‐line, uma metodologia que sofre de viés de autosseleção e viés de memória subjetiva, enfatizou a predisposição geral de os médicos desenvolverem opiniões quando há falta de dados.34
Em quatro estudos de HDMI, não foram observados efeitos colaterais significativos, exceto um paciente que relatou náusea, dois pacientes relataram dor no local da injeção e dois relataram rubor generalizado. Nenhum deles apresentou enfraquecimento muscular significativo ou necessidade de apoio respiratório. Deve‐se esperar baixa pressão arterial diastólica durante a HDMI, caso aferida por esfigmomanômetro automatizado. Documentamos níveis normais de troponina de 0,05 ± 0,01 ng/mL e nenhuma alteração no ECG durante a HDMI.38 Deve‐se salientar, em um método não invasivo, que as alterações nos sons de Korotkoff entre 4 a 5 determinam a pressão sanguínea diastólica.43 O esfigmomanômetro automatizado dificulta a elucidação dessa alteração quando os pacientes recebem altas doses de agonista adrenérgico ß2 ou HDMI. Um estudo com cateter intra‐arterial invasivo pode conseguir refinar esse ponto.
Um problema contemporâneo é que uma proporção cada vez maior de pacientes com asma é obesa44,45 e isso exige a necessidade de ajuste da dosagem intravenosa. Em nosso estudo, ajustamos para peso corporal ideal quando o IMC é ≥ 25. Também são necessários estudos adicionais nessa área.
MgSO4 inalado em casos de asmaA grande eficácia dos beta‐agonistas nebulizados no tratamento de asma torna seu papel incontestável. Contudo, os medicamentos inalados são difíceis de chegar aos brônquios afetados, mesmo em condições ideais. Estudos mostraram que apenas cerca de 10% dos broncodilatadores atingem o pulmão e são, em grande parte, afetados pela frequência respiratória, pelos volumes correntes, pela ventilação do espaço morto (Vd/Vt), pela broncoconstrição, pelo método de entrega, pela “respiração bucal” e pelo tamanho e pela deposição de partículas.
O uso de sulfato de magnésio inalado apresentou resultados incoerentes. Uma análise sistemática mostrou que os ensaios clínicos que estudam o uso de MgSO4 inalado não constatam um efeito benéfico e seu uso não é amplamente recomendado.46
ConclusõesAs melhorias no manejo da asma grave no SE e um diagnóstico correto para internações em hospitais podem ter um impacto econômico significativo, especialmente em áreas com poucos recursos. Um manejo inicial no SE pré‐planejado, organizado e decisivo é essencial para reverter uma doença que pode evoluir para insuficiência respiratória. Enfatizamos o papel do MgSO4 como terapia adjuvante no manejo inicial da asma, ao passo que os agonistas adrenérgicos ß2 e corticosteroides continuam o manejo principal. Existe a possibilidade de que os resultados incompatíveis de estudos anteriores com MgSO4 tenham decorrido de uma falha em atingir efeitos do magnésio e espasmolíticos no sangue para que os agonistas adrenérgicos ß2 atingissem o local de ação. A incorporação de HDMI a 50mg/kg/hora por cinco horas nos SEs facilita a alta antecipada, reduz as taxas de internação e tem bom custo‐benefício.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Irazuzta JE, Chiriboga N. Magnesium sulfate infusion for acute asthma in the emergency department. J Pediatr (Rio J). 2017;93:19–25.