To assess the performance of cerebrospinal fluid (CSF) lactate as a biomarker to differentiate bacterial meningitis (BM) from viral meningitis (VM) in children, and to define an optimal CSF lactate concentration that can be called significant for the differentiation.
MethodsChildren with clinical findings compatible with meningitis were studied. CSF lactate and other conventional CSF parameters were recorded.
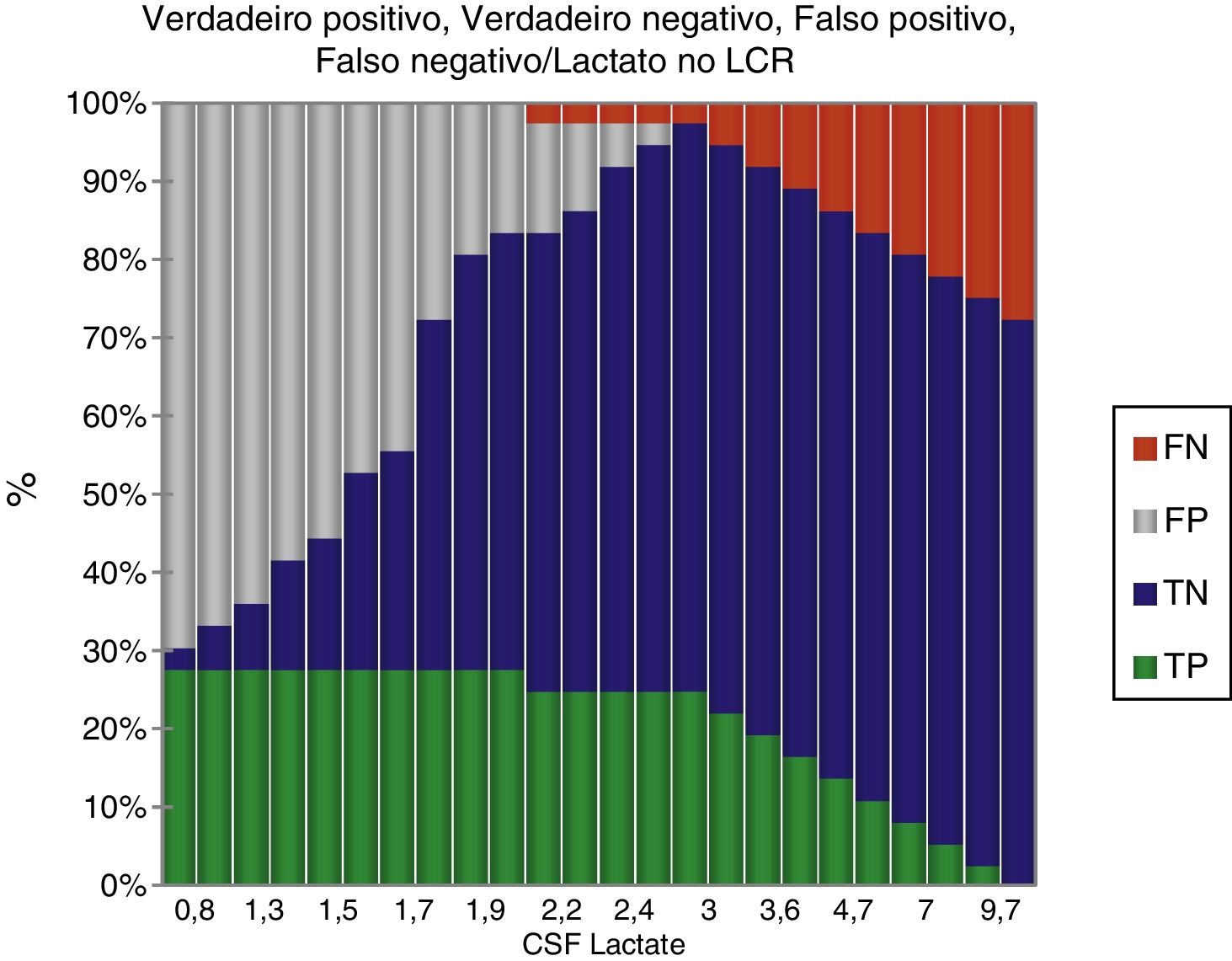
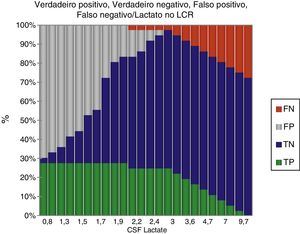
ResultsAt a cut‐off value of 3mmol/L, CSF lactate had a sensitivity of 0.90, specificity of 1.0, positive predictive value of 1.0, and negative predictive value of 0.963, with an accuracy of 0.972. The positive and negative likelihood ratios were 23.6 and 0.1, respectively. When comparing between BM and VM, the area under the curve (AUC) for CSF lactate was 0.979.
ConclusionsThe authors concluded that CSF lactate has high sensitivity and specificity in differentiating bacterial from viral meningitis. While at a cut‐off value of 3mmol/L, CSF lactate has high diagnostic accuracy for BM, mean levels in VM remain essentially below 2mmol/L.
Estudar o desempenho do lactato no líquido cefalorraquidiano como biomarcador para diferenciar a meningite bacteriana da meningite viral em crianças, e definir uma concentração de lactato ótima no líquido cefalorraquidiano que possa ser significativa para a diferenciação.
MétodosForam estudadas crianças com achados clínicos compatíveis com meningite. O nível de lactato no líquido cefalorraquidiano e outros parâmetros convencionais do líquido cefalorraquidiano foram registrados.
ResultadosEm um valor de corte de 3 mmol/L, o lactato no líquido cefalorraquidiano apresentou uma sensibilidade de 0,90, especificidade de 1,0, valor preditivo positivo de 1,0, valor preditivo negativo de 0,963, com uma precisão de 0,972. Os índices de probabilidade positivo e negativo foram 23,6 e 0,1, respectivamente. Para comparação entre a meningite bacteriana e viral, a área abaixo da curva do lactato no líquido cefalorraquidiano foi 0,979.
ConclusõesConcluímos que o lactato no líquido cefalorraquidiano possui alta sensibilidade e especificidade na diferenciação da meningite bacteriana da meningite viral. Embora em um valor de corte de 3 mmol/L o lactato no líquido cefalorraquidiano possua alta precisão de diagnóstico da meningite bacteriana, os níveis médios na meningite viral permanecem basicamente abaixo de 2 mmol/L.
Casos de meningite bacteriana (MB) aguda exigem diagnóstico e tratamento imediatos devido a taxas de mortalidade significativas.1,2 O atraso no início de uma terapia adequada poderá piorar o prognóstico.1 Embora a meningite bacteriana cause morbidez significativa e mortalidade apesar de avanços na terapia antibiótica, a meningite asséptica (MA) é basicamente uma condição benigna que exige apenas cuidado de apoio.3 Assim, a rápida diferenciação entre as meningites bacteriana e asséptica é importante para permitir o início precoce da terapia adequada. Apesar da disponibilidade de vacinas contra os organismos prevalentes, a MB continua a ser um problema de saúde com sequelas de longo prazo em crianças e adultos, especialmente em países com poucos recursos.4,5
Embora a cultura continue a ser o padrão de base para o diagnóstico, os resultados demoram muitos dias.6 O diagnóstico rápido é feito por meio da avaliação de marcadores convencionais no LCR: contagem de leucócitos, açúcar, proteína e coloração de gram.7 Contudo, a meningite às vezes apresenta‐se com manifestações atípicas no LCR e as culturas poderão nem sempre ser positivas ou estar disponíveis para o diagnóstico precoce.8 Nos últimos anos, foi proposto que o lactato no LCR poderá ser um bom marcador que pode diferenciar a meningite bacteriana da meningite parcialmente tratada e da meningite asséptica.9 Entretanto, outros pesquisadores têm sugerido que o lactato no LCR não oferece informações adicionais clinicamente úteis em relação aos marcadores convencionais no LCR.10,11 A precisão do diagnóstico relatado de lactato no LCR para o diagnóstico diferenciado de MB e MA tem variado em todos os estudos.10,11 Este estudo prospectivo foi feito para avaliar o nível de lactato no LCR, como um biomarcador para diferenciar a MB da MV (meningite viral) em crianças e definir uma concentração de lactato ótima no LCR que possa ser significativa para a diferenciação.
MétodosFizemos um estudo prospectivo que incluiu crianças com meningite entre um mês e 15 anos, atendidas no departamento de emergência do hospital SKIMS (Sher‐I‐Kashmir Institute of Medical Sciences), Kashmir, por aproximadamente dois anos (janeiro de 2014 a dezembro de 2015). Incluímos crianças que tiveram achados clínicos compatíveis com meningite (por exemplo, febre, dores de cabeça, vômito, rigidez na nuca, consciência reduzida). Amostras de sangue foram colhidas e uma punção lombar foi feita após a avaliação clínica inicial. Foram feitos exames bioquímicos e citológicos de amostras do LCR, inclusive contagem de leucócitos, contagem de neutrófilos, nível de glicose, concentração de proteína e lactato. Foi feita cultura de LCR para meningite bacteriana; reação em cadeia da polimerase (PCR) do LCR para o vírus do herpes simples e sorologia para meningite viral. Em amostras de sangue coletadas na mesma época, fez‐se contagem de leucócitos séricos, glicose sérica e hemocultura. Excluímos crianças com quaisquer das seguintes características: gravemente doente, intervenção neurocirúrgica recente, trauma, qualquer foco de infecção não relacionado à meningite e crianças que haviam tomado antibióticos antes da internação.
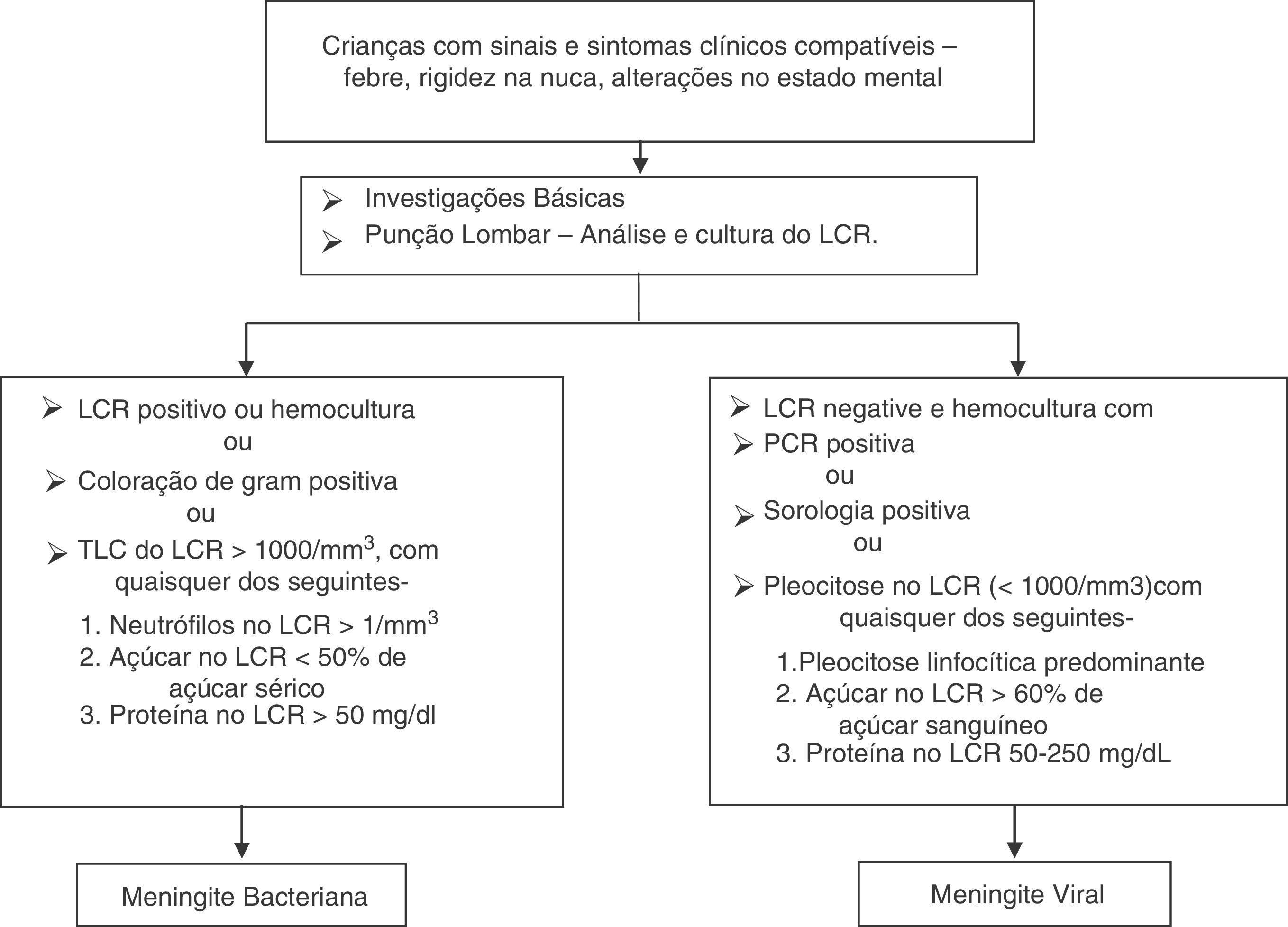
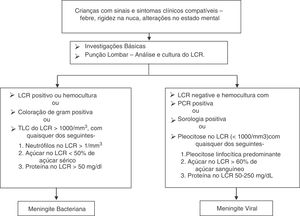
As definições de caso de meningite estão dispostas no fluxograma representado abaixo (fig. 1). Na ausência de etiologia viral comprovada, a meningite foi considerada viral nos casos em que a cura foi obtida sem qualquer tratamento com antibiótico, além da terapia antiviral.
Os seguintes dados foram registrados em relação aos pacientes estudados: dados demográficos (idade, sexo, peso), número total de pacientes internados, número de crianças excluídas e razões, histórico de saúde, achados clínicos e resultados dos testes feitos. O estudo foi aprovado pelo comitê de ética do hospital. O consentimento informado por escrito foi obtido de todos os pais/responsáveis.
Os programas usados para análise estatística foram o SPSS (SPSS estatística para Windows, Versão 20.0. NY, EUA) e o XLSTAT 2016 (Microsoft® Excel/XLSTAT© 2016, Addinsoft, Inc., Brooklyn, NY, EUA). Os resultados foram expressos como a média (IC de 95%). Os valores médios foram comparados com o teste não paramétrico de Mann‐Whitney e o limite de relevância estatística foi estabelecido em p < 0,05. A eficiência do diagnóstico de lactato diferente no LCR foi expressa como sensibilidade, especificidade, valor preditivo positivo e valor preditivo negativo. O poder discriminativo dos diversos parâmetros estudados foi determinado por meio de curvas de característica de operação do receptor (ROC).12
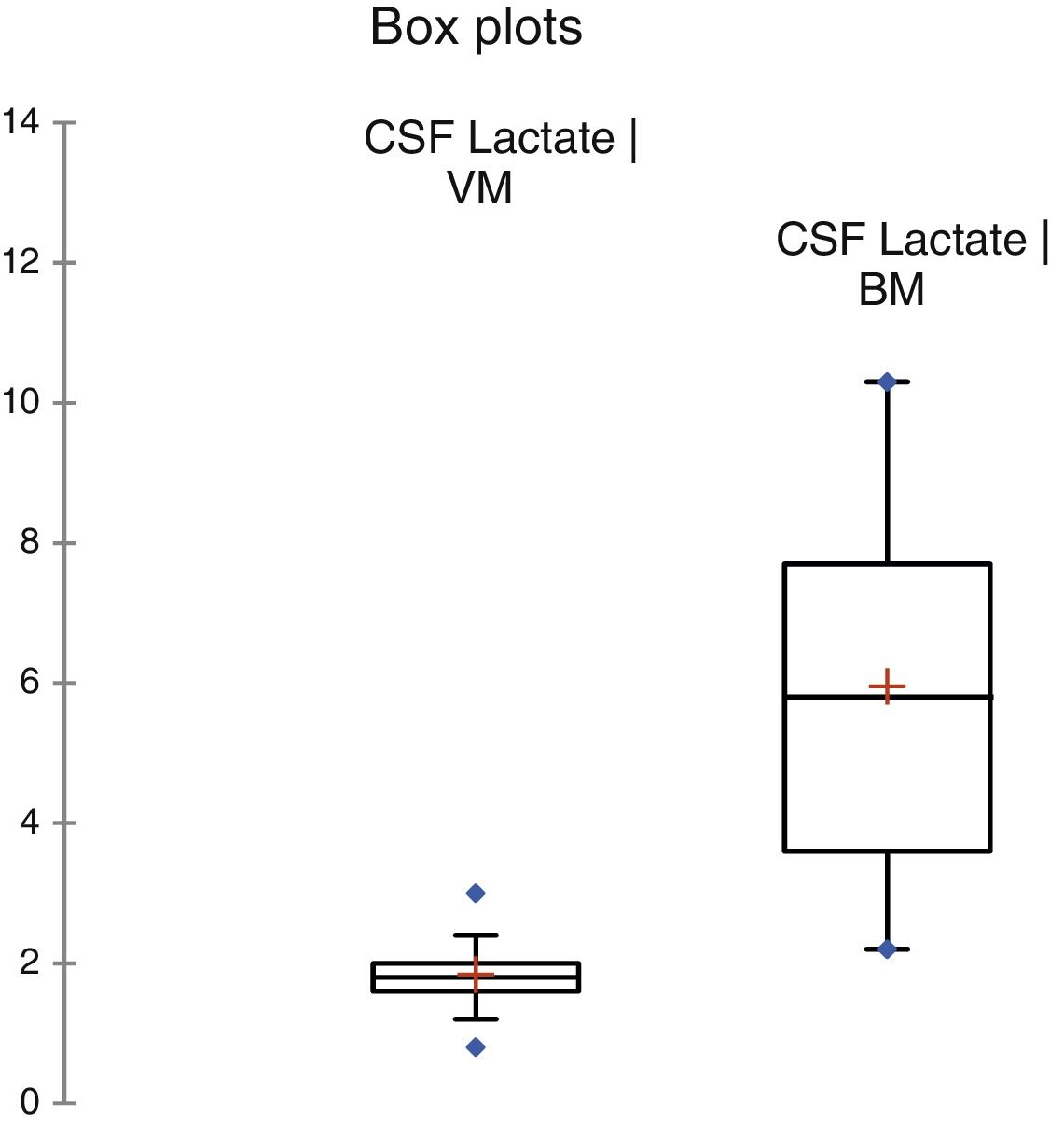
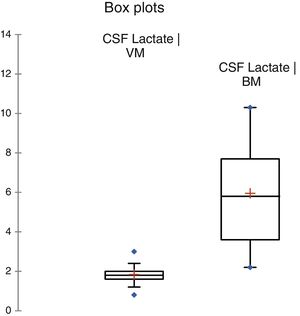
ResultadosDurante o período do estudo, 378 pacientes foram elegíveis para uma punção lombar. A MB foi diagnosticada em 60 (15,8%) e 156 (41,3%) atenderam aos critérios de meningite viral. Os 162 (42,8%) que não se encaixaram em qualquer dos grupos foram excluídos, descartou‐se a possibilidade de meningite. Ambos os grupos foram comparáveis em termos de características básicas (tabela 1). A cultura de LCR foi positiva em 19 (31,7%) pacientes e a hemocultura apresentou resultados positivos em nove (15%). As seguintes bactérias foram identificadas em culturas de LCR: Streptococcus pneumoniae (12), Haemophilus influenza (uma), Klebsiella pneumonia (quatro), E. coli (dois). As bactérias identificadas na hemocultura foram Streptococcus pneumoniae (cinco), Klebsiella pneumonia (três), E. coli (uma). A coloração de gram foi positiva em 16 (26,7%) pacientes com MB. Entre os 156 pacientes com MV, a meningite por herpes foi identificada em seis por meio de PCR. Os níveis de LCR de diferentes parâmetros estão resumidos na tabela 1. A figura 2 apresenta a eficiência do diagnóstico de lactato no LCR e a figura 3 apresenta a comparação em diagrama de caixa do lactato no LCR nas meningites bacteriana e viral. Em um valor de corte de 3 mmol/L, o lactato no LCR apresentou uma sensibilidade de 0,90, especificidade de 1,0, valor preditivo positivo de 1,0, valor preditivo negativo de 0,963, com uma precisão de 0,972. Para comparação entre a MB e a MV, a área abaixo da curva (AUC) do lactato no LCR foi 0,979. A média do lactato no LCR (IC de 95%) em pacientes com sangue positivo e negativo e/ou cultura de LCR foi de 6,22 (5,05‐7,39) e 5,84 (4,90‐6,79) mmol/L, respectivamente (p = 0,24). Não houve diferença estatisticamente significativa nas concentrações de lactato no LCR entre pacientes com meningite bacteriana gram‐positiva e gram‐negativa [6,91 (5,22‐8,61) em comparação com 5,05 (3,65‐6,45) mmol/L] (p = 0,116).
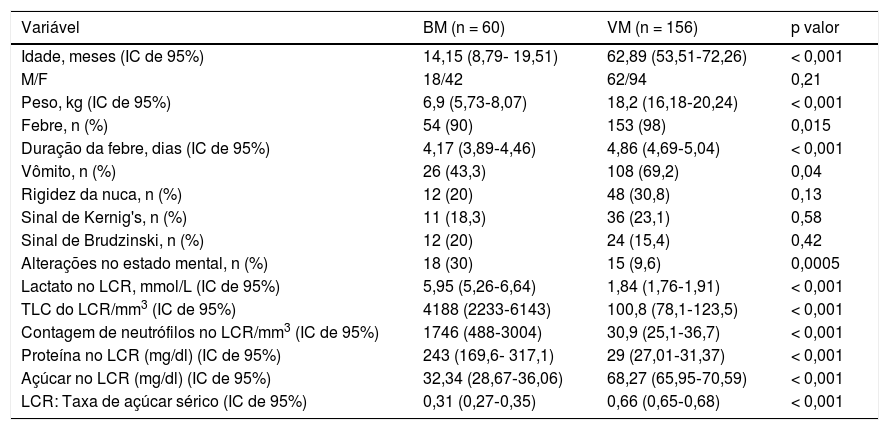
Características demográficas, clínicas e do LCR dos pacientes
| Variável | BM (n = 60) | VM (n = 156) | p valor |
|---|---|---|---|
| Idade, meses (IC de 95%) | 14,15 (8,79‐ 19,51) | 62,89 (53,51‐72,26) | < 0,001 |
| M/F | 18/42 | 62/94 | 0,21 |
| Peso, kg (IC de 95%) | 6,9 (5,73‐8,07) | 18,2 (16,18‐20,24) | < 0,001 |
| Febre, n (%) | 54 (90) | 153 (98) | 0,015 |
| Duração da febre, dias (IC de 95%) | 4,17 (3,89‐4,46) | 4,86 (4,69‐5,04) | < 0,001 |
| Vômito, n (%) | 26 (43,3) | 108 (69,2) | 0,04 |
| Rigidez da nuca, n (%) | 12 (20) | 48 (30,8) | 0,13 |
| Sinal de Kernig's, n (%) | 11 (18,3) | 36 (23,1) | 0,58 |
| Sinal de Brudzinski, n (%) | 12 (20) | 24 (15,4) | 0,42 |
| Alterações no estado mental, n (%) | 18 (30) | 15 (9,6) | 0,0005 |
| Lactato no LCR, mmol/L (IC de 95%) | 5,95 (5,26‐6,64) | 1,84 (1,76‐1,91) | < 0,001 |
| TLC do LCR/mm3 (IC de 95%) | 4188 (2233‐6143) | 100,8 (78,1‐123,5) | < 0,001 |
| Contagem de neutrófilos no LCR/mm3 (IC de 95%) | 1746 (488‐3004) | 30,9 (25,1‐36,7) | < 0,001 |
| Proteína no LCR (mg/dl) (IC de 95%) | 243 (169,6‐ 317,1) | 29 (27,01‐31,37) | < 0,001 |
| Açúcar no LCR (mg/dl) (IC de 95%) | 32,34 (28,67‐36,06) | 68,27 (65,95‐70,59) | < 0,001 |
| LCR: Taxa de açúcar sérico (IC de 95%) | 0,31 (0,27‐0,35) | 0,66 (0,65‐0,68) | < 0,001 |
IC, intervalo de confiança; LCR, líquido cefalorraquidiano; MB, meningite bacteriana; MV, meningite viral; TLC, contagem total de leucócitos.
Os resultados neurológicos da meningite bacteriana normalmente são pobres, o que ressalta a importância do diagnóstico e do tratamento precoces.13 Felizmente, a meningite bacteriana é menos comum do que a meningite asséptica, em uma série de 3295 crianças com pleocitose, apenas 4% apresentaram meningite bacteriana.14 A incidência de MB em nosso estudo foi de 15,8%. A idade média dos pacientes do grupo com MB era significativamente menor do que a do grupo com MV. Em outras palavras, a MB em nosso estudo foi mais prevalente em faixas etárias mais baixas. Essa observação foi de acordo com o estudo de vigilância feito em Louisville, Kentucky,15 que concluiu que os mais afetados com a MB pneumocócica são os indivíduos com menos de dois anos, que também foram o organismo etiológico mais comum em nosso estudo.
Rigidez na nuca, febre e estado mental alterado estão entre os sinais e sintomas mais comumente relatados em adultos com meningite bacteriana,8 apesar de um ou mais desses sinais e sintomas normalmente não se apresentarem.16,17 A febre (90%) foi relatada como o sintoma mais comum, seguida de vômito (43,3%) e alterações no estado mental (30%). A rigidez na nuca (20%) e o sinal de Brudzinski (20%) foram os sinais mais comuns apresentados. Observamos, no geral, a tríade clássica presente apenas em 20% dos pacientes com meningite bacteriana. Van de Beek et al., em uma série, relataram que todas as três características estavam presentes em apenas 44% de 696 adultos com meningite bacteriana comprovada,18 porém a ausência de todas as três excluiu o diagnóstico, com uma sensibilidade de 99%. Berkley et al. observaram que 50‐90% dos pacientes com meningite bacteriana relataram rigidez no pescoço.19 Thomas et al. ainda concluíram que o valor diagnóstico pobre de rigidez no pescoço não melhora com os sinais de Kernig ou Burdzinski porque nenhum deles tem uma sensibilidade de mais de 10%.16
Nossos resultados mostraram que, no geral, o histórico clínico e o exame têm uma baixa precisão de diagnóstico quando usados individualmente. Essa observação estava de acordo com os achados de estudos anteriores em crianças e adultos.20,21 Dessa forma, o ônus do diagnóstico final reside no exame do LCR e no isolamento bacteriano por meio de culturas, em um caso clinicamente compatível. Nigrovic et al. relataram que a avaliação combinada do histórico, a microscopia do LCR e a bioquímica do LCR apresentaram uma sensibilidade de 100% e uma especificidade de 66% na diferenciação entre MB e MV em crianças.14 Contudo, a manifestação atípica do exame do LCR, inclusive cultura negativa e coloração de gram negativa, pode resultar no diagnóstico perdido de meningite bacteriana. Estudos em adultos observaram que suplementar o lactato no LCR para exames de rotina do LCR pode estimar a chance de meningite bacteriana mais satisfatoriamente em um período muito curto.21,22
O mecanismo do aumento na concentração de lactato no LCR de pacientes com meningite não está claro, porém tem sido relacionado à glicólise anaeróbica do tecido do cérebro devido a uma diminuição no fluxo de sangue cerebral e um aumento do oxigênio.23 Observamos um aumento estatisticamente significativo do lactato no LCR em pacientes com MB em comparação com pacientes com MV. Em um valor de corte de 3 mmol/L, o lactato no LCR apresentou alta sensibilidade, especificidade e precisão para diferenciar a MB da MV. Os valores de corte estudados com relação à concentração do lactato no CSF variam de 2,1 a 4,44 mmol/L, em diferentes estudos feitos com adultos e crianças.22,24 Embora a epidemiologia da meningite bacteriana difira de acordo com a idade,25 estudos têm demonstrado que o valor diagnóstico do lactato no LCR é semelhante em crianças e adultos.21 Huy et al., em uma análise sistemática sobre a avaliação da concentração do lactato no líquido cefalorraquidiano para distinguir a meningite bacteriana da asséptica, relataram uma sensibilidade que varia de 0,86 a 1,00 (média, 0,96; intervalo de confiança [IC] de 95%, 0,95 a 0,98) e uma especificidade que variou amplamente de 0,43 a 1,00 (média, 0,94; IC de 95%, 0,93 a 0,96). A média do índice de probabilidade positivo (LR+) foi calculada em 14,53 (IC de 95%, 8,07 a 26,19) e o índice de probabilidade negativo (LR‐) em 0,07 (IC de 95%, 0,05 a 0,09).22
Observamos que a AUC da concentração de lactato no LCR foi 0,979, indicou um nível de precisão geral excelente.26 Essa observação estava de acordo com a literatura anterior, com AUCs que variam de 0,977 a 0,988.22,27 Os índices de probabilidade positivos e negativos foram 23,6 e 0,1, respectivamente. Sakushima et al., em sua análise sistemática, observaram que o lactato no LCR apresentou índice de probabilidade positivo (LR+) de 22,9 (IC de 95%: 12,6‐41,9), índice de probabilidade negativo (LR‐) de 0,07 (IC de 95%: 0,05‐0,12) e razões de chance de diagnóstico de 313 (IC de 95%: 141‐698). Eles concluíram que o índice de probabilidade negativo muito baixo significa que a falta de lactato no LCR é um fator particularmente bom para descartar a meningite bacteriana.21
Em nosso estudo, não houve diferença significativa no lactato no LCR em pacientes com MB gram‐positiva ou gram‐negativa. Como a concentração de lactato no LCR não é específica para a MB nem para qualquer bactéria específica em pacientes com MB, os resultados sempre devem ser interpretados em linha com achados clínicos e resultados de ensaios convencionais, inclusive concentrações de proteína, células, glicose no LCR e um exame microbiológico do LCR.28 Além disso, o lactato no LCR não pode ser usado para fazer a escolha da seleção de antibióticos, que deve ter como base os resultados do exame de esfregaço microscópio e/ou da cultura de bactérias.
Nosso estudo apresentou várias limitações. Apenas uma única medição do lactato foi feita na internação hospitalar, não foram feitas avaliações repetidas para monitorar o tratamento e a resposta. Além disso, não foram feitas comparações diretas com marcadores séricos convencionais nem com algum biomarcador do LCR (como a proteína C reativa [PCR]).
Concluímos que o lactato no LCR tem alta sensibilidade e especificidade para diferenciar a MB da MV. Embora em um valor de corte de 3 mmol/L o lactato no LCR tenha alta precisão de diagnóstico da MB, os níveis médios na MV permanecem basicamente abaixo de 2 mmol/L. Pesquisas adicionais que incluíram estudos de custo‐benefício devem ser feitas para investigar a eficácia do lactato no LCR como um marcador de diagnóstico da MB e para avaliar o impacto econômico de usar essa técnica como um ensaio de rotina no hospital para distinguir a MB da MV.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Nazir M, Wani WA, Malik MA, Mir MR, Ashraf Y, Kawoosa K, et al. Cerebrospinal fluid lactate: a differential biomarker for bacterial and viral meningitis in children. J Pediatr (Rio J). 2018;94:88–92.