To compare the results obtained with the sweat test using the conductivity method and coulometric measurement of sweat chloride in newborns (NBs) with suspected cystic fibrosis (CF) in the neonatal screening program.
MethodsThe sweat test was performed simultaneously by both methods in children with and without CF. The cutoff values to confirm CF were>50mmol/L in the conductivity and>60mmol/L in the coulometric test.
ResultsThere were 444 infants without CF (185 males, 234 females, and 24 unreported) submitted to the sweat test through conductivity and coulometric measurement simultaneously, obtaining median results of 32mmol/L and 12mmol/L, respectively. For 90 infants with CF, the median values of conductivity and coulometric measurement were 108mmol/L and 97mmol/L, respectively. The false positive rate for conductivity was 16.7%, and was higher than 50mmol/L in all patients with CF, which gives this method a sensitivity of 100% (95% CI: 93.8 to 97.8), specificity of 96.2% (95% CI: 93.8 to 97.8), positive predictive value of 83.3% (95% CI: 74.4 to 91.1), negative predictive value of 100% (95% CI: 90.5 to 109.4), and 9.8% accuracy. The correlation between the methods was r=0.97 (p>0.001). The best suggested cutoff value was 69.0mmol/L, with a kappa coefficient=0.89.
ConclusionThe conductivity test showed excellent correlation with the quantitative coulometric test, high sensitivity and specificity, and can be used in the diagnosis of CF in children detected through newborn screening.
Comparar os resultados obtidos no teste do suor pelo método da condutividade e a dosagem coulométrica de cloreto no suor em recém0nascidos (RN) suspeitos da triagem neonatal para fibrose cística (FC).
MétodosO teste do suor foi feito simultaneamente pelos dois métodos em crianças com e sem FC. Os valores de corte para confirmar FC foram na condutividade>50mmol/L e no teste coulométrico>60mmol/L.
ResultadosFizeram o teste do suor por condutividade e dosagem coulométrica simultaneamente 444 RN sem FC (185 do sexo masculino, 234 do feminino e 24 não informado) e obtiveram resultado mediano de 32mmol/L e 12mmol/L respectivamente. Para os noventa RN com FC os valores medianos de condutividade e dosagem coulométrica foram 108mmol/L e 97mmol/L respectivamente. O índice de falso positivo para condutividade foi de 16,7% e em todos os pacientes FC foi superior a 50mmol/L, o que confere ao método 100% de sensibilidade (IC 95%=93,8 a 97,8), especificidade de 96,2% (IC 95%=93,8 a 97,8), valor preditivo positivo 83,3 (IC 95% = 74,4 a 91,1), valor preditivo negativo 100% (IC 95% = 90,5 a 109,4) e acurácia 9,8%. A correlação entre os métodos foi de r=0,97 (p>0,001).O melhor valor de corte sugerido foi de 69,0mmol/L, coeficiente de kappa=0,89.
ConclusãoO teste da condutividade apresentou excelente correlação com o quantitativo coulométrico, alta sensibilidade e especificidade e pode ser usado no diagnóstico da FC em crianças detectadas pela triagem neonatal.
A fibrose cística (FC) é uma doença autossômica recessiva, resultado de mutações do gene, situado no braço longo do cromossomo 7, Cystic Fibrosis Transmembrane Conductance Regulator (CFTR), com uma incidência em torno de 1:10.000 no Brasil.1,2 Trata‐se de doença multissistêmica. O acometimento pulmonar é responsável pela maior morbimortalidade dos pacientes. Os sinais e sintomas clínicos incluem doença pulmonar crônica, insuficiência pancreática, anomalias no trato gastrointestinal e no canal secretor de glândulas sudoríparas com um aumento na concentração de cloreto no suor.3‐5 A sobrevida depende da confirmação diagnóstica precoce e o tratamento é instituído nas fases iniciais da doença. A identificação é feita pela presença de sinais ou sintomas; história familiar; teste de triagem neonatal tripsina imunorreativa (TIR) alterado e confirmado pelo teste do suor positivo em duas dosagens independentes, presença de duas mutações da FC ou diferença de potencial nasal alterado. Esse último teste requer habilidade considerável e é pouco usado em nosso meio.6,7
No Brasil, a triagem da FC foi introduzida no Programa Nacional de Triagem Neonatal (PNTN) em 2001 com a pesquisa da tripsina imunorreativa (TIR) no sangue coletado dos recém nascidos (RN) e o teste do suor.2
O teste confirmatório, padrão ouro, é a análise quantitativa de eletrólitos no suor com precisão superior a 90%.8 A sudorese é estimulada pela pilocarpina, feita por meio da iontoforese, e o suor obtido pelo método Gibson e Cooke. Contudo, é necessária habilidade para prevenir evaporação durante a coleta e a determinação posterior do peso do suor em balança analítica de precisão seguida da composição química da amostra. O sistema de coleta do suor em microtubo capilar Macroduct® (Wescor Inc. Logan, Utah, EUA), pela sua simplicidade e eficiência, tem sido amplamente usado. O microtubo evita a evaporação e as etapas de pesagem e diluição são eliminadas. O suor pode ter sua composição iônica analisada imediatamente ou ser submetido a um analisador de condutividade, antes da determinação química.9 O teste é positivo se a concentração de cloretos estiver acima de 60mmol/L em pelo menos duas dosagens independentes.8,10 Para lactentes abaixo de seis meses consideram‐se suspeitos valores entre 30mmol/L e 50mmol/L.9–11 A condutividade constitui‐se também método opcional e válido para o diagnóstico laboratorial da FC.7,8,10 O sistema mede a capacidade do suor de conduzir corrente elétrica em miliampere (mA), que depende da concentração de Na+ e Cl−.12
O analisador da condutividade Sweat Check 3120® (Wescor Inc. Logan, Utah, EUA) especificamente para ser usado com o coletor de suor Wescor Macroduct® (Wescor Inc. Logan, Utah, EUA), mede a condutividade em 6 a 10 microlitros da amostra. Valores acima de 80mmol/L e quadro clínico compatível justificam o início do tratamento e entre 50mmol/L e 80mmol/L indicam necessidade do teste quantitativo, pois a condutividade é considerada método de triagem por não ser seletivo ao íon cloreto.8‐10
O objetivo deste estudo foi comparar os valores de cloro no suor pelo teste quantitativo coulométrico com os valores de condutividade em RN com e sem FC do programa de triagem neonatal do Paraná.
MétodosEsta pesquisa foi aprovada pelo Comitê de Ética do HC‐UFPR sob registro 271EXT025/2008‐06, CAAE 0117.0.208.000‐08. Trata‐se de estudo transversal prospectivo, de coorte da avaliação da triagem neonatal para FC do Estado do Paraná. De janeiro de 2002 a dezembro de 2008 foram avaliadas 1.218.642 RN. A triagem inicial foi feita pela dosagem da TIR em amostras de sangue coletadas por punção cutânea do calcanhar e impregnadas em papel filtro, determinada por imunofluorimetria no sistema AutoDelfia (Perkin Elmer®, MA, EUA) e feita em três estágios. Crianças com valores alterados ≥ 70μg/L em duas amostras distintas nos primeiros 30 dias de vida foram convocadas por uma equipe de assistentes sociais, por meio de busca ativa, a fazer gratuitamente o teste do suor (condutividade seguido de teste quantitativo coulométrico de dosagem de Cloreto), a fim de descartar a suspeita de FC. Um questionário informativo sobre os testes foi aplicado entre os responsáveis pela criança, que pela reconvocação se apresentaram voluntariamente e consentiram em fazê‐los. Fizeram o teste em ambos os métodos 2.309 RN e foi necessária a repetição em 99 RN (4,3%) pela quantidade insuficiente de suor. Das 2.309 crianças, 90 casos de FC foram confirmados. Para o estudo, usou‐se um grupo constituído de 444 RN selecionado por conveniência proveniente das 2.219 crianças com teste do suor normal e os 90 casos com teste do suor positivo confirmados com FC.
Coleta do suorA indução da sudorese foi feita pela técnica de iontoforese por pilocarpina. Discos gelatinosos impregnados com 0,5% de pilocarpina Pilogel® (Pilocarpine hydrochloride, Alcon Laboratories, Reino Unido) foram afixados por meio de eletrodos padrões Wescor® (Wescor Inc. Logan, Utah, EUA), positivo e negativo, e se encaixaram perfeitamente no braço da criança após rigorosa antissepsia e limpeza com água deionizada. O aparelho promove a estimulação por meio de uma corrente iontoforética de 1,5mA durante cinco minutos. A pilocarpina é ionizada e conduzida para uma área de glândulas sudoríparas da pele preferencialmente na porção anterior do antebraço.8,9 Na impossibilidade desse sítio de coleta usou‐se a porção anterior da coxa.
Após a estimulação a área foi limpa com água deionizada e o suor coletado diretamente no Macroduct® (Wescor Inc. Logan, Utah, EUA) descartável afixado firmemente ao local, conforme recomendação do fabricante. O tempo de coleta não excedeu 30 minutos e nem foi inferior a 20 minutos.9 A taxa média durante a coleta não foi inferior a 1g/m2/min ou 10μL de suor pelo sistema de coleta Macroduct® (Wescor Inc. Logan, Utah, EUA), volume mínimo de suor necessário nesse dispositivo.9,13
Método da condutividadeImediatamente após a coleta o suor foi submetido à medida da condutividade pelo equipamento Sweat Check (Wescor®). Os valores de normalidade, limítrofe e anormal, foram estabelecidos conforme equação relacionando condutividade por cloreto.11,13 Após mensurada a condutividade a mesma amostra de suor, capturada em um tubo tipo Eppendorf®, foi imediatamente encaminhada para a dosagem quantitativa de cloreto.
Para evitar que o resultado da condutividade influenciasse a análise quantitativa de cloreto, as duas técnicas foram empregadas por equipes diferentes e uma desconhecia o resultado da outra.
Dosagem quantitativa do cloreto por coulometriaPara essa dosagem o equipamento usado foi o cloridrômetro digital Labconco® (Labconco®, KS, EUA), que é um titulador colorimétrico de íons cloreto. São necessários 10 uL do suor para que a reação ocorra em poucos segundos do contato com a solução reagente e o par de eletrodos fornecendo a leitura digital em mmol/L.14‐16
A monitoração do método para a triagem inicial foi feita pelos controles internos dos kits, controle Tiriqas (França) e CDC de Atlanta (EUA). Para o controle de qualidade dos testes do suor, foram usados, em todos os ensaios, padrões comerciais de solução de NaCl nas concentrações de 40mmol/L, 70mmol/L e 130mmol/L, além de padrões internos preparados de NaCl de 10mmol/L, 50mmol/L e 100mmol/L. Este estudo foi feito em instituição credenciada pelo Ministério da Saúde para triagem neonatal da FC. O serviço usualmente entrega na alta hospitalar o “informativo aos pais” que contém esclarecimentos sobre a triagem neonatal. O teste do suor, quando necessário, foi feito mediante convocação prévia e busca ativa por equipe especializada e os pais foram informados por meio de um questionário aplicado no local do teste. Por se tratar de rotina do serviço credenciado não foi aplicado o Termo de Consentimento Livre e Esclarecido.
Análise estatísticaA estimativa da diferença entre médias foi feita pelo teste t de Student e pela análise da variância (Anova) e da diferença entre frequências pelo teste qui‐quadrado de Pearson. Foi calculado o coeficiente de correlação de Pearson entre os métodos quantitativo coulométrico (padrão ouro) e a condutividade e o coeficiente de kappa para estimar a concordância entre os métodos. A curva ROC (Receiver Operating Characteristic) foi construída para estimar o ponto de corte e índices de sensibilidade e especificidade do teste de condutividade, considerando o método coulométrico como padrão‐ouro. Para todos os testes considerou‐se o nível de significância mínimo de 5% com o programa Statistica ‐ Statsoft® (StatSoft, Inc., DELL®, OK, EUA).
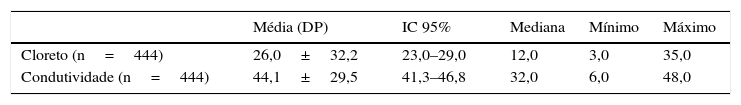
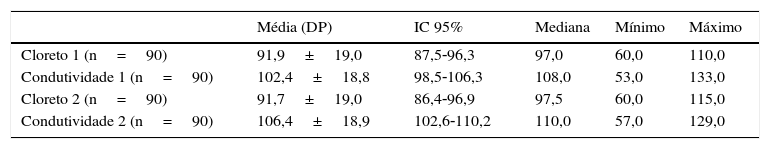
ResultadosO estudo originou‐se de 1.218.642 RN provenientes do programa de triagem neonatal do Paraná, dos quais 13.235 (1,08%) tiveram o primeiro exame (TIR1) superior a 70μg/L e foram convocados para novo exame (TIR‐2). Desses, 10.926 (82,5%) normalizaram e 2.309 (17,4%) mantiveram o valor alterado e foram submetidos ao teste do suor, por ambos os métodos, que resultou em 2.219 (96,1%) normais e 90 (3,9%) com FC. Dos 2.309 RN que fizeram o teste do suor, por conveniência foram separados dois grupos, um de 444 indivíduos sem FC e outro com 90 indivíduos com FC. Do grupo sem FC, 185 (41,6%) eram masculinos, 234 (52,7%) femininos e em 25 casos (5,6%) essa informação não estava disponível. Quanto à etnia, 420 (94,6%) eram brancos e em 24 casos (5,4%) era desconhecida. A média de peso ao nascimento foi de 3.228,8g±2.352,8g (IC 95%=3.002,4 a 3.455,4g). No grupo com FC a distribuição entre os sexos e a etnia foi de 46 (51,1%) masculinos, 44 (48,8%) femininos, 85 (94,5%) brancos e cinco (5,5%) não brancos. A média de peso ao nascimento foi de 3.091,2g±477,9g (IC 95%= 2.000,0 a 3.997,0g). O volume de suor coletado de todas as crianças foi maior do que 15μL e possibilitou a aplicação dos dois métodos. No grupo sem FC os resultados medianos dos testes do suor por coulometria e condutividade foram de 12mmol/L e 32mmol/L respectivamente (tabela 1). No grupo com FC os valores medianos obtidos foram de 97mmol/L e 108mmol/L respectivamente, o que evidencia boa correspondência entre os testes considerando‐se que a condutividade mensura todos os íons presentes no suor (tabela 2).
Dosagem quantitativa de cloreto e da condutividade em pacientes sem FC
| Média (DP) | IC 95% | Mediana | Mínimo | Máximo | |
|---|---|---|---|---|---|
| Cloreto (n=444) | 26,0±32,2 | 23,0–29,0 | 12,0 | 3,0 | 35,0 |
| Condutividade (n=444) | 44,1±29,5 | 41,3–46,8 | 32,0 | 6,0 | 48,0 |
FC, fibrose cística; DP, desvio padrão; IC 95%, intervalo de confiança de 95%.
Os valores de cloreto e condutividade estão expressos em mmom/L.
Dosagem quantitativa de cloreto e da condutividade em pacientes com FC
| Média (DP) | IC 95% | Mediana | Mínimo | Máximo | |
|---|---|---|---|---|---|
| Cloreto 1 (n=90) | 91,9±19,0 | 87,5‐96,3 | 97,0 | 60,0 | 110,0 |
| Condutividade 1 (n=90) | 102,4±18,8 | 98,5‐106,3 | 108,0 | 53,0 | 133,0 |
| Cloreto 2 (n=90) | 91,7±19,0 | 86,4‐96,9 | 97,5 | 60,0 | 115,0 |
| Condutividade 2 (n=90) | 106,4±18,9 | 102,6‐110,2 | 110,0 | 57,0 | 129,0 |
DP, desvio padrão; IC 95%, intervalo de confiança de 95%; FC, fibrose cística.
Cloreto e condutividade 1 e 2 correspondem ao primeiro e segundo exame.
Os valores de cloreto e condutividade estão expressos em mmol/L.
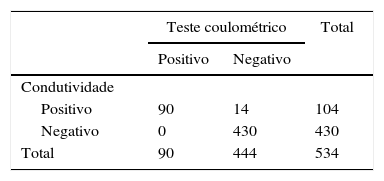
Do grupo sem FC, 14 (3,15%) tiveram condutividade elevada (> 50 mmo/L), mas dosagens normais de cloreto (< 60,0mmol Cl‐/L), e foram considerados falso positivos. Os resultados evidenciaram excelente correlação entre os métodos e as propriedades obtidas da comparação entre eles, considerando‐se como padrão ouro a dosagem quantitativa de cloreto (tabela 3).
Concordância entre a condutividade e o teste quantitativo coulométrico de dosagem de cloreto
| Teste coulométrico | Total | ||
|---|---|---|---|
| Positivo | Negativo | ||
| Condutividade | |||
| Positivo | 90 | 14 | 104 |
| Negativo | 0 | 430 | 430 |
| Total | 90 | 444 | 534 |
Coeficiente de kappa=0,89; Teste exato de Fisher, p<0,001; sensibilidade=100 (95,9‐100); especificidade=96,8 (94,8‐98,1); VPP (valor preditivo positivo)=86,5; VPN (valor preditivo negativo)=100; acurácia=97,4; falso positivo=13,5; falso negativo=0; positive likelihoods ratio=31,7 (18,9‐53,1); negative likelihoods ratio=0.
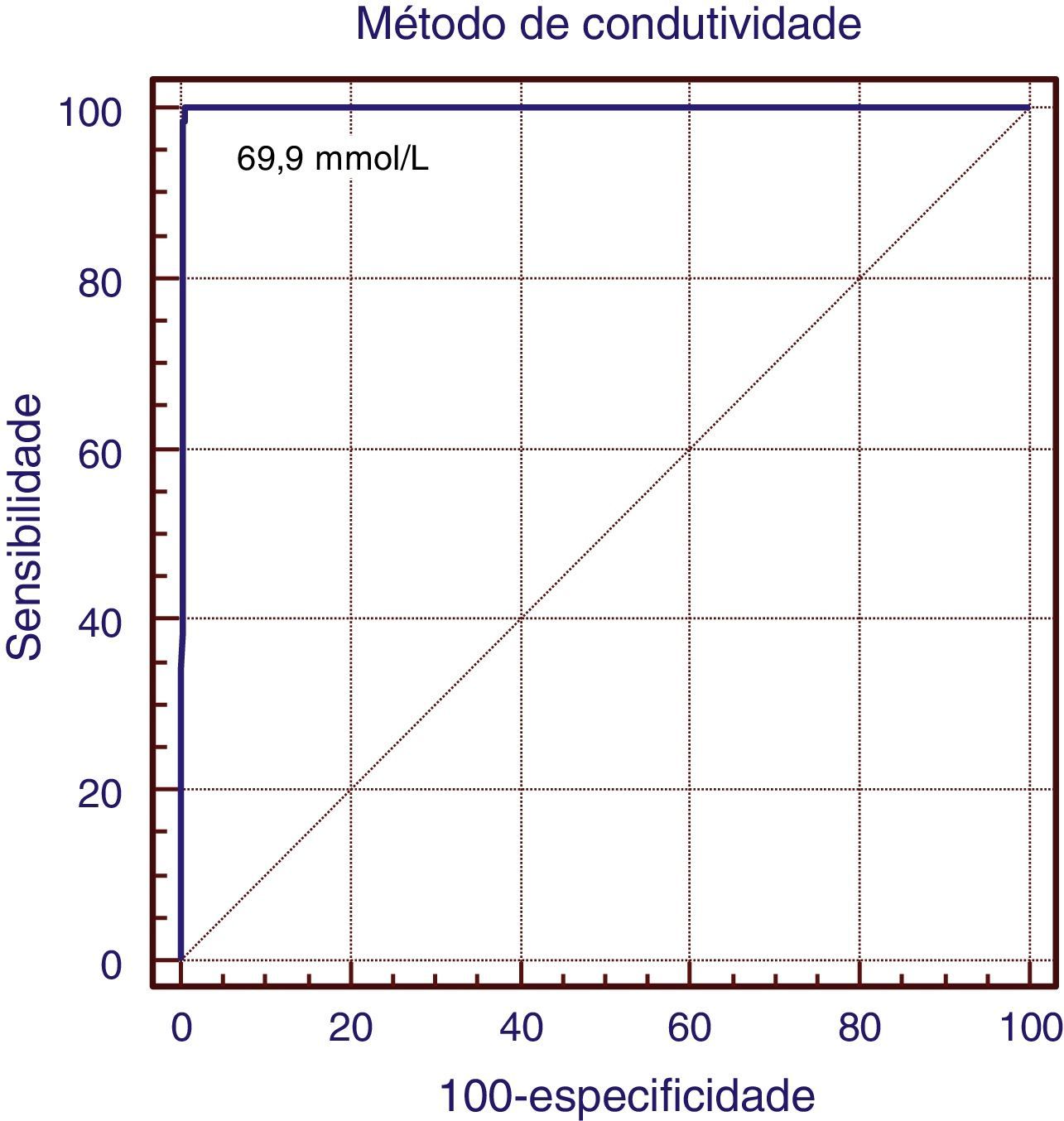
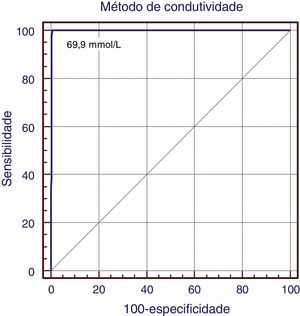
Todos os pacientes FC apresentaram valores de condutividade maiores do que 80mmol/L, o que conferiu ao teste sensibilidade de 100% (IC 95%: 94,8 a 100), especificidade de 96,2% (IC 95%: 93,8 a 97,8), valor preditivo positivo de 83,3% (IC 95%: 74,4‐91,1), valor preditivo negativo de 100% (IC 95%: 90,5 a 109,4), acurácia de 96,8%, índice de falsos positivos de 16,7%, falsos negativos nulo, positive likelihoods ratio=31,7 (18,9‐53,1) e negative likelihoods ratio=0. O coeficiente de correlação entre os dois métodos foi de 0,97. Coeficiente de kappa=0,89 (p<0,001). Na Curva ROC (fig. 1), observou‐se 100% de superposição sob a curva pelo método da condutividade e o valor de corte sugerido foi de 69,0mmol/L.
DiscussãoNa avaliação feita neste estudo, o método de condutividade pôde ser visto como uma ferramenta de diagnóstico, pois todos os testes estatísticos usados na comparação com o método quantitativo de dosagem de cloreto coulométrico, padrão ouro, indicaram forte precisão. O valor de corte sugerido na análise pela curva ROC foi de 69mmol/L e os valores de condutividade 60mmol/L a 69mmol/L como limites de intervalo de equívocos (p=0,001). Os resultados obtidos neste estudo sugerem que o método analítico da condutividade pode ser um procedimento de diagnóstico definitivo e confiável para FC. O coeficiente de correlação (r=0,97) encontrado no presente estudo demonstra boa convergência entre esses métodos.
Apesar de alguns estudos mostrarem que a condutividade correlaciona‐se bem com a concentração de cloreto,7,13,14,17‐19 esse fato não é aceito pela Clinical and Laboratory Standards Institute (CLSI) como método para o diagnóstico definitivo, relega‐o ao status de “método de triagem”13,14 e recomenda que nos indivíduos com condutividade do suor de 50mmol/L seja feita avaliação quantitativa do cloreto.
Atualmente, a análise quantitativa de cloreto ou sódio é o método mais usado e conclusivo para o diagnóstico da FC, pois mais de 99% dos indivíduos homozigotos para o gene da FC apresentam cloreto e sódio no suor, acima de 60 e 70mmol/L, respectivamente.15,20 Alguns estudos sugerem que o ponto de corte em RN deve ser de 30mmol/L, para evitar a possibilidade de falso negativo.10,15 Os eletrólitos no suor podem estar transitoriamente elevados durante as primeiras 24 horas de vida. Por esse motivo é sugerido que o teste seja feito após as 48 horas.15
O presente trabalho demonstrou que a condutividade é capaz de discriminar pacientes FC de indivíduos normais, com 16,7% de falsos positivos (tabela 3). Como a condutividade resulta do somatório dos eletrólitos no suor, espera‐se que os resultados sejam mais elevados. A mediana da condutividade nos casos sem FC foi respectivamente de 32mmol/L e 12mmol/L e nos casos com FC de 108mmol/L e 97mmol/L no primeiro exame e de 110mmol/L e 97,5mmol/L no segundo exame feitos em dias diferentes (tabelas 1 e 2). Os resultados obtidos na condutividade sempre foram mais elevados e não houve casos de falso negativo. Os resultados sugerem que esse método analítico, pelos critérios de sensibilidade 100% (IC 95%: 94,8 a 100), especificidade de 99,5% (IC 95%: 93,8 a 97,8) e valor de condutividade de 69,0mmol/L, deve ser considerado confirmatório da doença. Não foram reportados casos falso negativos de FC na população triada que podem ocorrer, pois existem algumas mutações do gene CFTR, no qual os eletrólitos no suor estão dentro da normalidade.7
Estudos têm demonstrado excelente correlação entre a condutividade e a titulação coulométrica de cloreto. Amon et al. avaliaram a condutividade e a concentração de cloreto no suor em 471 indivíduos sem FC e encontraram valores médios de 33,4mmol/L (13 a 87mmol/L) e 16,4mmol/L (5 a 60mmol/L) para os dois métodos respectivamente. Nos 43 pacientes com FC o valor médio da condutividade foi de 113,1mmol/L (90 a 136mmol/L) e do cloreto de 98,8mmol/L (77 a 117mmol/L). Observou‐se boa correlação entre os métodos (r=0,97).13
Lezana et al. compararam os dois métodos em 3.834 indivíduos com suspeita clínica, com 1,8 a 54 anos, e a mediana da condutividade encontrada em pacientes sem FC e com FC foi de 36mmol/L e de 11mmol/L, respectivamente. Encontraram que o coeficiente de correlação entre os métodos foi de 0,60 (p<0,001). A curva ROC demonstrou alta concordância entre eles, excluiu FC para condutividade < 75mmol/L e confirmou FC para ≥ 90mmol/L, com sensibilidade 99,7%, especificidade 100%, VPP de VPN de 100% e 99,97% respectivamente. O coeficiente de kappa encontrado foi de 0,99.14 Os resultados obtidos no presente estudo, em população essencialmente de RN, corroboram os resultados desses autores.
Mastella et al. avaliaram 287 indivíduos e encontraram valor médio de cloreto e de condutividade de 16,3mmol/L (4 a 60mmol/L) e 39,8mmol/L (19 a 87mmol/L) em pacientes sem FC e em pacientes com FC de 95,7mmol/L (32 a 121mmol/L) e 112mmol/L (45 a 173mmol/L).21
Mattar et al. compararam o método clássico de Gibson e Cooke e a condutividade em 738 crianças e encontraram em 714 valores medianos de cloro e condutividade no suor de 11mmol/L e 25mmol/L respectivamente. Nos 24 pacientes com FC os valores médios encontrados foram de 87mmol/L e 103mmol/L, respectivamente. Esses autores encontraram para valores de condutividade acima de 90mmol/L, sensibilidade de 83,3%, especificidade de 99,7%, VPP 90,9% e VPN 99,4% respectivamente. O valor da condutividade para excluir FC foi < 75mmol/L. Observaram boa concordância entre os métodos (coeficiente de kappa=0,93).18
Riedi et al. encontraram forte correlação entre a dosagem de sódio e a condutividade no suor. Dos 175 pacientes sem FC os valores médios de sódio e da condutividade encontrados foram de 36,3mmol/L (12 a 75mmol/L) e 40,9mmol/L (16 a 75mmol/L) e nos 31 pacientes com FC de 113,2mmol/L (80 a 146mmol/L) e 118,5mmol/L (84 a 155mmol/L). Embora não seja preconizada a dosagem do sódio no diagnóstico de FC, esses autores encontraram uma boa correlação entre os métodos (r=0,99) (p<0,0001).19
Khoa‐Nguyen et al. demonstraram a linearidade entre os métodos de titulação colorimétrica, coulométrica e a condutividade na faixa de 10 a 120mmol/L. Estabeleceram uma taxa de correspondência da medida coulométrica e condutividade na razão de 30, 40 e 60mmol/L para 57, 66 e 84mmol/L respectivamente. Esses autores apoiam que um teste do suor por condutividade<50mmol/L descarta o diagnóstico de FC na ausência de sinais clínicos.17 No presente estudo, todos os 90 casos FC apresentaram resultado de condutividade superiores a 50mmol/l e corroboraram o achado desses autores.
A aparente vantagem do sistema Macroduct Wescor® é a capacidade de fazer leituras diretas dos resultados com pequenas quantidades de suor.11 Para a confirmação diagnóstica são necessários dois testes positivos feitos em datas diferentes.15 A sudorese inadequada pode falsear os resultados e por isso recomenda‐se um volume mínimo aceitável de 15μL de suor coletados em 30 minutos.11,13,15 LeGrys et al. definem como volume de suor suficiente e ideal o obtido com pelo menos 75mg de peso pelo método de Gibson‐Cooke22 ou pelo menos 10‐15μL pela bobina Macroduct® do Sistema Wescor,23 recomendações essas seguidas neste estudo.
Alguns autores avaliaram a taxa de repetições do teste do suor por volume inadequado e recomendaram uma porcentagem limite de 5% de reteste em pacientes com idade superior a três meses.23,24 No presente estudo foi necessária a repetição do teste em 99 crianças (4,3%), motivada por volume insuficiente, portanto dentro do recomendado.
A preferência pelo método da condutividade se justifica por ser de fácil execução em relação às dosagens tradicionais quantitativas de cloreto, principalmente aquelas que usam papel filtro ou gaze para a coleta do suor, nas quais a quantidade de amostra pode ser fator limitante. Os resultados obtidos neste estudo corroboram os já publicados por outros autores e reforçam a adoção desse teste como método diagnóstico, por exercer menor influência do operador na qualidade dos resultados.
Este estudo sugere que a condutividade é válida para a análise quantitativa de cloreto no suor para diagnosticar ou excluir FC e pode ser considerada como método diagnóstico.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Domingos MT, Magdalena NI, Cat MN, Watanabe AM, Rosário Filho NA. Sweat conductivity and coulometric quantitative test in neonatal cystic fibrosis screening. J Pediatr (Rio J). 2015;91:590–5.