Melatonin has a protective role in adults with cardiovascular disease, but the effects of melatonin in children with cardiac dysfunction are not well understood. This study was designed to explore the variations in melatonin, myeloperoxidase, and caspase‐3 levels in children suffering from heart failure.
MethodsSeventy‐two pediatric patients with heart failure and twelve healthy children were enrolled in this study. A modified Ross scoring system was used to evaluate clinical cardiac function. Patients with a score of >2 points were included in the study and were divided into three groups according to severity of heart failure: mild (score: 3–6), moderate (score: 7–9), and severe (score: 10–12). Echocardiographic parameters, laboratory data, and serum levels of melatonin, myeloperoxidase, and caspase‐3 were measured and analyzed in all patients.
ResultsCompared with patients with mild and moderate heart failure, patients in the severe heart failure group had significantly decreased left ventricular ejection fraction (p<0.001), and significantly increased serum melatonin levels (p=0.013) and myeloperoxidase levels (p<0.001). Serum melatonin levels were positively correlated with serum caspase‐3 levels (p<0.001). The optimal cutoff values of serum melatonin levels for the diagnosis of severe heart failure and primary cardiomyopathy in pediatric patients with heart failure were 54.14pg/mL and 32.88pg/mL, respectively.
ConclusionsSerum melatonin and myeloperoxidase levels were increased in children with severe heart failure. It is likely that increasing melatonin levels may act as a compensatory mechanism in pediatric children with heart failure.
A melatonina possui um papel protetor em adultos com doença cardiovascular, porém os efeitos da melatonina em crianças com disfunção cardíaca não são bem entendidos. O estudo foi projetado para explorar a variação nos níveis de melatonina, mieloperoxidase e caspase 3 em crianças que sofrem de insuficiência cardíaca.
Métodos72 pacientes pediátricos com insuficiência cardíaca e 12 crianças saudáveis foram inscritos no estudo. Um sistema de classificação de Ross modificada foi utilizado para avaliar a função cardíaca clínica. Os pacientes com escore de > 2 pontos foram incluídas no estudo e foram divididos em três grupos de acordo com a gravidade da insuficiência cardíaca: leve (escore: 3‐6), moderada (escore: 7‐9) e grave (escore: 10‐12). Os parâmetros ecocardiográficos, dados laboratoriais e níveis séricos de melatonina, mieloperoxidase e caspase 3 foram medidos e analisados em todos os pacientes.
ResultadosEm comparação com os pacientes com insuficiência cardíaca de gravidade leve e moderada, os pacientes no grupo de insuficiência cardíaca grave apresentaram redução significativa da fração de ejeção do ventrículo esquerdo (p<0,001) e aumento significativo nos níveis séricos de melatonina (p=0,013) e níveis de mieloperoxidase (p<0,001). Os níveis séricos de melatonina foram positivamente correlacionados com os níveis séricos de caspase 3 (p<0,001). Os valores de corte ideais dos níveis séricos de melatonina para diagnóstico de IC e cardiomiopatia primária em pacientes pediátricos com insuficiência cardíaca foram 54,14 pg/mL e 32,88 pg/mL, respectivamente.
ConclusõesOs níveis séricos de melatonina e mieloperoxidase mostraram aumento em crianças com insuficiência cardíaca grave. Especulamos se o aumento nos níveis de melatonina pode agir como um mecanismo compensatório em crianças pediátricas com insuficiência cardíaca.
A prevalência de insuficiência cardíaca (IC) tem aumentado e representa uma carga crescente em termos de custos de tratamento e mortalidade, principalmente quando ocorre em crianças pequenas. Consequentemente, é necessário um melhor entendimento da melhor forma para avaliar e tratar a IC. Apesar de terem sido feitos avanços no diagnóstico e tratamento da IC em adultos, falta conscientização semelhante para pacientes pediátricos com IC.1
A melatonina (N‐acetil‐5‐metoxitriptamina), um produto secretor da glândula pineal humana, é bem conhecida por sua influência sobre o sistema cardiovascular. A melatonina tem uma ação protetora no coração feita por meio de mecanismos mediados por receptores e independentes de receptores.2 O mecanismo mediado por receptores envolve receptores de membrana de melatonina clássicos (MT1 e MT2); contudo, a localização precisa desses receptores não foi completamente explicada.3 O mecanismo independente de receptores de melatonina ocorre por meio de sua função como um potente antioxidante e eliminador de radicais livres.4 Foi mostrado que a melatonina reduz a hipertensão,5 protege o coração isquêmico/reperfundido6 e resiste ao processo de aterosclerose.7 A hipertrofia dos cardiomiócitos inicialmente ocorre como uma resposta compensatória, porém eventualmente se torna patológica e pode levar a IC. A melatonina afeta a sobrecarga hemodinâmica, a disponibilidade de óxido nítrico (NO), os radicais livres e os perfis lipídicos que também podem modificar a hipertrofia dos cardiomiócitos.8
A associação entre a melatonina e a IC pediátrica não foi totalmente entendida. Fizemos um estudo para investigar os níveis circulantes de melatonina em crianças com IC.
MétodosEste estudo pediátrico foi aprovado pelo Comitê de Ética. Todas as amostras de sangue dos pacientes foram coletadas após o consentimento informado por escrito ter sido assinado pelos pais ou responsáveis.
Coleta de amostras de sangue e dados clínicosAs amostras de sangue de 72 crianças diagnosticadas com IC e 12 crianças saudáveis submetidas a exames de rotina foram coletadas entre dezembro de 2014 e dezembro de 2015 no Centro de Exame Clínico. A idade média das crianças com insuficiência cardíaca foi de um ano (intervalo 0‐11,75 anos), com 44 pacientes com menos de um ano (61,1%), 16 pacientes entre um e 13 anos (22,2%) e pacientes entre quatro e sete anos (4,2%) e nove pacientes com> 8 anos (12,5%). As cardiopatias incluíram: defeitos do septo ventricular (n=11), defeitos do septo atrial (n=3), tetralogia de Fallot (n=1), persistência do canal arterial (n=3), cardiopatia congênita complexa (n=20), estenose da aorta (n=1) e ventrículo único (n=3). Outras doenças incluíram: cardiomiopatia primária (n=20), miocardite (n=4), arritmias (n=4), pneumonia (n=1) e leucemia (n=1). Todas as amostras de sangue foram coletadas entre 8h e 10h, perto do horário em que as crianças também foram submetidas a exame clínico. Com base nos critérios de Ross modificados para função cardíaca,9 a IC foi dividida em leve (escore: 3‐6), moderada (escore: 7‐9), grave (escore: 10‐12). Para analisar a associação entre os dados clínicos relevantes e a incidência de IC em crianças, os dados de 72 crianças com IC foram coletados retroativamente. Os dados incluíram idade, sexo, duração da internação, exame ecocardiográfico, valores laboratoriais, diagnóstico e frequência cardíaca detectada no momento da internação. As concentrações de mioglobina (MB), troponina I (TnI), isoenzima MB da creatina quinase (CK‐MB) e peptídeo natriurético cerebral (BNP) foram medidas por imunoensaio quimioluminescente (Siemens®, Munique, Alemanha) por um examinador no laboratório clínico do hospital. As características clínicas de todas as 84 crianças que foram avaliadas e as patologias dos 72 pacientes pediátricos com IC estão resumidas na tabela 1.
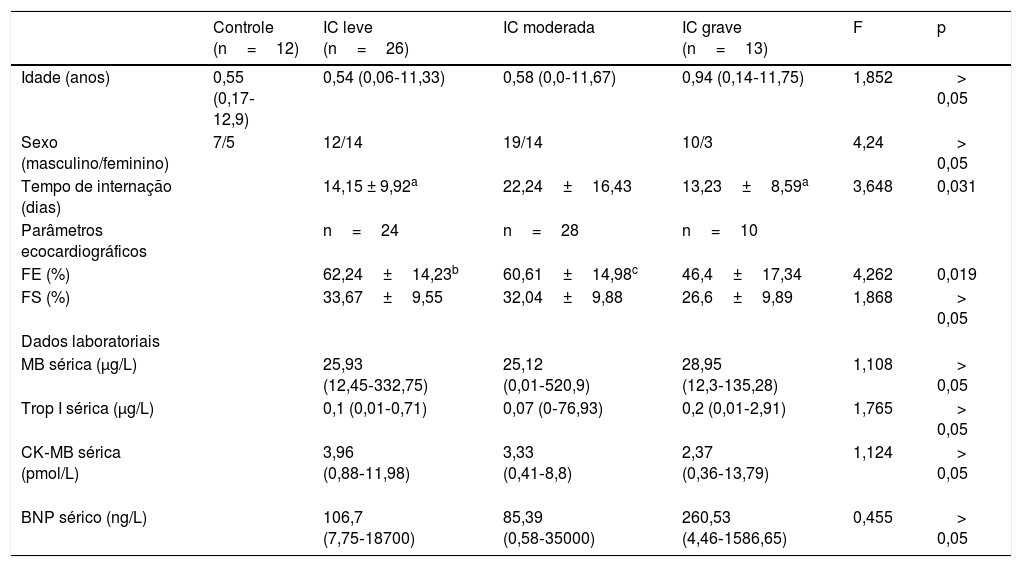
Valores clínicos, ecocardiográficos e laboratoriais e níveis séricos de melatonina de pacientes pediátricos com insuficiência cardíaca e controles saudáveis
| Controle (n=12) | IC leve (n=26) | IC moderada | IC grave (n=13) | F | p | |
|---|---|---|---|---|---|---|
| Idade (anos) | 0,55 (0,17‐12,9) | 0,54 (0,06‐11,33) | 0,58 (0,0‐11,67) | 0,94 (0,14‐11,75) | 1,852 | > 0,05 |
| Sexo (masculino/feminino) | 7/5 | 12/14 | 19/14 | 10/3 | 4,24 | > 0,05 |
| Tempo de internação (dias) | 14,15 ± 9,92a | 22,24±16,43 | 13,23±8,59a | 3,648 | 0,031 | |
| Parâmetros ecocardiográficos | n=24 | n=28 | n=10 | |||
| FE (%) | 62,24±14,23b | 60,61±14,98c | 46,4±17,34 | 4,262 | 0,019 | |
| FS (%) | 33,67±9,55 | 32,04±9,88 | 26,6±9,89 | 1,868 | > 0,05 | |
| Dados laboratoriais | ||||||
| MB sérica (μg/L) | 25,93 (12,45‐332,75) | 25,12 (0,01‐520,9) | 28,95 (12,3‐135,28) | 1,108 | > 0,05 | |
| Trop I sérica (μg/L) | 0,1 (0,01‐0,71) | 0,07 (0‐76,93) | 0,2 (0,01‐2,91) | 1,765 | > 0,05 | |
| CK‐MB sérica (pmol/L) | 3,96 (0,88‐11,98) | 3,33 (0,41‐8,8) | 2,37 (0,36‐13,79) | 1,124 | > 0,05 | |
| BNP sérico (ng/L) | 106,7 (7,75‐18700) | 85,39 (0,58‐35000) | 260,53 (4,46‐1586,65) | 0,455 | > 0,05 |
BNP, peptídeo natriurético cerebral; CK‐MB, isoenzima MB da creatina quinase; FE, fração de ejeção; FS, fração de encurtamento; MB, mioglobina; Trop I, troponina I altamente sensível.
Os valores são expressos como média±DP ou mediana (intervalo).
Todas as amostras de soro foram armazenadas em um freezer a ‐80°C antes dos testes. Os níveis de melatonina, MPO e caspase 3 foram medidos com o kit Elisa para melatonina humana (Arigo, Taiwan), kit Elisa para MPO humana (eBioscience® Thermofisher, CA, EUA) e kit Elisa para caspase 3 humana (Westang Bio‐tech®, Shanghai, China), respectivamente. Todos os ensaios foram feitos de acordo com as orientações dos fabricantes.
Análise estatísticaTodas as análises estatísticas foram feitas com o software SPSS (IBM SPSS Estatística para Windows, Versão 19.0. NY, EUA). Todos os dados são mostrados como média ± DP, com exceção dos dados que não foram distribuídos normalmente, que são mostrados como mediana (intervalo). Para as variáveis normalmente distribuídas, as comparações entre grupos foram avaliadas com uma análise de variância unidirecional (Anova). O método de menor diferença significativa (LSD) foi usado para estimar as comparações por pares. Para variáveis não normalmente distribuídas, as comparações entre grupos foram avaliadas com um teste H de Kruskal‐Wallis e o teste qui‐quadrado foi usado para comparações. A análise de regressão linear foi feita para determinar a associação entre os níveis séricos de melatonina com fração de ejeção (FE) e com níveis de caspase 3 e MPO em pacientes pediátricos com IC. Uma análise da correlação de Pearson foi usada para determinar se houve uma associação linear entre a concentração sérica de melatonina e esses dados mencionados. Para determinar o valor de corte adequado de melatonina no soro para diagnóstico IC grave e cardiomiopatia primária em pacientes pediátricos com IC, foram analisadas a área sob a curva ROC (AUC), a sensibilidade, a especificidade, o valor preditivo positivo (VPP), o valor preditivo negativo (VPN) e o índice de Youden (J). Um valor de p <0,05 foi considerado estatisticamente significativo para todos os testes.
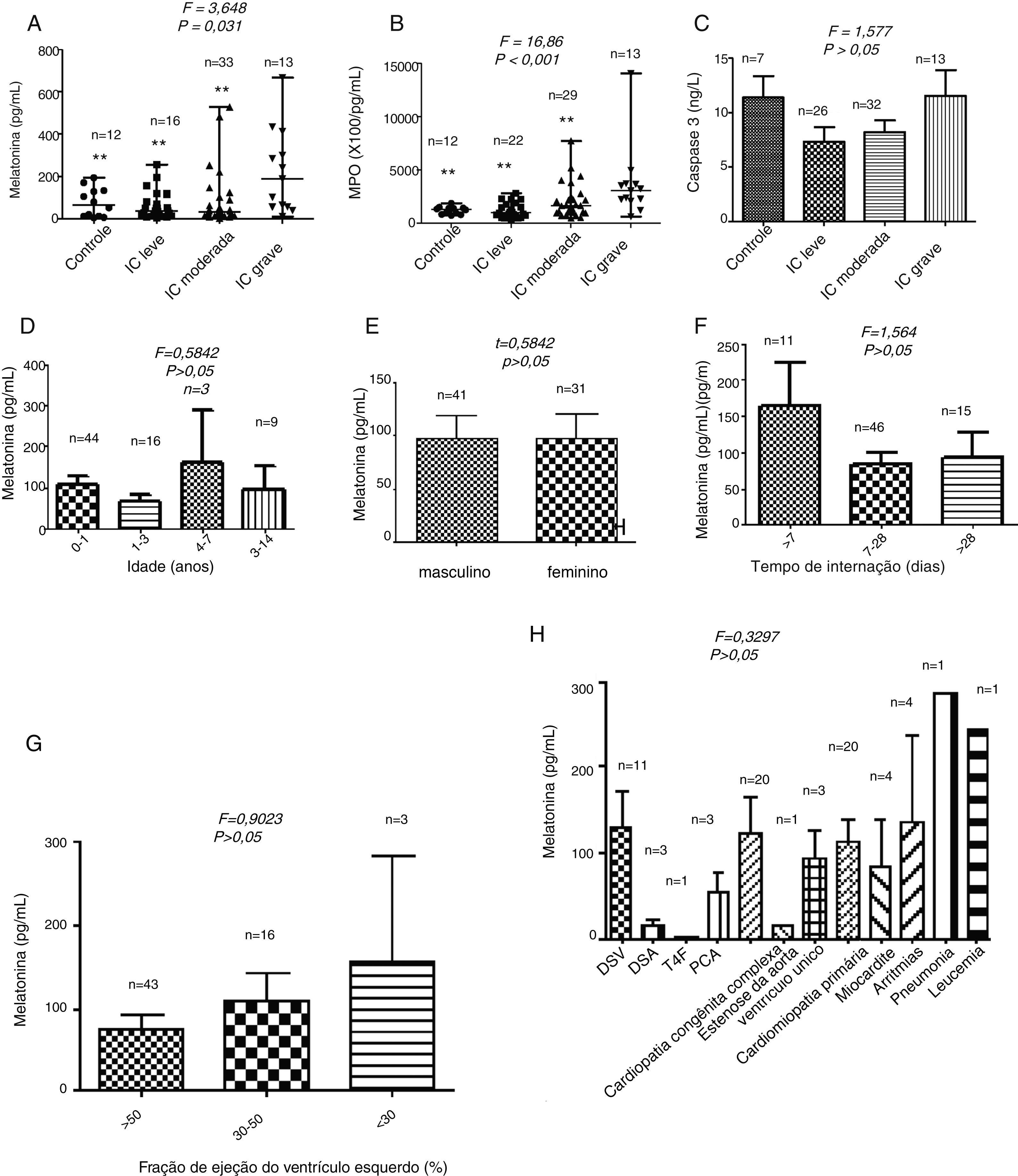
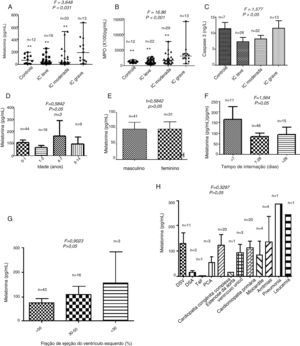
ResultadosNíveis séricos de melatonina, MPO e caspase 3A FE no grupo com IC grave foi a menor entre os quatro grupos (p=0,019). A duração da internação (p=0,031) também foi diferente entre os quatro grupos (tabela 1). Conforme mostrado na figura 1A, o nível médio de melatonina no soro foi de 188,3 pg/mL, com intervalo de 10,06‐666,7 pg/mL no grupo de IC grava, que foi a maior mediana entre os quatro grupos (p=0,031). A figura 1B representa os níveis séricos de MPO; no grupo com IC grave, o valor médio de MPO foi de 304,200 pg/mL, com intervalo de 61,880‐1,402,700 pg/mL, que foi o mais alto entre os quatro grupos (p <0,001). Não foram encontradas diferenças significativas nos níveis de caspase 3 entre os quatro grupos (p> 0,05) (figura 1C). Não houve relação entre os níveis circulantes de melatonina e a idade, o sexo, o tempo de internação, a FE ou a etiologia da IC (todos p> 0,05) (figura 1D‐H).
Níveis séricos de melatonina (A), MPO (B) e caspase 3 (C) em pacientes por grau de disfunção cardíaca. Níveis séricos de melatonina em pacientes pediátricos estratificados por idade (D), sexo (E), tempo de internação (F), fração de ejeção (G) e etiologia da insuficiência cardíaca (H). ** p < 0,01 em comparação com o grupo de insuficiência cardíaca grave.
DSV, defeitos do septo ventricular; DSA, defeitos do septo atrial; T4F, tetralogia de Fallot; PCA, persistência do canal arterial.
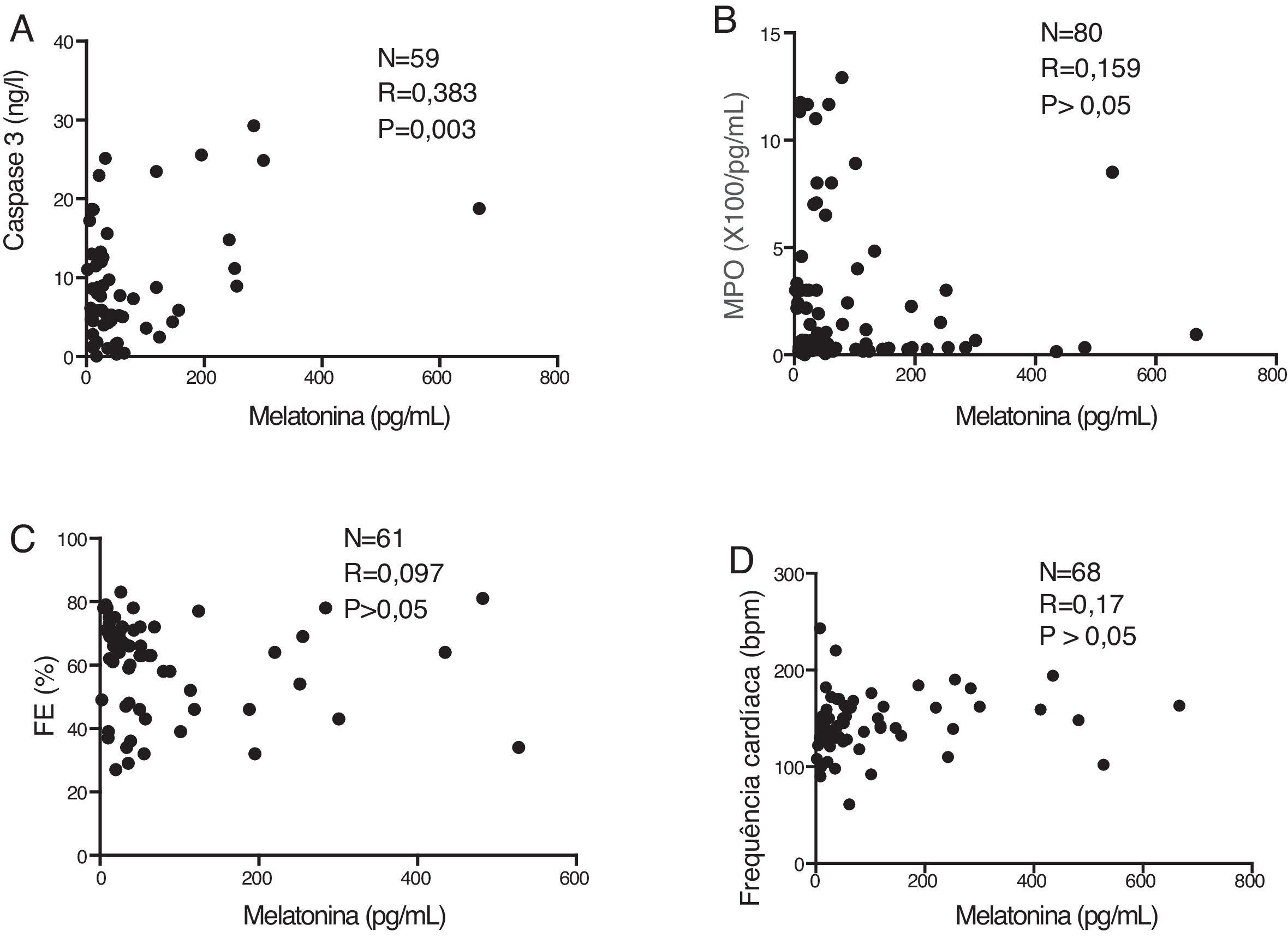
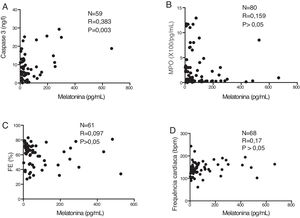
Houve uma correlação positiva significativa entre o nível sérico de melatonina e o nível sérico de caspase 3 (p=0,003) (figura 2A). Em contrapartida, os níveis séricos de melatonina não foram correlacionados a MPO (p> 0,05) (figura 2B), FE (p> 0,05) (figura 2C) ou à frequência cardíaca dos pacientes detectada no momento da internação (p> 0,05) (figura 2D).
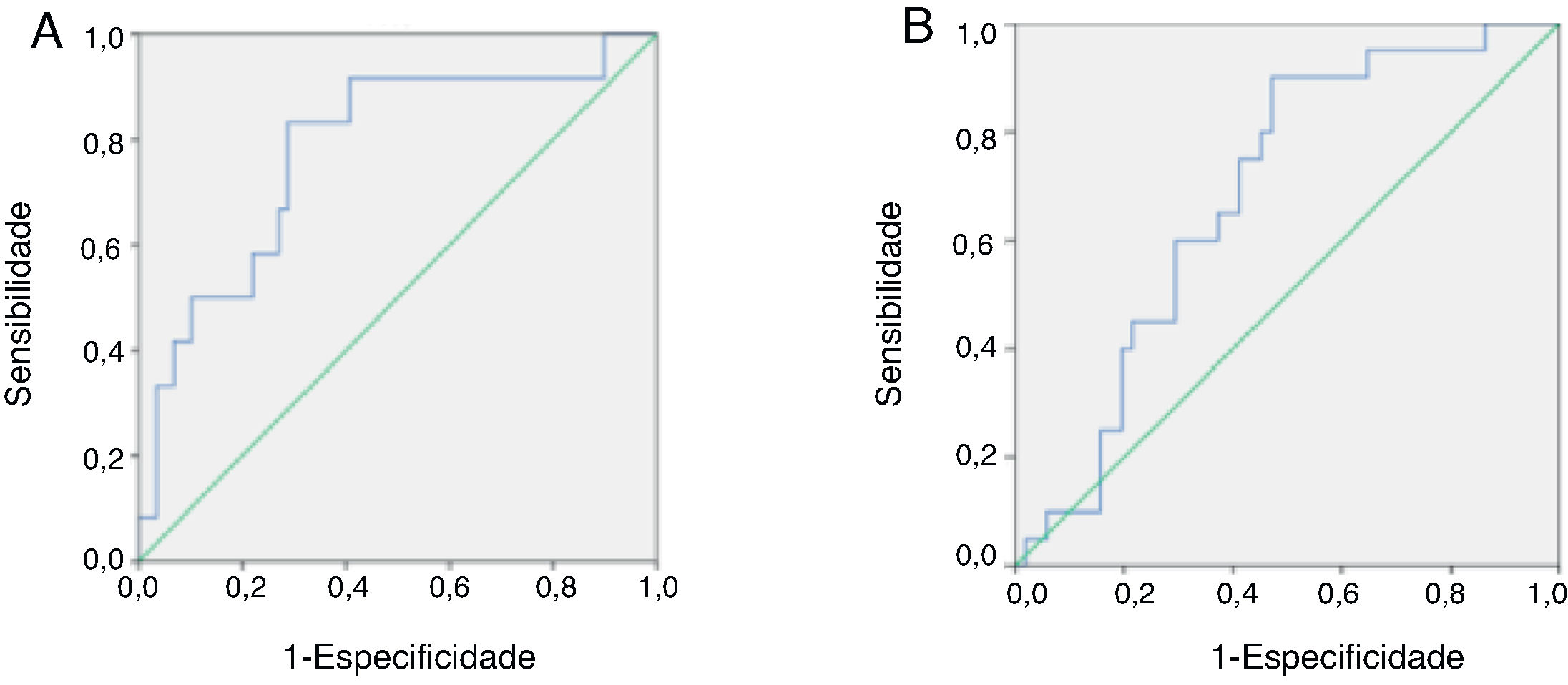
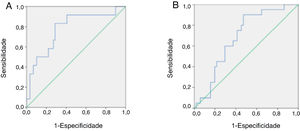
Curvas de ROC das concentrações séricas de melatonina em pacientes pediátricos com ICAs concentrações séricas de melatonina, que variam de 1,1851‐667,6936 pg/mL, foram usadas para gerar as curvas de ROC e definir o valor ideal de melatonina no soro para diagnosticar IC grave em pacientes pediátricos. A AUC, sensibilidade, especificidade, VPP, VPN e valor de J foram avaliados. Dentre todos os pacientes pediátricos com IC, um valor de corte de 54,1404 pg/mL resultou no índice J mais elevado (0,545) com sensibilidade de 0,833, especificidade de 0,712, VPP de 0,37 e VPN de 0,94, indicou que esse pode ser o valor de corte ideal para diagnosticar IC grave (figura 3A).
Comparação das curvas de ROC para o desempenho diagnóstico da melatonina na identificação de insuficiência cardíaca (IC) grave (A) e cardiomiopatia primária (B) em pacientes pediátricos com IC. (A) AUC=0,780 para melatonina p=0,002. O valor de corte máximo foi de 54,1404 pg/mL para melatonina (sensibilidade=0,833, especificidade=0,712, VPP=0,37, VPN=0,94 e J=0,545). (B) AUC=0,683 para melatonina (p=0,017). O valor de corte máximo foi 32,8805 pg/mL para melatonina (sensibilidade=0,900, especificidade=0,529, VPP=0,43, VPN=0,93 e J=0,429). VPP, valor preditivo positive; VPN, valor preditivo negativo; J, índice de Youden.
As curvas de ROC para concentrações de melatonina circulante foram usadas para definir o valor ideal de melatonina no soro para diagnosticar cardiomiopatia primária em pacientes pediátricos com IC. Dentre todas as crianças com IC, um valor de corte de 32,8805 pg/mL resultou no índice J mais elevado (0,429) com sensibilidade de 0,9, especificidade de 0,529, VPP de 0,43 e VPN de 0,93, indicou que esse pode ser o valor de corte ideal para diagnosticar cardiomiopatia primária nesses pacientes (figura 3B).
DiscussãoA IC é uma doença grave e é a fase terminal de muitas doenças cardiovasculares pediátricas, principalmente cardiomiopatia primária ou doença cardíaca congênita.10 Contudo, o mecanismo molecular não é totalmente entendido. As doenças cardiovasculares foram associadas a ritmicidade temporal e transtorno afetivo sazonal.11 Hipertensão, isquemia do miocárdio, arritmia, angina e morte súbita devido a IC normalmente têm maior incidência na manhã, principalmente entre 6h e 12h.12 As doenças cardiovasculares também parecem mostrar variação na gravidade com alterações sazonais.13 A melatonina é secretada pela glândula pineal com ritmicidade diurna. A exposição à luz, principalmente durante o dia, inibe a secreção de melatonina.14 Contudo, o papel da melatonina na fisiopatologia associada à ritmicidade da IC em pacientes pediátricos continua incerto.
Uma pesquisa demonstrou que menores níveis de melatonina são observados no subgrupo da classe III da New York Heart Association (NYHA) de pacientes adultos com IC.15 Um estudo separado revelou que os níveis séricos de melatonina em pacientes com IC que sofrem de cardiomiopatia hipertensiva foram menores do que em indivíduos sem IC.16 Nossos dados contradizem o que é visto em adultos e mostra que os níveis circulantes de melatonina foram significativamente maiores em crianças com IC grave. Nossos dados sugerem que pode haver um mecanismo separado em pacientes pediátricos com IC que afeta os níveis de melatonina. A melatonina desempenha um papel protetor nas doenças cardiovasculares, age como antioxidante e poderoso eliminador de radicais livres.17 Especulamos se o aumento da concentração de melatonina em pacientes pediátricos com IC grave pode ser um mecanismo compensatório; essa especulação garante investigação adicional.
Vários estudos sugeriram que o estresse oxidativo excessivo está associado a apoptose de células do miocárdio18 e ao processo patológico que leva a IC.19 Neste estudo, os níveis de MPO aumentaram em pacientes com IC grave, indicaram que o estresse excessivo de espécies reativas de oxigênio está envolvido no desenvolvimento patológico de IC pediátrica. Embora não tenham sido encontradas diferenças significativas nos níveis séricos de caspase 3 entre os grupos, constatamos que os níveis circulantes de melatonina estão positivamente associados a caspase 3 no soro, sugerem um possível papel da melatonina no processo apoptótico que leva à IC pediátrica. Estudos anteriores demonstraram que as concentrações séricas de melatonina variaram com a idade e as crianças mais novas mostraram níveis mais elevados de melatonina em condições saudáveis; contudo, não encontramos relação entre melatonina e idade, sexo, tempo de internação, FE, frequência cardíaca detectada no momento da internação ou etiologia da IC. Essa diferença dos estudos anteriores pode ser devida ao fato de que as amostras séricas nos estudos anteriores foram coletadas de crianças saudáveis, ao passo que examinamos crianças com IC pediátrica.
É comprovado que os níveis plasmáticos de peptídeo natriurético cerebral (BNP) ou peptídeo natriurético pró‐cerebral N‐terminal (NT‐proBNP) são úteis no diagnóstico, prognóstico e manejo de crianças com insuficiência cardíaca.20 Houve uma correlação negativa entre as concentrações plasmáticas de BNP ou NT‐proBNP e as idades em neonatos e crianças com disfunção cardíaca.21,22 Em nosso estudo, não foi encontrada essa correlação entre os níveis séricos de melatonina e as idades em crianças com IC. Contudo, esses valores de melatonina no diagnóstico de crianças com IC são muito melhores do que BNP ou NT‐proBNP. Em adultos, a melatonina tem sido sugerida não somente como um biomarcador de diagnóstico, mas também como uma possível opção terapêutica para doenças cardiovasculares.17 Assim, é necessário saber os níveis de melatonina em crianças cardíacas para demonstrar o real benefício da melatonina no manejo de crianças com IC.
Os níveis circulantes de melatonina e MPO foram elevados em pacientes pediátricos com insuficiência cardíaca grave. Além disso, os níveis séricos de melatonina foram correlacionados com os níveis séricos de caspase 3. São necessários estudos adicionais para investigar o papel da melatonina em crianças com IC.
Aprovação pelo Comitê de Ética e consentimento informadoEste estudo foi aprovado pelo Comitê de Ética. Todas as amostras de sangue dos pacientes foram coletadas após o consentimento informado por escrito ter sido assinado pelos pais ou responsáveis.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Fengchuan Jing e Danyi Peng por fornecerem as informações e pelo apoio durante este estudo.
Como citar este artigo: Wu Y, Si F, Luo L, Yi Q. Serum levels of melatonin may contribute to the pathogenesis of heart failure in children with median age of 1 year. J Pediatr (Rio J). 2018;84:446–52.