To evaluate the association between oxidative and inflammatory stress markers with peri‐intraventricular hemorrhage (PIVH) in very‐low birth weight newborns.
MethodsThis was a prospective study conducted in a level III neonatal unit. Basal and stimulated reactive oxygen intermediates (ROIs), reduced glutathione (GSH), and interleukin‐6 (IL‐6) levels were measured in umbilical cord blood. Newborns underwent serial ultrasound at the bedside, at 6, 12, 24, and 72hours of life and at seven days for the diagnosis of PIVH, classified as grades I to IV. Two groups were assessed, those with and without PIVH; maternal and neonatal control variables were used for comparison. Univariate and multiple regression analyses were applied.
ResultsA total of 125 newborns were assessed. PIVH incidence rate was 12.0%. In the univariate analysis, basal ROI, the use of two or more doses of corticosteroids, birth weight < 1,000g, ventilatory support use, and SNAPPE II value ≥ 22 were significantly associated with PIVH. However, in the multivariate analysis, only antenatal steroid use was independently associated with the disease (OR 1.94; 95% CI: 0.048 to 0.773; p=0.02).
ConclusionROI, GSH, and IL‐6 levels were not associated with the occurrence of PIVH in very‐low birth weight infants.
Avaliar a associação entre marcadores de estresse oxidativo e inflamatório com a hemorragia peri‐ e intraventricular (HPIV) em recém‐nascidos (RN) de muito baixo peso ao nascer.
MétodosEstudo prospectivo em unidade neonatal nível III. Foi feita dosagem em sangue de cordão umbilical de intermediários reativos de oxigênio (ROI) basal e estimulado, glutationa reduzida (GR) e interleucina‐6 (IL‐6). Recém‐nascidos foram submetidos a ultrassonografia seriada, à beira do leito, com seis, 12, 24 e 72 horas de vida e sete dias para o diagnóstico de HPIV, classificada em graus de I a IV. Foram avaliados dois grupos: com e sem HPIV e variáveis de controle maternas e neonatais foram usadas para comparação. Análise univariada e de regressão múltipla foram aplicados.
ResultadosForam avaliados 125 recém‐nascidos. A taxa de incidência de HPIV foi de 12%. Na análise univariada o valor basal de ROI, o uso de duas ou mais doses de corticosteroide, peso ao nascer menor do que 1.000g, o uso de assistência respiratória e valor de SNAPPE II maior ou igual a 22 foram significativamente associados à HPIV. Porém, na análise multivariada, apenas o uso antenatal de esteroides se mostrou independentemente associado à doença (OR 1,94 IC95% 0,048‐0,773 p=0,02).
ConclusãoROI, GR e Il‐6 não foram associados à ocorrência de HPIV em RN de muito baixo peso ao nascer.
A hemorragia peri‐intraventricular (HPIV) permanece como uma doença de alta incidência em recém‐nascidos (RN) pré‐termo, especialmente naqueles com peso de nascimento menor do que 1.500g e com idade gestacional menor do que 34 semanas. A doença está relacionada com o desenvolvimento de hidrocefalia pós‐hemorrágica, as alterações do neurodesenvolvimento, a necessidade de terapias de reabilitação especializadas e o elevado custo social.1,2
O local mais comum de HPIV é a matriz germinativa, à qual está situada na região subependimária periventricular e é irrigada por vasculatura frágil e imatura. Ela é sítio importante de proliferação de precursores neuronais antes de sua migração para o local definitivo no córtex cerebral. Vários fatores, especialmente aqueles ligadas aos fenômenos de hipoperfusão e reperfusão cerebral, podem determinar o sangramento nesse local, o mais comum da HPIV.2,3
Além do mecanismo de rotura vascular relacionado à alteração do fluxo sanguíneo cerebral, a HPIV pode ocorrer por outros mecanismos, de origem vascular ou não.2
Estudos experimentais e em seres humanos mostraram haver uma relação entre HPIV e estresse oxidativo. Em trabalhos experimentais em cachorros recém‐nascidos pré‐termo, Ment et al. demonstraram que o bloqueio da produção de radicais livres por etansilato e indometacina, ou com o uso de superóxido‐dismutase, tinham um efeito protetor no aparecimento de HPIV após injúria de reperfusão por hipotensão hipovolêmica.3‐5
Mais recentemente, surgiram evidências da associação da HPIV com processos inflamatório‐infecciosos intrauterinos,6‐8 bem como associação entre os níveis séricos de interleucina‐6 (IL‐6), com lesão do endotélio vascular da matriz por citocinas.9‐11
No entanto, a avaliação específica de marcadores de estresse oxidativo como as espécies reativas de oxigênio e da enzima antioxidante glutationa não tem sido feita em relação ao desenvolvimento de HPIV.
Este estudo foi idealizado com o intuito de avaliar a associação de marcadores de estresse oxidativo, especificamente a produção de intermediários reativos do oxigênio (ROI) e níveis da glutationa reduzida (GR), e de inflamação, nominalmente o nível sérico da IL‐6, dosados no sangue de cordão umbilical, como fatores de risco para o desenvolvimento de HPIV.
MétodosEstudo de coorte prospectivo. Foram selecionados todos os RNs vivos pré‐termo (< de 37 semanas de gestação), de peso de nascimento menor do que 1.500g, internados em unidade neonatal universitária nível 3, de 1° de maio de 2009 a 31 de outubro de 2010. Foram critérios de exclusão: não obtenção da coleta de sangue do cordão umbilical; não autorização da mãe ou responsável; malformação grave do sistema nervoso central e óbito neonatal antes de seis horas de vida, que impossibilitando a feitura da primeira ultrassonografia cerebral.
O tamanho da amostra foi calculado de acordo com o nível sérico umbilical de IL‐6 como marcador de desenvolvimento de HPIV em RNs de muito baixo peso, baseado no estudo de Heep et al.,9 no qual a IL‐6 foi categorizada em valores > 100 pg/ml ou ≤ 100pg/ml, com taxas de HPIV de 63% e 38% nesses grupos, respectivamente. Considerando um nível de significância de 5%, um poder do teste de 80% e uma taxa local de incidência de HPIV de 20%, o tamanho da amostra mínimo calculado foi de n=125.9
O desfecho avaliado foi a hemorragia peri‐intraventricular (HPIV) e foram avaliados dois grupos: com e sem HPIV, classificada de acordo com Papile et al.12
Para o diagnóstico de HPIV os RNs foram submetidos à ultrassonografia cerebral, à beira do leito, com seis, 12, 24 e 72 horas de vida e com sete dias de vida. Foi usada a fontanela anterior como janela acústica, com ecógrafo Xario® (Toshiba®, CA, Estados Unidos) com transdutor de 5 mHz. Os exames foram gravados e arquivados em CD‐ROM e revistos por dois avaliadores experientes. Em caso de dúvida, um terceiro especialista emitiu sua opinião.
Para a determinação dos marcadores bioquímicos, a coleta de sangue do cordão umbilical foi feita no momento do parto, após o nascimento do RN e com a placenta ainda inserida, por punção dos vasos umbilicais. Constituiu‐se em amostra mista, arterial e venosa. A seguir, o material foi distribuído em três frascos, dois com anticoagulante e um contendo oxalato de silício, e as amostras foram processadas imediatamente.
A dosagem da produção de ROI de leucócitos polimorfonucleares foi determinada por citometria de fluxo, em dois momentos: produção espontânea (ou basal), com os leucócitos incubados apenas em solução de Hanks, e estimulada, com os leucócitos incubados em forbol‐miristato acetato.13 Valores expressos em nMolx106 células.
A dosagem do nível de GR eritrocitária foi determinada por espectrofotometria, com dosagens feitas em duplicatas e resultados expressos em mg% em relação ao hematócrito.14
A dosagem de IL‐6 foi determinada nas amostras congeladas a −80°C por Enzyme Linked Immuno Sorbent Assay (ELISA), conforme orientações do fabricante (R&D Systems®, MN, Estados Unidos).15
Para efeitos de comparação entre os grupos foram analisadas ainda as seguintes variáveis maternas e neonatais de controle, às quais poderiam interferir no desfecho HPIV: primiparidade, doença hipertensiva, uso antenatal de corticosteroide e número de doses ≥ 2, parto vaginal, apresentação cefálica, corioamnionite, gemelaridade, peso ao nascer < 1.000 g, idade gestacional < 30 semanas, sexo masculino, índice de Apgar < 7 no primeiro e quinto minutos, necessidade de reanimação, pequeno para idade gestacional, assistência respiratória, uso de surfactante e valor de SNAPPE II.
Doença hipertensiva materna foi definida foi definida como a presença de pressão arterial sistólica (PAS) ≥ 140mmHg ou mais e pressão arterial diastólica (PAD) ≥ 90mmHg, em duas tomadas, com intervalo não inferior a quatro horas entre elas, ou a presença de PAS ≥ 160mmHg e PAD ≥ 110mmHg em única medida.16 Corioamnionite foi definida como a presença de febre materna (temperatura materna ≥37,8° C), associada a dois ou mais dos seguintes sinais: dor à palpação uterina, líquido amniótico fétido/purulento, taquicardia fetal (> 160 bpm), taquicardia materna (> 100 bpm) e leucocitose (contagem leucocitária total > 15.000/ml).17 Pequeno para idade gestacional: foi definido como o RN que apresenta o peso de nascimento menor do que o percentil10, de acordo com a curva de crescimento fetal de Alexander et al.18
Para os valores de SNAPPE II e de ROI, GR e IL‐6, o limite de corte para categorização foi obtido através do ponto de maximização na curva ROC.
As variáveis clínicas só foram consideradas presentes ou ausentes quando do momento da detecção da HPIV pela ultrassonografia seriada. Em caso de não haver desenvolvimento da HPIV, avaliaram‐se as variáveis até o sétimo dia de vida.
Para fins de análise estatística, os valores de peso ao nascer, idade gestacional, idade materna e da produção de ROI e dos níveis sanguíneos de GR e IL‐6 foram expressos como mediana e percentis 25 e 75 e avaliados pelo teste de Mann‐Withney. Testes de qui‐quadrado ou de Fisher foram usados para comparação das variáveis categóricas. Para verificar as variáveis independentes com a ocorrência do desfecho HPIV, foi aplicada análise de regressão logística múltipla passo a passo, com adaptação para cálculo da razão de incidência, com o uso das variáveis que na análise univariada apresentaram nível de significância ≥ 0,2. O nível de significância aceito foi de p < 0,05.
O Statistical Package for the Social Sciences (SPSS), versão 15.0 para Windows (SPSS Inc. Statistics for Windows, Chicago, Estados Unidos), foi usado em toda a análise estatística. Foi obtida a aprovação dos pais por meio do termo de consentimento livre e esclarecido. O estudo foi aprovado pelo Comitê de Ética em Pesquisa local sob o parecer número 971/2008.
ResultadosDurante o período de estudo foram elegíveis 138 crianças com peso ao nascer inferior a 1.500 gramas. Dessas, 13 não foram incluídas. Em 12 crianças não foi possível a coleta de sangue umbilical e, dessas, duas apresentaram HPIV (16,66%), uma com grau I e outra com grau III. Um RN foi excluído, pois, apesar de sido colhido o sangue de cordão umbilical, ele morreu com menos de seis horas de vida, o que impossibilitou a feitura da ultrassonografia.
Permaneceram para a análise do estudo 125 crianças. O número de mães foi de 111, pois houve 14 gestações múltiplas, 11 duplas e três triplas. Não houve recusa materna em participar do estudo.
Das 125 crianças estudadas, 15 apresentaram HPIV (12%), seis delas com grau I, duas com grau II, quatro com grau III e três com grau IV. A forma leve da doença (graus I e II) ocorreu em oito ocasiões (53,33%) e a forma grave (graus III e IV) em sete RNs (46,66%). A taxa de HPIV no grupo não incluído foi semelhante ao grupo estudado – 16,6% x 12%, p=0,342.
Em quatro casos (26,67%) A HPIV foi diagnosticada já com seis horas de vida, inclusive com formas graves, e quase a metade (46,6%) foi demonstrada com até 24 horas de vida.
Houve 14 óbitos entre a população estudada e quatro desses RNs (28,57%) apresentaram as formas graves da doença (três RNs apresentaram grau III e um grau IV). Todos os óbitos, exceto três, ocorreram após 72 horas de vida. Dos três casos de óbito entre seis e 72 horas de vida, um deles já apresentava lesão hemorragia parenquimatosa à ecografia cerebral (grau IV de Papille et al.)12 e foi classificado como “HPIV presente”. Outros dois casos morreram com 31 e 43 horas de vida, sem lesão hemorrágica à ecografia de seis‐12‐24 horas de vida, sem HPIV na necropsia, e foram considerados como “HPIV ausente”.
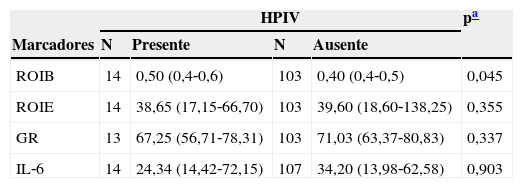
Na avaliação dos marcadores observou‐se que a produção basal de ROI apresentou mediana estatisticamente mais elevada no grupo que apresentou HPIV (p=0,045). No entanto, a produção estimulada não apresentou diferença estatística. Os valores de mediana da glutationa e de IL‐6 também não apresentaram diferença estatisticamente significativa entre os grupos (tabela 1).
Valores de ROI basal e estimulado, glutationa e IL‐6 em sangue de cordão umbilical de recém‐nascidos pré‐termo de muito baixo peso, segundo a ocorrência de HPIV
| HPIV | pa | ||||
|---|---|---|---|---|---|
| Marcadores | N | Presente | N | Ausente | |
| ROIB | 14 | 0,50 (0,4‐0,6) | 103 | 0,40 (0,4‐0,5) | 0,045 |
| ROIE | 14 | 38,65 (17,15‐66,70) | 103 | 39,60 (18,60‐138,25) | 0,355 |
| GR | 13 | 67,25 (56,71‐78,31) | 103 | 71,03 (63,37‐80,83) | 0,337 |
| IL‐6 | 14 | 24,34 (14,42‐72,15) | 107 | 34,20 (13,98‐62,58) | 0,903 |
N, número de casos; ROIB, ROI basal; ROIE, ROI estimulado (valores em nMolx106 cel); GR, glutationa reduzida (valores em mg%); Il‐6, interleucina‐6 (valores em pg/ml).
Valores em mediana (p25‐p75).
Quanto às variáveis clínicas de controle, o grupo com HPIV apresentou significativamente as menores medianas de peso ao nascer (870 x 1.042g, p=0,017), idade gestacional (27 x 29 semanas, p=0,014) e maiores valores de SNAPPE II (26 x 17, p=0,016).
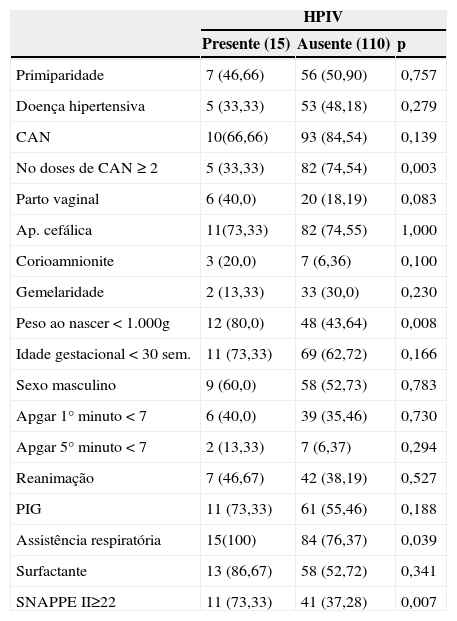
Em relação ao uso antenatal de betametasona, observou‐se que 82,4% (103/125) dos recém‐nascidos receberam a medicação, 87 deles receberam o ciclo completo, mas sem diferença significativa na incidência de HPIV (10/15 versus 93/110, p=0,1395). No entanto, quando se avaliou o uso do corticosteroide segundo o número de doses usadas, observou‐se que o uso de duas ou mais doses de betametasona foi mais estatisticamente frequente (p=0,003) no grupo sem HPIV (tabela 2).
Distribuição da ocorrência de HPIV de acordo com as variáveis categóricas de controle
| HPIV | |||
|---|---|---|---|
| Presente (15) | Ausente (110) | p | |
| Primiparidade | 7 (46,66) | 56 (50,90) | 0,757 |
| Doença hipertensiva | 5 (33,33) | 53 (48,18) | 0,279 |
| CAN | 10(66,66) | 93 (84,54) | 0,139 |
| No doses de CAN ≥ 2 | 5 (33,33) | 82 (74,54) | 0,003 |
| Parto vaginal | 6 (40,0) | 20 (18,19) | 0,083 |
| Ap. cefálica | 11(73,33) | 82 (74,55) | 1,000 |
| Corioamnionite | 3 (20,0) | 7 (6,36) | 0,100 |
| Gemelaridade | 2 (13,33) | 33 (30,0) | 0,230 |
| Peso ao nascer < 1.000g | 12 (80,0) | 48 (43,64) | 0,008 |
| Idade gestacional < 30 sem. | 11 (73,33) | 69 (62,72) | 0,166 |
| Sexo masculino | 9 (60,0) | 58 (52,73) | 0,783 |
| Apgar 1° minuto < 7 | 6 (40,0) | 39 (35,46) | 0,730 |
| Apgar 5° minuto < 7 | 2 (13,33) | 7 (6,37) | 0,294 |
| Reanimação | 7 (46,67) | 42 (38,19) | 0,527 |
| PIG | 11 (73,33) | 61 (55,46) | 0,188 |
| Assistência respiratória | 15(100) | 84 (76,37) | 0,039 |
| Surfactante | 13 (86,67) | 58 (52,72) | 0,341 |
| SNAPPE II≥22 | 11 (73,33) | 41 (37,28) | 0,007 |
CAN, corticosteroide antenatal; PIG, pequeno para idade gestacional; SNAPPE II, Score for Neonatal Acute Physiology and Perinatal Extension.
Variáveis categóricas expressas em percentagem.
Em relação às outras variáveis de controle, na análise univariada, a HPIV foi significativamente associada com peso ao nascer menor do que 1.000g, uso de duas ou mais doses de corticosteroide antenatal, assistência respiratória e valores de SNAPPE‐II ≥22. As demais variáveis não se apresentaram diferença significativa entre os dois grupos (tabela 2).
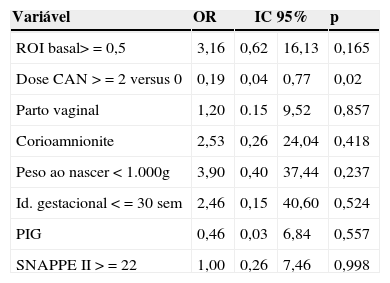
Na análise multivariada, permaneceram para análise: ROI basal (> 0,5 nMolx106cel), duas ou mais doses de corticosteroides, parto vaginal, peso ao nascer < 1.000g, idade gestacional ≤ 30 semanas, estado nutricional e SNAPPE ≥22. No resultado final da análise múltipla, a produção de ROI não se mostrou independentemente associada à ocorrência da doença. Observou‐se que apenas o uso antenatal de duas ou mais doses de corticosteroide foi independentemente associada a HPIV, como fator protetor – OR 0,194 IC 95% 0,048‐0,773, p=0,02 (tabela 3). As dosagens de glutationa e de IL‐6 não foram avaliadas no modelo final de regressão multivariada pois já não apresentaram diferença estatística no modelo univariado.
Análise de regressão múltipla para avaliação de variáveis associadas à HPIV em recém‐nascidos de muito baixo peso ao nascer
| Variável | OR | IC 95% | p | |
|---|---|---|---|---|
| ROI basal> = 0,5 | 3,16 | 0,62 | 16,13 | 0,165 |
| Dose CAN > = 2 versus 0 | 0,19 | 0,04 | 0,77 | 0,02 |
| Parto vaginal | 1,20 | 0.15 | 9,52 | 0,857 |
| Corioamnionite | 2,53 | 0,26 | 24,04 | 0,418 |
| Peso ao nascer < 1.000g | 3,90 | 0,40 | 37,44 | 0,237 |
| Id. gestacional < = 30 sem | 2,46 | 0,15 | 40,60 | 0,524 |
| PIG | 0,46 | 0,03 | 6,84 | 0,557 |
| SNAPPE II > = 22 | 1,00 | 0,26 | 7,46 | 0,998 |
OR, odds ratio; IC 95%, intervalo de confiança de 95%; ROI, intermediários reativos de oxigênio; CAN, corticosteroide antenatal; PIG, pequeno para idade gestacional; SNAPPE II, Score for Neonatal Acute Physiology and Perinatal Extension.
O estudo envolveu uma população de RNs de risco para o desenvolvimento de HPIV. Adotou‐se o critério peso de nascimento como fator de inclusão no trabalho, pois, embora a prematuridade em si seja o fator principal de risco para a doença, a definição da idade gestacional pode não ser exata, devido às incertezas dos métodos de aferição. Redes de pesquisas estrangeiras e nacionais também adotam o peso de nascimento como critério de inclusão que facilita a comparação de dados entre as unidades.19‐21
A ultrassonografia cerebral foi feita nas primeiras horas vida, pois os fatores de risco perinatais e neonatais precoces são bastante importantes na origem da HPIV e assim poder se fazer uma análise dos marcadores sanguíneos com a HPIV. A doença foi detectada nas primeiras horas de vida, como demonstrado no estudo, pois quase a metade dos casos de hemorragia ocorreu até 24 horas de vida, o que está de acordo com outros estudos.22 Além do aspecto diagnóstico, a feitura de ultrassonografia precoce seriada permitiu que fossem selecionados mais adequadamente os fatores de riscos neonatais presentes em dado momento e fosse estabelecida sua relação com o diagnóstico da doença. Boa parte dos trabalhos que avaliaram os fatores de risco para a HPIV considerou a ocorrência da doença em até sete dias de vida e não foi possível precisar qual fator realmente foi determinante na gênese da doença.23
A produção basal de ROI foi significativamente mais elevada nos RNs que posteriormente desenvolveram HPIV. Tal fato implica que os leucócitos apresentavam um potencial de ativação importante já ao nascimento e poderiam participar de eventos relacionados a dano oxidativo.
Estudos demonstraram que, em RNs a termo normais, a produção de ânions superóxidos por leucócitos polimorfonucleares de cordão foi significativamente maior quando o parto era vaginal, comparada com amostras de sangue de RNs cujas mães foram submetidas a parto cesárea, sem trabalho de parto. Isso sugere que a ativação leucocitária faz parte dos mecanismos da parturição e do processo de nascimento normais. Porém, no trabalho de parto prematuro, essa ativação leucocitária no feto poderia provocar dano celular tecidual, tanto pela intensidade da reação como pela imaturidade funcional.24,25
Perrone et al. avaliaram a produção basal e estimulada de ânions superóxidos em 168 RN pré‐termo de 24 a 32 semanas de gestação. Na avaliação em conjunto de várias doenças oxidativas neonatais relacionadas ao estresse oxidativo, os autores não encontraram diferenças na produção de ânion superóxido por leucócitos de sangue umbilical. No entanto, os autores não comentam os dados em relação à HPIV isoladamente, pelo pequeno número de casos.26
A produção estimulada de ROI não se mostrou diferente nos dois grupos. Tal fato poderia ser explicado ou porque a produção do grupo com HPIV já estava no seu máximo, ou, como se trata de estimulação artificial in vitro, que isso talvez não reflita as complexas condições de estímulos biológicos in vivo. Em estudo feito com leucócitos polimorfonucleares de RNs a termo, demonstrou‐se que, após sua estimulação com N‐formil‐metionil‐leucil‐fenilalanina, a geração de radicais superóxidos aumentou significativamente, mas não houve aumento suplementar quando, ao meio de cultura, foi adicionado IL‐10 ou dexametasona.27
Quanto à glutationa, não se observou diferenças nos valores encontrados entre os grupos. Estudos demonstraram que, à medida que a gestação atinge o termo, os níveis sanguíneos do sistema antioxidante, enzimáticos ou não, elevam‐se gradativamente e agem como fator protetor para a hiperóxia relativa que se segue ao nascimento. Dessa forma, a baixa reserva do sistema antioxidante não enzimático ao nascimento prematuro expõe o RN a um maior risco de lesão oxidativa.28,29 No entanto, o baixo poder amostral do teste para a glutationa encontrado no presente trabalho (11,5%) impede generalizações para um efeito protetor ou não.
Os níveis séricos de IL‐6 não se mostraram diferentes nos grupos com e sem HPIV. Tal resultado poderia se justificar pela baixa incidência de corioamnionite clínica na população (8%). Além disso, o tratamento antimicrobiano efetivo prévio das mães, prática rotineira do nosso serviço, poderia ter reduzido os níveis fetais das citocinas, uma vez que elas têm meia‐vida curta.30‐32
A incidência elevada de doença hipertensiva na amostra (46,4%) pode também explicar a falta de associação dos marcadores de inflamação e HPIV. Experimentalmente, Kauma et al. demonstraram que a placenta de mulheres hipertensas produzia menores quantidades de IL‐6 em relação às gestantes normotensas.33 O uso antenatal de corticosteroide também poderia alterar a produção placentária de IL‐6, como demonstrado em cultura de células placentárias34 e em estudo em humanos.32
Os estudos que demonstraram relação de HPIV com níveis aumentados de IL‐6 apresentam alguns aspectos que justificam tal diferença, tais como RNs mais prematuros e, portanto, mais sujeitos à HPIV, população selecionada (gestantes com suspeita clínica de corioamnionite), maior incidência de corioamnionite histológica na amostra e coleta de IL‐6 no sangue do RN e não de sangue umbilical.9‐11 No estudo de Bhandari et al., os níveis de IL‐6 em sangue umbilical foram significativamente mais elevados no grupo que desenvolveu HPIV, porém em análise de regressão, com o uso das variáveis clínicas e com correção para a idade gestacional, os níveis de Il‐6 não foram associados independentemente à HPIV.35
As variáveis clínicas podem ter interferido nos resultados bioquímicos como citado anteriormente e, das variáveis estudadas, apenas o uso antenatal de duas ou mais doses de corticosteroide foi associado como fator protetor no desenvolvimento da HPIV, o que está de acordo com a literatura. Revisão sistemática demonstrou que o uso antenatal de esteroides promoveu uma redução significativa na incidência de HPIV, considerando‐se todas as formas da doença – RR 0,54 IC 95% de 0,43‐0,69 e na prevenção de formas graves – RR 0,28 IC 95% de 0,16‐0,50. No entanto, a proteção não foi observada quando o nascimento ocorreu antes de 24 horas da administração da primeira dose (RR 0,54 IC95% 0,21 – 1,36), tendo, porém, sido observada quando o nascimento se deu antes de 48 horas da primeira dose – RR 0,26 IC 95% 0,09 – 0,75.36
O próprio uso do esteroide é capaz de alterar a resposta dos marcadores biológicos estudados, com diminuição da produção de ROI e IL‐6,27,32,34,37 talvez assim impedindo que tais fatores marcadores possam se expressar e não podendo tais marcadores se constituírem fatores independentemente associados à HPIV. A feitura de estudos com exposição controlada ao uso antenatal de esteroides, em caso de vigência de ameaça de parto prematuro, não seria, no entanto, ética.
ConclusãoA produção basal de intermediários reativos do oxigênio em sangue de cordão umbilical foi estatisticamente mais elevada nos RNs que desenvolveram HPIV, porém, na análise múltipla, os níveis de ROI basal não se apresentaram estatisticamente como um fator de risco independente para HPIV. Os níveis de IL‐6 nem de glutationa também não se mostraram associados à HPIV.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) projeto 08/57405‐4.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Caldas JP, Braghini CA, Mazzola TN, Vilela MM, Marba ST. Peri‐intraventricular hemorrhage and oxidative and inflammatory stress markers in very‐low birth weight newborns. J Pediatr (Rio J). 2015;91:373–9.
Estudo conduzido no Centro de Investigação em Pediatria (Ciped), Faculdade de Ciências Médicas, Universidade Estadual de Campinas (Unicamp), e no Hospital da Mulher Prof. Dr. José Aristodemo Pinotti, Centro de Atenção Integral à Saúde da Mulher (CAISM), Universidade Estadual de Campinas, Campinas, SP, Brasil.