The aim of this study is to define the predictors of chronic carditis in patients with acute rheumatic carditis (ARC).
MethodsPatients diagnosed with ARC between May 2010 and May 2011 were included in the study. Echocardiography, electrocardiography, lymphocyte subset analysis, acute phase reactants, plasma albumin levels, and antistreptolysin‐O (ASO) tests were performed at initial presentation. The echocardiographic assessments were repeated at the sixth month of follow‐up. The patients were divided into two groups according to persistence of valvular pathology at 6th month as Group 1 and Group 2, and all clinical and laboratory parameters at admission were compared between two groups of valvular involvement.
ResultsDuring the one‐year study period, 22 patients had valvular disease. Seventeen (77.2%) patients showed regression in valvular pathology. An initial mild regurgitation disappeared in eight patients (36.3%). Among seven (31.8%) patients with moderate regurgitation initially, the regurgitation disappeared in three, and four patients improved to mild regurgitation. Two patients with a severe regurgitation initially improved to moderate regurgitation (9.1%). In five (22.8%) patients, the grade of regurgitation [moderate regurgitation in one (4.6%), and severe regurgitation in 4 (18.2%)] remained unchanged. The albumin level was significantly lower at diagnosis in Group 2 (2.6±0.48g/dL). Lymphocyte subset analysis showed a significant decrease in the CD8 percentage and a significant increase in CD19 percentage at diagnosis in Group 2 compared to Group 1.
ConclusionThe blood albumin level and the percentage of CD8 and CD19 (+) lymphocytes at diagnosis may help to predict chronic valvular disease risk in patients with acute rheumatic carditis.
Definir os preditores da cardite crônica em pacientes com cardite reumática aguda (CRA).
MétodosOs pacientes diagnosticados com CRA entre maio de 2010 e maio de 2011 foram incluídos no estudo. Foram feitos os testes de ecocardiografia, eletrocardiograma, uma análise do subgrupo de linfócitos, provas de fase aguda, níveis de albumina plasmática, antiestreptolisina‐O (ASO) na manifestação inicial. As avaliações ecocardiográficas foram repetidas no 6° mês de acompanhamento. Os pacientes foram divididos em dois grupos de acordo com a persistência da patologia valvular no 6° mês como Grupo 1 e Grupo 2 e todos os parâmetros clínicos e laboratoriais na internação foram comparados entre dois grupos de comprometimento valvular.
ResultadosDurante o período do estudo de um ano, 22 pacientes apresentaram doença valvular; 17 (77,2%) apresentaram regressão da patologia valvular. Houve desaparecimento de regurgitação moderada inicial em oito pacientes (36,3%). Entre sete (31,8%) pacientes com regurgitação moderada inicialmente, a regurgitação desapareceu em três e quatro apresentaram melhoria para regurgitação leve. Dois pacientes com regurgitação grave inicialmente apresentaram melhoria para regurgitação moderada (9,1%). Em cinco (22,8%) pacientes o grau de regurgitação (regurgitação moderada em um [4,6%] e regurgitação grave em quatro [18,2]) continuou inalterado. O nível de albumina foi significativamente menor no diagnóstico no Grupo 2 (2,6±0,48 gr/dL). A análise do subgrupo de linfócitos mostrou uma redução significativa no percentual de CD8 e um aumento significativo no percentual de CD19 no Grupo 2 em comparação com o Grupo 1.
ConclusãoO nível de albumina no sangue e o percentual de linfócitos CD8 e CD19 (+) no diagnóstico podem ajudar a prever risco de doença valvular crônica em pacientes com cardite reumática aguda.
O período latente da febre reumática aguda (FRA) após infecções estreptocócicas, infiltração de células T e macrófagos nas válvulas do coração e a infiltração de células B nos nódulos de Aschoff indicam que o sistema imunológico está envolvido na patogênese da doença.1 Os estudos que investigam as alterações na resposta imune celular durante a FRA mostraram redução nos linfócitos CD8 (+) e aumento no nível de linfócitos CD4/CD8.2 Foi relatado que os níveis de CD8 se reduziram nos pacientes com doença cardíaca reumática em comparação com os pacientes com FRA ou indivíduos saudáveis, o que indica um processo imune no curso dessa doença e que as células T CD8 mostraram desempenhar um importante papel imunorregulatório na patogênese.3
As células B desempenham papeis como apresentação de antígenos, produção de citocina e regulação da organogênese linfoide, diferenciação de células T e função de células dendríticas.4 Assim, os papéis essenciais das células B foram demonstrados em várias doenças mediadas pelo sistema imunológico. Como as célula B são rigorosamente reguladas pela transdução de sinal por meio do receptor de célula B e dos receptores da superfície celular funcionalmente interrelacionados, como CD19, CD21, CD22, CD40, isso pode ser uma possível estratégia para regulação dessas doenças.5,6 Dentre eles, o CD19 geralmente é considerado um regulador de resposta positiva de células B.7
O nível de albumina plasmática pode diminuir em condições inflamatórias. A hipoalbuminemia reduz a pressão oncótica do plasma e pode contribuir para o surgimento de edema pulmonar na presença de pressão atrial esquerda elevada e contribuir para a progressão da insuficiência cardíaca, e é comumente vista em pacientes com insuficiência cardíaca.8 Vários estudos demonstraram uma baixa taxa de sobrevida e uma alta taxa de morte cardiovascular em pacientes com hipoalbuminemia (< 3,4g/dl)9 e um estudo enfatizou a albumina sérica <2,5g/dl como a variável preditora mais independente de mortalidade hospitalar.10 Porém, a relação albumina‐FRA nunca foi investigada para doença valvular crônica em crianças.
Este estudo visou a definir os preditores de cardite crônica por meio da avaliação de eletrocardiograma, ecocardiografia, análise do subgrupo de linfócitos e parâmetros laboratoriais, incluindo albumina, taxa de sedimentação de eritrócitos (TSE), hemograma completo e ASO, em pacientes diagnosticados com cardite reumática aguda antes do tratamento com esteroides.
Material e métodosForam incluídos no estudo retrospectivo 22 pacientes internados na unidade de cardiologia pediátrica com diagnóstico de cardite reumática aguda entre maio de 2010 e maio de 2011. Foram feitos hemograma completo, nível de albumina plasmática, proteína C reativa (PCR), taxa de sedimentação de eritrócitos (TSE), antiestreptolisina‐O (ASO), análise do subgrupo de linfócitos, ecocardiografia e eletrocardiograma antes do tratamento em pacientes elegíveis. O estudo foi aprovado pelo conselho de revisão institucional.
Todos os pacientes com diagnóstico presumido de FRA foram avaliados por ecocardiografia, independentemente dos achados de ausculta cardíaca. O diagnóstico de FRA teve como base os critérios modificados de Jones (dois maiores ou um maior – dois menores e preditores anteriores de estreptococos hemolítico beta do Grupo A [GABHS]).11 A regurgitação valvular foi considerada patológica quando a extensão de um jato colorido foi de no mínimo 1cm, visto em pelo menos dois planos separados com um pico de velocidade superior a 2,5 m/s no exame de ecocardiografia. Os pacientes que foram diagnosticados com CRA pela primeira vez foram incluídos no estudo. Os pacientes com diagnóstico prévio de FRA e/ou CRA não foram incluídos. Assim, prednisona a 2mg/kg/d (máximo de 60mg) foi iniciada para todos os pacientes. Após 2‐4 semanas de prednisona, a dose foi reduzida ao longo de duas semanas. Ácido acetilsalicílico foi acrescentado ao tratamento durante a redução do esteroide a uma dose de 90‐100mg/kg/d (máximo de 3,5g) e foi interrompido após afunilamento com uma duração total de quatro semanas.
Uma injeção de 1.200.000 U de penicilina G benzatina em pacientes que pesam mais de 27kg e 600.000 U intramuscular em pacientes que pesam 27kg ou menos a cada três semanas é o esquema recomendado para prevenção secundária.
No momento do diagnóstico, oito pacientes apresentaram regurgitação leve. Regurgitação moderada e grave esteve presente em oito e seis pacientes, respectivamente. Nenhum apresentou episódio recorrente de cardite durante o período de acompanhamento. Após a terapia com esteroides, as provas de fase aguda continuaram negativas durante todo o estudo. Os pacientes foram divididos em dois grupos como aqueles com (Grupo 1) e sem (Grupo) regressão na regurgitação valvular, de acordo com a avaliação ecocardiográfica no 6° mês após o tratamento, e os dados desses grupos no diagnóstico inicial foram comparados. Foi concedido acesso à base de dados do hospital por sua administração.
EcocardiografiaOs exames de ecocardiografia transtorácica bidimensional e com Doppler dos indivíduos foram feitos com o aparelho Vivid 3da GE (GE Healthcare, WI, EUA), com o uso de transdutores de 3MHz e 7MHz na avaliação cardíaca. As medições ecocardiográficas em modo M foram obtidas a partir do nível da válvula mitral posterior, de acordo com as recomendações da Sociedade Americana de Ecocardiografia. A gravidade da regurgitação valvular foi avaliada por ecocardiografia com Doppler colorido com o uso da largura e da extensão do fluxo do jato. Os critérios para regurgitação valvular com o uso de planos ortogonais foram um jato colorido verificado em pelo menos dois planos separados, a extensão de um jato colorido de no mínimo 1cm e um jato colorido em mosaico com um pico de velocidade superior a 2,5 m/s. A gravidade da regurgitação mitral e da regurgitação aórtica foi classificada qualitativamente de 1 a 4 a depender do fluxo do jato de regurgitação observado no átrio esquerdo ou no ventrículo esquerdo por ecocardiografia com Doppler colorido. A regurgitação mitral e a regurgitação aórtica detectadas pelo Doppler colorido foram consideradas grau 1 se o comprimento do jato tivesse 1,5cm; grau 2 se 1,5‐2,9cm; grau 3 se 3‐4,4cm; e grau 4 se 4,5cm.12 O grau 1 foi considerado leve, o grau 2 moderado e os graus 3 e 4 regurgitação grave.13,14
EletrocardiogramaForam obtidas gravações de ECG de superfície de 12 derivações de todos os pacientes. O intervalo QT foi medido do início da onda Q até o fim da onda T. Quando a onda U esteve presente, o fim da onda T foi definido como o ponto mais baixo entre as ondas T e U. A dispersão QT foi definida como a diferença entre os intervalos QT máximos e mínimos no ECG padrão de 12 canais. Os intervalos QT nos ECGs foram corrigidos com a fórmula de Bazett (QTc = QT/ √R – R) e foram expressos como QTc.15
Citometria de fluxoOs subgrupos de linfócitos foram medidos com o método de imunofluorescência indireta, com o uso de anticorpos monoclonais. O método envolve as etapas de coloração com anticorpos monoclonais, incubação, remoção de eritrócitos e fixação do material com paraformaldeído. Os anticorpos monoclonais são preparados na forma de um painel e contêm fluorocromo. Há vários fluorocromos com diferentes características espectrais; as células ou partículas em suspensão passam por uma câmara iluminada por uma luz laser e os sinais emitidos pelas células conforme sua passagem pela luz são coletados e analisados. A fonte dos sinais pode ser as características físicas da célula, como a magnitude e a granularidade, bem como vários fluorocromos ligados à célula. Assim, os dados podem ser coletados com relação às várias propriedades da célula ou da partícula, como imunofenotipagem, conteúdo de DNA, atividades enzimáticas, potencial e viabilidade da membrana celular. A presença de uma entidade (= antígeno) na célula pode ser demonstrada imunologicamente pelo método de imuno‐histoquímica por meio de uma mancha/uma enzina ligada a uma proteína produzida em resposta a essa entidade (= anticorpo) ou por microscopia de imunofluorescência por meio de uma substância fluorescente. Os antígenos da superfície celular são definidos com a terminologia “Agrupamento de Diferenciação, CD”.16 As amostras de sangue foram testadas no laboratório de hematologia. A análise da citometria de fluxo foi feita com sangue coletado em tubos com ácido etilendiaminotetraacético (2mg/mL), com um aparelho FC 500da Beckman Coulter (Beckman Coulter Life Sciences, IN, USA). Os percentuais de CD3, CD4, CD8 e CD19 são calculados.
Testes de laboratórioConhecidos como marcadores de inflamação e identificados como fatores de risco independentes para insuficiência cardíaca em doenças reumáticas, foram estudados a proteína C reativa (PCR) e a taxa de sedimentação de eritrócitos (TSE);17 albumina plasmática, um indicador negativo de inflamação associado a mortalidade cardíaca;10 nível de antiestreptolisinas (ASO) como um indicador de infeção por GABHS. O método colorimétrico verde de bromocresol foi usado para avaliar os níveis de albumina. As concentrações de proteína C reativa (PCR) e os níveis de ASO foram estudados de forma nefelométrica com o kit Behring. A sedimentação foi medida com o método de Westergren.
Avaliação estatísticaAs análises estatísticas foram feitas com o programa SPSS para Windows 17.0 (SPSS, Chicago, IL, E.U.A.). A distribuição normal das variáveis foi avaliada com o teste de Kolmogorov‐Smirnov. O teste t de Student foi usado para investigar a relevância das diferenças entre o controle e os grupos de pacientes da série com distribuição regular e o teste U de Mann‐Whitney foi usado para a série com distribuição irregular. Os valores de p abaixo de 0,05 foram considerados estatisticamente significativos.
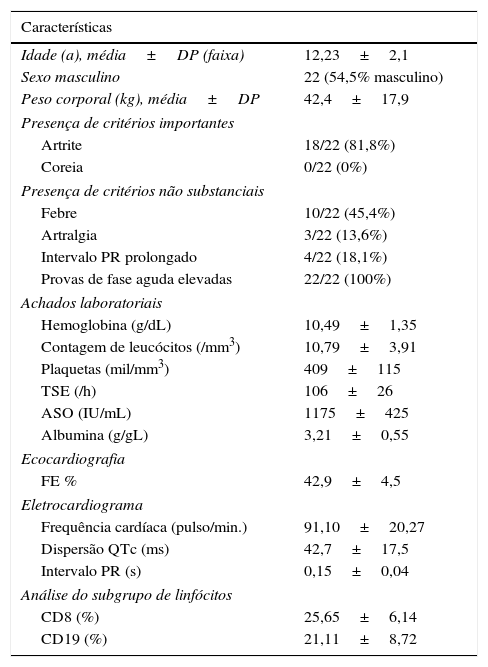
ResultadosForam incluídos no estudo 22 pacientes (12 meninos, 10 meninas, com média de 12,23±2,1 anos) diagnosticados com cardite reumática aguda. Nenhum com cardite apresentou coreia de Sydenham, eritema marginado nem nódulos subcutâneos. Os dados clínicos e laboratoriais detalhados são apresentados na tabela 1. A avaliação ecocardiográfica e eletrocardiográfica revelou a média da fração de encurtamento, a frequência cardíaca média, a dispersão QTc e o intervalo PR em termos de %, 42,9±4,5, 91,10±20,27/min, 42,7±17,5ms, 0,15±0,04 s, respectivamente (tabela 1). As características eletrocardiográficas não demonstraram diferença em termos de intervalo PR, frequência cardíaca média e dispersão QTc entre o Grupo 1 e Grupo 2 (p>0,05) (tabela 2).
Características demográficas e clínicas e parâmetros laboratoriais dos pacientes no momento do diagnóstico
| Características | |
|---|---|
| Idade (a), média±DP (faixa) | 12,23±2,1 |
| Sexo masculino | 22 (54,5% masculino) |
| Peso corporal (kg), média±DP | 42,4±17,9 |
| Presença de critérios importantes | |
| Artrite | 18/22 (81,8%) |
| Coreia | 0/22 (0%) |
| Presença de critérios não substanciais | |
| Febre | 10/22 (45,4%) |
| Artralgia | 3/22 (13,6%) |
| Intervalo PR prolongado | 4/22 (18,1%) |
| Provas de fase aguda elevadas | 22/22 (100%) |
| Achados laboratoriais | |
| Hemoglobina (g/dL) | 10,49±1,35 |
| Contagem de leucócitos (/mm3) | 10,79±3,91 |
| Plaquetas (mil/mm3) | 409±115 |
| TSE (/h) | 106±26 |
| ASO (IU/mL) | 1175±425 |
| Albumina (g/gL) | 3,21±0,55 |
| Ecocardiografia | |
| FE % | 42,9±4,5 |
| Eletrocardiograma | |
| Frequência cardíaca (pulso/min.) | 91,10±20,27 |
| Dispersão QTc (ms) | 42,7±17,5 |
| Intervalo PR (s) | 0,15±0,04 |
| Análise do subgrupo de linfócitos | |
| CD8 (%) | 25,65±6,14 |
| CD19 (%) | 21,11±8,72 |
ASO, antiestreptolisina O; FE, fração de encurtamento; TSE, taxa de sedimentação de eritrócitos.
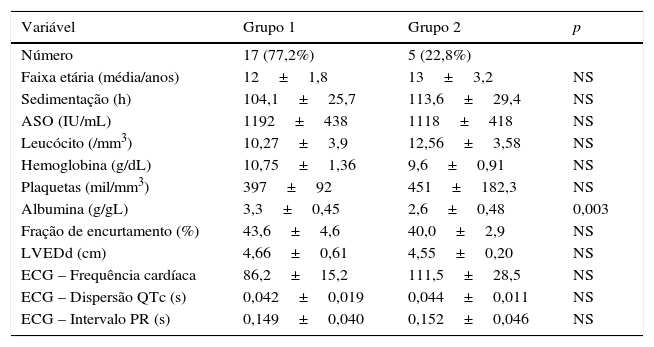
Comparação do eletrocardiograma‐ecocardiografia e achados laboratoriais dos grupos com e sem regressão na cardite
| Variável | Grupo 1 | Grupo 2 | p |
|---|---|---|---|
| Número | 17 (77,2%) | 5 (22,8%) | |
| Faixa etária (média/anos) | 12±1,8 | 13±3,2 | NS |
| Sedimentação (h) | 104,1±25,7 | 113,6±29,4 | NS |
| ASO (IU/mL) | 1192±438 | 1118±418 | NS |
| Leucócito (/mm3) | 10,27±3,9 | 12,56±3,58 | NS |
| Hemoglobina (g/dL) | 10,75±1,36 | 9,6±0,91 | NS |
| Plaquetas (mil/mm3) | 397±92 | 451±182,3 | NS |
| Albumina (g/gL) | 3,3±0,45 | 2,6±0,48 | 0,003 |
| Fração de encurtamento (%) | 43,6±4,6 | 40,0±2,9 | NS |
| LVEDd (cm) | 4,66±0,61 | 4,55±0,20 | NS |
| ECG – Frequência cardíaca | 86,2±15,2 | 111,5±28,5 | NS |
| ECG – Dispersão QTc (s) | 0,042±0,019 | 0,044±0,011 | NS |
| ECG – Intervalo PR (s) | 0,149±0,040 | 0,152±0,046 | NS |
ASO, antiestreptolisina O; ECG, eletrocardiograma; LVEDd, diâmetro diastólico final do ventrículo esquerdo; NS, não significativo.
Testes de sangue de rotina não demonstraram associação nos níveis de hemoglobina, sedimentação e anticorpo ASO entre o Grupo 1 e o Grupo 2, ao passo que o nível de albumina no sangue no diagnóstico foi encontrado significativamente menor no Grupo 2 (2,6±0,48) (tabela 2).
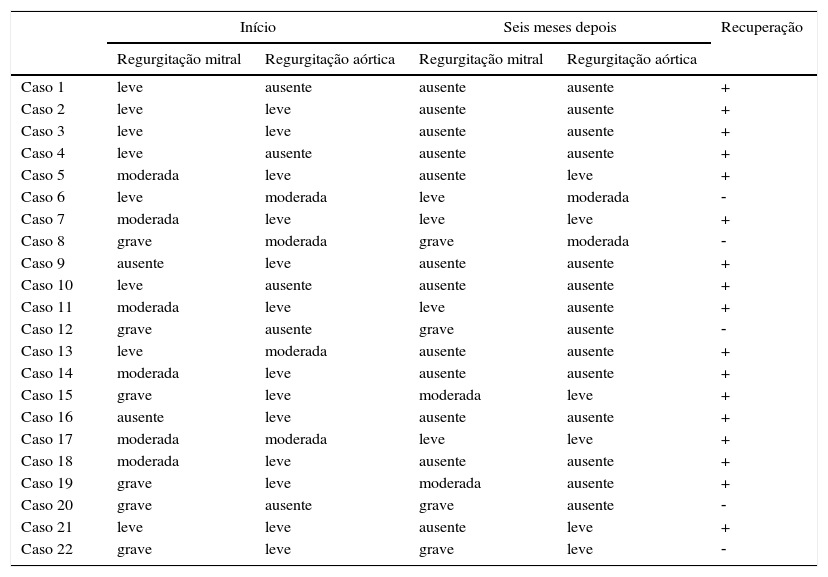
A avaliação ecocardiográfica revelou um comprometimento combinado da válvula em 68,2% dos pacientes, regurgitação mitral isolada em 22,7% e regurgitação aórtica isolada em 9,1%; 17 (77,2%) pacientes apresentaram regressão da patologia valvular, ao passo que em cinco (22,8%) o grau de regurgitação (regurgitação moderada em um [4,6%] e regurgitação grave em quatro [18,2%]) continuou inalterado (tabela 2). No momento do diagnóstico, oito pacientes apresentaram regurgitação leve. Regurgitação moderada e grave estiveram presentes em oito e seis pacientes, respectivamente. Houve desaparecimento da regurgitação moderada inicial em oito pacientes (36,3%) no 6° mês de acompanhamento. Entre sete (31,8%) pacientes com regurgitação moderada inicialmente, a regurgitação desapareceu em três e quatro pacientes apresentaram melhoria para regurgitação leve. Dois pacientes com regurgitação grave inicialmente apresentaram melhoria para regurgitação moderada (9,1%). Em cinco (22,8%) pacientes, o grau de regurgitação (regurgitação moderada em um [4,6%] e regurgitação grave em quatro [18,2]) continuou inalterado. O destino do comprometimento valvular em todos os pacientes estudados encontra‐se representado na tabela 3.
Relato da gravidade do comprometimento valvular em todos os pacientes no início do estudo e no 6° mês de acompanhamento
| Início | Seis meses depois | Recuperação | |||
|---|---|---|---|---|---|
| Regurgitação mitral | Regurgitação aórtica | Regurgitação mitral | Regurgitação aórtica | ||
| Caso 1 | leve | ausente | ausente | ausente | + |
| Caso 2 | leve | leve | ausente | ausente | + |
| Caso 3 | leve | leve | ausente | ausente | + |
| Caso 4 | leve | ausente | ausente | ausente | + |
| Caso 5 | moderada | leve | ausente | leve | + |
| Caso 6 | leve | moderada | leve | moderada | ‐ |
| Caso 7 | moderada | leve | leve | leve | + |
| Caso 8 | grave | moderada | grave | moderada | ‐ |
| Caso 9 | ausente | leve | ausente | ausente | + |
| Caso 10 | leve | ausente | ausente | ausente | + |
| Caso 11 | moderada | leve | leve | ausente | + |
| Caso 12 | grave | ausente | grave | ausente | ‐ |
| Caso 13 | leve | moderada | ausente | ausente | + |
| Caso 14 | moderada | leve | ausente | ausente | + |
| Caso 15 | grave | leve | moderada | leve | + |
| Caso 16 | ausente | leve | ausente | ausente | + |
| Caso 17 | moderada | moderada | leve | leve | + |
| Caso 18 | moderada | leve | ausente | ausente | + |
| Caso 19 | grave | leve | moderada | ausente | + |
| Caso 20 | grave | ausente | grave | ausente | ‐ |
| Caso 21 | leve | leve | ausente | leve | + |
| Caso 22 | grave | leve | grave | leve | ‐ |
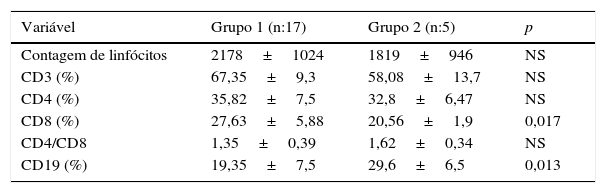
A análise do subgrupo de linfócitos mostrou linfopenia em 31,8% (sete) dos pacientes. Os linfócitos T CD3 e CD4 apresentaram redução em 40,9% (nove) dos pacientes. Adicionalmente, os linfócitos T CD8 também apresentaram redução em 13,6% dos pacientes com níveis reduzidos de CD3 e CD4. O percentual de CD8 no diagnóstico reduziu significativamente no Grupo 2, ao passo que houve um aumento significativo no percentual de CD19 (tabela 4).
Comparação da análise do subgrupo de linfócitos dos grupos com (Grupo 1) e sem (Grupo 2) regressão da cardite
| Variável | Grupo 1 (n:17) | Grupo 2 (n:5) | p |
|---|---|---|---|
| Contagem de linfócitos | 2178±1024 | 1819±946 | NS |
| CD3 (%) | 67,35±9,3 | 58,08±13,7 | NS |
| CD4 (%) | 35,82±7,5 | 32,8±6,47 | NS |
| CD8 (%) | 27,63±5,88 | 20,56±1,9 | 0,017 |
| CD4/CD8 | 1,35±0,39 | 1,62±0,34 | NS |
| CD19 (%) | 19,35±7,5 | 29,6±6,5 | 0,013 |
NS, não significativo.
Vários antígenos com similaridade às proteínas M estreptococos hemolítico beta do Grupo A foram identificados em indivíduos suscetíveis: epitopos da miosina cardíaca, vimentina, laminina e outras proteínas intracelulares. Essa similaridade causa reatividade cruzada, leva a reações autoimunes e pode resultar em dano do miocárdio. Assim, vários estudos tentaram definir essas ações por meio da investigação de subgrupos de linfócitos.18 Ratos imunizados com proteína M5 estreptocócica desenvolveram lesões nas válvulas cardíacas; células T CD4 (+) e macrófagos CD68 (+)19 foram detectados em infiltrações e infiltração predominante de linfócitos T de CD4 foi encontrada em biópsias de tecidos do coração de pacientes submetidos a cirurgia valvular devido a cardite reumática.20 Os pacientes com febre reumática aguda e cardite reumática aguda apresentaram aumento significativo nos linfócitos T CD4, linfócitos B CD22 e na razão CD4:CD8 e redução significativa nos linfócitos T CD8 e CD3, em comparação aos pacientes com cardite reumática crônica, faringite estreptocócica e indivíduos saudáveis.2 Constatou‐se que a redução no CD8 estava associada à atividade reumática em estudos anteriores. No presente estudo, os linfócitos T CD8 no sangue periférico no diagnóstico inicial eram <20,56±1,9% no grupo sem recuperação das lesões nas válvulas cardíacas e esse achado foi considerado um importante indicador para o grupo sem regressão na cardite. O resultado de nosso estudo pode ser atribuído ao fato de que apenas as células T CD8 podem causar anergia aos superantígenos estreptococos hemolítico beta do Grupo A e podem, assim, desempenhar um importante papel imunorregulatório na patogênese da doença.21 No presente estudo, a razão CD4:CD8 aumentou no grupo sem recuperação nos achados valvulares, em comparação com o grupo sem recuperação; contudo, a diferença não foi estatisticamente significativa. O percentual de células B positivas para CD19 foi significativamente elevado nos pacientes com FRA, o que sugere um papel dos linfócitos B na inflamação e/ou autoimunidade na patogênese dessa doença.22 Nosso estudo demonstrou menor nível do CD8 no Grupo 2 do que no Grupo 1 e maior nível do CD19 no Grupo 2 do que no Grupo 1 no diagnóstico.
Um estudo feito por Saito et al. demonstrou que os pacientes com esclerose sistêmica superexpressaram o CD19, uma importante molécula reguladora expressa pelos linfócitos B. As células B dos ratos com deficiência de CD19 são hiporresponsivas a sinais transmembranares, ao passo que as células B que superexpressam são hiperrenponsivas e geram autoanticorpos. Assim, uma via de sinalização dependente de CD19 nas células B contribui para o desenvolvimento da autoimunidade sistêmica.23 Um estudo feito por Iwata et al. é o primeiro a demonstrar que as células B desempenham um papel fundamental no processo de cicatrização de feridas. A expressão de CD19 regula positivamente o processo de cicatrização de feridas. Um atraso na cicatrização de feridas em ratos com CD19‐/‐ foi associado a redução na infiltração de neutrófilos e macrófagos.24 No presente estudo, o percentual de CD8 no diagnóstico reduziu significativamente nos pacientes com CRA sem recuperação no comprometimento valvular, ao passo que houve uma aumento significativo no percentual de CD19. Devido ao papel dos linfócitos CD8 e CD19 (+) na autoimunidade e na inflamação, acreditamos que a alteração desses dois subgrupos de linfócitos pode ter um papel na patogênese e na previsão de comprometimento valvular crônico em pacientes com FRA.
O nível de albumina no sangue pode reduzir em condições inflamatórias e insuficiência cardíaca. As possíveis causas de redução nos níveis de albumina no sangue na insuficiência cardíaca incluem redução da síntese devido a congestão hepática, aumento na atividade metabólica, inflamação e proteinúria. Para hipoalbuminemia, os níveis <3,5g/dl têm demonstrado ser um risco e a albumina <2,5g/dl tem demonstrado ser um fator de risco independente em doenças cardíacas.10 No presente estudo, o nível de albumina no sangue no diagnóstico foi de 2,6±0,48 no grupo sem recuperação em lesões valvulares após o 6° mês de acompanhamento após o diagnóstico de cardite ativa e isso foi significativamente menor em comparação com o grupo com recuperação em lesões valvulares. Como o exame físico dos pacientes não mostrou edema e mostrou percentis de estatura‐peso normais e os testes da função hepática também se mostraram normais, esse resultado não foi, na maior parte do tempo, associado ao maior nível de inflamação e gravidade da regurgitação valvular.
Um aumento na dispersão QT pode refletir o comprometimento cardíaco na febre reumática e ser um importante parâmetro no diagnóstico e na decisão terapêutica sobre a cardite reumática. Os pesquisadores revelaram que a dispersão QT é maior com uma patologia valvular mais grave em pacientes com CRA. Foi descoberto que a dispersão QT reduziu após a fase inicial da CRA, o que reflete uma melhoria eletrofisiológica nesse subgrupo de pacientes. Essas observações sugeriram que a dispersão QT aumenta em associação com o comprometimento cardíaco em crianças sem febre reumática aguda.25 Contudo, quando comparado com a dispersão QTc em pacientes com CRA sem recuperação nos achados valvulares no grupo sem recuperação, a dispersão QTc não foi estatisticamente diferente.
Machado et al. revelaram que os níveis de ASO foram significativamente maiores em pacientes com FRA, em comparação com aqueles com coreia de Sydenham, artrite idiopática e amigdalofaringite recorrente.26 Contudo, em nosso estudo, ao comparar os níveis de ASO em pacientes com CRA sem recuperação nos achados valvulares com o grupo sem recuperação, os níveis de ASO não podem predizer a persistência da patologia valvular em pacientes com CRA. Além disso, os níveis de PCR e sedimentação não predisseram a persistência da patologia valvular nesse subgrupo de pacientes.
Alguns estudos tentaram estabelecer os fatores de risco para cardite crônica e o diâmetro diastólico final do ventrículo esquerdo inicial.27 A presença de polimorfismo do TNF‐α 308G>A,28 a deficiência nas células CD4 para produção de IL4 no tecido da válvula cardíaca29 e a presença de HLA‐DR7DR53 associado às moléculas de DQ foram relatados como possíveis preditores de cronicidade. No presente estudo, o nível de albumina no sangue e os níveis de CD8‐CD19 no diagnóstico foram verificados como fatores de risco determinantes.
Concluindo, o nível de albumina no sangue e, principalmente, a expressão de CD18‐CD19 no diagnóstico são úteis na definição do grupo em risco de desenvolver cardite crônica em pacientes com cardite reumática aguda. São necessários estudos mais prospectivos e em grande escala para avaliar ainda mais o impacto dos subgrupos de linfócitos para predizer doença valvular crônica em pacientes com FRA.
Um modelo retrospectivo e tamanho da amostra relativamente pequeno foram as principais limitações de nosso estudo. O fácil acesso a tratamento médico e a antibióticos e a melhoria da situação socioeconômica em nosso país podem ter levado ao aumento na incidência de FRA e podem resultar em uma menor coorte de pacientes com CRA, em comparação com as décadas anteriores.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Oner T, Ozdemir R, Genc DB, Kucuk M, Karadeniz C, Demirpence S, et al. Parameters indicative of persistence of valvular pathology at initial diagnosis in acute rheumatic carditis: the role of albumin and CD19 expression. J Pediatr (Rio J). 2016;92:581–7.