The association between diabetes mellitus and infections is very common. These infections, even when mild, interfere with blood glucose control. The aim of this review is to describe infections that occur in children and adolescents with DM, as well as to provide recommendations on glycemia management during these episodes.
Source of dataA non‐systematic review was carried out in the PubMed database, using the terms “diabetes mellitus,” “infection,” “children,” and “adolescents.” The most relevant publications were selected.
Synthesis of dataIn addition to the usual community diseases, some infections may occur predominantly in diabetic patients, especially when there is inadequate glycemic control, and common infections can be more severe in these patients. Alterations caused by the disease itself and the immune response are responsible for the risk of higher frequency and severity of infections. During infections, an increase in blood glucose occurs and usually an increase in insulin dose is required.
ConclusionsPediatric patients with diabetes have some immune system disorders that, when associated with high glycemia, increase the risk of infections and their severity, and should be promptly identified and treated. The presence of an infectious condition, in turn, raises blood glucose and increases the risk of decompensation, and pediatricians should be cautioned to intensify monitoring and insulin therapy, and to avoid the risk of DKA. It should also be noted that many infections are preventable and can be avoided with adequate vaccine coverage.
A associação entre diabetes mellitus e infecções é muito frequente. Essas infecções, mesmo quando leves, interferem no controle da glicemia. O objetivo desta revisão é descrever as infecções que ocorrem em crianças e adolescentes com DM, bem como orientar o manejo glicêmico nestes episódios.
Fonte dos dadosFoi feita uma revisão não sistemática na base de dados PubMed, com os termos “diabetes mellitus”, “infecção”, “crianças” e “adolescentes”. Foram selecionadas as publicações mais relevantes.
Síntese dos dadosAlém de infecções comunitárias habituais, algumas infecções ocorrem predominantemente no paciente com diabetes, principalmente quando não há um controle glicêmico adequado, e infecções comuns podem ser mais graves nesse paciente. Alterações da própria doença e da resposta imune, em conjunto com alterações do microbioma, são responsáveis pela maior frequência e gravidade das infecções. Durante as infecções, ocorre um aumento da glicemia e habitualmente é necessário o aumento da dose de insulina.
ConclusõesO paciente pediátrico com diabetes apresenta algumas desordens imunes que, quando associadas a elevaçao da glicemia, aumentam o risco de infecção e sua gravidade. A presença da infecção, por sua vez, eleva a glicemia e aumenta o risco de descompensação. Desta forma, a monitorização da glicemia, bem como o aumento da dose de insulina, são fundamentais para evitar o risco de cetoacidose diabética. Destaca‐se ainda que muitas infecções são imunopreveníveis e podem ser evitadas com uma cobertura vacinal adequada.
A associação entre diabetes mellitus (DM) e infecções é um tema de grande interesse médico e motivo de muita discussão na literatura médica. Inúmeros estudos avaliaram essa associação, a maioria em adultos, mas vários também sobre o impacto e a incidência das infecções em crianças e adolescentes com DM. É descrito que, além de infecções comunitárias habituais, algumas infecções ocorrem preferencialmente nos pacientes com diabetes e outras infecções comuns podem ser mais agressivas nesses pacientes. Existem evidências de que um adequado controle glicêmico melhora a função imune e diminui a morbimortalidade associada a infecções graves em paciente com DM.1–5
É importante lembrar que a classificação do DM é feita de acordo com a etiopatogenia da doença, os mais frequentes são o DM tipo 2 (DM2), principalmente nos adultos, e o DM tipo 1 (DM1), principalmente nas crianças e adolescentes. Nem sempre os estudos definem o tipo de DM ao avaliar o risco e a prevalência de infecções. Contudo, independentemente do tipo de diabetes, os critérios diagnósticos são bem claros e estabelecidos. Atualmente considera‐se diabetes mellitus quando há: glicemia de jejum maior ou igual a 126mg/dL; glicemia no tempo 2 horas durante teste de tolerância oral a glicose maior ou igual a 200mg/dL; HbA1c maior ou igual a 6,5%; ou presença de sintomas de diabetes associado a glicemia ao acaso maior ou igual a 200mg/dL.6
O DM1, por sua vez, é causado por um processo autoimune voltado contra as células beta pancreáticas, responsáveis pela produção e secreção de insulina, o que leva à sua destruição, com consequente deficiência na ação de insulina e hiperglicemia. É o tipo mais comum em crianças e adolescentes em nosso meio e é associada principalmente a complicações microvasculares (retinopatia, nefropatia e neuropatia).6
O DM2 é causado por alterações metabólicas que incluem a presença de resistência periférica à insulina associada à falência pancreática secundária. É a forma mais frequente em adultos e está fortemente associada a obesidade e sedentarismo. Embora a maioria das crianças e adolescentes seja portadora de DM1, já há alguns anos vem ocorrendo um aumento no aparecimento de DM2, decorrente da elevação da prevalência de sobrepeso e obesidade nessa faixa etária.7 Portanto, trataremos aqui de infecções em DM em geral, apontaremos as especificidades, quando existirem.
Neste artigo iremos discutir, no paciente com diabetes: (i) as alterações do sistema imune; (ii) principais infecções associadas ao diabetes, (iii) como manejar a insulinoterapia quando houver quadro infeccioso, (iv) vacinas no paciente com diabetes.
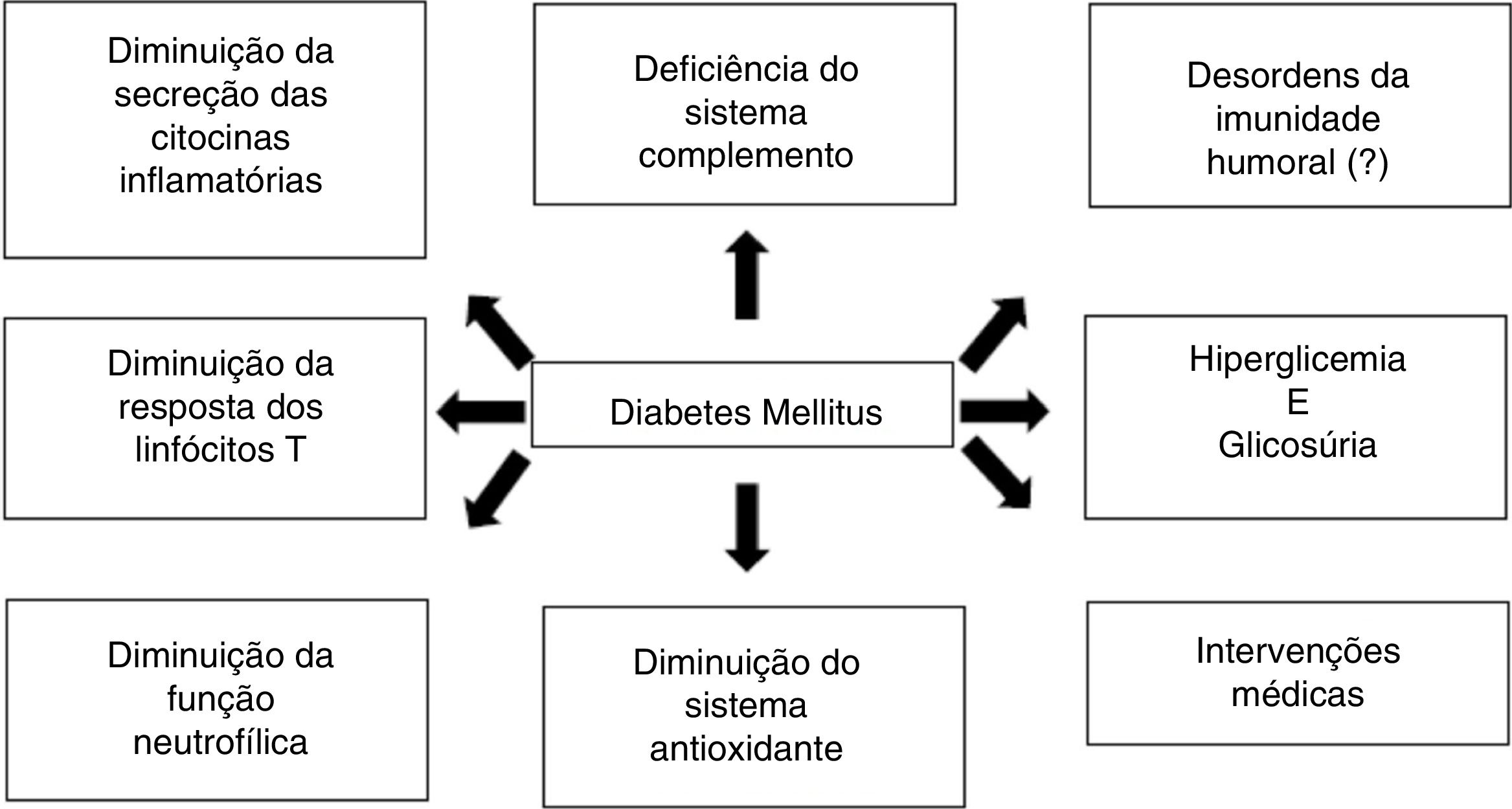
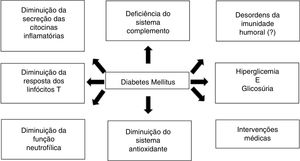
O sistema imune no paciente com diabetes mellitusDe forma geral, as alterações da própria doença e da resposta imune são os prováveis responsáveis pelo aumento no risco de infecções no paciente com diabetes, especialmente diminuição da resposta das células T e da função dos neutrófilos, monócitos/macrófagos, células dendríticas, células natural killer (NK), em conjunto com alterações do microbioma.1–4 A figura 1 resume de forma esquemática a interação entre DM e resposta imune.
Mais especificamente, discutimos a seguir quais alterações da resposta imune podem estar presentes em pacientes com DM:
Sistema complementoO sistema complemento tem como principais funções a participação na resposta inflamatória, opsonização e fagocitose pelos macrófagos e neutrófilos, bem como a lise de microorganismos. Alguns estudos mostram que pacientes com diabetes apresentam deficiência do componente C4, o que pode estar associado a disfunção dos polimorfonucleares e diminuição da resposta das citocinas.3,8
Citocinas inflamatóriasPacientes com DM têm menor secreção das interleucinas (IL)‐1, IL‐6, IL‐10, IL‐22. Há diminuição da quantidade de interferon gama (IFN‐γ) liberada pelas células T e células NK e de fator de necrose tumoral (TNF) liberado pelas células T e macrófagos. Além disso, há menor expressão do complexo maior de histocompatibilidade classe I, o que prejudica a imunidade celular.3,8
Leucócitos polimorfonucleares e mononuclearesDurante a hiperglicemia e/ou acidose pode ocorrer uma diminuição da mobilização dos leucócitos polimorfonucleares (PMN), da quimiotaxia e da atividade fagocitária. Ocorre um bloqueio na função antimicrobiana, com aumento da apoptose dos PMN e diminuição da transmigração pelo endotélio. O sistema antioxidante envolvido na atividade bactericida também pode estar comprometido.3,5,8
As células mononucleares e os monócitos de pacientes com DM liberam menores quantidades de IL‐1 e IL‐6 na resposta ao estímulo por lipopolissacarídeos.3,8
AnticorposDados clínicos quanto à imunidade humoral são limitados, mas sabe‐se que a resposta de anticorpos após vacinação e infecções comuns é normal em pacientes diabéticos.3 Vários estudos mostram uma resposta adequada e até aumentada a algumas vacinas, como influenza. Isso poderia ser explicado pela hiperativação crônica que existe na doença.1
O microbioma do paciente com diabetes mellitusPacientes com DM podem apresentar várias alterações no seu microbioma: mudança da flora da pele, inclusive uma maior colonização por Staphylococcus aureus, lesões na pele favorecidas pela hiperglicemia crônica e mudança do microbioma intestinal causada pela doença e/ou pelo tratamento.1,2
Principais infecções associadas ao diabetes mellitusA tabela 1 mostra as principais infecções associadas ao diabetes mellitus.1–3
Principais infecções associadas ao diabetes mellitus
| Infecções que ocorrem com mais frequência em pacientes com DM |
| ‐ Infecções do trato respiratório: Streptococcus pneumoniae, influenza, tuberculose |
| ‐ Infecções de pele e partes moles |
| ‐ Infecções do trato urinário |
| ‐ Infecções periodontais |
| ‐ Infecções por Candida spp |
| ‐ Infecções cirúrgicas |
| Infecções com forte associação com diabetes |
| ‐ Otite externa maligna |
| ‐ Mucormicose rinocerebral |
| ‐ Fasceíte necrotizante |
| ‐ Gangrena de Fournier |
| ‐ Infecções enfisematosas |
| ‐ Infecções do pé diabético |
| ‐ Melioidose |
Considerando o foco de interesse do artigo, discutimos abaixo as infecções mais frequentes em pediatria e as mais associadas a diabetes em geral.
Infecções mais frequentes em crianças e adolescentes com diabetesInfecções respiratóriasAs infecções respiratórias são a principal causa de infecção em crianças, inclusive pacientes diabéticos. Os principais agentes etiológicos da infecção do trato respiratório inferior são o Streptococcus pneumoniae e os vírus respiratórios, inclusive o vírus influenza.
Embora a prevalência do estado de portador de Streptococcus pneumoniae em nasofaringe de crianças com diabetes não seja aumentada em relação a crianças eutróficas ou portadoras de outras doenças crônicas,9 alguns estudos já demonstraram que pacientes diabéticos são mais suscetíveis a infecções pneumocócicas e também apresentam maior risco de bacteremia, pior prognóstico e maior mortalidade nessas infecções.10 Existem poucos dados na literatura em crianças, mas, de forma geral, pacientes diabéticos apresentam chance maior de ser hospitalizados e de evoluir com complicações do que pacientes não diabéticos durante a estação de influenza.11
Infecções por Candida sppO diabetes é um fator de risco bem conhecido para candidíase. A localização mais comum é vulvo‐vaginal e o risco é maior, depende do tipo de DM, da gravidade e do grau de controle da glicemia. Pacientes com DM tipo 1 com hemoglobina glicada elevada e controle glicêmico inadequado têm maior probabilidade de ter colonização por Candida spp. A hiperglicemia prejudica a função dos neutrófilos, inclusive a capacidade de fagocitose, atua ainda como nutriente para a Candida. Pacientes com DM mal controlado têm maior atividade das proteinases ácidas, enzimas que facilitam a adesão do fungo à célula epitelial.12,13
Vários estudos mostram maior prevalência de colonização vaginal assintomática e de infecção sintomática por Candida spp. em mulheres diabéticas. A colonização vaginal em meninas diabéticas pré‐puberes é pouco frequente, por volta de 12,5%, pois os baixos níveis estrogênicos resultam numa rica flora anaeróbica, que inibe o crescimento de espécies de Candida. Essa colonização aumenta com a idade, chega a 55%. A espécie mais comumente encontrada é a Candida albicans, seguida pela Candida glabrata.12,13
O diagnóstico clínico em pacientes com candidíase vulvo‐vaginal se baseia nos sinais clínicos típicos, como secreção vaginal espessa esbranquiçada, prurido, dor, queimação, eritema e edema. Pacientes diabéticas podem apresentar quadros recorrentes, com até mais de quatro episódios ao ano. Quando houver recorrência, deve‐se fazer cultura da secreção vaginal para identificação da espécie de Candida.14
O tratamento pode ser tópico com clotrimazol ou cetoconazol ou sistêmico, com fluconazol em dose única. Nos casos de candidíase recorrente, o tratamento deve ser direcionado para a espécie isolada, pode ser tópico com creme de clotrimazol ou com fluconazol sistêmico por 10 a 14 dias. Nesses casos, recomenda‐se um esquema de manutenção com fluconazol, uma vez por semana, por, pelo menos, seis meses.14
Infecções periodontaisCrianças e adolescentes com DM1, especialmente mal controlado, têm prevalência duas a três vezes maior de infecção periodontal. O fator predisponente é a alteração da vascularização da gengiva, além do comprometimento imune.15
A periodontite pode levar à perda dos ligamentos, com mobilidade dos dentes e necessidade de extração. Podem ocorrer abscessos dentários e bacteremia.
Infecções do trato urinárioAs infecções do trato urinário (ITU) são mais prevalentes em indivíduos com DM e podem ocorrer complicações e manifestações graves.16
Alguns fatores contribuem para um maior risco de ITU: comprometimento da resposta imune do hospedeiro, esvaziamento vesical incompleto por neuropatia autonômica (no DM tipo 2), alteração do controle metabólico, visto que elevação de glicose na urina também favorece a colonização por microrganismos patogênicos. Os agentes mais frequentes são os mesmos da população geral: Eschericia coli e outras enterobactérias.16
As infecções mais comuns são bacteriúria assintomática, ITU inferior (cistite), ITU superior (pielonefrite) e urosepse. Também pode haver complicações: necrose papilar renal, cistite enfisematosa, abscesso renal.16
Muito se discute sobre bacteriúria assintomática em pacientes com diabetes. Apesar de mais prevalente,17 estudo randomizado controlado do tratamento antimicrobiano na bacteriúria assintomática mostrou que não há diferença no desenvolvimento de ITU, tempo para início dos sintomas, risco de pielonefrite ou necessidade de hospitalização.18 Dessa forma, apesar de controverso, parece não haver necessidade de rastreamento ou tratamento de bacteriúria assintomática nestes pacientes.
Infecções de pele e partes molesInfecções de pele e partes moles são frequentes em pessoas com diabetes, particularmente quando o controle glicêmico está inadequado. Podem ocorrer candidíase, infecções bacterianas, dermatomicoses, onicomicoses.
Nas infecções bacterianas (furunculose, celulites) os principais agentes são o Streptococcus pyogenes e o Staphylococcus aureus.
Infecções de partes moles profundas também correm com maior frequência em diabéticos, como piomiosite, fasceíte necrotizante e gangrena de Fournier.3
Infecções fortemente associadas ao diabetes, menos frequentes em pediatriaFasceíte necrotizanteÉ uma infecção rara e grave com alta mortalidade (50‐70%). O DM é a condição predisponente mais comumente associada a essa infecção, que acomete o tecido celular subcutâneo e a fáscia muscular, causa necrose extensa. Os sinais clínicos sugestivos são: lesão de pele com falência de resposta à antibioticoterapia inicial, tecido subcutâneo endurecido, com extensão além da área de pele envolvida, toxemia, lesões bolhosas, pele com áreas de necrose e equimoses, presença de crepitação. O quadro clínico inclui toxemia, febre, letargia, celulite (90% dos casos), edema (80%), alteração da coloração da pele ou gangrena (70%) e anestesia da área de pele envolvida. Tomografia computadorizada (TC) ou ressonância magnética (RM) podem mostrar edema que se estende além do plano fascial.3
Os locais mais acometidos são extremidades, parede abdominal e períneo. Quando acomete períneo, pênis ou escroto é chamada gangrena de Fournier.3
A intervenção cirúrgica é a principal terapêutica, com manutenção da antibioticoterapia até que os procedimentos cirúrgicos não sejam mais necessários, o paciente tenha melhoria clínica e esteja sem febre há mais de 48 horas. Geralmente a infecção é polimicrobiana e a primeira opção antimicrobiana é cefalosporina de terceira geração associada a metronidazol ou clindamicina.3
TuberculoseSegundo dados da Organização Mundial de Saúde, em 2017, 790.000 pacientes com tuberculose (TB) tinham diabetes e o número absoluto de TB associada ao DM já é semelhante ao da coinfecção TB‐HIV (vírus da imunodeficiência adquirida).19 No Brasil, o Ministério da Saúde avaliou a série histórica de TB de 2009 a 2017 e observou que o percentual de pessoas com TB que apresentam DM aumentou de 5,5% para 7,7%, o que representa um incremento médio anual de 3,9%.20
Embora dados publicados associando DM e tuberculose (TB) refiram‐se em sua maioria a DM2 no adulto, estudos com pacientes portadores de DM1 mostram redução da produção de IL‐1B em resposta ao Mycobacterium tuberculosis.21 Há também maior risco de TB em pacientes com DM1, que em algumas populações chega a ser três a quatro vezes maior do que nos controles não diabéticos, tanto em adolescentes como em adultos.22
Paciente com DM são mais facilmente infectados e podem evoluir mais rapidamente para tuberculose. O DM pode também afetar negativamente o curso da tuberculose, retardar a resposta microbiológica, reduzir a cura e aumentar a chance de recaídas.20 Dessa forma, é importante o rastreamento dos sintomas de TB e a identificação do sintomático respiratório nos pacientes com DM.20 Durante o tratamento de TB em pessoas com DM já estabelecido, deve ser dada especial atenção ao controle da glicemia.20
Otite externa malignaÉ é uma infecção invasiva do conduto auditivo externo e da base do crânio que ocorre em idosos com diabetes. Mais de 98% dos casos são causados por Pseudomonas aeruginosa. Raramente pode ser causada por Aspergillus spp. ou outros fungos. O fator predisponente é a microangiopatia do conduto auditivo.3
O quadro clínico é de cefaleia intensa, otalgia, otorreia, surdez, que pode durar meses a anos. Pode haver celulite no local, sinais neurológicos focais, paralisia de nervos cranianos, osteomielite dos ossos da base do crânio e da articulação temporo‐mandibular. Na otoscopia observa‐se tecido granuloso no conduto auditivo, sem acometimento da membrana timpânica. O tratamento deve ser sistêmico com antibióticos anti‐Pseudomonas, as quinolonas são os mais usados, por 6 a 8 semanas; e debridamento cirúrgico, se necessário.3
Infecções do sítio cirúrgicoA associação entre DM e infecções do sítio cirúrgico é bem conhecida e é atribuída à hiperglicemia pós‐operatória, mostra a importância do controle glicêmico adequado.
MucormicoseÉ um tipo raro de infecção causada por fungos das espécies Rhizopus e Mucor, que causam infecções em imunodeprimidos, com invasão dos vasos sanguíneos. A produção de cetona redutase pelo Rhizopus spp. permite seu crescimento em condições de hiperglicemia e acidose.3
São descritas formas rinocerebral, pulmonar, gastrointestinal, cutânea e disseminada. A forma rinocerebral é a mais frequente em pacientes com DM, além de ser a mais grave, com 80% de letalidade. Apresenta‐se com dor facial ou ocular, obstrução nasal, fadiga, febre. Pode haver lesões escurecidas intranasais. O diagnóstico é feito com biópsia das lesões. O tratamento é com anfotericina B ou voriconazol.3
Manejo do paciente com diabetes que apresenta infecçãoOs efeitos das doenças no diabetesA obtenção de um bom controle glicêmico em crianças e adolescentes com diabetes é fundamental para que não haja risco aumentado de apresentar infecções. Entretanto, nessa faixa etária é muito difícil de se atingir controle metabólico adequado, considerado atualmente como hemoglobina glicada abaixo de 7,0%.23
O maior estudo multicêntrico feito no Brasil, o Brazilian Diabetes type 1 Study Group (BrazDiab1SG), analisou os dados de 1.692 jovens (< 18 anos) com diagnóstico de DM1 e demonstrou controle glicêmico inadequado em sua grande maioria (87,1%). A HbA1c média foi de 9,4%, foi diferente de acordo com a classe social: alta=8,6±1,9%, média=9,1±2,1, baixa=9,4±2,4% e muito baixa=9,8±2,7% (p<0,001). As pacientes do sexo feminino apresentaram HbA1c média mais elevada (9,6±2,5%), quando comparadas aos do sexo masculino (9,2±2,4%); enquanto os adolescentes (13‐18 anos) tinham HbA1c mais elevada (9,9±2,2%), comparados às crianças menores de 13 anos (8,8±1,9%), com mais crianças atingindo a meta de HbA1c (29,2%), comparadas aos adolescentes (17,9%).24 Mesmo em países desenvolvidos a obtenção de bom controle é abaixo do desejável e alguns estudos sugerem que o percentual de pacientes fora da meta glicêmica esteja até aumentando.25
A associação em nosso meio, de pior controle metabólico com pacientes provenientes de classes socioeconômicas mais baixas, favorece o ciclo hiperglicemia – infecção – hiperglicemia. O achado, em crianças com DM, de baixas concentrações de IgG e redução da proteína 4 do complemento, variante B (C4B), relacionados a pior controle glicêmico, provavelmente fazem parte desse ciclo.26
É certo que infecções, mesmo as doenças típicas da infância, interferem de maneira importante no controle da glicemia. Decorrente do processo infeccioso há elevação de hormônios contrarreguladores, cortisol, epinefrina e hormônio do crescimento (GH), por aumento da neoglicogênese, glicogenólise e aumento da resistência insulínica. Esse aumento na resistência insulínica exige ajuste na dose de insulina que o paciente vem usando, tanto a basal quanto bólus. Geralmente há um período de horas ou dias até que essa necessidade seja percebida e o aumento da dose pode demorar para ser efetuado, o que gerahiperglicemia durante esse período.
A hiperglicemia mantida pode levar à elevação da produção de corpos cetônicos. A evolução desse quadro pode chegar até cetoacidose diabética (CAD), a principal causa de óbito em pacientes com DM1 jovens.27
Cuidados especiais com o paciente infectadoPara evitar a pioria metabólica e minimizar o risco de CAD, alguns cuidados práticos devem ser tomados quando houver quadro infecioso em uma criança ou adolescente com diabetes:
- ‐
Monitoração glicêmica mais frequente.
- ‐
Monitoração de cetonas (sérica ou urinária) – Importante relembrar que há três tipos de corpos cetônicos, acetona, B hidroxibutiraro (BOHB) e aceto acetato (AcAc). Em situações de descompensação a relação de BOHB:AcAc modifica do normal 1:1 para até 10:1. A maioria das fitas urinárias de detecção de cetona, bem como as dosagens laboratoriais, mede apenas o AcAc, pode mascarar a presença de cetonas no sangue, limitar a percepção da pioria metabólica. Por esse motivo, o ideal nessas situações de infecção é usar fitas reagentes que medem BOHB no sangue.
- ‐
Ajustar a dose de insulina – na grande maioria das vezes há necessidade de aumento de dose da insulina de 10–30%.
- ‐
Nunca parar totalmente de aplicar insulina – mesmo em situações de falta de ingesta alimentar –, pois a insulina é necessária para o metabolismo basal, que até pode estar aumentado em situações de stress.
- ‐
Manter hidratação com quantidades suficientes de sódio e água.
- ‐
Tratar o fator desencadeante.
Dentro da rotina de pacientes infectados e com necessidade de especial atenção e monitoração da glicemia, é importante ressaltar ainda os pacientes portadores de diabetes relacionado à fibrose cística (DRFC).28 A fibrose cística (FC) é a doença autossômica dominante mais comum entre brancos, identificada principalmente pelo seu quadro de infecções de repetição e perda progressiva de função pulmonar. O diagnóstico e a sobrevida desses pacientes têm aumentado, foi até incluída no teste do pezinho em vários estados do Brasil. Com isso temos observado o aparecimento de suas comorbidades, o diabetes é a mais precoce e mais prevalente, chega a acometer 50% da população portadora de FC por volta dos 30 anos, pico de incidência inicia na puberdade (10%).29 O DRFC em geral costuma ser de fácil controle, contudo requer insulinoterapia como tratamento, e o pediatra deve estar atento para intervir de maneira mais intensa nos momentos de internações por exacerbações pulmonares, quando há necessidade de aumento da dose de insulina.
Impacto das infecções associadas ao diabetes mellitus no sistema de saúdePacientes com DM frequentemente procuram atendimento médico e necessitam ser hospitalizados por infecções, trazem um impacto financeiro importante ao sistema de saúde.30,31 Dados nacionais mostram que o custo médio da hospitalização de adultos com DM é 19% mais elevado do que a hospitalização sem DM.32
Estudo recente avaliou o número de crianças e adolescentes com DM tipo 1 e tipo 2 que procuraram atendimento médico para tratamento de infecções, bem como o impacto socioeconômico, entre 2008 e 2014. As infecções responderam por 30% dos custos (US$ 255 milhões/ano) das visitas médicas e hospitalizações, enquanto foram responsáveis por apenas 14% das visitas. As causas mais frequentes foram as infecções respiratórias, seguidas pelas infecções de pele e partes moles.30
Vacinação no paciente com diabetes mellitusA vacinação dos pacientes com DM é uma estratégia fundamental para a redução da morbidade e mortalidade por doenças infecciosas. As infecções também são responsáveis por desencadear complicações do diabetes, como hipoglicemia e cetoacidose.4
Algumas doenças imunopreveníveis apresentam maior frequência e gravidade em pacientes com DM. Além das infecções pneumocócicas e da influenza, esses pacientes estão potencialmente expostos a infecção pelo vírus da hepatite B em decorrência dos procedimentos relacionados ao tratamento e controle da doença, em especial a monitoração da glicemia capilar. Um estudo mostrou que pacientes adultos com DM apresentam risco 1,5 a 2 vezes maior de contrair hepatite B quando comparados àqueles sem a doença na mesma faixa etária.33
Além das vacinas que fazem parte do Calendário Nacional de Vacinação do Ministério da Saúde do Brasil, as vacinas influenza, pneumococo (polissacarídica 23‐valente) e Haemophilus influenzae tipo b estão disponíveis, por meio dos Centros de Referência em Imunobiológicos Especiais (Cries).34
Vacina hepatite BO esquema habitual para imunocompetentes consiste em três doses, com intervalos de um mês entre a primeira e a segunda dose e seis meses entre a primeira e a terceira dose (zero, um e 6 meses). O Brasil adota hoje para o esquema básico de vacinações de quatro doses, a primeira de hepatite B monovalente ao nascimento, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, e as demais na forma de vacina Penta (DTP, Hib, HB) aos 2, 4 e 6 meses. Para as demais idades adota‐se o esquema de três doses, zero, um e 6 meses. A vacina hepatite B pode ser aplicada simultaneamente ou com qualquer intervalo com as outras vacinas do Programa Nacional de Imunizações brasileiro para todas as faixas etárias.
Em pacientes com DM, recomenda‐se fazer a sorologia (Anti‐Hbs) após 30 a 60 dias da última dose. Aqueles que não responderem com nível adequado de anticorpos devem ser revacinados com mais três doses de vacina. Aqueles que permanecerem anti‐HBs negativos após dois esquemas completos de três doses devem ser considerados não respondedores e suscetíveis, em caso de exposição.
Vacina influenzaDeve ser aplicada anualmente, a partir dos 6 meses. Crianças com menos de 9 anos, ao receber a vacina pela primeira vez, requerem duas doses com intervalo de 4 a 6 semanas. Apenas uma dose anual é suficiente nas vacinações subsequentes.
Vacina pneumocócicaA vacina pneumocócica 10‐valente (Pnc10) é oferecida a partir dos 2 meses, até 59 meses (tabela 1). A vacina pneumocócica 23‐valente (Pnc10) pode ser administrada a partir dos 2 anos em todas as faixas etárias7, e é feita em duas doses, com intervalo de 5 anos (tabela 2).
Esquema de vacinação pneumocócica, conforme a idade
| Faixa etária de início | Esquema primário | Reforços | |
|---|---|---|---|
| Pnc10 | Pnc10 | Pn23 | |
| 2 a 6 meses | Três doses (zero/2/4 meses) | De 12 a 15 meses | A partir de 2 anos |
| 7 a 11 meses | Duas doses (zero/2 meses) | De 12 a 15 meses | Primeira dose, pelo menos 6 a 8 semanas após a última dose da Pnc10 |
| 12 a 59 meses | Duas doses (zero/2 meses) | Nenhum | Segunda dose, cinco anos após a primeira dose de Pn23 |
É oferecida a partir dos 2 meses, até 19 anos (tabela 3). A Sociedade Brasileira de Imunizações (SBIm) recomenda que pacientes com diabetes sejam imunizados com as vacinas hepatite B, influenza, pneumococo (conjugada 13‐valente e polissacarídica 23V), Haemophilus influenzae tipo b, varicela e herpes zoster.35
Esquema de vacinação Haemophilus influenzae tipo b
| Idade | Esquema primário |
|---|---|
| 2 a 6 meses | Três doses (com intervalo de 60 dias) |
| 7 a 11 meses | Duas doses (4 a 8 semanas de intervalo) |
| 12 a 59 meses | Duas doses (4 a 8 semanas de intervalo) se imunodeprimido.Dose única, se imunocompetente. |
| 5 anos a 19 anos | Duas doses (4 a 8 semanas de intervalo) se imunodeprimido.Dose única, se imunocompetente. |
Apesar do aumento do risco de doenças passíveis de prevenção por vacinas, e das recomendações internacionais de vacinação, vários estudos nacionais mostraram que a cobertura vacinal dos pacientes com DM para as vacinas recomendadas pelo Programa Nacional de Imunização está abaixo do ideal, mostra a vulnerabilidade desse grupo a uma gama considerável de doenças imunopreveníveis, bem como a necessidade de ampliação de estratégias de imunização para esses pacientes.36–40 Essa redução na taxa vacinal parece ser um fenômeno global, inclusive a faixa etária pediátrica. Estudos mostram que a taxa de vacinação em crianças com DM é mais baixa do que em crianças eutróficas e até do que em crianças com outras doenças crônicas, a desinformação é a principal causa da não‐vacinação.41
ConclusãoO paciente pediátrico com diabetes apresenta algumas alterações do sistema imune que, quando associadas a elevado controle glicêmico, aumentam o risco de infecções e da sua gravidade, devem ser identificadas e tratadas prontamente. A presença de quadro infeccioso, por sua vez, eleva a glicemia e aumenta o risco de descompensações, deve o pediatra estar atento para intensificar os cuidados com monitoração e insulina e evitar o risco de cetoacidose diabética. A vacinação não tem sido feita de forma completa nos pacientes com diabetes. A atenção às vacinas para esses pacientes é de fundamental importância, auxilia muito na redução de riscos de infecções e consequente descontrole da glicemia.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Calliari LE, Almeida FJ, Noronha RM. Infections in children with diabetes. J Pediatr (Rio J). 2020;96(S1):39–46.