Intussusception surveillance was initiated after the nationwide introduction of live attenuated monovalent rotavirus vaccine (RV1). The objective is to assess the epidemiology of intussusception and compare the number of cases before and after the introduction of rotavirus vaccine.
MethodsCases of intussusception occurring between March 2006 and January 2008 were identified through a prospective enhanced passive surveillance system established in sentinel state hospitals. Retrospective review of medical records was used to identify cases, which occurred in sentinel hospitals between January 2001 and February 2006.
ResultsFrom 2001‐2008, 331 intussusception cases were identified, 59.5% were male, with peak incidence among those 18‐24 weeks of age. Overall<10% of cases were among infants 6‐14 weeks of age (when the first dose of RV1 is administered). The most frequently observed signs or symptoms of intussusception included vomiting (89.4%), bloody stool (75.5%), and abdominal distention (71.8%). A majority (92.1%) of the case‐patients required surgery for treatment; 31.8% of those who underwent surgery required bowel resection, and 13 (3.9%) died. Among the 21 hospitals that reported cases throughout the entire surveillance period (2001‐2008), the number of intussusception events during 2007 (n=26) and 2008 (n=19) was not greater than the average annual number (n=31, range 24–42) during baseline years 2001‐2005.
ConclusionsAlthough this analysis did not identify an increase in intussusception cases during the two years after RV1 introduction, these results support the need for special epidemiologic methods to assess the potential link between rotavirus vaccine and this very rare adverse event.
A vigilância da intussuscepção foi iniciada após a introdução da vacina monovalente viva atenuada contra rotavírus (RV1) em todo o país. O objetivo é avaliar a epidemiologia da intussuscepção e comparar a quantidade de casos antes e depois da introdução da vacina contra rotavírus.
MétodosOs casos de intussuscepção entre março de 2006 e janeiro de 2008 foram identificados por meio de um sistema de vigilância passivo prospectivo aprimorado estabelecido em hospitais‐sentinela estaduais. A análise retrospectiva de prontuários médicos foi usada para identificar os casos que ocorreram em hospitais‐sentinela entre janeiro de 2001 e fevereiro de 2006.
ResultadosDe 2001‐2008, identificamos 331 casos de intussuscepção, 59,5% dos quais ocorreram em pacientes do sexo masculino, com pico de incidência entre aqueles com 18‐24 semanas de idade. Em geral,<10% dos casos ocorreram entre neonatos com 6‐14 semanas de idade (quando a 1a dose de RV1 é administrada). Os sinais ou sintomas de intussuscepção observados com mais frequência incluíam vômito (89,4%), fezes com sangue (75,5%) e distensão abdominal (71,8%). A maioria (92,1%) dos pacientes precisou de cirurgia para o tratamento; 31,8% dos que se submeteram à cirurgia precisaram de ressecção intestinal e 13 (3,9%) vieram a óbito. Entre os 21 hospitais que relataram casos durante todo o período de vigilância (2001‐2008), a quantidade de casos de intussuscepção em 2007 (n=26) e 2008 (n=19) não foi maior do que a quantidade média anual (31, faixa de 24‐42) durante os anos‐base de 2001‐2005.
ConclusõesEmbora esta análise não tenha identificado um aumento nos casos de intussuscepção nos dois anos após a introdução da RV1, esses resultados justificam a necessidade de métodos epidemiológicos especiais para avaliar a possível associação entre a vacina contra rotavírus e esse evento adverso muito raro.
O rotavírus é a principal causa de diarreia grave, representa ∼ 453.000 óbitos anualmente entre crianças com<5 anos em todo o mundo.1 A Organização Mundial de Saúde (OMS) recomendou a introdução global de uma das duas vacinas licenciadas contra o rotavírus [RotaTeq ou RV5 (Merck®, PA, EUA) e Rotarix ou RV1 (Rotarix®, GlaxoSmithKline Biologicals, Rixensart, Bélgica)] nos programas nacionais de imunização para a prevenção da doença grave por rotavírus.2 Em março de 2006, o Ministério da Saúde introduziu a RV1, vacina monovalente viva atenuada derivada da cepa humana G1P[8], em todos os 27 estados por meio de seu Programa Nacional de Imunização (PNI).
Um problema importante nos programas de imunização com vacina contra rotavírus é a necessidade do monitoramento da segurança a respeito da intussuscepção, forma de obstrução intestinal que ocorre a uma taxa histórica de aproximadamente 50 em 100.000 neonatos.3 Descobriu‐se que uma vacina contra rotavírus anterior (Rotashield, Wyeth Vaccines, PA, EUA) com base em uma cepa diferente (rhesus) das vacinas atualmente recomendadas pela OMS estava associada a um risco maior de intussuscepção: ∼ 10 casos a mais a cada 100.000 neonatos vacinados.4 Grandes ensaios clínicos não detectaram um risco de intussuscepção associado a quaisquer das vacinas atualmente usadas;5,6 contudo, a vigilância após a autorização no México e na Austrália observou um pequeno risco de intussuscepção após a 1ª dose.7,8 No México, foi encontrada uma associação entre a RV1 e a intussuscepção: a vacina causou 1‐4 casos de intussuscepção a mais a cada 100.000 neonatos vacinados.8,9 Na Austrália, uma possível aglomeração temporal de episódios de intussuscepção foi observada durante os sete dias após a 1a dose tanto da RV1 quanto da RV5, embora não tenha havido aumento no risco geral em 12 meses de idade.7 No Brasil, não foi identificado aumento no risco após a primeira dose, porém um possível baixo risco foi identificado após a segunda dose de RV1 (1,5 caso a mais a cada 100.000 neonatos vacinados).9 Não foi identificado aumento no risco de intussuscepção após o uso de RV5 nos Estados Unidos, porém um risco maior de menos de um em 65.000 neonatos vacinados não foi excluído.10 As quedas marcadas em diarreia grave e fatal foram demonstradas em países que adotaram a vacina com antecedência após a introdução da vacina contra rotavírus.11 Como os benefícios comprovados da vacinação superaram com folga o baixo risco de intussuscepção observado em alguns ambientes, as agências reguladoras continuaram a recomendar a vacinação contra o rotavírus a todas as crianças do mundo.2 O monitoramento contínuo após a autorização da segurança e da eficácia das vacinas contra rotavírus é fundamental para avaliar o perfil de risco‐benefício das vacinas contra rotavírus.
Nosso objetivo era monitorar e caracterizar os casos de intussuscepção em um subgrupo de hospitais que participam deste estudo e comparar o número de casos de intussuscepção antes e depois da introdução da vacina contra rotavírus.
Material e métodosDefinição de caso de intussuscepçãoOs casos de intussuscepção foram definidos como residentes no Estado de São Paulo, com menos de um ano e diagnosticados com base no Nível I de certeza diagnóstica, conforme definido pelos critérios do Grupo de Trabalho Colaborativo em Intussuscepção da Universidade de Brighton.12 O diagnóstico de intussuscepção é classificado como de Nível 1 caso confirmado por enema opaco com ar ou bário, ultrassom (com redução confirmada em ultrassom ou enema posteriores), cirurgia ou necropsia.
Ambiente e fontes de dadosSão Paulo é um estado brasileiro altamente industrializado. Também é o mais populoso: mais de 41 milhões de pessoas (41.579.695 em 2011). A coorte de recém‐nascidos tem diminuído ao longo dos últimos anos. Em 2001, 686.533 crianças nasceram em São Paulo, ao passo que 605.558 nasceram em 2008.13 A cobertura de vacinas de duas doses contra rotavírus entre crianças com menos de um ano atingiu 85,1% em 2007 e 86,3% em 2008.14 No Estado de São Paulo existem 9.549 leitos pediátricos clínicos e 1.048 leitos pediátricos cirúrgicos distribuídos pelos 893 hospitais públicos e privados.
Os dados sobre intussuscepção foram obtidos de 58 hospitais no Estado de São Paulo de 2001 até 2008. Esses hospitais‐sentinela foram escolhidos dentre aqueles com serviços de cirurgia pediátrica que atendiam como os principais hospitais para onde pacientes com obstrução intestinal eram encaminhados em cada região metropolitana ou grupos de municípios (fig. 1). Nem todos esses hospitais fizeram vigilância durante todo o período do estudo, 2001‐2008. Assim, para comparar os períodos pré‐ e pós‐vacina, usamos apenas dados de 21 dos 58 hospitais que faziam vigilância de intussuscepção em todo o período de 2001‐2008. Esses hospitais tinham 10,2% dos leitos pediátricos clínicos e 12,7% dos leitos pediátricos cirúrgicos do Estado de São Paulo, porém representaram 30% dos diagnósticos de alta de obstrução intestinal identificados entre crianças com menos de um ano internadas em hospitais públicos de São Paulo de 2001 a 2005.
Foram usadas duas abordagens para averiguar casos de intussuscepção. Para estabelecer uma referência pré‐vacina, os casos de intussuscepção internados entre janeiro de 2001 e fevereiro de 2006 foram identificados em cada hospital‐sentinela por meio de análise retrospectiva de diagnósticos de alta codificados como obstrução intestinal (K56) de acordo com a Classificação Internacional de Doenças, 10° edição (CID‐10) e diagnósticos de intussuscepção em livros de registro radiológicos ou cirúrgicos. A busca foi feita em 2006 e os dados foram obtidos a partir de prontuários médicos com formulários padronizados. Os casos que ocorreram entre março de 2006 e dezembro de 2008 foram identificados por meio de um sistema de vigilância prospectiva estabelecido em hospitais‐sentinela estaduais privados e públicos. A equipe médica e cirúrgica em hospitais‐sentinela participou de um treinamento inicial na identificação de casos de intussuscepção com a definição de caso Nível I validada da Universidade de Brighton. Foi pedido que a equipe do hospital, principalmente cirurgiões pediátricos, informasse casos eletronicamente com um formulário padrão de coleta de dados. Visitas e ligações periódicas eram feitas no hospital para incentivar os relatos e resolver preocupações. Uma análise periódica de registros cirúrgicos e radiológicos era feita para garantir a completude dos relatórios.
Análise estatísticaResumimos as características demográficas e clínicas de casos de pacientes de todos os hospitais com estatísticas descritivas. Para examinar possível variação sazonal e distribuição etária de casos de intussuscepção, traçamos a quantidade de internações por intussuscepção em São Paulo por ano e semana de idade. Nessa análise, usamos casos de todos os 58 hospitais de vigilância.
Também nos interessamos por mudanças na quantidade de casos de intussuscepção antes e depois da introdução da vacina. Assim, traçamos a quantidade de casos de intussuscepção por ano nesses 21 hospitais que fizeram vigilância durante todo o período de 2001‐2008. Como a abrangência da vacina contra o rotavírus entre neonatos foi alta após 2006,14 comparamos o número de casos de intussuscepção em 2007 e 2008 com o número médio anual de casos durante os anos‐base de 2001‐2005, consideramos 2006 um ano de transição, quando a vacina contra o rotavírus foi introduzida. Também traçamos o número de casos de intussuscepção desses 21 hospitais por ano civil, de acordo com quatro faixas etárias:<6 semanas, 6‐14 semanas, 15‐24 semanas e 25‐52 semanas. Todas as análises estatísticas foram feitas com o Epi‐Info 3.5.1 (Epi Info™, GA, EUA) e o Microsoft Excel 2007 (Microsoft®, WA, EUA).
ÉticaO estudo foi aprovado pelo Comitê de Ética da Irmandade da Santa Casa de Misericórdia de São Paulo, número de registro 38053.
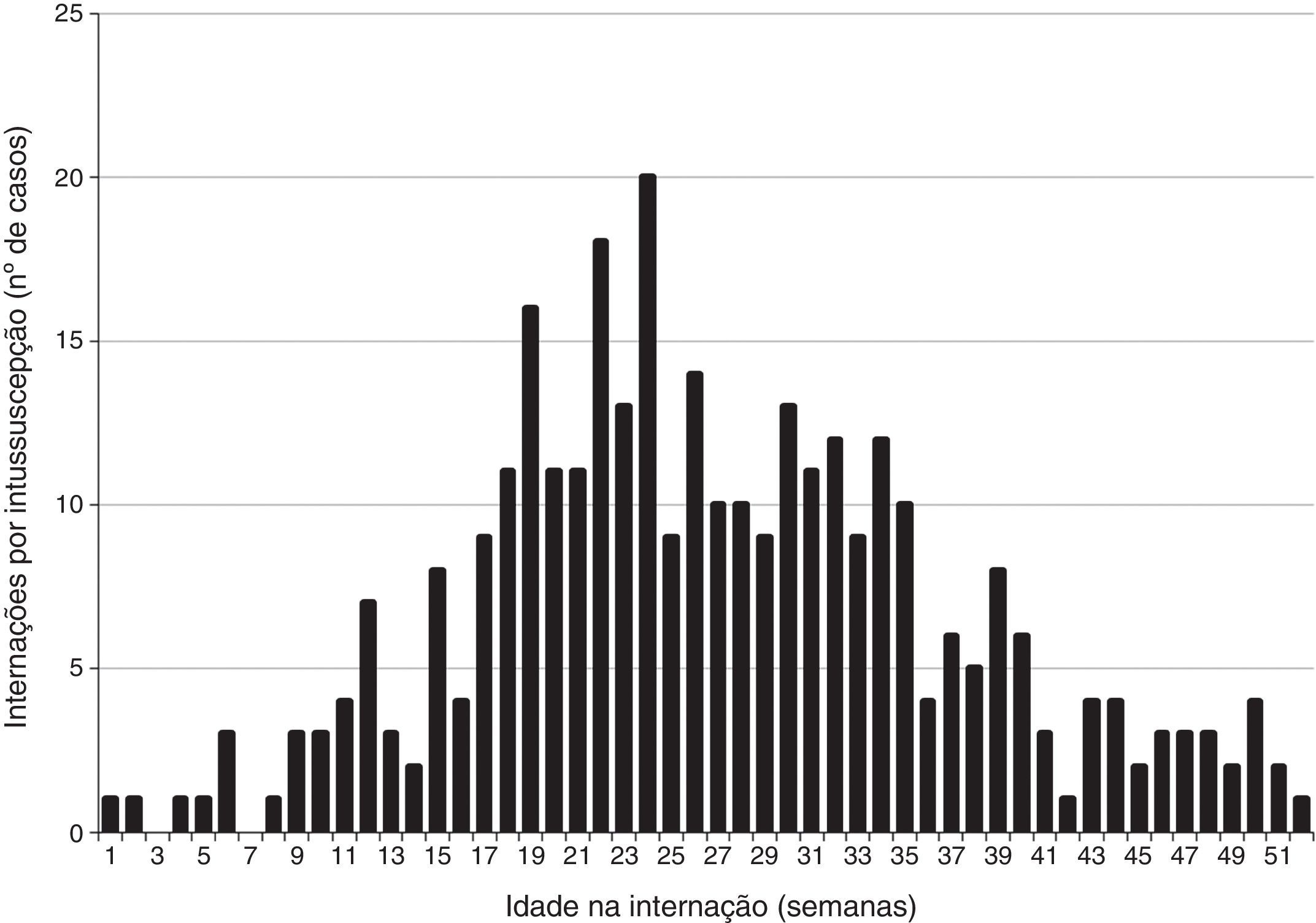
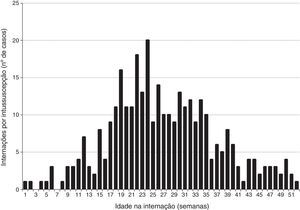
ResultadosCaracterísticas clínicas e demográficas dos casosEntre 2001 e 2008 identificamos 331 casos de intussuscepção no Estado de São Paulo (fig. 1). Ocorriam com maior probabilidade em neonatos do sexo masculino (59,5%) e com idade média de 26 semanas (tabela 1), com pico de incidência em neonatos com 18‐24 semanas (fig. 2). Apenas 9,1% dos casos de intussuscepção ocorreram entre crianças com<15 semanas, quando a 1ª dose da vacina contra rotavírus normalmente é administrada no Brasil, ao passo que 36,6% ocorreram entre crianças com 15‐24 semanas, quando a 2ª dose da vacina contra rotavírus normalmente é administrada, e 54,4% entre crianças com 25‐52 semanas. Os casos de intussuscepção ocorreram durante o ano todo sem evidência de pico sazonal (dados não apresentados).
Características demográficas e clínicas de casos de intussuscepção internados. Estado de São Paulo, Brasil, 2001 a 2008 (n=331)
| Casos de intussuscepção | |
|---|---|
| Sexo masculino n (%) | 197 (59,5) |
| Idade (semanas) | |
| Mediana | 26 |
| Faixa | 1‐52 |
| Duração dos sintomas antes da internação (dias) | |
| Mediana | 1 |
| Faixa | 0‐7 |
| Sinais e sintomas, número total (%)a | |
| Vômito | 288/322 (89,4) |
| Fezes com sangueb | 191/253 (75,5) |
| Distensão abdominal | 183/255 (71,8) |
| Hematoqueziac | 182/293 (62,1) |
| Sangue detectado no exame retal | 113/202 (55,9) |
| Palidez | 123/234 (52,6) |
| Febre | 135/307 (44,0) |
| Massa abdominal | 105/273 (38,5) |
| Letargia | 69/223 (30,9) |
| Massa retal | 30/209 (14,4) |
| Método de diagnóstico (%) | |
| Ultrassom | 146 (44,1) |
| Enema opaco | 71 (21,5) |
| Cirurgia | 113 (34,1) |
| Necrópsia | 1 (0,3) |
| Tratamento definitivo (%) | |
| Enema com ar ou opaco | 26 (7,9) |
| Cirurgia abdominal | 305 (92,1) |
| Sem ressecção intestinal | 159 (52,1) |
| Com ressecção intestinal | 97 (31,8) |
| Desconhecida | 49 (16,1) |
| Duração da internação – dias | |
| Mediana | 5 |
| Faixa | 0‐76 |
| Óbito (%) | 13/331 (3,9) |
Os sinais ou sintomas observados com mais frequência (tabela 1) incluíam vômito (89,4%), fezes com sangue (75,5%) e distensão abdominal (71,8%). A duração média dos sintomas antes do atendimento médico foi de ∼ 1 dia. O diagnóstico de intussuscepção foi feito por ultrassonografia, enema opaco e cirurgia em 44,1%, 21,5% e 34,1% dos pacientes, respectivamente. A maioria (92,1%) dos pacientes recebeu tratamento cirúrgico para intussuscepção e pelo menos 31,8% dos pacientes submetidos a cirurgia precisaram de ressecção intestinal. Entre os 331 pacientes internados para intussuscepção durante o período do estudo, 13 (3,9%) vieram a óbito. Entre os sobreviventes, a duração média de internação foi de ∼ 5 dias (faixa: 0‐76 dias).
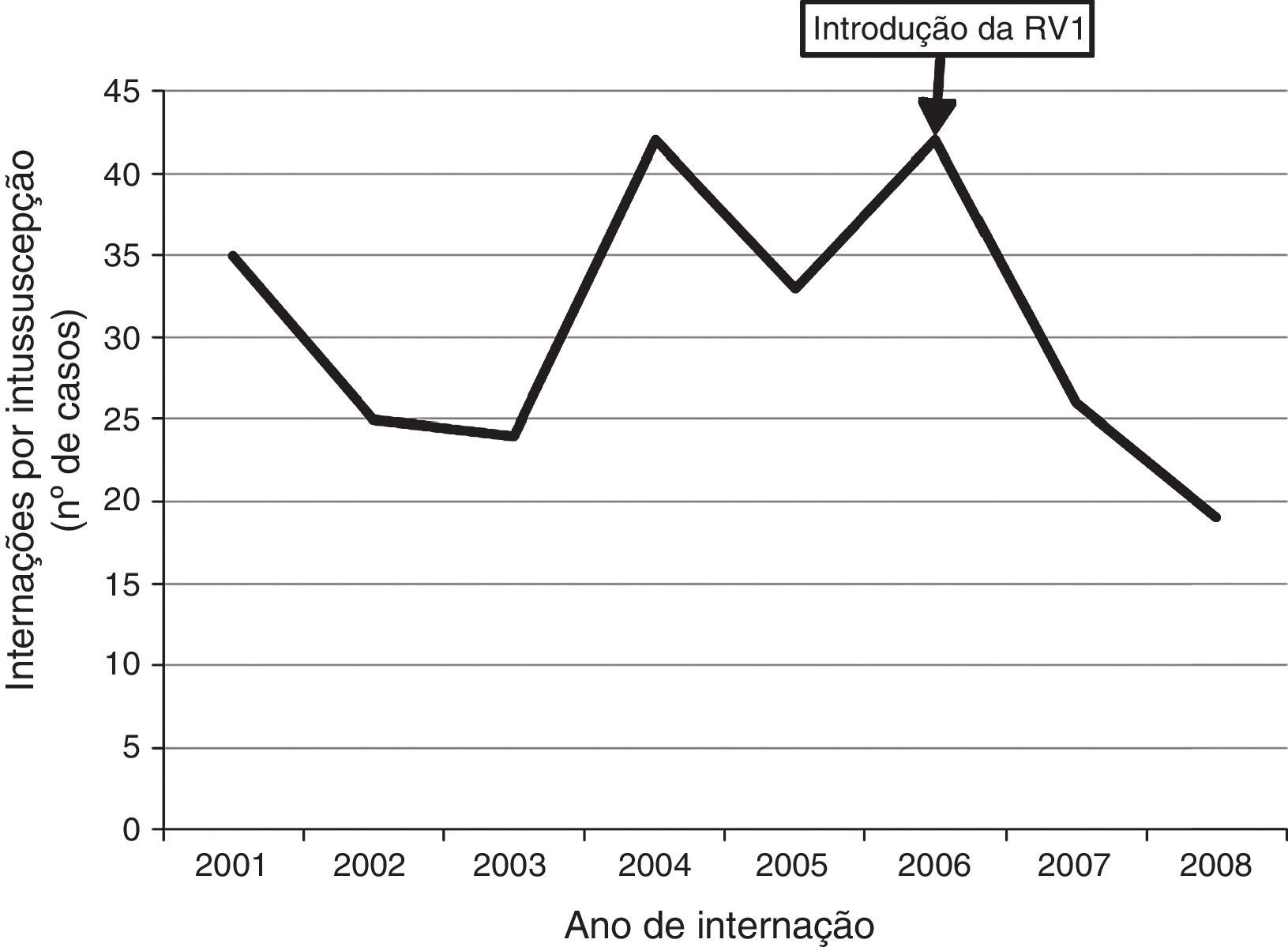
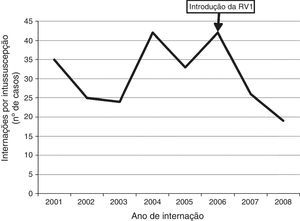
Distribuição temporal de casosEntre os 331 pacientes, 246 (74,3%) eram de 21 hospitais que identificaram e relataram intussuscepção durante todo o período de vigilância de 2001‐2008. As características demográficas e clínicas em geral dos casos desses 21 hospitais eram semelhantes àquelas dos casos de hospitais que relataram casos apenas em parte do período de vigilância (dados não apresentados). Ao restringir a análise aos casos dos 21 hospitais com relatos estáveis durante todo o período de vigilância de 2001‐2008, não observamos um aumento no número de casos de intussuscepção relatados durante o período de vigilância posterior à introdução da vacina. O número de casos de intussuscepção observados em 2007 (n=26) e 2008 (n=19) foi, de certa forma, inferior ao número médio anual de casos de intussuscepção (n=32 casos por ano, faixa de 24‐42 casos por ano) em 2001‐2005 (fig. 3).
DiscussãoOs esforços para gerar capacidade de monitoramento de intussuscepção pela Divisão de Imunização do Estado de São Paulo identificaram várias lições importantes para os futuros esforços de monitoramento de segurança da vacina contra rotavírus no Brasil. Primeiro, a distribuição etária de intussuscepção em São Paulo é semelhante à de outras regiões do mundo, com<10% dos casos entre crianças com<15 semanas.15–17 Nessa idade, normalmente é administrada a primeira dose da vacina contra rotavírus – dose com o maior risco potencial de intussuscepção. Esse achado indica que seria necessário expandir a vigilância para um grande número de hospitais a fim de identificar casos suficientes para avaliar o risco de intussuscepção depois de uma dose de vacinação contra o rotavírus. Um aumento quatro a cinco vezes maior do risco de intussuscepção em relação ao histórico pode não ser detectado ao avaliar tendências de intussuscepção entre todos os neonatos com menos de um ano, que normalmente apresentam taxas históricas de ∼ 40‐50 em 100.000.18 Segundo, a cirurgia é o tratamento mais comum para a intussuscepção no Brasil em comparação com ambientes mais desenvolvidos, em que o tratamento não cirúrgico com enema com ar/opaco é usado mais frequentemente.19–21 Esse achado tem implicações em ambientes pobres em recursos no sentido de que uma rede de contatos com cirurgiões e hospitais com centros cirúrgicos poderia aprimorar a vigilância da intussuscepção após a introdução da vacina. Terceiro, embora tenha sido feita uma interpretação cautelosa, não observamos um aumento substancial na quantidade de casos de intussuscepção durante o período após a introdução da vacina, quando cerca de 85% dos neonatos receberam vacinação no Brasil.
O Brasil foi um dos países que adotaram a vacina com antecedência e que documentaram grandes reduções nas internações e nos óbitos relacionados a diarreia entre crianças com menos de cinco anos desde a introdução de uma vacina contra rotavirus.14 Embora ensaios clínicos de vacinas contra rotavírus não tenham identificado um risco maior de intussuscepção relacionado à vacina, avaliações após a autorização no México e na Austrália constataram baixo risco depois da primeira dose de ambas as vacinas contra rotavírus, totalizando ∼ 1 a 4 casos a mais de intussuscepção a cada 100.000 crianças vacinadas.7–9 Embora tenha sido feita uma interpretação cautelosa, como nossa vigilância não pretendia quantificar o risco de intussuscepção associado à RV1, ficamos tranquilizados pela ausência de um grande aumento em casos de intussuscepção em um nível populacional após a introdução da vacina no Estado de São Paulo, Brasil.
A análise de tendências não pode excluir um risco de magnitude semelhante àquele observado no México e na Austrália após a 1ª dose, principalmente porque as taxas históricas de intussuscepção são muito baixas (∼ 10‐20 em 100.000 neonatos durante as semanas 6‐12, quando a primeira dose é administrada no Brasil).3,9 Pode ser útil avaliar as tendências em faixas etárias estreitas, porém o tamanho da amostra normalmente é insuficiente para excluir o risco com segurança, mesmo em conjuntos de dados nacionais de países com grandes coortes de natalidade, como os Estados Unidos.3
Seria necessário fazer estudos epidemiológicos analíticos, como os que usam o método de série de casos ou caso‐controle, para avaliar a magnitude do risco de 1‐2 eventos adversos excedentes a cada 100.000 crianças vacinadas. As plataformas de vigilância semelhantes às estabelecidas pelo Estado de São Paulo são o eixo principal desses estudos epidemiológicos. A busca por casos de intussuscepção permanece ativa e independe da situação da vacinação. De fato, vários desses hospitais de São Paulo melhoraram e deram continuidade à vigilância como parte de um estudo de âmbito nacional no Brasil que avaliou o risco de intussuscepção após a RV1 com o modelo de série de casos e caso‐controle autocontrolados. Nesse estudo de âmbito nacional, nenhum risco de intussuscepção foi encontrado após a primeira dose da vacina contra rotavírus no Brasil, porém um risco de nível baixo foi detectado após a segunda dose.9 Iniciar esse tipo de vigilância hospitalar ativa de resultados específicos como intussuscepção seria importante para o monitoramento da segurança em outros ambientes sem qualquer plataforma nacional de monitoramento da segurança existente, principalmente com relação à geração de capacidade de monitoramento da segurança e estabelecimento de plataformas que possam ser usadas em estudos especializados para avaliar o risco à medida que surgirem novas preocupações de segurança.
Em nossa coorte, 90% dos casos de intussuscepção precisaram de cirurgia. Esse dado é comparável a padrões de tratamento em ambientes pobres em recursos, ao passo que em países industrializados apenas 10‐50% dos pacientes precisam de tratamento cirúrgico.15,19–21 As razões para as taxas elevadas de tratamento cirúrgico entre os casos é tema para uma futura investigação. Os atrasos no atendimento e no tratamento também poderão explicar o aumento da mortalidade intra‐hospitalar de 4‐5% em algumas regiões do Brasil9 e ∼ 12‐13% na África,15 em comparação com 1% no México9 e<1% em países industrializados.19–21 Melhorar o diagnóstico e a intervenção precoce com técnicas de redução não invasivas pode reduzir a morbidez e a mortalidade no Brasil. É necessário fazer estudos adicionais que identifiquem fatores de risco de resultados graves com relação à intussuscepção no Brasil.
Essa avaliação tem várias limitações. Primeiro, nosso estudo considerou serviços de sentinela. Os casos relatados não representam todos os casos de intussuscepção do Estado de São Paulo durante o período estudado. Os serviços selecionados têm 30% dos leitos pediátricos do sistema público de saúde do Estado de São Paulo, que abrange ∼ 60% das pessoas. Sem um denominador populacional preciso, não podemos calcular incidências. Os resultados em números absolutos podem ser influenciados por mudanças populacionais, como queda na taxa de natalidade ao longo do tempo. Segundo, usar métodos de vigilância diferentes antes e depois da introdução da vacina limita nossa capacidade de comparar com confiança a taxa de eventos entre os dois períodos, principalmente por causa de diferenças nos métodos de averiguação de casos. Nossos resultados apenas não podem ser usados para refutar uma associação casual entre a vacinação contra o rotavírus e intussuscepção e não podem ser comparados diretamente com dados de monitoramento após a autorização no México e na Austrália.7,8 Terceiro, o histórico de vacinação dos casos não estava disponível. Ademais, a completude e a precisão dos dados que descrevem o quadro clínico e o manejo de casos de intussuscepção refletem a completude dos relatórios em prontuários médicos. Quarto, a intussuscepção é um evento raro, principalmente entre neonatos com menos de três meses; mudanças relativamente pequenas em números absolutos em faixas etárias mais estreitas, como neonatos entre 6‐14 semanas, podem resultar em um aumento ou redução na tendência por acaso. Por último, a vigilância hospitalar pode não representar todos os casos de intussuscepção, principalmente em ambientes pobres em recursos, nos quais o acesso a tratamento e instalações de diagnóstico pediátrico é limitado.
Desde 2006, as vacinas contra o rotavírus foram introduzidas em mais de 30 países.22 Embora os benefícios da vacinação contra o rotavírus em termos de redução de diarreia grave e fatal tenham superado com folga o baixo risco de intussuscepção, o monitoramento contínuo de intussuscepção após a introdução da vacina é importante para garantir a segurança da vacina e manter a confiança pública no programa de vacinação contra rotavírus. Nossa experiência em estabelecer vigilância de intussuscepção no monitoramento após a autorização da segurança da vacina contra rotavírus em São Paulo deve fornecer informações valiosas para outros países semelhantes que estão introduzindo a vacina contra rotavírus e não têm sistemas de monitoramento de segurança existentes.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Fernandes EG, Leshem E, Patel M, Flannery B, Pellini AC, Veras MA, et al. Hospital‐based surveillance of intussusception among infants. J Pediatr (Rio J). 2016;92:181–7.