Staphylococcus aureus is responsible for a large number of infections in pediatric population; however, information about the behavior of such infections in this population is limited. The aim of the study was to describe the clinical, epidemiological, and molecular characteristics of infections caused by methicillin‐susceptible and resistant S. aureus (MSSA–MRSA) in a pediatric population.
MethodA cross‐sectional descriptive study in patients from birth to 14 years of age from three high‐complexity institutions was conducted (2008–2010). All patients infected with methicillin‐resistant S. aureus and a representative sample of patients infected with methicillin‐susceptible S. aureus were included. Clinical and epidemiological information was obtained from medical records and molecular characterization included spa typing, pulsed‐field gel electrophoresis (PFGE), and multilocus sequence typing (MLST). In addition, staphylococcal cassette chromosome mec (SCCmec) and virulence factor genes were detected.
ResultsA total of 182 patients, 65 with methicillin‐susceptible S. aureus infections and 117 with methicillin‐resistant S. aureus infections, were included in the study; 41.4% of the patients being under 1 year. The most frequent infections were of the skin and soft tissues. Backgrounds such as having stayed in day care centers and previous use of antibiotics were more common in patients with methicillin‐resistant S. aureus infections (p≤0.05). Sixteen clonal complexes were identified and methicillin‐susceptible S. aureus strains were more diverse. The most common cassette was staphylococcal cassette chromosomemec IVc (70.8%), which was linked to Panton-Valentine leukocidin (pvl).
ConclusionsIn contrast with other locations, a prevalence of infections in children under 1 year of age in the city could be observed; this emphasizes the importance of epidemiological knowledge at the local level.
O Staphylococcus aureus é responsável por um grande número de infecções na população pediátrica; contudo, as informações sobre o comportamento dessas infecções nessa população são limitadas. O objetivo do estudo foi descrever as características clínicas, epidemiológicas e moleculares de infecções causadas por Staphylococcus aureus suscetíveis e resistentes à meticilina (MSSA-MSRA) em uma população pediátrica.
MétodoUm estudo transversal descritivo foi realizado em pacientes entre 0 e 14 anos de idade de três instituições de alta complexidade (2008-2010). Todos os pacientes infectados com S. aureus resistentes à meticilina e uma amostra representativa de pacientes infectados com S. aureus suscetíveis à meticilina foram incluídos. As informações clínicas e epidemiológicas foram obtidas de prontuários médicos, e a caracterização molecular incluiu tipagem spa, Eletroforese em Gel de Campo Pulsado (PFGE) e Tipagem de sequências multilocus (MLST). Além disso, o Cassete Cromossômico Estafilocócico mec (SCCmec) e genes de fatores de virulência foram detectados.
Resultados182 pacientes, 65 com infecções por S. aureus suscetíveis à meticilina e 117 com infecções por S. aureus resistentes à meticilina, foram incluídos no estudo; 41,4% dos pacientes com menos de um ano de idade. As infecções mais frequentes foram da pele e dos tecidos moles. Os históricos como internações em centros de atendimento e o uso prévio de antibióticos foram mais comuns em pacientes com infecções por S. aureus resistentes à meticilina (p ≤ 0,05). Dezesseis complexos clonais foram identificados, e as cepas de S. aureus suscetíveis à meticilina foram mais diversificadas. O cassete mais comum foi o Cassete Cromossômico Estafilocócicomec IVc (70,8%), relacionado à leucocidina de panton-valentine (pvl).
ConclusõesEm comparação a outros locais, observamos uma prevalência de infecções em crianças com menos de um ano de idade na cidade; o que enfatiza a importância de conhecer a epidemiologia em nível local.
A situação complexa da resistência do S. aureus à meticilina em todo o mundo levou a seu manejo atual, é considerada uma prioridade para a OMS e um desafio para a saúde pública humana em diferentes regiões; contudo, tanto as cepas de MSSA quanto de MRSA têm uma capacidade de virulência e patogenicidade que permite que atinjam altas taxas de infecção.
Alguns grupos da população são mais suscetíveis a infecções por S. aureus; em especial a população pediátrica tem uma função imunológica menos efetiva, taxas de colonização bacteriana persistentemente altas, hábitos de higiene ruins e constante exposição a ambientes escolares que favorecem a aquisição de infecção e a disseminação do microorganismo.1,2 A epidemiologia das infecções por S. aureus nessa população é diversificada e as frequências de infecção por MRSA diferem entre as regiões geográficas, variam de 6%3 a 69,9%;4 na Colômbia, foram encontradas frequências de até 47,4%.5
Em Medellín, apesar de o S. aureus ser um dos principais agentes responsáveis por infecções na população pediátrica, tanto em hospitais quanto na comunidade, há poucas informações sobre as características das infecções causas por esse microrganismo nessa população. Este estudo tem como objetivo descrever as características clínicas, epidemiológicas e moleculares das infecções por S. aureus (MSSA‐MRSA) na população pediátrica da cidade.
MétodosPopulação estudadaUm estudo transversal observacional foi feito de fevereiro de 2008 a junho de 2010 em três hospitais terciários de Medellín, segunda cidade da Colômbia. Os pacientes até 14 anos infectados por S. aureus (MSSA‐MRSA) foram recrutados prospectivamente e apenas o primeiro isolado de cada indivíduo foi avaliado. Todos os pacientes isolados com MRSA obtidos durante o período do estudo foram incluídos e, considerando que a prevalência de MSSA é maior, uma amostra foi definida. O tamanho da amostra foi calculado com base na prevalência de MSSA em 2007 em cada instituição, totalizou 65 isolados. Os isolados com MSSA incluídos foram selecionados aleatoriamente todo mês, de fevereiro de 2008 a junho de 2010, com uma tabela de números aleatórios de acordo com registros de cada instituição participante.
O protocolo de pesquisa e o consentimento informado (assinado pelos pais ou responsáveis) foram aprovados pelo Comitê de Bioética de Pesquisa com Seres Humanos do Centro de Pesquisa Universitário da Universidade de Antioquia (n° de aprovação 0841150) e pelo comitê de bioética de cada hospital.
Dados clínicos e epidemiológicosOs dados clínicos e epidemiológicos de cada paciente foram obtidos de prontuários médicos. As informações incluíram características clínicas e demográficas, uso de antimicrobianos, fatores de risco, comorbidades, tipo de infecção, tratamento, tempo de internação e resultado. De acordo com critérios do Centro de Controle e Prevenção de Doenças dos Estados Unidos (CDC), uma infecção é considerada presente no momento da internação (POA) quando a data do evento ocorre no dia da internação em um ambiente hospitalar, dois dias antes da internação e um dia civil após a internação. Uma infecção é considerada associada ao serviço de saúde (HAI) quando a data do evento ocorre a partir do terceiro dia civil de internação em um ambiente hospitalar. Pacientes com infecções do sítio cirúrgico e evento associado ao ventilador foram excluídos.6
Identificação e susceptibilidade a antibióticosA identificação do S. aureus foi feita por métodos laboratoriais padrão com base na morfologia das colônias em ágar de sangue de ovelhas e testes de catalase e coagulase positivos. A susceptibilidade a antibióticos de isolados de S. aureus foi avaliada de acordo com as diretrizes do Instituto de Padrões Clínicos e Laboratoriais (CLSI, 2009) com o sistema VITEK® 2 (BioMérieux, Inc, NC, USA). Os antibióticos testados incluíram clindamicina, eritromicina, gentamicina, linezolida, moxifloxacina, oxacilina, rifampicina, tetraciclina, tigeciclina, trimetoprim‐sulfametoxazol e vancomicina. A cepa de S. aureus ATCC 29213 foi usada para controle de qualidade.
Confirmação por reação em cadeiada polimerase (PCR) do S. aureus e resistência à meticilinaA presença dos genes nuc e femA específicos da espécie, bem como do gene mecA, foi verificada pela reação em cadeia da polimerase (PCR) conforme descrito anteriormente.7,8
Tipagem molecular: tipagem spa (spa), tipagem de sequências multilocus (MLST) e eletroforese em gel de campo pulsado (PFGE)Em todos os isolados, a região polimórfica X do gene A da proteína (spa) foi amplificada e sequenciada conforme descrito anteriormente.9 Os tipos spa correspondentes foram atribuídos com o software eGenomics9,10 e os tipos spa do Ridom foram atribuídos posteriormente com o website da tipagem spa (http://www.spaserver.ridom.de/) desenvolvido pela Ridom GmbH e curado pelo SeqNet.org (http://www.SeqNet.org/).11 A MLST foi feita em um subgrupo de dez isolados que representavam os tipos spa mais frequentes, com a metodologia descrita por Enright et al.12 Números de alelos e tipos de sequências (ST) foram atribuídos com o banco de dados mantido em http://saureus.mlst.net/, ao passo que complexos clonais (CC) foram inferidos com a análise eBURST.13 Os complexos clonais de todas as cepas remanescentes foram inferidos pela análise de padrões de repetição do spa10 ou por referência ao website do servidor do spa Ridom.
A PFGE, após a digestão SmaI, foi feita de acordo com um protocolo descrito em outra fonte.14 Os padrões de fragmentos de DNA foram normalizados com a cepa NCTC 8325 do S. aureus. A análise de bloco foi feita com o coeficiente Dice no software BioNumerics (BioNumerics®, versão 6.0, Bélgica). Os dendrogramas foram gerados pelo método da ligação média não ponderada (UPGMA). A similaridade dos pontos de corte de 80% e 95% foi usada para definir tipos e subtipos, respectivamente.14
Tipagem do SCCmecNo que diz respeito a isolados de MRSA, os tipos e subtipos do SCCmec foram determinados com conjuntos de múltiplas reações PCR, conforme descrito anteriormente.15,16 As cepas de MRSA foram incluídas como controles positivos dos tipos e subtipos do SCCmec.
Detecção de fatores de virulência estafilocócicaTodos os isolados foram examinados para verificar a existência de genes com a codificação de enterotoxinas estafilocócicas (sea, seb, sec, sed, see), toxina da síndrome do choque tóxico 1 (tst) e toxinas esfoliativas a e b (eta, etb), com os protocolos e as cartilhas descritos por Mehrotra et al.8 Os genes lukS/F‐PV, que codificam a leucocidina de Panton‐Valentine (PVL), e o gene arcA, associado ao elemento móvel catabólico da arginina (ACME), também foram avaliados por PCR.17,18
Análises estatísticasForam feitas comparações de características clínicas, epidemiológicas e moleculares entre pacientes infectados por MSSA e MRSA e entre os diferentes grupos de infecções obtidos após aplicação dos critérios do CDC.
As variáveis categóricas foram comparadas com o teste qui‐quadrado ou teste exato de Fisher ou teste t de Student e o teste U de Mann‐Whitney para variáveis contínuas. Valores de p ≤ 0,05 foram considerados estatisticamente significativos. As análises estatísticas foram feitas com o pacote de software SPSS (IBM SPSS Estatística para Windows, Versão 21.0. NY, EUA).
ResultadosDados clínicos e epidemiológicosForam incluídos 182 pacientes pediátricos com infecções por S. aureus; desses, 65 apresentaram infecções por MSSA e 117 por MRSA; 119 pacientes vieram do hospital A, 51 do hospital B e 12 do hospital C.
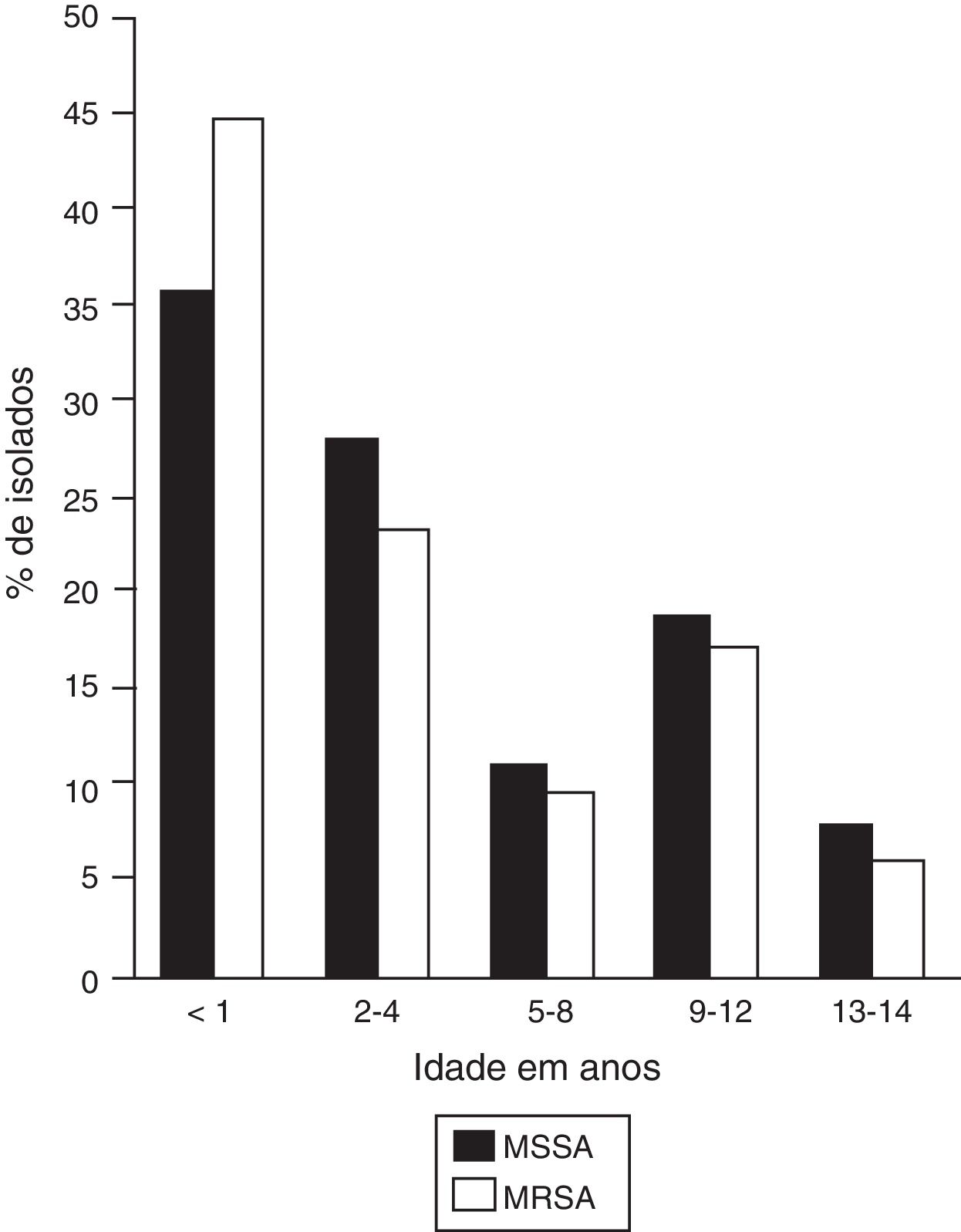
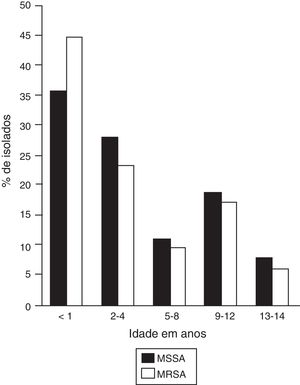
Na população estudada selecionada, a proporção de meninos e meninas foi 2:1 e a média foi de dois anos; contudo, 41,2% (n=75) das infecções ocorreram em pacientes até um ano, nos quais foi observada uma alta frequência de infecções por MRSA e MSSA (fig. 1).
Frequência de infecções por faixa etária.
MSSA, Staphylococcus aureus suscetível à meticilina (n=65); MRSA, Staphylococcus aureus resistente à meticilina (n=117).
A figura mostra a distribuição etária de pacientes infectados por cepas de MSSA e MRSA. Uma maior frequência de infecções é observada em crianças com menos de um ano.
De acordo com os critérios do CDC, 62,7% (n=101) das infecções eram observadas no momento da internação (POA) e 37,3% (n=60) corresponderam a Infecções Associadas ao Serviço de Saúde (HAI) (p=0,391). O tipo de infecção mostra diferenças estatisticamente significativas de acordo com o hospital. Nos hospitais A e B houve predominância de infecções POA e no hospital C houve predominância de HAI (p=0,029). Foram identificadas 21 (11,5%) infecções do sítio cirúrgico, as quais não foram incluídas nesta classificação.
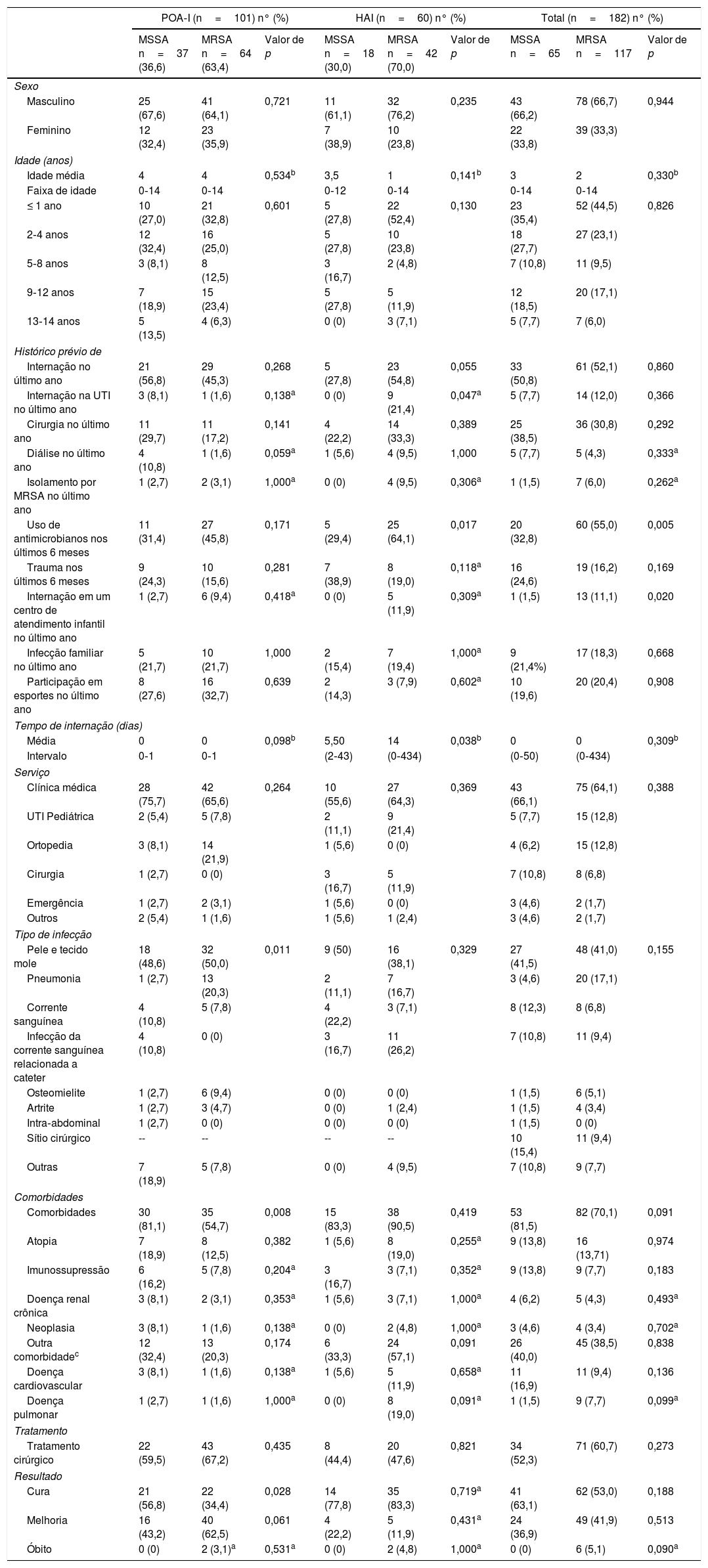
As características clínico‐epidemiológicas dos pacientes avaliados no estudo são descritas na tabela 1. Em geral, um histórico prévio de internação foi o antecedente mais frequente entre os pacientes, com 51,65% (n=94); além disso, as internações em centros de atendimento (MRSA 11,1%, n=13, em comparação com MSSA 1,5%, n=1; p=0,020) e o uso prévio de antibióticos (MRSA 55%, n=60, em comparação com MSSA 32,8%, n=20; p=0,005) foram os antecedentes mais frequentes em pacientes com infecções por MRSA.
Características clínicas e epidemiológicas de pacientes com infecções por Staphylococcus aureus (MSSA‐MRSA)
| POA‐I (n=101) n° (%) | HAI (n=60) n° (%) | Total (n=182) n° (%) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| MSSA n=37 (36,6) | MRSA n=64 (63,4) | Valor de p | MSSA n=18 (30,0) | MRSA n=42 (70,0) | Valor de p | MSSA n=65 | MRSA n=117 | Valor de p | |
| Sexo | |||||||||
| Masculino | 25 (67,6) | 41 (64,1) | 0,721 | 11 (61,1) | 32 (76,2) | 0,235 | 43 (66,2) | 78 (66,7) | 0,944 |
| Feminino | 12 (32,4) | 23 (35,9) | 7 (38,9) | 10 (23,8) | 22 (33,8) | 39 (33,3) | |||
| Idade (anos) | |||||||||
| Idade média | 4 | 4 | 0,534b | 3,5 | 1 | 0,141b | 3 | 2 | 0,330b |
| Faixa de idade | 0‐14 | 0‐14 | 0‐12 | 0‐14 | 0‐14 | 0‐14 | |||
| ≤ 1 ano | 10 (27,0) | 21 (32,8) | 0,601 | 5 (27,8) | 22 (52,4) | 0,130 | 23 (35,4) | 52 (44,5) | 0,826 |
| 2‐4 anos | 12 (32,4) | 16 (25,0) | 5 (27,8) | 10 (23,8) | 18 (27,7) | 27 (23,1) | |||
| 5‐8 anos | 3 (8,1) | 8 (12,5) | 3 (16,7) | 2 (4,8) | 7 (10,8) | 11 (9,5) | |||
| 9‐12 anos | 7 (18,9) | 15 (23,4) | 5 (27,8) | 5 (11,9) | 12 (18,5) | 20 (17,1) | |||
| 13‐14 anos | 5 (13,5) | 4 (6,3) | 0 (0) | 3 (7,1) | 5 (7,7) | 7 (6,0) | |||
| Histórico prévio de | |||||||||
| Internação no último ano | 21 (56,8) | 29 (45,3) | 0,268 | 5 (27,8) | 23 (54,8) | 0,055 | 33 (50,8) | 61 (52,1) | 0,860 |
| Internação na UTI no último ano | 3 (8,1) | 1 (1,6) | 0,138a | 0 (0) | 9 (21,4) | 0,047a | 5 (7,7) | 14 (12,0) | 0,366 |
| Cirurgia no último ano | 11 (29,7) | 11 (17,2) | 0,141 | 4 (22,2) | 14 (33,3) | 0,389 | 25 (38,5) | 36 (30,8) | 0,292 |
| Diálise no último ano | 4 (10,8) | 1 (1,6) | 0,059a | 1 (5,6) | 4 (9,5) | 1,000 | 5 (7,7) | 5 (4,3) | 0,333a |
| Isolamento por MRSA no último ano | 1 (2,7) | 2 (3,1) | 1,000a | 0 (0) | 4 (9,5) | 0,306a | 1 (1,5) | 7 (6,0) | 0,262a |
| Uso de antimicrobianos nos últimos 6 meses | 11 (31,4) | 27 (45,8) | 0,171 | 5 (29,4) | 25 (64,1) | 0,017 | 20 (32,8) | 60 (55,0) | 0,005 |
| Trauma nos últimos 6 meses | 9 (24,3) | 10 (15,6) | 0,281 | 7 (38,9) | 8 (19,0) | 0,118a | 16 (24,6) | 19 (16,2) | 0,169 |
| Internação em um centro de atendimento infantil no último ano | 1 (2,7) | 6 (9,4) | 0,418a | 0 (0) | 5 (11,9) | 0,309a | 1 (1,5) | 13 (11,1) | 0,020 |
| Infecção familiar no último ano | 5 (21,7) | 10 (21,7) | 1,000 | 2 (15,4) | 7 (19,4) | 1,000a | 9 (21,4%) | 17 (18,3) | 0,668 |
| Participação em esportes no último ano | 8 (27,6) | 16 (32,7) | 0,639 | 2 (14,3) | 3 (7,9) | 0,602a | 10 (19,6) | 20 (20,4) | 0,908 |
| Tempo de internação (dias) | |||||||||
| Média | 0 | 0 | 0,098b | 5,50 | 14 | 0,038b | 0 | 0 | 0,309b |
| Intervalo | 0‐1 | 0‐1 | (2‐43) | (0‐434) | (0‐50) | (0‐434) | |||
| Serviço | |||||||||
| Clínica médica | 28 (75,7) | 42 (65,6) | 0,264 | 10 (55,6) | 27 (64,3) | 0,369 | 43 (66,1) | 75 (64,1) | 0,388 |
| UTI Pediátrica | 2 (5,4) | 5 (7,8) | 2 (11,1) | 9 (21,4) | 5 (7,7) | 15 (12,8) | |||
| Ortopedia | 3 (8,1) | 14 (21,9) | 1 (5,6) | 0 (0) | 4 (6,2) | 15 (12,8) | |||
| Cirurgia | 1 (2,7) | 0 (0) | 3 (16,7) | 5 (11,9) | 7 (10,8) | 8 (6,8) | |||
| Emergência | 1 (2,7) | 2 (3,1) | 1 (5,6) | 0 (0) | 3 (4,6) | 2 (1,7) | |||
| Outros | 2 (5,4) | 1 (1,6) | 1 (5,6) | 1 (2,4) | 3 (4,6) | 2 (1,7) | |||
| Tipo de infecção | |||||||||
| Pele e tecido mole | 18 (48,6) | 32 (50,0) | 0,011 | 9 (50) | 16 (38,1) | 0,329 | 27 (41,5) | 48 (41,0) | 0,155 |
| Pneumonia | 1 (2,7) | 13 (20,3) | 2 (11,1) | 7 (16,7) | 3 (4,6) | 20 (17,1) | |||
| Corrente sanguínea | 4 (10,8) | 5 (7,8) | 4 (22,2) | 3 (7,1) | 8 (12,3) | 8 (6,8) | |||
| Infecção da corrente sanguínea relacionada a cateter | 4 (10,8) | 0 (0) | 3 (16,7) | 11 (26,2) | 7 (10,8) | 11 (9,4) | |||
| Osteomielite | 1 (2,7) | 6 (9,4) | 0 (0) | 0 (0) | 1 (1,5) | 6 (5,1) | |||
| Artrite | 1 (2,7) | 3 (4,7) | 0 (0) | 1 (2,4) | 1 (1,5) | 4 (3,4) | |||
| Intra‐abdominal | 1 (2,7) | 0 (0) | 0 (0) | 0 (0) | 1 (1,5) | 0 (0) | |||
| Sítio cirúrgico | -- | -- | -- | -- | 10 (15,4) | 11 (9,4) | |||
| Outras | 7 (18,9) | 5 (7,8) | 0 (0) | 4 (9,5) | 7 (10,8) | 9 (7,7) | |||
| Comorbidades | |||||||||
| Comorbidades | 30 (81,1) | 35 (54,7) | 0,008 | 15 (83,3) | 38 (90,5) | 0,419 | 53 (81,5) | 82 (70,1) | 0,091 |
| Atopia | 7 (18,9) | 8 (12,5) | 0,382 | 1 (5,6) | 8 (19,0) | 0,255a | 9 (13,8) | 16 (13,71) | 0,974 |
| Imunossupressão | 6 (16,2) | 5 (7,8) | 0,204a | 3 (16,7) | 3 (7,1) | 0,352a | 9 (13,8) | 9 (7,7) | 0,183 |
| Doença renal crônica | 3 (8,1) | 2 (3,1) | 0,353a | 1 (5,6) | 3 (7,1) | 1,000a | 4 (6,2) | 5 (4,3) | 0,493a |
| Neoplasia | 3 (8,1) | 1 (1,6) | 0,138a | 0 (0) | 2 (4,8) | 1,000a | 3 (4,6) | 4 (3,4) | 0,702a |
| Outra comorbidadec | 12 (32,4) | 13 (20,3) | 0,174 | 6 (33,3) | 24 (57,1) | 0,091 | 26 (40,0) | 45 (38,5) | 0,838 |
| Doença cardiovascular | 3 (8,1) | 1 (1,6) | 0,138a | 1 (5,6) | 5 (11,9) | 0,658a | 11 (16,9) | 11 (9,4) | 0,136 |
| Doença pulmonar | 1 (2,7) | 1 (1,6) | 1,000a | 0 (0) | 8 (19,0) | 0,091a | 1 (1,5) | 9 (7,7) | 0,099a |
| Tratamento | |||||||||
| Tratamento cirúrgico | 22 (59,5) | 43 (67,2) | 0,435 | 8 (44,4) | 20 (47,6) | 0,821 | 34 (52,3) | 71 (60,7) | 0,273 |
| Resultado | |||||||||
| Cura | 21 (56,8) | 22 (34,4) | 0,028 | 14 (77,8) | 35 (83,3) | 0,719a | 41 (63,1) | 62 (53,0) | 0,188 |
| Melhoria | 16 (43,2) | 40 (62,5) | 0,061 | 4 (22,2) | 5 (11,9) | 0,431a | 24 (36,9) | 49 (41,9) | 0,513 |
| Óbito | 0 (0) | 2 (3,1)a | 0,531a | 0 (0) | 2 (4,8) | 1,000a | 0 (0) | 6 (5,1) | 0,090a |
HAI, infecção associada ao serviço de saúde; MRSA, Staphylococcus aureus resistente à meticilina; MSSA, Staphylococcus aureus suscetível à meticilina; POA‐I, infecção presente no momento da internação.
As diferenças significativas (valores de p ≤ 0,05) são mostradas em negrito.
Outras comorbidades: doença cardiovascular, doença pulmonar crônica, doenças do sistema nervoso, doenças de pele, desnutrição, síndrome colestática, estenose subglótica, mordida de cobra, incompatibilidade do Rh‐ABO, síndrome do intestino curto, nesidioblastose, papilomatose laríngea e pulmonar, hemofilia B, osteomielite crônica, malformações congênitas, nefropatia e outras.
Em HAI, um histórico prévio de internação na unidade de terapia intensiva (UTI) (MRSA 21,4%, n=9, em comparação com MSSA 0%; p=0,047) e o uso prévio de antibióticos nos últimos seis meses (MRSA 64,1%, n=25, em comparação com MSSA 29,4%, n=5; p=0,017) foram mais frequentes em pacientes com infecções por MRSA.
Por outro lado, o tempo de internação foi maior em pacientes com HAI, com uma diferença significativa em favor de pacientes com infecções por MRSA (MRSA 0‐434 dias, Ma=14, em comparação a MSSA 2‐43 dias, Ma=5,5; p=0,038).
Os locais de infecção mais frequentes foram a pele e o tecido mole, com 41,21% (n=75), e o serviço médico mais comum foi a clínica médica, com 64,84% (n=110).
A frequência de comorbidades na população foi de 74,1% (n=135), mais frequente em pacientes com infecções POA causadas por MSSA (MSSA 81,1%, n=30, em comparação com MRSA 54,7%, n=35; p=0,008).
Precisaram de tratamento cirúrgico 57,6% da população e a cura foi o resultado mais frequente, principalmente em infecções POA causadas por MSSA (MSSA 56,8%, n=21, em comparação com MRSA 34,4%, n=22; p=0,028). Seis dos pacientes incluídos no estudo faleceram; contudo, essa foi a mortalidade bruta e não atribuída à infecção por S. aureus.
Perfil de resistênciaOs isolados de MSSA apresentaram seis perfis de resistência, 61,5% (n=40) foram suscetíveis a todos os antibióticos avaliados, 16,9% (n=11) à tetraciclina e 9,2% (n=6) à eritromicina e à clindamicina. Os isolados de MRSA apresentaram oito perfis de resistência, 44,4% (n=52) foram resistentes apenas à oxacilina, seguidos por 28,2% (n=33) com resistência à oxacilina e à tetraciclina. Todos os isolados foram suscetíveis a vancomicina, linezolida e tigeciclina.
Tipagem molecularEntre todos os isolados, 16 complexos clonais (CC) foram identificados. As cepas de MSSA foram as mais diversificadas, com um número maior de CCs, os mais comuns foram CC8 (29,2%, n=19), CC45 (16,9%, n=11) e CC1 (10,8%, n=7), ao passo que nas cepas de MRSA os CCs mais comuns foram CC8 (70,9%, n=83) e CC5 (22,2%, n=26).
A presença do gene mecA foi confirmada nas 117 cepas de MRSA selecionadas. Dessas, foi possível identificar o tipo de SCCmec em 113 cepas, quatro isolados foram não tipáveis. Dos isolados de MSRA, 70,8% abrigavam o SCCmec IVc (n=80), seguido pelo SCCmec I (20,3%, n=23), SCCmec IVa (5,3%, n=6) e SCCmec V (2,7%, n=3). Um isolado foi identificado com o SCCmec IV, porém não foi possível identificar seu subtipo (0,9%; n=1).
Entre os pacientes com infecções POA, 87,1% (n=54) de isolados de MRSA abrigavam o SCCmec IVc, seguido pelo SCCmec I (8,1%, n=5) e pelo SCCmec IVa (4,8%, n=3). Ao mesmo tempo, isolados de MRSA de pacientes com infecções HAI abrigavam o SCCmec tipo IVc em 56,1% (n=23), seguido pelo SCCmec tipo I (26,8%; n=11), IVa (7,3%; n=3), V (7,3%, n=3) e IV (2,43%, n=1). O SCCmec IVc foi o tipo mais frequente em ambos os tipos de infecção.
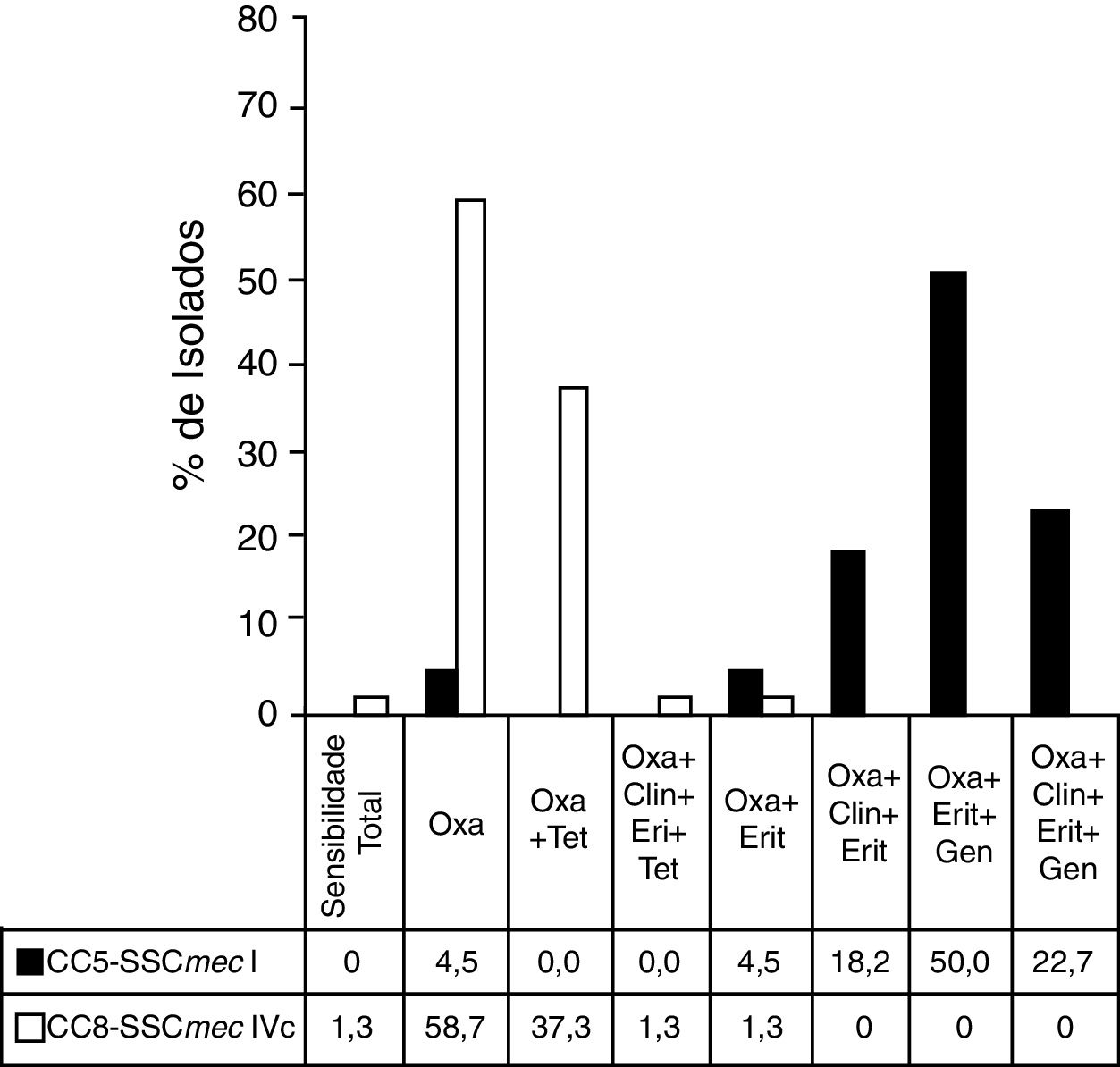
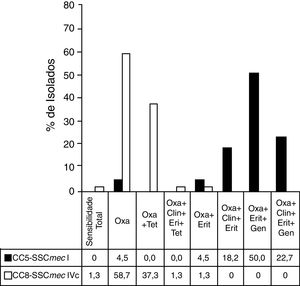
Os perfis de resistência dos clones de MRSA mais importantes são apresentados na figura 2.
Perfis de resistência nos principais clones de MRSA.
A figura mostra o perfil de resistência antimicrobiana dos principais clones de MRSA encontrados no estudo.
Antibióticos avaliados: Oxacilina (Oxa), Tetraciclina (Tet), Clindamicina (Clin), Eritromicina (Eri), Gentamicina (Gen).
Coluna sombreada: isolados pertencentes ao CC5‐SCCmec‐I (n=22); Coluna branca: isolados pertencentes a CC8‐SCCmec‐IVc (n=75).
Foram identificados 40 tipos spa diferentes em cepas de MSSA e MRSA. Os tipos mais comuns foram t1610 (17,6%, n=32), t008 (17%, n=31), t149 (11%, n=20) e t024 (9,9%; n=18). Em isolados de MSSA pertencentes ao CC8, foram destacados como os mais frequentes os tipos t1635 e t008, cada um com 9,2% (n=6), e o t922 com 6,2% (n=4) pertencente ao CC1. As cepas mais importantes de MRSA foram as pertencentes ao CC8 e as mais frequentes foram CC8‐SCCmecIVc‐t1610 (27,43%, n=31), CC8‐SCCmecIVc‐t008 (19,47%, n=22), CC5‐SCCmec I‐t149 (16,81%, n=19) e CC8‐SCCmec IVc‐t024 (15,04%, n=17).
Durante o período do estudo, uma variação foi observada nos complexos clonais mais importantes, nos isolados de MSSA e MRSA. O CC5 quase desapareceu completamente, ao passo que o CC8 e o CC45 permaneceram constantes. Além disso, o aumento de outros CCs foi evidente, apesar de nenhum deles ter sido especificamente predominante. Durante os três anos do estudo, o clone pertencente ao CC8‐SCCmec IVc de MRSA foi aumentando, foi o mais prevalente, ao passo que o CC5‐SCCmec I desapareceu no terceiro ano.
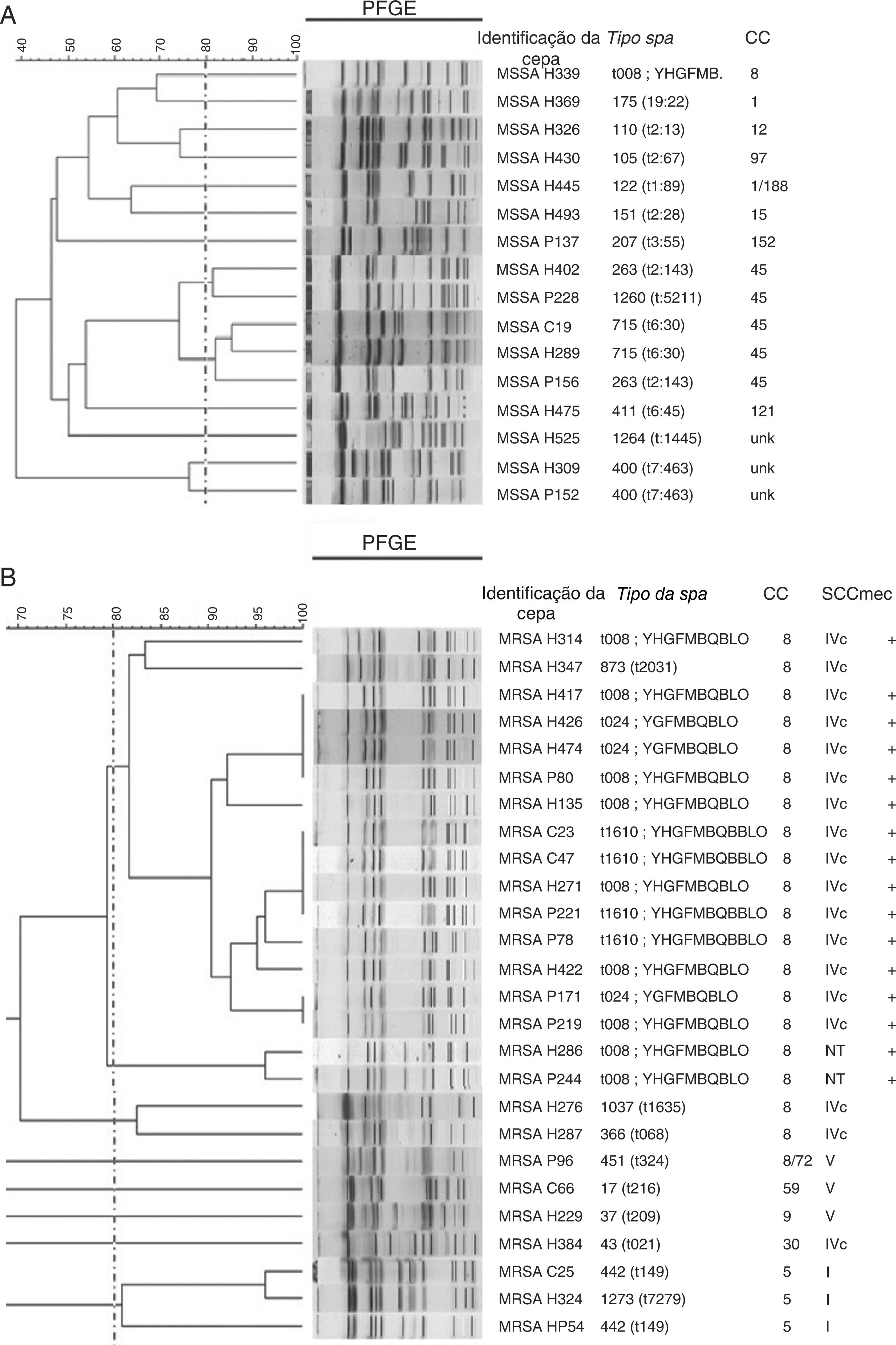
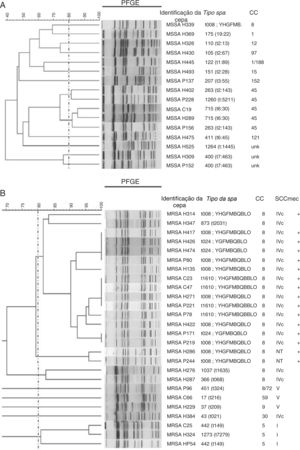
Foram analisados 16 isolados de MSSA com PFGE e uma grande diversidade foi encontrada nos resultados (fig. 3A). A análise de MRSA por PFGE foi feita em 26 isolados e quatro grupos relacionados foram identificados. O maior grupo apresentou 15 isolados, que pertenciam ao CC8 e abrigavam o SCCmec IVc; 14 deles foram positivos para pvl e apresentaram tipos spa diferentes (t008, 7/15; t1610, 4/15; t024, 3/15 e t2031, 1/15) (fig. 3B).
Relação genética em isolados de MSSA e MRSA.
Dendrograma UPGMA mostra a relação genética em uma amostra de isolados de Staphylococcus aureus suscetível à meticilina (MSSA) (A) e Staphylococcus aureus resistente à meticilina (MRSA) (B).
A linha pontilhada indica o ponto de corte ou o coeficiente dos dados de 80%; ela é usada para definir os clones por PFGE. Os blocos acima desse percentual são considerados geneticamente relacionados.
Os isolados identificados com a letra H pertencem ao hospital A, os isolados identificados com a letra P pertencem ao hospital B e os isolados identificados com a letra C pertencem ao hospital C.
Oito genes de fatores de virulência foram detectados, em cepas de MSSA e MRSA; apesar disso, uma maior prevalência de genes foi observada nos isolados de MSSA em comparação com os isolados de MRSA. Diferenças estatisticamente significativas foram observadas entre cepas de MSSA e MRSA com relação a genes de pvl (MRSA 76,9%, n=90, em comparação com MSSA 32,3%, n=21; p=0,000), sed (MSSA 33,8%, n=8, em comparação com MRSA 10,3%, n=12; p=0,000) e see (MSSA 12,3%, n=8, em comparação com MRSA 2,6%, n=3; p=0,018).
A presença da pvl mostrou diferenças estatisticamente significativas entre isolados com SCCmec IVc e outros tipos de SCCmec (SCCmec IVc 95%, n=76, em comparação com outro SCCmec 30,3%, n=10; p=0,000). Isso sugere que o gene da pvl é associado com mais frequência com isolados de SCCmec IVc do que de SCCmec I. Genes como sed e tst foram associados ao SCCmec IVa (sed p=0,001; tst p=0,012), ao passo que o gene eta foi associado ao SCCmec V (p=0,027). Nenhum gene etb e arcA (ACME) foi encontrado nos isolados.
DiscussãoAs infecções causadas por S. aureus (MSSA‐MRSA) na população infantil continuam a ser uma grande preocupação, tanto na comunidade quanto no ambiente hospitalar. Em geral, os estudos na população pediátrica são poucos e alguns apresentam limitações: muitos têm como foco alguns tipos de infecção e a maioria não apresenta informações sobre infecções causadas por cepas de MSSA, que continuam a ser relevantes e não foram substituídas pelas cepas de MRSA.
Neste estudo, um número significativo de infecções ocorreu em pacientes até um ano (41,2%), que apresentaram principalmente infecções de pele e do tecido mole causadas por MRSA. Curiosamente, poucos estudos sobre infecções por S. aureus na população infantil concordam com esses achados, conforme relatado na China por Wu et al., em 2010; eles constataram que 37,6% das infecções de pele e do tecido mole ocorreram em crianças com menos de um ano.19 Da mesma forma, a morbidez e a mortalidade relatadas pelo CDC nos Estados Unidos têm descrito uma importante prevalência de infecções de pele e do tecido mole em pacientes neonatais.20 Contudo, outras publicações apresentam diferenças quanto aos tipos de infecção; autores como Ilczyszyn et al., na Polônia,21 e Qiao et al., na China,22 mostram que infecções por S. aureus em crianças até um ano são principalmente do tipo invasivo (bacteremia e pneumonia).22
Da mesma forma, resultados de outros estudos contrastam com os nossos com relação à idade; estudos no Brasil23 e na Argentina,24 por exemplo, mostram uma alta prevalência de infecções por S. aureus em pacientes entre dois e cinco anos de idade e outros estudos feitos na Colômbia, em cidades como Bucaramanga25 e Cartagena,5 descrevem uma alta prevalência de infecções por S. aureus em crianças entre quatro e cinco anos e entre 10 e 17 anos, respectivamente.
As infecções em diferentes faixas etárias são determinadas pelas particularidades de cada população e com base nos fatores de risco aos quais os neonatos são expostos; além disso, a população infantil tem um sistema imunológico menos adaptado, que permite uma maior colonização, mais suscetível ao desenvolvimento de quadros clínicos, e apresenta mais complicações.1,2
Nesse sentido, um estudo prévio, feito em Medellín em 2011, revelou frequências de colonização por S. aureus (MSSA e MRSA) de 45,9% em crianças com menos de dois anos.26 Esse é um aspecto importante, considerando a relação entre colonização e o desenvolvimento de infecções por S. aureus; pois existe a possibilidade de as frequências de infecção encontradas em pacientes pediátricos estarem relacionadas, entre outros aspectos, às frequências de colonização relatadas na cidade.
Em especial, neste estudo, foi constatada uma relação entre o histórico de internações em centros de atendimento e infecções por MRSA, que poderia ser devida à frequência de colonização relatada anteriormente em crianças de centros de atendimento de Medellín. Rodríguez et al. estabeleceram que as cepas colonizadoras estavam intimamente relacionadas às cepas que causam infecção na cidade.26 Os centros de atendimento foram descritos como um importante reservatório do microrganismo, tornam‐se locais favoráveis para sua disseminação. Esses ambientes permitem a troca de objetos entre as crianças, que apresentam hábitos de higiene ruins, o que aumenta a probabilidade de disseminação.2
Um estudo anterior publicado sobre infecções por S. aureus na população adulta de Medellín27 constatou que cepas de S. aureus abrigavam SCCmec IVc, normalmente associadas ao ambiente da comunidade, predominaram como agentes etiológicos das infecções associadas ao serviço de saúde, tiraram o posto das tradicionais cepas com SCCmec tipo I dominantes nos hospitais. Além disso, as frequências do SCCmec IVc foram maiores na população infantil em comparação com as relatadas na população adulta (58,7% em adultos, em comparação com 70,8% na população pediátrica).27
Essa descoberta mostra o sucesso do SCCmec IVc na população infantil, causa da grande preocupação, porque facilita a manutenção de fatores de virulência como leucocidina de Panton‐Valentine (PVL) e aumenta a possibilidade de disseminação nessa população. Conforme descrito, o SCCmec IV é menor; assim, o custo biológico da resistência diminui, favorece sua propagação em outras cepas. A disseminação ocorre principalmente em cepas pertencentes a complexos clonais específicos, como o CC8, o que poderia ser comprovado nos resultados da PFGE e conforme relatado anteriormente.28
Por outro lado, os tipos spa predominantes neste estudo, t1610, t008, t149 e t024, foram identificados anteriormente, principalmente em cepas de MRSA que infectaram pacientes pediátricos e adultos, não apenas na Colômbia e na América Latina, mas também em muitos países em todo o mundo.29,30 Esses achados mostram a ampla circulação entre a população geral e sugerem a capacidade patogênica de disseminação dessas cepas.
No que diz respeito aos perfis de resistência, uma diferença foi observada entre este e outros estudos, que poderá ser devida a diferenças no uso de antimicrobianos, no contexto clínico e em outros contextos. A heterogeneidade confirma a importância de saber o comportamento dessas infecções em cada região e instituição. Além disso, as diferenças entre os perfis de resistência dos principais clones de MRSA relatados no estudo permitem uma abordagem clínica para o reconhecimento dos clones predominantes, sem necessidade de tipagem molecular.
No presente estudo, uma predominância de infecções POA foi observada, contudo as infecções associadas ao serviço de saúde continuam a ser muito importantes na população infantil. Ao mesmo tempo, as cepas de MSSA constituem uma importante fonte de infecções; nesse caso, elas abrigavam uma diversidade de genes de fatores de virulência em comparação com as cepas de MRSA, aspecto descrito anteriormente.
Os resultados deste estudo são informações valiosas para o conhecimento da epidemiologia local e o controle de infecções em crianças na cidade. Além disso, ele demonstra que a epidemiologia desse microrganismo é diversificada e que, devido às particularidades de cada região, os dados não podem ser extrapolados. Em geral, o estudo permitiu verificar uma maior prevalência do SCCmec IVc em crianças do que em adultos, o que poderia indicar uma maior disseminação do cassete cromossômico nessa população e exigir estudos adicionais.
Apesar de o grupo do estudo não constituir uma coorte completa, os pacientes e os isolados avaliados resultam de uma amostragem feita com cuidado.
FinanciamentoProcesso de consolidação de estratégias de sustentabilidade Codi (Comitê de Desenvolvimento e Pesquisa). Universidade de Antioquia, Microba (Grupo de Pesquisa em Microbiologia Básica e Aplicada) 2016‐2017.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Salazar‐Ospina L, Jiménez JN. High frequency of methicillin‐susceptible and methicillin‐resistant Staphylococcus aureus in children under 1 year old with skin and soft tissue infections. J Pediatr (Rio J). 2018;94:380–9.