This study analyzed the relationship between latent iron deficiency evaluated by ferritin, and the myelination of the central nervous system evaluated through the brainstem evoked response audiometry test.
MethodA total of 109 full‐term newborns, born without anemia and risk factor for hearing deficiency, were enrolled. After delivery, umbilical cord blood was collected to determine ferritin and hematocrit levels. The brainstem evoked response audiometry test was carried out in the first 28 days of life. Analysis was performed between the control group (n=71) with ferritin greater than 75ng/mL, and the latent iron deficiency group (n=38) with ferritin between 11 and 75ng/mL. Results were presented as mean±standard deviation. Statistical analysis was performed using GraphPad prism7 and SPSS with a significance level of 5%.
ResultsA significant higher V‐wave (p=0.02) and interpeak intervals I–III (p=0.014), I–V (p=0.0003), and III‐V (p=0.0002) latencies were found in the latent iron deficiency group, as well as a significant inversely proportional correlation between ferritin and the same wave and intervals (p=0.003, p=0.0013, p=0.0002, p=0.009, respectively). Multiple correlation analysis showed a significant correlation of latent iron deficiency with all interpeak intervals, even taking into account newborn gestational age.
ConclusionIron deficiency anemia is a prevalent pathology; this study showed auditory delayed maturation associated to intrauterine iron deficiency, even in its latent form. This reinforces the importance of adopting effective measures, on a global scale, to prevent and treat this pathology in different life periods, especially in the most vulnerable population.
Este estudo analisou a relação entre deficiência de ferro latente avaliada pela ferritina e a mielinização do sistema nervoso central avaliada pelo teste de Potenciais Evocados Auditivos de Tronco Encefálico.
MétodoForam incluídos no estudo 109 recém‐nascidos a termo, nascidos sem anemia e fator de risco para deficiência auditiva. Após o parto, o sangue do cordão umbilical foi coletado para determinar os níveis de ferritina e hematócrito. O teste de Potenciais Evocados Auditivos de Tronco Encefálico foi realizado nos primeiros 28 dias de vida. A análise foi realizada entre o grupo controle (n=71) com ferritina acima de 75ng/mL e o grupo com deficiência de ferro latente (n=38) com ferritina entre 11 e 75ng/mL. Os resultados foram apresentados como média±desvio‐padrão. A análise estatística foi realizada utilizando o software GraphPad prism7 e SPSS com nível de significância de 5%.
ResultadosLatências significativamente maiores da onda V (p=0,02) e dos intervalos interpicos I‐III (p=0,014), I‐V (p=0,0003) e III‐V (p=0,0002) foram encontradas no grupo de deficiência de ferro latente, assim como uma correlação significativa inversamente proporcional entre a ferritina e a mesma onda e intervalos (p=0,003, p=0,0013, p=0,0002, p=0,009, respectivamente). A análise de correlação múltipla mostrou uma correlação significativa da deficiência de ferro latente com todos os intervalos interpicos, mesmo se levarmos em consideração a idade gestacional do recém‐nascido.
ConclusãoA anemia ferropriva é uma patologia prevalente e este estudo demonstrou maturação auditiva tardia associada à deficiência intrauterina de ferro, mesmo em sua forma latente. Isso reforça a importância da adoção de medidas efetivas, em escala global, para prevenir e tratar essa patologia em diferentes períodos da vida, principalmente na população mais vulnerável.
A nutrição é fundamental para o desenvolvimento normal do sistema nervoso central (SNC) e é particularmente importante durante toda a gravidez e a infância. Esses são períodos essenciais para o crescimento do cérebro e para o desenvolvimento adequado cognitivo, motor e psicossocial na infância, bem como na idade adulta. Assim, deficiências nutricionais durante esses períodos têm o potencial de prejudicar a cognição, o comportamento e a produtividade nos anos escolares e na vida adulta. Entre as deficiências nutricionais, a deficiência de ferro ocupa um lugar de destaque.1
O ferro tem um papel fundamental no desenvolvimento neural, participa dos processos de mielinização e sinaptogênese.2 Em relação à vida embrionária, a importância do ferro nos três primeiros meses está relacionada principalmente à embriogênese do sistema nervoso, enquanto que no último trimestre o feto precisa formar suas próprias reservas de ferro. Estudos sugerem que o pico de absorção de ferro no SNC coincide com o pico de mielinização, especialmente nos estágios fetal tardio e pós‐natal inicial.3
A deficiência de ferro (DF) é a deficiência nutricional mais comum no mundo, afeta cerca de um quarto da população mundial, e esses números aumentam ainda mais durante a gravidez, chegam a 59%.4 Além disso, algumas patologias maternas e fetais podem afetar os estoques de ferro do recém‐nascido (RN), tais como a hipertensão arterial, diabetes mellitus, restrição do crescimento fetal intrauterino, tabagismo durante a gravidez e parto prematuro, tornam o período perinatal especialmente suscetível à deficiência nutricional desse elemento.2
A anemia ferropriva tem efeitos bem conhecidos no SNC, como a redução da velocidade de condução nervosa e alterações cognitivo‐comportamentais.5 A deficiência de ferro sem anemia, que tem uma prevalência 3‐5 vezes maior do que a da anemia ferropriva, também pode prejudicar o SNC.3 Os oligodendrócitos, células responsáveis pela produção de mielina, são particularmente sensíveis à deficiência de ferro6 e foi demonstrado que os RNs submetidos à deficiência intrauterina de ferro apresentavam danos ao SNC em longo prazo, atingem menores escores de linguagem e de desenvolvimento motor aos cinco anos em comparação com aqueles nascidos com estoques de ferro normais.2
Como parte do SNC, o sistema auditivo em desenvolvimento é particularmente vulnerável a mudanças nutricionais durante a vida fetal e pós‐natal iniciais, especialmente devido ao acelerado processo de crescimento e desenvolvimento neuronal, mielinização e estabelecimento da rede sináptica.7 A maturação neural do sistema auditivo progride na direção caudorrostral e a mielinização da via do nervo auditivo é considerada um índice de mielinização cerebral.8
O teste Peate (Potencial Evocado Auditivo do Tronco Encefálico) consiste em registrar o estímulo elétrico do ouvido interno para o tronco encefálico em resposta a um estímulo acústico.9 Esse teste avalia a atividade eletrofisiológica do sistema auditivo no nível do tronco encefálico a partir do nervo coclear, núcleos cocleares, complexo olivar superior e ponte para o colículo inferior‐mesencefálico.10
As ondas avaliadas pelo Peate compreendem três ondas maiores (I, III e V) que podem ser mensuradas com confiabilidade em recém‐nascidos com idade gestacional superior a 34 semanas. As latências absolutas para cada uma das ondas e seus intervalos, conforme determinado pelo Peate, são influenciadas pelo grau de mielinização, desenvolvimento neuronal, função sináptica e crescimento axonal do sistema nervoso auditivo e são uma medida da velocidade de condução nervosa em diferentes níveis da via auditiva.11 Como a relação entre essas latências e a mielinização é negativa, uma latência menor significa maior (melhor) mielinização e vice‐versa.12
Embora os dados da literatura mostrem a estreita relação entre o desenvolvimento do sistema auditivo e a homeostase do ferro, as alterações que a DF sem anemia causa, também chamada de deficiência de ferro latente (DFL), ainda não estão completamente claras.13–15
Considerando as possíveis repercussões negativas da DFL no processo de mielinização do SNC, este estudo teve como objetivo analisar a relação entre a DFL através da ferritina sérica do cordão umbilical e a mielinização do nervo auditivo através do Peate em RN com idade gestacional igual ou superior a 37 semanas.
MétodosEste estudo foi feito na Maternidade da Santa Casa de Misericórdia em uma cidade com 240.000 habitantes do estado de São Paulo, de agosto de 2016 a janeiro de 2018. A Maternidade da Santa Casa de Misericórdia é atualmente a única instituição responsável por todos os nascimentos na cidade e sua microrregião.
O projeto foi aprovado pelo Comitê de Ética em Pesquisa Institucional (Processo 791.511). Apenas os RNs cujos pais ou representantes legais assinaram o termo de consentimento livre e esclarecido foram incluídos no estudo.
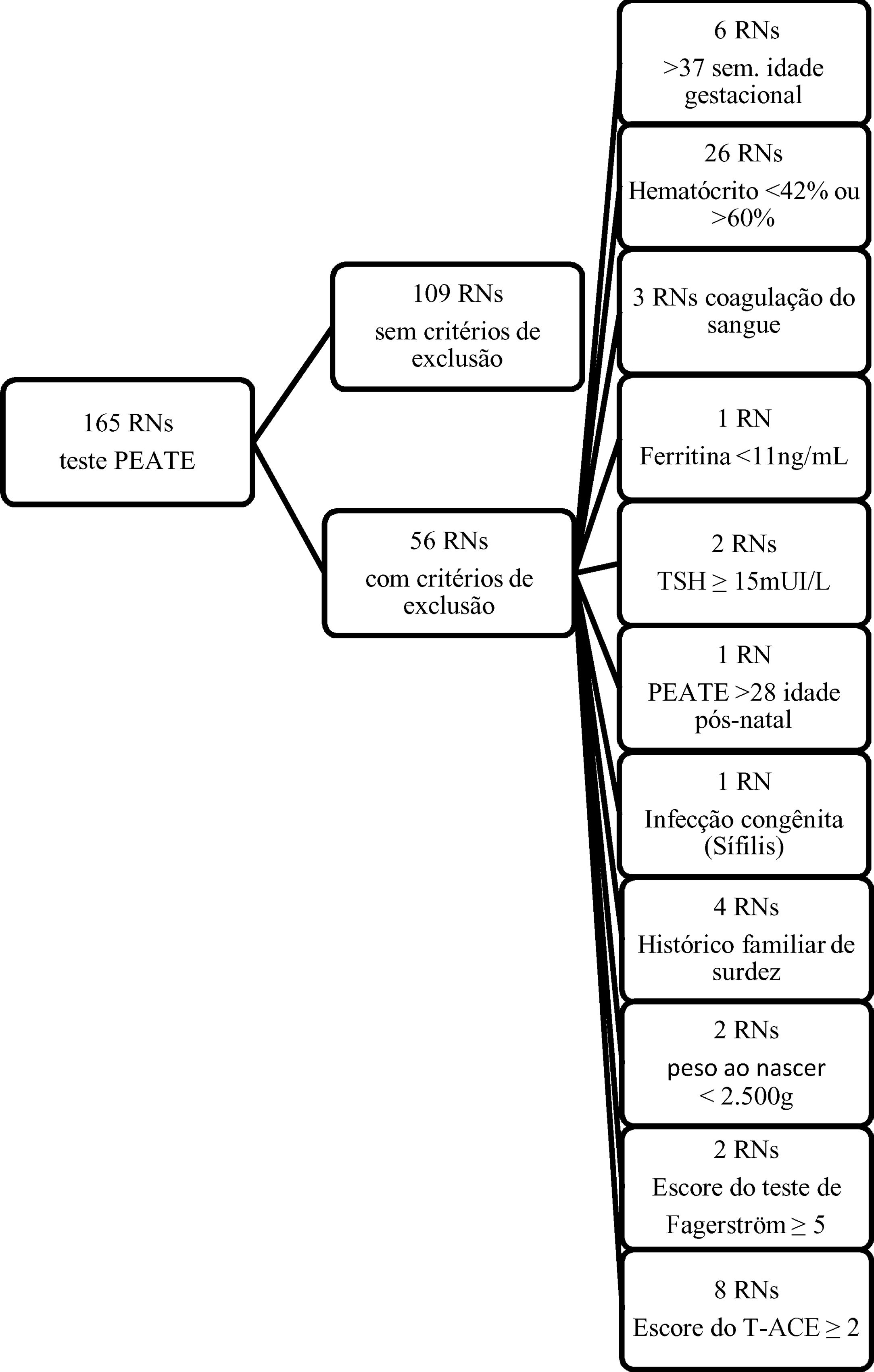
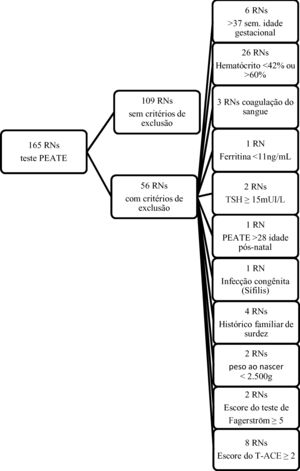
Tiveram o sangue coletado 165 recém‐nascidos (RNs) e foram submetidos à avaliação otológica através do Peate e 109 RNs a termo com peso>2.500g, nascidos sem sofrimento fetal (Apgar ≥ 7), que preencheram os critérios de inclusão, foram integralmente estudados (fig. suplementar 1). Todas as mães responderam um questionário sociodemográfico elaborado pelos pesquisadores. Os dados maternos e neonatais foram obtidos dos prontuários hospitalares.
Após o parto, o sangue do cordão umbilical foi coletado para determinar os níveis de ferritina e hematócrito. As amostras foram então mantidas à temperatura ambiente até a sua mensuração, até quatro horas após a coleta. Todos os RNs foram submetidos a avaliação otológica nos primeiros 28 dias após o nascimento. Foram feitos dois testes: o de emissões otoacústicas (EOA) e o Peate. O teste das EOA foi feito antes da alta hospitalar, entre 24h e 48h após o nascimento, e o Peate foi feito após a alta hospitalar, em até 28 dias. As avaliações audiológicas foram feitas por um único fonoaudiólogo habilitado, que não teve acesso prévio aos resultados dos exames de sangue.
Critérios de inclusão: RNs de ambos os sexos com IG de 37 semanas ou mais, peso> 2.500g, nascidos na Maternidade da Santa Casa de Misericórdia, durante o período do estudo, do sistema público ou suplementar de saúde. Apenas os RNs com valor normal de hematócrito (≥ 42% e ≤ 60%) foram incluídos no estudo. RNs cujas mães tinham hipertensão arterial ou diabetes mellitus foram incluídos no estudo, dada a maior probabilidade de esses RNs apresentarem deficiência de ferro.
Critérios de exclusão: RNs com risco de deficiência auditiva (história familiar de perda auditiva congênita em parentes de primeiro grau), aqueles com infecções congênitas (toxoplasmose, rubéola, citomegalovírus, herpes, sífilis, HIV), síndromes genéticas/anomalias cromossômicas, problemas perinatais (doença hemolítica, hipoglicemia, icterícia prolongada, sepse neonatal, permanência em Unidade de Terapia Intensiva [UTI] e presença de anormalidade craniofacial, uma vez que qualquer uma dessas comorbidades pode isoladamente causar alterações nos resultados do Peate), RNs com índice de Apgar de 1 ou 5 minutos <7 e ferritina <11 ng/mL, bem como filhos de mães com escore no T‐ACE ≥ 2 e escore no teste de Fagerström ≥ 5 durante a gestação (o T‐ACE é um questionário de rastreamento do uso de álcool adaptado para identificar o risco de beber durante a gravidez e o teste de Fagerström é um instrumento padrão para avaliar o nível de dependência da nicotina). RNs com valores aumentados de TSH (hormônio estimulante da tireoide) no programa de triagem neonatal (TSH no sangue ≥ 15mUI / L (ponto de corte APAE‐SP)) também foram excluídos.
Os RNs foram divididos em dois grupos: Grupo 1 (Controle): valor da ferritina no cordão umbilical>75ng/mL, lactentes sem deficiência de ferro; Grupo 2 (deficiência de ferro latente – DFL): valor da ferritina no cordão umbilical ≥ 11 e ≤ 75 ng/mL, lactentes com deficiência de ferro latente.13,15–17
O hematócrito foi medido com o método proposto por Wintrobe et al. (1987). A determinação da ferritina foi feita por imunoensaio quimioluminescente em fase sólida (Immulite/Immulite 1.000 Ferritin, Siemens Healthcare Diagnostics, Inglaterra).
O teste de EOA foi feito com um teste de triagem com resposta “passa ou falha” e o Peate com um modo diagnóstico. Apenas os lactentes submetidos a triagem auditiva com o teste de EOA e passaram foram recrutadas para o Peate. O teste de EOA foi feito pelo mesmo fonoaudiólogo responsável pelo teste Peate.
O equipamento usado para o Peate foi o Bio‐Logic Navigator Pro® (Estímulo: clique; Transdutor: fones de inserção; Polaridade: alternada) (e3 Diagnostics®, IL, EUA). O teste foi feito enquanto o RN dormia em um ambiente silencioso, com isolamento elétrico e luz fraca, e não exigiu sedação. Fones de ouvido com estimulação monoaural foram usados. Foi usado estímulo sonoro com intensidade de 80 dBNA, a uma taxa de 27,7 cliques/s (Padronização de Hood, 1998). A impedância entre os eletrodos foi considerada inferior a 3 kOhms, de acordo com o manual de instruções do equipamento. Os parâmetros usados foram: cliques com polaridade alternada, filtro passa‐baixa de 100Hz e passa‐alta de 1.500Hz, 2.000 estímulos, taxa de apresentação de 27,7 estímulos/segundo e uma análise de janela de 10,66ms. Cada registro foi duplicado para garantir a reprodutibilidade dos resultados. Para cada paciente, foi selecionada a menor latência de cada onda e o menor intervalo interpico entre as duas orelhas.15
Para analisar o efeito do diabetes mellitus (DM) e/ou hipertensão da mãe nos valores do Peate, foi projetada uma variável denominada Patho categorizada como: 0=sem patologia e 1=hipertensão e/ou DM, para cálculos estatísticos. Contabilizando o principal papel da ferritina como variável de corte (determinaram‐se dois grupos significativos: maior ou menor do que 75 ng/mL), analisamos a contribuição da deficiência de ferro latente para os resultados do Peate através de uma variável denominada DFL, onde 0=sem deficiência de ferro latente (DFL) e 1=DFL.
A análise estatística básica foi feita com o software GraphPad Prism, versão 7 para Windows (GraphPad Software, CA, EUA) e modelos multivariados pelo IBM SPSS (SPSS para Windows, Chicago, EUA). Os resultados foram apresentados como média± desvio‐padrão (DP), mediana (valor mínimo‐máximo) ou porcentagem, a depender da variável. A significância estatística das diferenças foi determinada pelo teste t não paramétrico (Mann‐Whitney) ou pelo teste exato de Fisher, como necessário. A correlação linear entre todas as variáveis foi calculada pelo método de Spearman. Modelos de regressão multivariada foram usados para análise de correlação múltipla de duas maneiras: 1) As variáveis significativas para p <0,10 no modelo univariado (correlação de Spearman) foram incluídas no modelo múltiplo para avaliar a contribuição de cada uma dessas variáveis; 2) Análise em um processo stepwise no qual os preditores não contribuintes foram excluídos pelo processo estatístico, destacaram‐se os correlatos mais significativos dos valores do Peate. A análise de covariância foi feita para avaliar a influência da DFL nos resultados do Peate, levou‐se em consideração a idade gestacional do RN. O nível de significância adotado foi de 5%.
ResultadosAmostras de sangue, testes EOA e Peate foram feitos em 109 RNs. O teste EOA foi normal em todos os indivíduos.
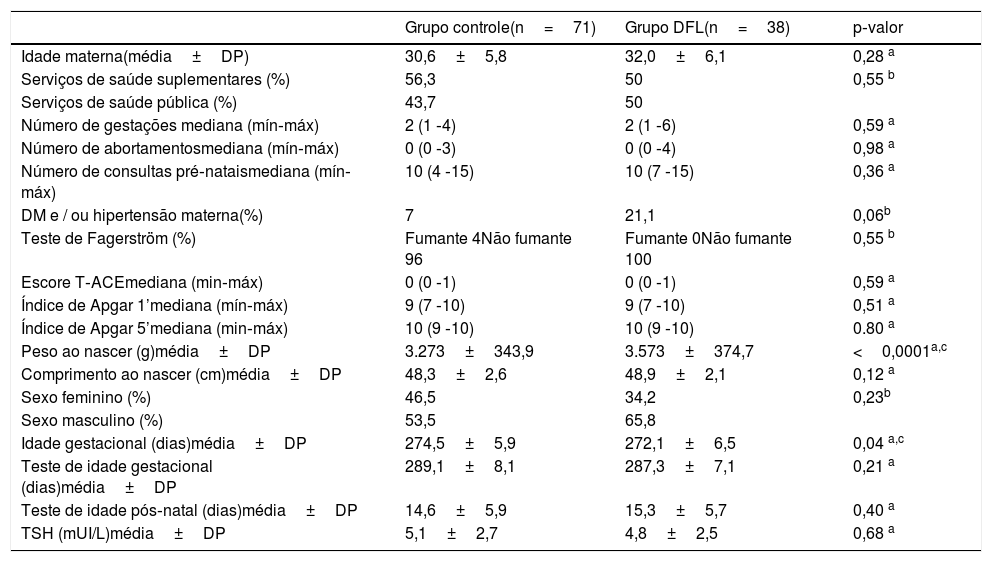
Após a divisão dos grupos, 71 RNs apresentaram ferritina sérica normal (> 75 ng/mL) e compuseram o grupo controle; 38 RNs apresentaram deficiência de ferro latente (≥ 11 e ≤ 75 ng/mL) e constituíram o grupo DFL (tabela 1). Não houve diferença significativa entre os grupos quanto à idade materna, ao número de gestações, aos abortamentos prévios e ao número de consultas de pré‐natal. O grupo DFL apresentou um número maior de gestantes com DM e/ou hipertensão (p=0,06) (tabela 1).
Características maternas e neonatais dos grupos Controle e DFL
| Grupo controle(n=71) | Grupo DFL(n=38) | p‐valor | |
|---|---|---|---|
| Idade materna(média±DP) | 30,6±5,8 | 32,0±6,1 | 0,28 a |
| Serviços de saúde suplementares (%) | 56,3 | 50 | 0,55 b |
| Serviços de saúde pública (%) | 43,7 | 50 | |
| Número de gestações mediana (mín‐máx) | 2 (1 ‐4) | 2 (1 ‐6) | 0,59 a |
| Número de abortamentosmediana (mín‐máx) | 0 (0 ‐3) | 0 (0 ‐4) | 0,98 a |
| Número de consultas pré‐nataismediana (mín‐máx) | 10 (4 ‐15) | 10 (7 ‐15) | 0,36 a |
| DM e / ou hipertensão materna(%) | 7 | 21,1 | 0,06b |
| Teste de Fagerström (%) | Fumante 4Não fumante 96 | Fumante 0Não fumante 100 | 0,55 b |
| Escore T‐ACEmediana (min‐máx) | 0 (0 ‐1) | 0 (0 ‐1) | 0,59 a |
| Índice de Apgar 1’mediana (mín‐máx) | 9 (7 ‐10) | 9 (7 ‐10) | 0,51 a |
| Índice de Apgar 5’mediana (min‐máx) | 10 (9 ‐10) | 10 (9 ‐10) | 0.80 a |
| Peso ao nascer (g)média±DP | 3.273±343,9 | 3.573±374,7 | <0,0001a,c |
| Comprimento ao nascer (cm)média±DP | 48,3±2,6 | 48,9±2,1 | 0,12 a |
| Sexo feminino (%) | 46,5 | 34,2 | 0,23b |
| Sexo masculino (%) | 53,5 | 65,8 | |
| Idade gestacional (dias)média±DP | 274,5±5,9 | 272,1±6,5 | 0,04 a,c |
| Teste de idade gestacional (dias)média±DP | 289,1±8,1 | 287,3±7,1 | 0,21 a |
| Teste de idade pós‐natal (dias)média±DP | 14,6±5,9 | 15,3±5,7 | 0,40 a |
| TSH (mUI/L)média±DP | 5,1±2,7 | 4,8±2,5 | 0,68 a |
DFL, deficiência de ferro latente; DM, diabetes mellitus; DP, desvio‐padrão; máx, máximo; mín, mínimo; T‐ACE, questionário de rastreamento alcoólico adaptado para identificar o risco de beber durante a gravidez; teste de Fagerström, instrumento padrão para avaliar o nível de dependência da nicotina; TSH, hormônio estimulante da tireoide.
O peso ao nascer foi significativamente maior e a IG significativamente menor no grupo DFL, quando comparado com o controle. O peso ao nascer para o grupo controle foi de 3,273± 343,9g e para o grupo DFL, 3,573± 374,7g, (p <0,0001). A média de IG do grupo controle foi de 274,5± 5,9 dias e para o grupo DFL, 272,1±6,5 (p=0,04). A idade pós‐natal e a idade gestacional corrigida para o teste de Peate não foram significativamente diferentes entre os grupos, assim como os índices de Apgar, comprimento ao nascer e distribuição por sexo (tabela 1).
Os valores de hematócrito foram 47,0±3,6 para o grupo controle e 48,4±4,3 para o grupo DFL (p=0,10). Os valores de ferritina foram 160,1±94,2 para o grupo controle e 49,6±17,1 para o grupo DFL. Os valores de ferritina foram significativamente diferentes entre os grupos, como resultado do desenho do estudo (p <0,0001).
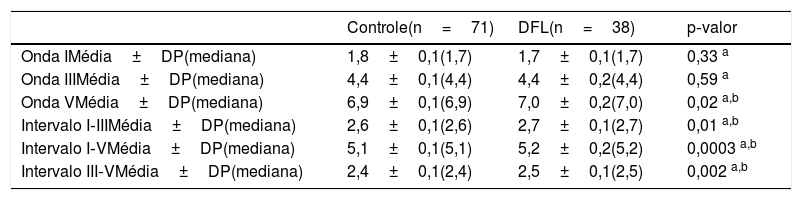
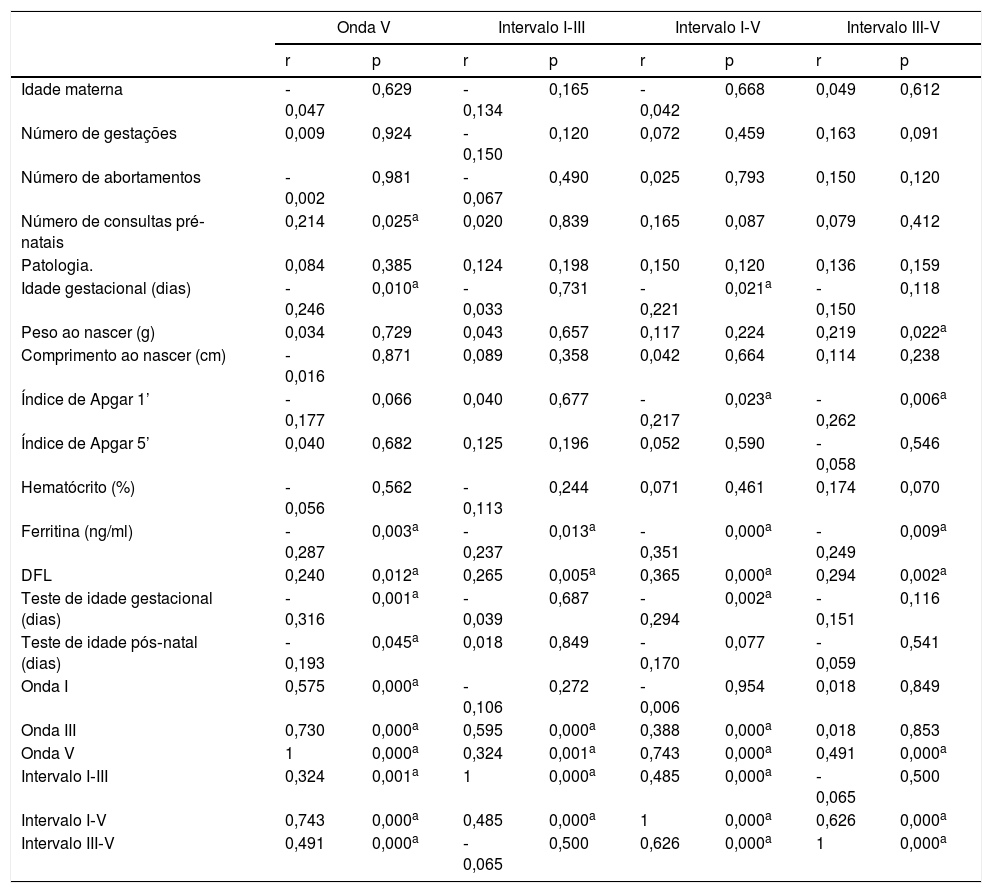
Os valores de latência da onda V (p=0,02), intervalos I‐III (p=0,014), I‐V (p=0,0003) e III‐V (p=0,002) foram significativamente maiores no grupo DFL em comparação com o grupo controle (tabela 2). Todos esses parâmetros apresentaram uma correlação negativa não paramétrica significativa com a ferritina e positiva com DFL: onda V (r=‐0,29; p=0,003; r=‐0,29; p=0,003), intervalo I‐III (r=‐0,24; p=0,013; r=‐0,29; p=0,003), intervalo I‐V (r=‐0,35; p=0,0002; r=‐0,29; p=0,003) e intervalo III‐V (r=‐0,25; p=0,009; r=‐0,29; p=0,003), respectivamente (tabela 3).
Valores de Peate para os grupos Controle e DFL
| Controle(n=71) | DFL(n=38) | p‐valor | |
|---|---|---|---|
| Onda IMédia±DP(mediana) | 1,8±0,1(1,7) | 1,7±0,1(1,7) | 0,33 a |
| Onda IIIMédia±DP(mediana) | 4,4±0,1(4,4) | 4,4±0,2(4,4) | 0,59 a |
| Onda VMédia±DP(mediana) | 6,9±0,1(6,9) | 7,0±0,2(7,0) | 0,02 a,b |
| Intervalo I‐IIIMédia±DP(mediana) | 2,6±0,1(2,6) | 2,7±0,1(2,7) | 0,01 a,b |
| Intervalo I‐VMédia±DP(mediana) | 5,1±0,1(5,1) | 5,2±0,2(5,2) | 0,0003 a,b |
| Intervalo III‐VMédia±DP(mediana) | 2,4±0,1(2,4) | 2,5±0,1(2,5) | 0,002 a,b |
DFL, grupo deficiência de ferro latente; DP, desvio‐padrão; Peate, Potencial Evocado Auditivo do Tronco Encefálico.
Coeficiente de correlação (r) e nível de significância (p) da análise de correlação (Spearman) da onda V, Intervalo I‐III, Intervalo I‐V, Intervalo III‐V e todas as variáveis relevantes
| Onda V | Intervalo I‐III | Intervalo I‐V | Intervalo III‐V | |||||
|---|---|---|---|---|---|---|---|---|
| r | p | r | p | r | p | r | p | |
| Idade materna | ‐0,047 | 0,629 | ‐0,134 | 0,165 | ‐0,042 | 0,668 | 0,049 | 0,612 |
| Número de gestações | 0,009 | 0,924 | ‐0,150 | 0,120 | 0,072 | 0,459 | 0,163 | 0,091 |
| Número de abortamentos | ‐0,002 | 0,981 | ‐0,067 | 0,490 | 0,025 | 0,793 | 0,150 | 0,120 |
| Número de consultas pré‐natais | 0,214 | 0,025a | 0,020 | 0,839 | 0,165 | 0,087 | 0,079 | 0,412 |
| Patologia. | 0,084 | 0,385 | 0,124 | 0,198 | 0,150 | 0,120 | 0,136 | 0,159 |
| Idade gestacional (dias) | ‐0,246 | 0,010a | ‐0,033 | 0,731 | ‐0,221 | 0,021a | ‐0,150 | 0,118 |
| Peso ao nascer (g) | 0,034 | 0,729 | 0,043 | 0,657 | 0,117 | 0,224 | 0,219 | 0,022a |
| Comprimento ao nascer (cm) | ‐0,016 | 0,871 | 0,089 | 0,358 | 0,042 | 0,664 | 0,114 | 0,238 |
| Índice de Apgar 1’ | ‐0,177 | 0,066 | 0,040 | 0,677 | ‐0,217 | 0,023a | ‐0,262 | 0,006a |
| Índice de Apgar 5’ | 0,040 | 0,682 | 0,125 | 0,196 | 0,052 | 0,590 | ‐0,058 | 0,546 |
| Hematócrito (%) | ‐0,056 | 0,562 | ‐0,113 | 0,244 | 0,071 | 0,461 | 0,174 | 0,070 |
| Ferritina (ng/ml) | ‐0,287 | 0,003a | ‐0,237 | 0,013a | ‐0,351 | 0,000a | ‐0,249 | 0,009a |
| DFL | 0,240 | 0,012a | 0,265 | 0,005a | 0,365 | 0,000a | 0,294 | 0,002a |
| Teste de idade gestacional (dias) | ‐0,316 | 0,001a | ‐0,039 | 0,687 | ‐0,294 | 0,002a | ‐0,151 | 0,116 |
| Teste de idade pós‐natal (dias) | ‐0,193 | 0,045a | 0,018 | 0,849 | ‐0,170 | 0,077 | ‐0,059 | 0,541 |
| Onda I | 0,575 | 0,000a | ‐0,106 | 0,272 | ‐0,006 | 0,954 | 0,018 | 0,849 |
| Onda III | 0,730 | 0,000a | 0,595 | 0,000a | 0,388 | 0,000a | 0,018 | 0,853 |
| Onda V | 1 | 0,000a | 0,324 | 0,001a | 0,743 | 0,000a | 0,491 | 0,000a |
| Intervalo I‐III | 0,324 | 0,001a | 1 | 0,000a | 0,485 | 0,000a | ‐0,065 | 0,500 |
| Intervalo I‐V | 0,743 | 0,000a | 0,485 | 0,000a | 1 | 0,000a | 0,626 | 0,000a |
| Intervalo III‐V | 0,491 | 0,000a | ‐0,065 | 0,500 | 0,626 | 0,000a | 1 | 0,000a |
DFL, variável que representa o papel da ferritina como ponto de corte (onde 0=sem deficiência de ferro latente (DFL] e 1=deficiência de ferro latente (DFL]); p, valor de p; Patologia, variável que explica o efeito das mães com diabetes mellitus (DM) ou hipertensão (categorizada como 0=sem patologia, 1=hipertensão e / ou DM); r, coeficiente de correlação.
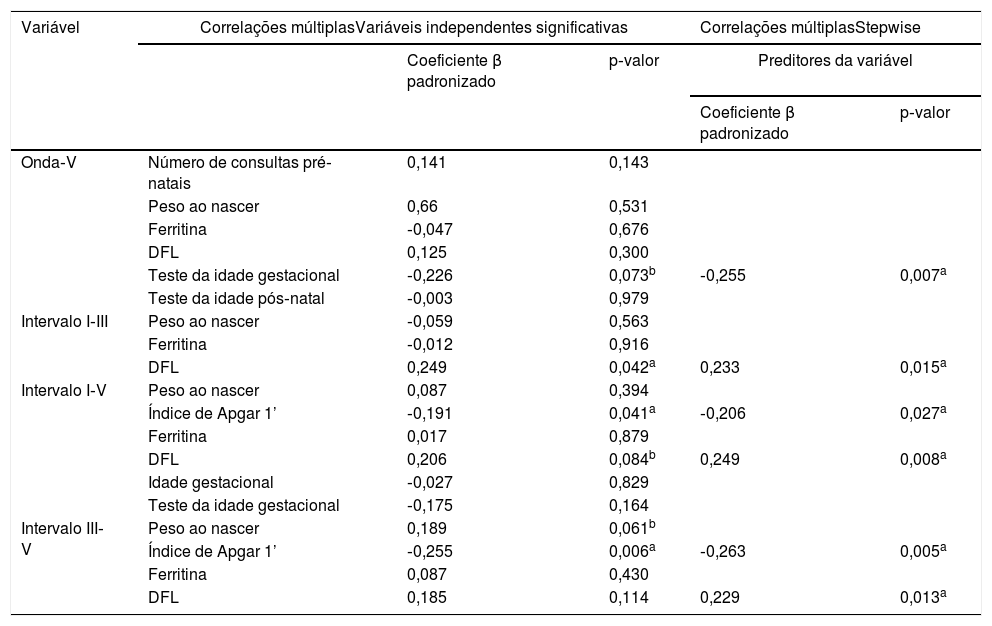
A análise de correlação múltipla das variáveis significativas para cada intervalo do Peate e onda V estão representadas na tabela 4. Com a abordagem stepwise, o preditor mais significativo dos valores da onda V foi o teste da idade gestacional (β padronizado=0,255, p=0,007); para o intervalo I‐III foi a DFL (β padronizado=0,233, p=0,015); para o intervalo I‐V foram a DFL (β padronizado=0,249, p=0,08) e Apgar 1’ (β padronizado=0,206, p=0,027); para o intervalo III‐V foram DFL (β padronizado=0,229, p=0,013) e Apgar 1’(β padronizado=0,263, p=0,05). A análise de covariância mostrou que a DFL contribuiu para os resultados de todos os intervalos do Peate, mesmo se levarmos em consideração a idade gestacional: intervalo I‐III (F=5,087, p=0,026), intervalo I‐V (F=6,436, p=0,013) e intervalo III‐V (F=5,856, p=0,017). A significância para a onda V foi limítrofe (F=2,909, p=0,91).
Análises de correlações múltiplas para onda V e intervalos I‐III, I‐V, III‐V
| Variável | Correlações múltiplasVariáveis independentes significativas | Correlações múltiplasStepwise | |||
|---|---|---|---|---|---|
| Coeficiente β padronizado | p‐valor | Preditores da variável | |||
| Coeficiente β padronizado | p‐valor | ||||
| Onda‐V | Número de consultas pré‐natais | 0,141 | 0,143 | ||
| Peso ao nascer | 0,66 | 0,531 | |||
| Ferritina | ‐0,047 | 0,676 | |||
| DFL | 0,125 | 0,300 | |||
| Teste da idade gestacional | ‐0,226 | 0,073b | ‐0,255 | 0,007a | |
| Teste da idade pós‐natal | ‐0,003 | 0,979 | |||
| Intervalo I‐III | Peso ao nascer | ‐0,059 | 0,563 | ||
| Ferritina | ‐0,012 | 0,916 | |||
| DFL | 0,249 | 0,042a | 0,233 | 0,015a | |
| Intervalo I‐V | Peso ao nascer | 0,087 | 0,394 | ||
| Índice de Apgar 1’ | ‐0,191 | 0,041a | ‐0,206 | 0,027a | |
| Ferritina | 0,017 | 0,879 | |||
| DFL | 0,206 | 0,084b | 0,249 | 0,008a | |
| Idade gestacional | ‐0,027 | 0,829 | |||
| Teste da idade gestacional | ‐0,175 | 0,164 | |||
| Intervalo III‐V | Peso ao nascer | 0,189 | 0,061b | ||
| Índice de Apgar 1’ | ‐0,255 | 0,006a | ‐0,263 | 0,005a | |
| Ferritina | 0,087 | 0,430 | |||
| DFL | 0,185 | 0,114 | 0,229 | 0,013a | |
DFL, deficiência de ferro latente, variável que representando o papel da ferritina como ponto de corte (onde 0 = sem deficiência de ferro latente [DFL] e 1 = deficiência de ferro latente [DFL]).
O cérebro e o sistema auditivo em desenvolvimento são particularmente vulneráveis a mudanças nutricionais durante a vida fetal e pós‐natal iniciais, especialmente devido ao processo acelerado de crescimento e desenvolvimento neuronal, mielinização e formação da rede sináptica cerebral.3 A DF perinatal resulta na deficiência das reações redox do metabolismo energético do hipocampo e do córtex frontal, modificações das concentrações de glutamato e dopamina e do padrão de mielinização neuronal.18
Este estudo mostrou que a deficiência de ferro latente determinou um aumento significativo na latência da onda V e de todos os intervalos interpicos no teste Peate, com uma correlação proporcional inversa entre as concentrações de ferritina sérica e os parâmetros do Peate. Em estudos com animais, a deficiência de ferro sem anemia resultou em diminuição do número de sinapses e em menor amplitude de onda no Peate, com aumento da suscetibilidade à perda auditiva induzida por ruído.19 Outros estudos em animais também relataram consequências funcionais significativas no Peate como resultado da deficiência de ferro limítrofe e em ratos Long‐Evans, a gravidade das alterações no Peate correlacionou‐se com o nível de ferro sérico.14 Lee et al. (2012) analisaram o Peate em ratas com deficiência de ferro e demonstraram uma diminuição significativa na velocidade de condução nervosa aos 40 dias de vida.6 Outros estudos em roedores demonstraram que as alterações neurocomportamentais resultantes da deficiência de ferro durante a gravidez e lactação persistem mesmo quando as concentrações de ferro são normalizadas após o desmame.20
Estudos em seres humanos também sugerem que a deficiência de ferro latente causa danos ao desenvolvimento neuropsicomotor de bebês prematuros e nascidos a termo. Tamura et al. (2002) relataram menos habilidades motoras e menor desenvolvimento de linguagem aos cinco anos em RNs com ferritina sérica no quartil inferior em comparação com aqueles com ferritina acima desse valor.21 Em outro estudo, recém‐nascidos de mães diabéticas com baixos níveis séricos de ferritina no soro do cordão umbilical apresentaram menor memória de reconhecimento auditivo ao nascimento e escores menores de desenvolvimento psicomotor com um ano.22
Em um estudo que mostrou uma associação entre a DFL e ondas do Peate, 33 RNs com ferritina normal e 12 RNs com DFL, com idade gestacional ≥ 35 semanas, encontrou‐se latência significativamente aumentada em indivíduos com DFL, conforme demonstrado neste estudo.15 Outro estudo avaliou os RNs com idade gestacional ≥ 34 semanas e os resultados indicaram maior latência de onda V e intervalos interpicos I‐V e III‐V no grupo DFL.13 Lou (2016) também mostrou que aos 10 meses bebês nascidos com deficiência de ferro latente também apresentavam diminuição da amplitude da onda V e aumento da latência da onda I.16 Todos esses estudos, inclusive o nosso, demonstraram alterações no intervalo I‐V, o que pode significar que toda a via auditiva pode ser afetada pela deficiência de ferro intrauterina. O grau de reversibilidade das alterações do Peate secundárias à DFL intrauterina ainda não está bem estabelecido e faltam estudos que definam em que medida e até quando as alterações causadas pela DFL podem perdurar, bem como os fatores que afetam a reversibilidade dessas alterações.16 Berglund et al. (2011), por exemplo, fizeram um ensaio de intervenção com ferro e não demonstraram um efeito auditivo significativo da suplementação de ferro pós‐natal em bebês com peso ao nascer marginalmente baixo.23
Neste estudo, houve uma diferença significativa na idade gestacional entre os dois grupos, o que poderia ser um fator de confusão para a análise, embora todo o grupo estudado fosse nascido a termo e o teste de idade do Peate e o teste de idade pós‐natal não fossem significativamente diferentes entre os grupos. A correlação entre a IG e os valores do Peate (onda V, intervalos I‐III e I‐V) mostrou que, mesmo em RNs a termo, a idade gestacional influencia os valores do Peate. No entanto, este estudo e estudos recentes com um desenho metodológico similar que incluíram RNs ≥ 35 semanas15 ou ≥ 34 semanas,13 demonstraram uma relação significativa entre a DFL e latências mais altas no Peate, mesmo após o controle da IG como uma variável.
Usamos a concentração de ferritina para definir um estado de deficiência de ferro latente, um parâmetro também usado em estudos recentes sobre o assunto.16 Embora existam novos ensaios de armazenamento de ferro, além da ferritina, eles não foram padronizados para uso em neonatos e não estão prontamente disponíveis.17
Uma questão não respondida é se as alterações na mielinização das vias auditivas são representativas do desenvolvimento da substância branca em outras áreas do cérebro.24
Também não está claro se os lactentes com risco de deficiência de ferro devem ser rotineiramente avaliados quanto aos níveis de ferro logo após o nascimento.25 Isso pode ser crítico para populações nas quais a deficiência de ferro materna durante a gravidez é muito comum, como a população brasileira. Atualmente, a suplementação de ferro não é recomendada para recém‐nascidos a termo nos primeiros meses após o nascimento26,27 e não há evidências de que a reposição de ferro precoce no período neonatal seja capaz de reverter as mudanças no desenvolvimento do SNC e no sistema auditivo.23,28,29
Uma limitação deste estudo é que, como em outros estudos observacionais, não foi possível estabelecer uma relação causal entre as alterações do Peate e a deficiência de ferro latente e atualmente não temos dados referentes ao acompanhamento subsequente desses RNs.16 Mais pesquisas são necessárias para responder a essas perguntas.
Em conclusão, a anemia por deficiência de ferro ainda é uma patologia muito prevalente e esta pesquisa, além de outros estudos sobre o assunto, aponta para danos sérios e talvez irreversíveis na maturação auditiva relacionados à DFL no útero. Portanto, é importante tomar medidas eficazes para a prevenção e manejo adequado desse desafio nutricional nas diferentes fases da vida, tais como suplementação de ferro durante a gestação, controle de doenças que apresentam risco de DF durante o período gestacional e avaliação e tratamento da anemia em qualquer fase da vida, especialmente nos indivíduos mais vulneráveis e em risco, como os RNs e grávidas.
Conformidade com padrões éticosA pesquisa foi aprovada pelo Comitê de Ética em Pesquisa com Seres Humanos da Universidade Federal de São Carlos (processo no 791,511).
FinanciamentoEste trabalho foi financiado pela Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) [concessão número 2015/15471‐4].
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosA todas as famílias que participaram desta pesquisa, bem como à Maternidade Santa Casa de Misericórdia. Agradecemos também à Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) pelo financiamento para a feitura deste projeto de pesquisa.
Como citar este artigo: Pallone LV, Jesus FA, Gonçalves GA, Navarra LC, Melo DG, Ferreira RA, et al. Effects of intrauterine latent iron deficiency on auditory neural maturation in full‐term newborns. J Pediatr (Rio J). 2020;96:202–9.