Fructooligosacharides and galactooligosacharides soften fecal bolus and increase frequency of depositions when added to infant formula. This study aimed to determine the effects of galactooligosaccharide in pediatric patients with chronic constipation.
MethodsFrom 2010 to 2012, 20 constipated patients (4‐16 years of age) attended to at a primary healthcare unit were enrolled in a double‐blinded, placebo‐controlled crossover trial. Eleven children ingested galactooligosaccharide (1.7g) for 30 days, followed by a 15‐day washout period, and a 30‐day period of placebo (maltodextrin). Nine patients ingested maltodextrin for 30 days, followed by 15‐day washout period, and galactooligosaccharide (1.7g) for 30 days. Constipation symptoms were considered as primary outcomes: bowel movements/week, straining during defecation, and stool consistency. Outcome symptoms were ranked according to a numerical scale elaborated for this study. Data were recorded at baseline, and on days 15 and 30 of each 30‐day crossover period. Repeated‐measures analysis of variance (ANOVA) was used to analyze symptoms along time.
ResultsAt baseline, there was no significant difference in symptoms severity between groups (p=0.45). Galactooligosaccharide ingestion was related to increase of the bowel movement frequency, p<0.0001; relief of defecation straining, p<0.0001; and decrease in stool consistency, p=0.0014, compared to placebo ingestion. Patients reported no side effects from galactooligosaccharide.
ConclusionGalactooligosaccharide was effective at improving clinical symptoms in this group of constipated children.
A adição de frutooligossacarídeos e galactooligossacarídeos a fórmulas infantis pode diminuir a consistência fecal e aumentar a frequência das evacuações. O objetivo do presente estudo foi determinar o efeito do galactooligossacarídeo em crianças com constipação crônica.
MétodosEntre 2010 e 2012, 20 pacientes constipados (4‐16 anos), atendidos numa unidade básica de saúde, completaram ensaio clínico duplo cego, placebo‐controlado e de delineamento crossover. Onze pacientes receberam galactooligossacarídeo (1,7g) por 30 dias, seguidos por 15 dias de washout, e, após, placebo (maltodextrina) por 30 dias; nove pacientes receberam placebo 30 dias, seguidos de 15 dias de washout e 30 dias de galactooligossacarídeo (1,7g). Os desfechos primários foram frequência semanal de evacuações, esforço evacuatório e consistência fecal, classificada por escala numérica elaborada para este estudo e compilada no primeiro, 15¿ e 30¿ dias de cada período de crossover. Análise estatística foi feita por método de análise de variância (Anova) para medidas repetidas.
ResultadosIntensidade dos sintomas nos grupos foi semelhante no início do estudo (p=0,45). Durante a ingestão de galactooligossacarídeo constatou‐se maior frequência de evacuações, p<0,0001, menor dificuldade evacuatória, p<0,0001 e diminuição da consistência fecal, p=0,0014. Efeitos colaterais não foram referidos durante a ingestão do prebiótico.
ConclusãoDurante a ingestão de galactooligossacarídeo os sintomas clínicos da constipação em crianças e adolescentes foram significantemente aliviados.
Dados sobre as últimas décadas indicaram a constipação infantil como um problema comum em todo o mundo e sua prevalência relatada variou de 0,7% a 30%. Além disso, nos últimos anos, o número de pacientes cresceu significativamente no mundo ocidental.1,2 Foram recomendadas diferentes terapêuticas para o tratamento da constipação, inclusive emolientes fecais, suplementação com fibra alimentar, laxantes, procinéticos e alimentos funcionais. Laxantes osmóticos e fibras alimentares são as ferramentas terapêuticas mais amplamente usadas; porém há muito poucos estudos comprovados para embasar quaisquer recomendações de tratamento da constipação em pacientes pediátricos.3,4
Alimentos funcionais com probióticos ou prebióticos foram identificados como úteis no estabelecimento de hábitos intestinais em crianças.5 Um estudo multicêntrico controlado mostrou que o consumo de laticínios fermentados que contêm Bifidobacterium lactis foi associado como um fator que aumenta a frequência de evacuações em crianças com constipação e frequência de evacuação < 3 vezes/semana.6
Com relação aos efeitos dos prebióticos sobre o efeito laxante, estudos feitos em pacientes pediátricos incluíram predominantemente neonatos alimentados exclusivamente com fórmulas lácteas. A ingestão de prebióticos mostrou‐se eficaz no tratamento da constipação, pois o consumo de frutooligossacarídeos e galactooligossacarídeos adicionados a fórmulas infantis aumenta o bolo fecal e a frequência das evacuações.7‐10
A lógica dos efeitos terapêuticos dos prebióticos sobre a constipação tem como base o fato de que os galactooligossacarídeos afetam a saúde do hospedeiro e estimulam o crescimento e/ou a atividade das bifidobactérias no cólon.11 As bifidobactérias, principalmente Lactobacillus acidophillus ou Bifidobacterium bifidum, fermentam carboidratos e produzem ácidos graxos de cadeia curta (AGCCs), o maior ânion no intestino grosso; os AGCCs conseguem aumentar o fluxo sanguíneo no cólon e a atividade muscular, melhorar o peso fecal úmido e promover, assim, o efeito laxante.12,13
O artigo atual visou avaliar a eficácia do prebiótico galactooligossacarídeo (GOS) no tratamento da constipação em crianças e adolescentes.
MétodosModelo: um estudo não randomizado, duplo cego, placebo‐controlado e de delineamento crossover foi feito de 8 de agosto de 2010 a 25 de março de 2012.
Configuração: unidade básica de saúde administrada por uma equipe de faculdade de medicina.
Pacientes: indivíduos de quatro a 16 anos que buscaram espontaneamente atendimento médico e após o primeiro exame, quando elegíveis, foram convidados a participar do estudo.
Critérios de elegibilidadeCritérios de inclusão: diagnóstico de constipação com base nos critérios Roma III para distúrbios funcionais.14 Adicionalmente, a fim de excluir intolerância a lactose e para serem incluídos no estudo, os pacientes devem relatar ingestão diária de no mínimo 250mL de leite de vaca sem relatar sintomas, especificamente dor abdominal, cólicas, diarreia ou flatulência após ingestão de leite.
Critérios de não inclusão: pacientes com outras condições de comorbidade, aqueles já em tratamento da constipação e aqueles que fizeram uso de antibióticos ou probióticos nos últimos seis meses.
Produtos estudadosProduto de teste: o prebiótico galactooligossacarídeo foi produzido da lactose por meio da ação da enzima β‐galactosidase, produzida pelo micro‐organismo da espécie Scopulariopsis.15 Um volume diário de 6mL da solução com Maltodextrina (placebo) prescrita e GOS ingerida pela manhã. Na mistura de GOS usada, um volume de 6mL continha 1,7g de GOS. Os pais e participantes foram informados dos possíveis efeitos colaterais da ingestão de GOS, como distensão abdominal, flatulência, cólicas abdominais e diarreia.
Controle: o placebo consistiu de uma solução com maltodextrina.
DesconhecimentoOs dois tratamentos, o prebiótico galactooligossacarídeo e placebo, foram idênticos quanto a viscosidade, cor, cheiro, gosto e embalagem. Todos os pacientes e a equipe de pesquisadores envolvidos não estavam cientes do tratamento administrado ao paciente.
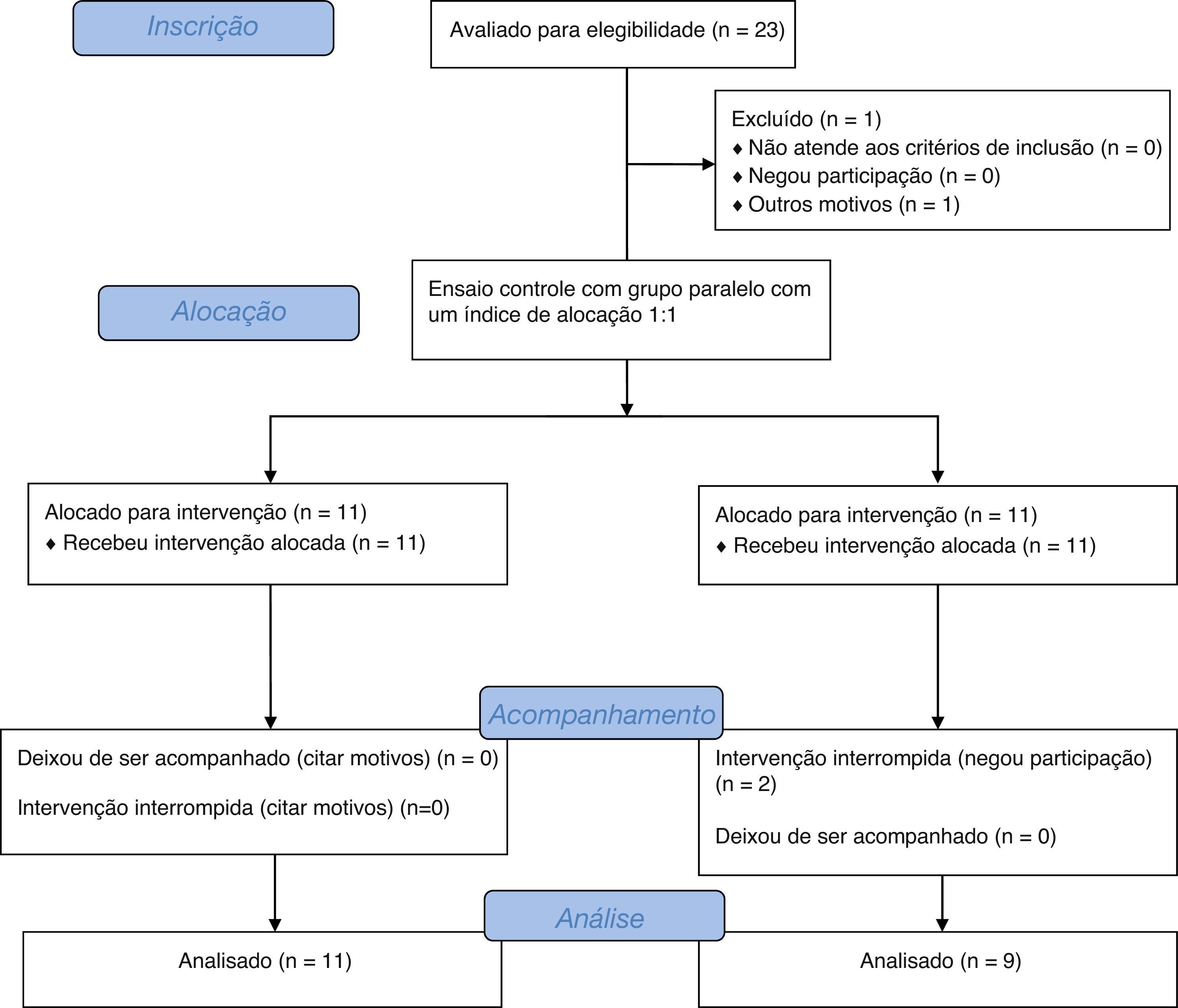
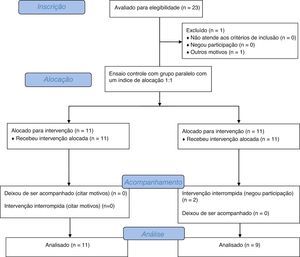
Ordem de inclusão de pacientes no estudo e fluxogramaO ensaio consistiu de um modelo crossover de duas sequências, dois períodos e dois tratamentos. Cada período de crossover durou 30 dias, separado por 15 dias como período de washout. A sequência de ingestão do galactooligossacarídeo (GOS) ou placebo definida pelo primeiro paciente inscrito no estudo foi escolhida por lote. A ordem de ingestão nos pacientes a seguir foi sistematicamente alternada. A figura 1 mostra um fluxograma do estudo.16
Estudo do fluxograma de acordo com os padrões consolidados de ensaios clínicos para divulgação.30
A coleta de dados clínicos relacionada aos sintomas de constipação, a entrega das substâncias (GOS e placebo) e o controle de uso foram atingidos durante as visitas domiciliares a cada duas semanas: no início do estudo, 15° dia e 30° dia, ambos com período de estudo de 30 dias. O uso das substâncias foi verificado pela devolução de frascos usados.
Cálculo do tamanho da amostraOs dados dos 10 primeiros indivíduos que concluíram o estudo foram examinados pela análise de variância (Anova) para calcular o tamanho da amostra.17 Foi usado o software SAS para calcular o tamanho da amostra, versão 9.2 do Sistema SAS para Windows (SAS Institute Inc. Cary, NC, EUA). A análise estatística com Anova foi aplicada para medidas repetidas. A Anova foi usada para analisar tratamentos comparativos, considerando a diferença nos resultados. Foi aplicada a análise de capacidade no contexto da Anova pressupondo um modelo crossover de duas sequências, dois períodos e dois tratamentos, a dimensão do efeito na população, o tamanho da amostra e o nível de significância. Um efeito estatisticamente significativo na Anova foi acompanhado testes de acompanhamento a fim de avaliar qual variável foi diferente entre os grupos. Os testes de acompanhamento foram feitos post hoc. O software SAS fpower foi então usado para calcular o tamanho da amostra após especificar a capacidade do estudo em 90% e alfa – 0,05. Essa fase mostrou que, por meio de uma análise de capacidade de 90%, seriam necessários nove indivíduos em cada grupo.
Não foi permitida suplementação adicional com fibra alimentar até a conclusão do ensaio. Fibra alimentar foi prescrita aos pacientes que recusaram participar ou que concluíram o estudo.
EfeitosTrês sintomas foram considerados desfechos primários: evacuações semanais, consistência fecal e esforço evacuatório/dor na evacuação. Esses sintomas foram classificados de acordo com valores numéricos. A frequência das evacuações foi classificada de 1 a 3da seguinte forma: 1=≥ 3 vezes por semana; 2=1 a 2 vezes por semana; e 3=< uma vez por semana. A intensidade do esforço evacuatório/dor na evacuação foi classificada de 1 a 3 (1=ausência de desconforto ou dor, 2=dor e/ou desconforto episódico e 3 = dor e/ou desconforto durante toda evacuação). A consistência fecal foi definida de acordo com uma escala fotográfica18 e variou de 3 a 0 (3 = pedaços duros, separados, 2 = tipo banana com rachaduras profundas, 1 = tipo banana com rachaduras superficiais e 0 = tipo banana com pedaços moles e separados/amolecidos. A soma de valores variou entre 2 e 9 e foi considerado um escore clínico que caracterizou a intensidade dos sintomas. A avaliação física e os escores dos pacientes foram compilados na entrevista inicial e no 15° e 30° dias em cada período.
Análise estatísticaAs análises descritivas foram feitas incluindo medidas da tendência central e dispersão das variáveis numéricas. No início do estudo foram comparados os dados clínicos e demográficos (teste de Mann‐Whitney).
O efeito do GOS foi determinado de acordo com um delineamento crossover de dois períodos e dois tratamentos: GOS e placebo. O teste de Kolmogorov‐Smirnov foi feito para testar a normalidade e os dados rejeitaram a hipótese de normalidade nula. Para a análise estatística, usamos a Anova para medidas repetidas com transformação na classificação (Anova em classificações). Classificação é um procedimento usado para transformar dados que violam as hipóteses de normalidade. A Anova em classificações significa que uma análise de variância padrão é calculada com base em dados transformados em classificação. O nível de significância adotado para os testes estatísticos foi de 5%.
O estudo foi aprovado pelo comitê de ética da instituição sob o processo número 366/2009, CAAE: 0280.0.146.000‐09. Todos os participantes e/ou pais responsáveis pela criança assinaram um formulário de consentimento informado por escrito. O estudo foi revisado e publicado no website americano ClinicalTrials.gov, número identificador: NCT0283766.
ResultadosForam incluídos inicialmente 23 pacientes, porém três deixaram de ser acompanhados devido a mudança de endereço sem comunicação prévia. Foram incluídas 20 crianças e adolescentes entre quatro e 16 anos, 8,8±4,1 anos (média ± DP). Doze crianças eram meninas. Após tomada de conhecimento, observou‐se que 11 pacientes receberam a sequência de GOS e placebo e nove pacientes receberam a sequência placebo e GOS. Nenhum dos pacientes recusou tratamento ou apresentou baixa aceitação da medicação. Na entrevista inicial, todos os pacientes relataram menos de três evacuações por semana ou fezes com consistência dura.
Como os pacientes foram alocados sistematicamente para os grupos de acordo com os cuidados de saúde consecutivos na primeira consulta, o efeito da alocação (ordem de ingestão do produto) foi calculado pela Anova para medidas repetidas e não mostrou diferença entre os escores dos grupos determinados pela alocação do grupo, p = 0,9427.
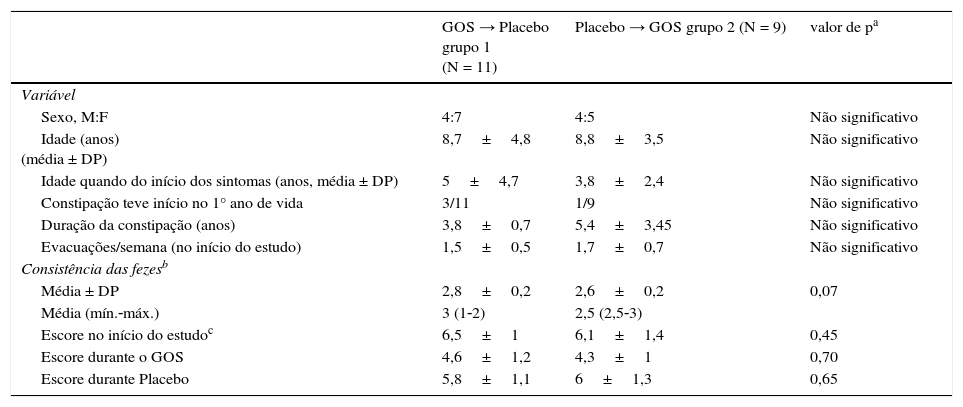
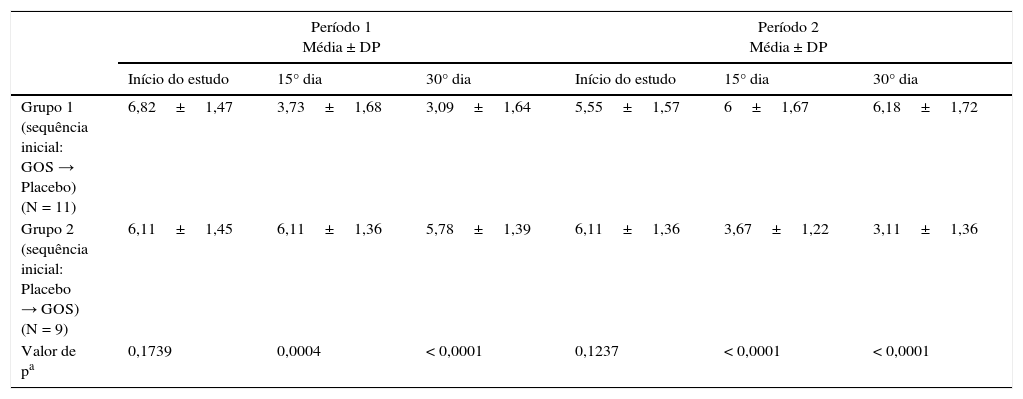
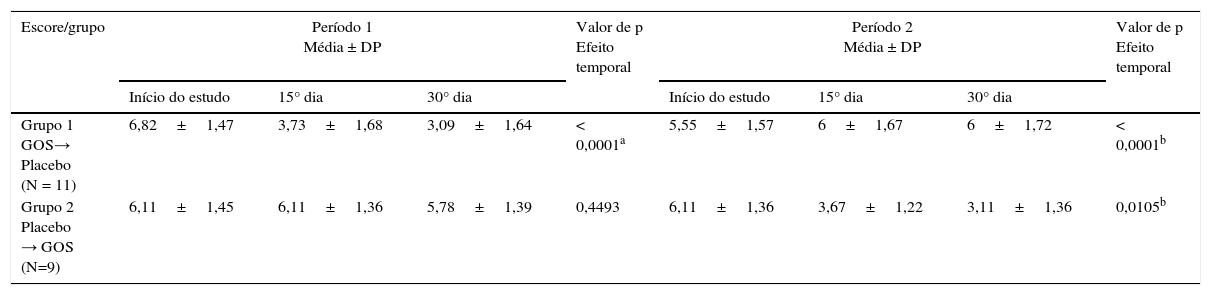
Escores clínicos com o passar do tempoA tabela 1 mostra os dados clínicos demográficos de 20 pacientes que concluíram o estudo. As tabelas 2 e 3 mostram a distribuição dos escores clínicos, considerando o efeito do GOS e o efeito temporal, respectivamente, ou seja, os escores clínicos com o passar do tempo. A média dos escores clínicos apresentou redução significativa durante a ingestão de GOS em ambos os grupos (tabela 2). A média dos escores clínicos com o passar do tempo mostrou que o efeito do GOS durou ao longo de sua ingestão, considerando que o período de washout anulou o efeito do GOS. Não houve interação entre os grupos/tempo (tabela 3).
Características demográficas e clínicas no início do estudo
| GOS → Placebo grupo 1 (N = 11) | Placebo → GOS grupo 2 (N = 9) | valor de pa | |
|---|---|---|---|
| Variável | |||
| Sexo, M:F | 4:7 | 4:5 | Não significativo |
| Idade (anos) (média ± DP) | 8,7±4,8 | 8,8±3,5 | Não significativo |
| Idade quando do início dos sintomas (anos, média ± DP) | 5±4,7 | 3,8±2,4 | Não significativo |
| Constipação teve início no 1° ano de vida | 3/11 | 1/9 | Não significativo |
| Duração da constipação (anos) | 3,8±0,7 | 5,4±3,45 | Não significativo |
| Evacuações/semana (no início do estudo) | 1,5±0,5 | 1,7±0,7 | Não significativo |
| Consistência das fezesb | |||
| Média ± DP | 2,8±0,2 | 2,6±0,2 | 0,07 |
| Média (mín.‐máx.) | 3 (1‐2) | 2,5 (2,5‐3) | |
| Escore no início do estudoc | 6,5±1 | 6,1±1,4 | 0,45 |
| Escore durante o GOS | 4,6±1,2 | 4,3±1 | 0,70 |
| Escore durante Placebo | 5,8±1,1 | 6±1,3 | 0,65 |
Escore clínico apresentado em média ± DP.
GOS, galactooligossacarídeo.
Escores clínicos com base na frequência de evacuação, consistência fecal e desconforto durante e evacuação
| Período 1 Média ± DP | Período 2 Média ± DP | |||||
|---|---|---|---|---|---|---|
| Início do estudo | 15° dia | 30° dia | Início do estudo | 15° dia | 30° dia | |
| Grupo 1 (sequência inicial: GOS → Placebo) (N = 11) | 6,82±1,47 | 3,73±1,68 | 3,09±1,64 | 5,55±1,57 | 6±1,67 | 6,18±1,72 |
| Grupo 2 (sequência inicial: Placebo → GOS) (N = 9) | 6,11±1,45 | 6,11±1,36 | 5,78±1,39 | 6,11±1,36 | 3,67±1,22 | 3,11±1,36 |
| Valor de pa | 0,1739 | 0,0004 | < 0,0001 | 0,1237 | < 0,0001 | < 0,0001 |
GOS, galactooligossacarídeo.
Dados clínicos e efeito tempo (dados clínicos com o passar do tempo) com o uso da análise de variância (Anova)
| Escore/grupo | Período 1 Média ± DP | Valor de p Efeito temporal | Período 2 Média ± DP | Valor de p Efeito temporal | ||||
|---|---|---|---|---|---|---|---|---|
| Início do estudo | 15° dia | 30° dia | Início do estudo | 15° dia | 30° dia | |||
| Grupo 1 GOS→ Placebo (N = 11) | 6,82±1,47 | 3,73±1,68 | 3,09±1,64 | < 0,0001a | 5,55±1,57 | 6±1,67 | 6±1,72 | < 0,0001b |
| Grupo 2 Placebo → GOS (N=9) | 6,11±1,45 | 6,11±1,36 | 5,78±1,39 | 0,4493 | 6,11±1,36 | 3,67±1,22 | 3,11±1,36 | 0,0105b |
Os valores do escore clínico variam de 9 (maior gravidade) a 2 (ausência de sintomas).
GOS, galactooligossacarídeo.
O prebiótico galactooligossacarídeo (GOS) quando ingerido por crianças constipadas mostrou‐se eficaz no aumento da frequência de evacuações, aliviou a dor ou o desconforto durante a evacuação e amoleceu a consistência das fezes. Nenhum evento adverso foi relatado.
O GOS foi eficaz na melhoria da constipação em idosos, grávidas e neonatos.19,20 Contudo, no melhor de nosso conhecimento, nenhum ensaio clínico avaliou os efeitos do GOS em crianças ou adolescentes constipados. Estudos que incluíram crianças em idade escolar ou adolescentes enquanto tratados em clínicas ambulatoriais são altamente onerosos e exigem controle rigoroso com relação à adesão aos medicamentos. No presente estudo, foi necessário esforço considerável para medir a adesão e os sintomas por meio de visitas domiciliares frequentes.
Os principais sintomas de crianças constipadas que buscam unidades básicas de saúde incluem fezes duras e grandes intervalos entre as evacuações. Menos de 15% dos pacientes relataram incontinência fecal retentiva.21 O tratamento primário prescrito para os sintomas de constipação iniciais em crianças varia consideravelmente e normalmente menos de 50% desses pacientes são tratados com sucesso.22 A ingestão de GOS promoveu alívio das queixas durante sua ingestão, independentemente de outra recomendação adjuvante.
No presente estudo, a duração média foi de três a cinco anos, provavelmente a maioria dos pacientes já tinha sido tratada, porém não deu continuidade à terapia. Nenhum paciente relatou sintomas de incontinência fecal retentiva ou apresentou retenção fecal palpável no abdome ou identificada por exame retal. Aparentemente, os pacientes apresentam constipação leve, responsiva a laxantes orais e sem complicações. Esse quadro clínico é encontrado comumente em unidades básicas de saúde em crianças constipadas. Nossos dados mostram que, como um grupo, crianças e adolescentes melhoram quando usam GOS e nenhuma mudança no sintoma foi registrada com placebo. Nenhum outro tipo de terapia foi recomendado, exceto adesão rigorosa aos produtos.
Apesar da escassez de dados que forneçam comprovação conclusiva para embasar as recomendações atuais de ingestão de fibras para pacientes pediátricos constipados, ensaios clínicos pediátricos mostraram que a ingestão de fibra alimentar aumenta a frequência de evacuação e a consistência mais leve das fezes.23 A modificação alimentar para aumentar o consumo de fibras é considerada um importante componente no tratamento da constipação. Suplementação de fibras alimentares não foi prescrita durante este ensaio, a fim de melhor avaliar o efeito isolado do GOS sobre as características fecais. Fibra alimentar foi prescrita aos indivíduos que se recusaram a participar ou que concluíram o estudo.
A ampla faixa etária e o tamanho da amostra devem ser discutidos como limitações no presente estudo. A patogênese de constipação não orgânica está intimamente relacionada à recusa de ir ao banheiro causada por dor durante a evacuação, geralmente durante o período de educação para usar o banheiro. Esses pacientes normalmente têm um histórico anterior de fezes duras e evacuação não frequente e dolorosa, normalmente acompanhada de gritos e retenção das fezes. Quando os sintomas não são tratados, a condição avança até que seja feito um diagnóstico. Em cerca de 50% das crianças pode ser observado um resultado de longo prazo e 25% das crianças com constipação funcional continuam a apresentar sintomas na vida adulta.24 A constipação de longo prazo está associada a impactação fecal, incontinência retentiva e megarreto. Independentemente das complicações e da idade, bons resultados clínicos foram definidos como > ou = 3 evacuações por semana por > ou = 4 semanas, com < ou = 2 episódios de incontinência fecal por mês, independentemente do uso de laxantes.24 Considerando o contexto da patogênese, deve‐se destacar que, apesar da variabilidade da idade, os indivíduos incluídos apresentam sintomas muito semelhantes em suas características de constipação e nenhum indivíduo apresenta sinais de complicações, como impactação fecal e exigência de laxantes agressivos. A respeito da questão amostra pequena, pode‐se considerar que o modelo crossover foi escolhido pois possibilita que os pesquisadores façam comparações entre amostras pequenas e o tamanho da amostra foi definido basicamente como suficiente pela análise estatística. Ao aceitar essas considerações, pode‐se dizer que os resultados atuais são verdadeiros para pacientes com sintomas leves.
Em estudos feitos para avaliar os efeitos dos prebiótico sobre a constipação infantil, a duração do tratamento variou de 21 dias a oito semanas para avaliação dos sintomas. Um período de quatro semanas foi proposto com base nesses estudos.25‐27
A dose fixa de GOS foi escolhida para fornecer um equilíbrio adequado entre a eficácia e a tolerância e, de acordo com os resultados dos ensaios em adultos, não pudemos verificar o efeito bifidogênico sobre a microbiota ou o aumento da produção de ácidos graxos de cadeia curta (AGCC) fecais. De acordo com a literatura, a adição de 12g/dia de GOS mostrou‐se eficaz e bem tolerada e resultou em aumento da quantidade fecal de bifidobactérias em indivíduos saudáveis.28,29 Mostrou‐se que a dose segura estimada em adultos varia de 0,3 a 0,4g/kg/dia e 2,5g de GOS é suficiente para induzir um efeito bifidogênico.30 Uma quantidade excessiva de GOS pode causar efeitos osmóticos adversos e levar a diarreia osmótica, sintomas não relatados por nossos pacientes durante a ingestão de GOS.
O estudo‐piloto mostrou que o GOS melhora os sintomas clínicos de constipação e pode representar uma medida favorável no tratamento da constipação. Para confirmar esses achados, é necessário um grande ensaio randomizado controlado por placebo.
FinanciamentoFaepex (Fundo de Apoio ao Ensino, à Pesquisa e à Extensão) da Faculdade de Ciências Médicas da Universidade Estadual de Campinas, liberado em 12/11/2009 sob o n° 519.294.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Beleli CA, Antonio MA, dos Santos R, Pastore GM, Lomazi EA. Effect of 4’galactooligosaccharide on constipation symptoms. J Pediatr (Rio J). 2015;91:567–73.
Trabalho vinculado à Faculdade de Ciências Médicas e Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil.
Trabalho conduzido em Unidade de Saúde Básica na periferia de Campinas, coordenado por equipe de pediatras do Departamento de Pediatria, Faculdade de Ciências Médicas, Universidade Estadual de Campinas (Unicamp), Campinas, SP, Brasil.