Evaluate the effect of combinations of green banana biomass and laxatives in children and adolescents with chronic constipation.
MethodsThis was a randomized study of 80 children and adolescents with functional constipation according to the Rome IV Criteria, who were divided into five groups: (1) green banana biomass alone; (2) green banana biomass plus PEG 3350 with electrolytes; (3) green banana biomass plus sodium picosulfate; (4) PEG 3350 with electrolytes alone; and (5) sodium picosulfate alone. Primary outcome measure was the reduction of the proportion of patients with Bristol Stool Form Scale ratings 1 or 2. Secondary outcome measures were: increase of the proportion of >3 bowel movements/week and reduction of the proportion of fecal incontinence, straining on defecation, painful defecation, blood in stool, abdominal pain, and decreased laxative doses.
ResultsOn consumption of green banana biomass alone, a statistically significant reduction was observed in the proportion of children with Bristol Stool Form Scale rating 1 or 2, straining on defecation, painful defecation, and abdominal pain. Conversely, no reduction was observed in fecal incontinence episodes/week, blood in stool, and no increase was observed in the proportion of children with >3 bowel movements/week. The percentage of children who required decreased laxative dose was high when green banana biomass was associated with sodium picosulfate (87%), and PEG 3350 with electrolytes (63%). Green banana biomass alone and associated with laxatives was well tolerated, and no adverse effects were reported.
ConclusionGreen banana biomass is advantageous as an adjunct therapy on functional constipation, mainly for reducing doses of laxatives.
Avaliar o efeito das combinações da biomassa de banana verde e laxantes em crianças e adolescentes com constipação crônica.
MétodosEstudo randomizado de 80 crianças e adolescentes com constipação funcional de acordo com os Critérios de Roma IV divididos em cinco grupos: 1) Somente biomassa de banana verde; 2) Biomassa de banana verde mais PEG 3350 com eletrólitos; 3) Biomassa de banana verde mais picossulfato de sódio; 4) PEG 3350 somente com eletrólitos e 5) somente picossulfato de sódio. O desfecho primário foi a redução da proporção de pacientes com as classificações 1 ou 2da Escala de Bristol para Consistência de Fezes. Os desfechos secundários foram: aumento da produção de > 3 evacuações/semana e redução da proporção de incontinência fecal, esforço na defecação, defecação dolorosa, sangue nas fezes, dor abdominal e redução nas dose de laxantes.
ResultadosNo consumo somente de biomassa de banana verde há uma redução estatisticamente significativa na proporção de crianças com classificação 1 ou 2da Escala de Bristol para Consistência de Fezes, esforço na defecação, defecação dolorosa e dor abdominal. Por outro lado, não houve redução nos episódios fecais/semana de incontinência, sangue nas fezes e nenhum aumento na proporção de crianças com > 3 evacuações/semana. O percentual de crianças que tiveram sua dose de laxante reduzida foi alto quando a biomassa de banana verde foi associada a picossulfato de sódio (87%) e PEG 3350 com eletrólitos (63%). A biomassa de banana verde sozinha e associada a laxantes foi bem tolerada e não houve efeitos adversos relatados.
ConclusãoA biomassa de banana verde é vantajosa como uma terapia adjuvante na constipação funcional, principalmente na redução das doses de laxantes.
A constipação funcional é um problema comum em todo o mundo e está entre as queixas mais comuns que levam uma criança a ser atendida em uma clínica de gastroenterologia pediátrica.1 A prevalência em uma análise sistemática relatou uma prevalência média e mediana em crianças de 14% e 12% respectivamente.2 O tratamento implica desimpactação, manutenção com laxantes e intervenções comportamentais. Como o baixo consumo de fibra alimentar tem sido associado ao aumento do fator de risco para constipação funcional, deve ser implantado o uso de uma dieta balanceada com aumento de ingestão de fibra alimentar.3
A fibra alimentar de verduras e frutas é muito importante no tratamento da constipação. Sabe‐se que banana verde contém fibra alimentar e uma alta concentração de amido resistente a amilase, que não é digerido nem absorvido no intestino, estimula a produção de ácidos graxos de cadeia curta no cólon e é útil no tratamento da constrição. De fato, o amido resistente atraiu o interesse devido a seus efeitos positivos no cólon humano e suas implicações para a saúde.4,5 Dessa forma, o amido resistente pode ser considerado uma fibra funcional por sua natureza indigesta e efeitos fisiológicos benéficos.6
A banana é produzida principalmente em países em desenvolvimento tropicais e subtropicais. O Brasil é o segundo produtor mundial, o que torna a banana uma fruta muito disponível e acessível, faz parte da dieta dos brasileiros.7 A fibra alimentar e a alta quantidade de amido resistente na banana verde (aproximadamente 74% de sua composição) parece contribuir como um possível agente terapêutico no tratamento da constipação funcional.8–11 Considerando os efeitos intestinais benéficos da fibra alimentar no tratamento da constipação funcional e que a banana verde é uma excelente fonte de amido resistente, o conhecimento das propriedades terapêuticas do amido resistente da banana verde deve ser explorado para aplicações na dieta humana. Os objetivos do estudo foram avaliar os efeitos do uso da biomassa de banana verde com diferentes combinações de laxantes no manejo de crianças e adolescentes com constipação funcional.
MétodosModelo do estudo e participantesEstudo clínico prospectivo, intervencional, randomizado de casos consecutivamente recrutados de crianças e adolescentes, encaminhadas do Sistema Público de Saúde para ambulatórios terciários de Gastroenterologia Pediátrica e Cirurgia Pediátrica da Faculdade de Medicina de Botucatu para tratamento de constipação funcional. Foi usado contato direto para recrutar os participantes e eles receberam explicações detalhadas do estudo. Todas as crianças com mais de 12 anos e os pais assinaram o formulário de consentimento informado aprovado pelo comitê de ética local (Protocolo 4349/2012). Para obter um grupo homogêneo, todos os pacientes elegíveis para o estudo atenderam aos critérios de inclusão: crianças e adolescentes treinados para higiene pessoal, cinco a 15 anos de idade; constipação funcional de acordo com os Critérios de Roma IV;12 tipos de classificação 1 ou 2da consistência das fezes avaliada com a Escala de Bristol para Consistência de Fezes de 7 pontos13,14 e sem uso de medicamentos, exceto laxantes. Os critérios de exclusão foram: problemas genéticos, neurológicos, comportamentais ou cognitivos.
Intervenções e resultadosO protocolo foi feito com participação por um período inicial de uma semana para estabelecer os hábitos intestinais atuais e após um período de tratamento de oito semanas. Durante o estudo, as informações a todos os pais e pacientes sobre a constipação funcional e a Escala de Bristol para Consistência de Fezes foi dada por instruções pessoais e folhetos. As crianças foram orientadas a tentar defecar no vaso sanitário no mesmo horário do dia por 10‐15 minutos.
Os dados sobre as características sociodemográficas e clínicas e investigação laboratorial foram coletados no dia da primeira consulta, usou‐se um protocolo de pesquisa padronizado. Foram medidos o peso corporal, a estatura e o crescimento, determinados com os escores z de acordo com os padrões de crescimento da OMS.
Durante o período de base (antes do início de suplementação com biomassa de banana verde) e durante o período de tratamento (oito semanas consecutivas), cada paciente foi monitorado por meio de um diário semanal padronizado (frequência de defecação, consistência das fezes de acordo com a Escala de Bristol para Consistência de Fezes, frequência de episódios de incontinência fecal, defecação dolorosa, dor abdominal, excreção de sangue, uso de laxantes e suas doses e efeitos adversos como dor, náusea, vômito, diarreia e flatulência.
Após os primeiros sete dias, os pacientes retornaram à clínica com o questionário preenchido e foram randomizados em um dos cinco grupos de intervenção: 1) somente a biomassa de banana verde; 2) biomassa de banana verde mais PEG 3350 com eletrólitos (BBV + PEGE); 3) biomassa de banana verde mais picossulfato de sódio (BBV + SP); 4) PEG 3350 com eletrólitos (PEGE) somente e 5) somente picossulfato de sódio (SP). Antes do início do estudo, todas as crianças foram submetidas a desimpactação retal. Os laxantes foram tomados e dosados de acordo com as diretrizes clínicas relatadas.1 O acompanhamento dos pacientes, a avaliação clínica, a frequência de efeitos adversos e o cumprimento do protocolo do estudo foram feito em consultas clínicas de rotina a cada duas semanas e por ligações telefônicas semanais.
Definições dos desfechos clínicosO desfecho primário foi a queda da proporção de crianças e adolescentes com classificações 1 ou 2 de consistência das fezes com a Escala de Bristol para Consistência de Fezes após oito semanas de tratamento em comparação com a linha de base. Os desfechos secundários foram: aumento na proporção de crianças com > 3 evacuações/semana, redução na proporção de episódios fecais/semana de incontinência e redução na defecação forçada e uso de laxantes.
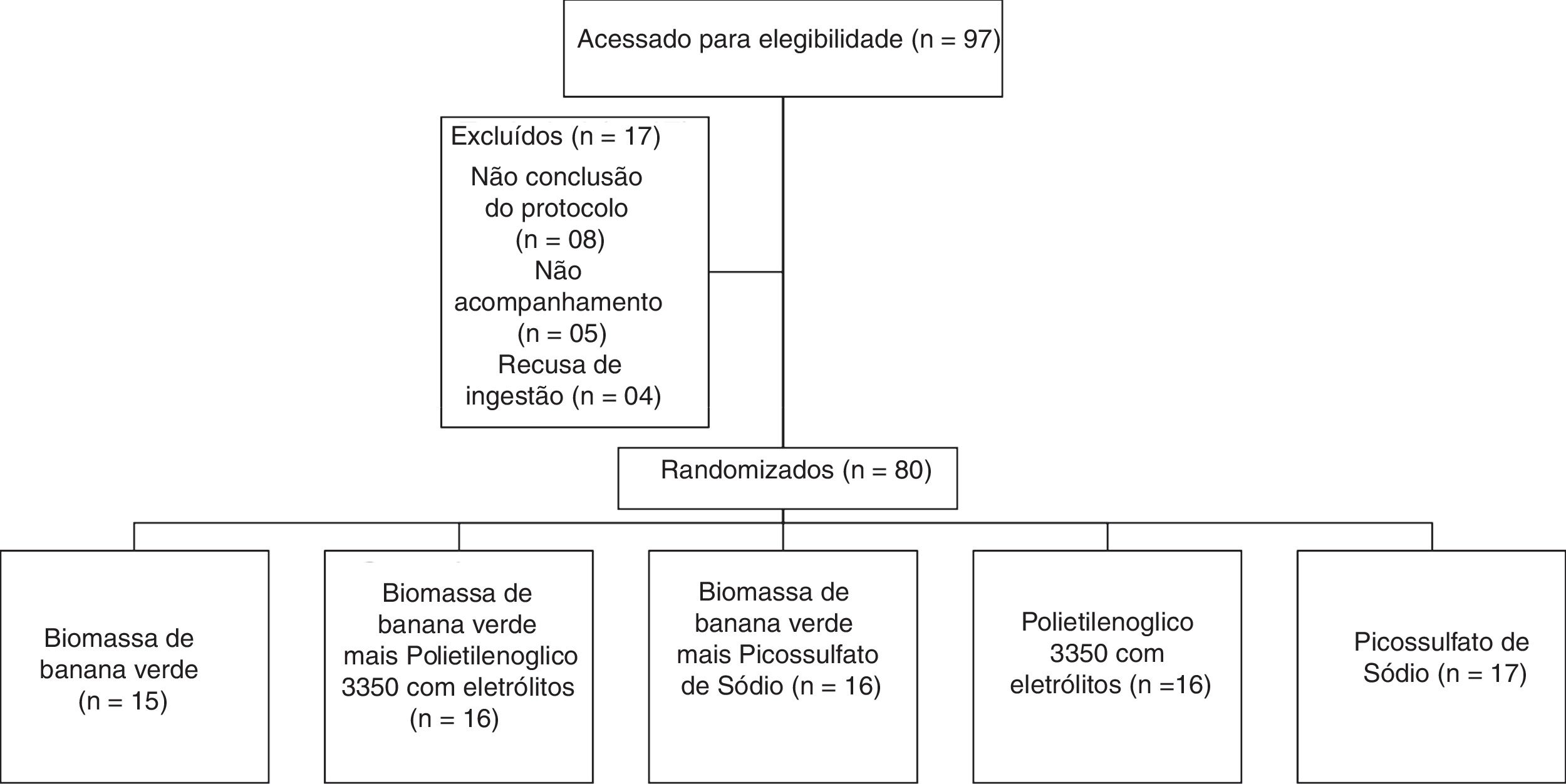
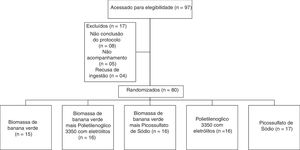
Tamanho da amostra e randomizaçãoO tamanho da amostra foi estimado em 80 pacientes com 16 indivíduos em cada grupo, com base na redução para 30% da proporção no desfecho primário após a intervenção com relevância bilateral de 0,05 e poder de 0,8. Esses indivíduos foram aleatoriamente atribuídos em cinco grupos de tratamento por um algoritmo matemático gerado com a versão 1.0 do StatMate (GaphPad Software, Inc., San Diego, CA, 92121. EUA). A sequência de alocação aleatória foi gerada pelo segundo autor (NCM) e todas as intervenções dietéticas pelo primeiro autor (VMGC) (fig. 1).
Preparação, composição e consumo da dieta do estudoA biomassa de banana verde foi produzida por uma mercearia local, fornecida semanalmente e de forma gratuita. A banana nanica verde comercial (Musa sp. AAA) foi comprada do mercado local. A biomassa foi preparada a partir de banana com casca. As frutas foram lavadas, cozidas em uma panela de pressão com água por 20 minutos; 50mL de água foram acrescentadas para cada 200g de banana verde. Depois disso, a biomassa foi homogeneizada e armazenada a 12° C em um refrigerador. A biomassa de banana verde ficou com aparência idêntica a uma massa firme, branca, homogênea e sem variação substancial na cor, sabor e cheiro. Um estudo‐piloto foi previamente feito para verificar a aceitação das crianças, acrescentaram‐se uma, duas ou três colheres da biomassa de banana verde no suco, iogurte, leite e sopas por preparação. Boa aceitação e resultados positivos iniciais foram atingidos com duas colheres de sopa. Como nenhum estudo ainda analisou a dosagem ideal de amido resistente, adotamos a dose de 2 colheres de sopa/dia de biomassa de banana verde (30g). Durante semanas, 2‐9 pais e crianças foram orientados verbalmente e por um folheto por um nutricionista da pesquisa sobre o consumo de sua dieta habitual e ingestão de fluídos. A adesão à ingestão da biomassa de banana verde foi planejada de acordo com os seguintes itens: reforço da importância de ingestão para retornos quinzenais das consultas clínicas; reforço da importância da ingestão para retornos semanais para retirada da biomassa de banana verde; fortalecimento da importância da ingestão por telefone, feita pelo autor do estudo; mistura da biomassa de banana verde nos alimentos da criança, considerou‐se que a biomassa de banana verde não tem odor nem sabor.
As amostras aleatórias do conteúdo de amido resistente na biomassa de banana verde foram analisados de acordo com Goñi et al.15 no Centro de Raízes e Amidos Tropicais da Faculdade de Agronomia de Botucatu (n° do certificado 035/2014), apresentaram um valor médio de 7,8 ± 0,2% de amido resistente e 4,4 ± 0,5% de fibra alimentar, exceto amido resistente.
Modelos estatísticosOs dados de base foram expressos como mediana e intervalo interquartil (25‐75), média e desvio‐padrão, dependeu da normalidade da distribuição das variáveis contínuas com o uso do teste de normalidade de Shapiro‐Wilk e contagens (n) e percentuais (5) das variáveis qualitativas. A diferença nas proporções das várias variáveis entre a linha de base e após oito semanas foi analisada com o teste exato de Fisher. Todos os testes estatísticos foram bilaterais e os valores de p < 0,05 foram considerados estatisticamente significativos. A gestão e análise dos dados foram feitas com a Versão 5.0 do Graph Pad, 2005 (Graph Pad Software Inc., San Diego, CA, EUA).
ResultadosO diagrama apresenta um fluxo de participação de 97 crianças e adolescentes. Portanto, 80 (82%) crianças e adolescentes com constipação funcional foram aleatoriamente alocados em cinco grupos e todos os dados dos resultados dessas crianças que concluíram o período de oito semanas de tratamento foram coletados para análise final.
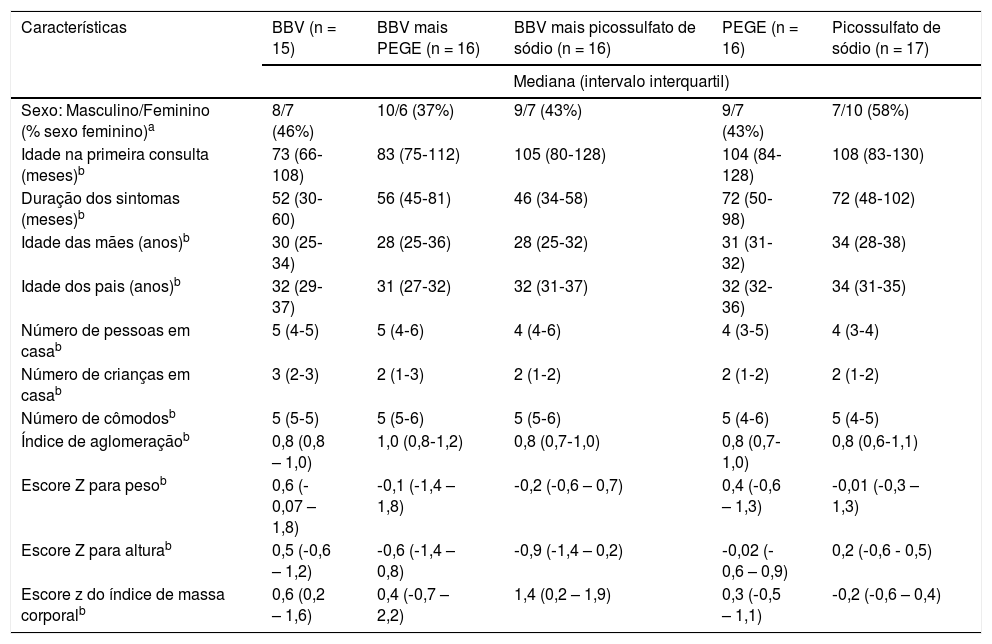
As características demográficas, antropométricas e dos sintomas dos cinco grupos antes do período de teste estão resumidas na tabela 1. Não houve diferença estatística em todas as variáveis entre os grupos. Longos períodos de constipação foram observados em todas as crianças e adolescentes.
Características de base de todas as crianças participantes com constipação funcional
| Características | BBV (n = 15) | BBV mais PEGE (n = 16) | BBV mais picossulfato de sódio (n = 16) | PEGE (n = 16) | Picossulfato de sódio (n = 17) |
|---|---|---|---|---|---|
| Mediana (intervalo interquartil) | |||||
| Sexo: Masculino/Feminino (% sexo feminino)a | 8/7 (46%) | 10/6 (37%) | 9/7 (43%) | 9/7 (43%) | 7/10 (58%) |
| Idade na primeira consulta (meses)b | 73 (66‐108) | 83 (75‐112) | 105 (80‐128) | 104 (84‐128) | 108 (83‐130) |
| Duração dos sintomas (meses)b | 52 (30‐60) | 56 (45‐81) | 46 (34‐58) | 72 (50‐98) | 72 (48‐102) |
| Idade das mães (anos)b | 30 (25‐34) | 28 (25‐36) | 28 (25‐32) | 31 (31‐32) | 34 (28‐38) |
| Idade dos pais (anos)b | 32 (29‐37) | 31 (27‐32) | 32 (31‐37) | 32 (32‐36) | 34 (31‐35) |
| Número de pessoas em casab | 5 (4‐5) | 5 (4‐6) | 4 (4‐6) | 4 (3‐5) | 4 (3‐4) |
| Número de crianças em casab | 3 (2‐3) | 2 (1‐3) | 2 (1‐2) | 2 (1‐2) | 2 (1‐2) |
| Número de cômodosb | 5 (5‐5) | 5 (5‐6) | 5 (5‐6) | 5 (4‐6) | 5 (4‐5) |
| Índice de aglomeraçãob | 0,8 (0,8 – 1,0) | 1,0 (0,8‐1,2) | 0,8 (0,7‐1,0) | 0,8 (0,7‐1,0) | 0,8 (0,6‐1,1) |
| Escore Z para pesob | 0,6 (‐0,07 – 1,8) | ‐0,1 (‐1,4 – 1,8) | ‐0,2 (‐0,6 – 0,7) | 0,4 (‐0,6 – 1,3) | ‐0,01 (‐0,3 – 1,3) |
| Escore Z para alturab | 0,5 (‐0,6 – 1,2) | ‐0,6 (‐1,4 – 0,8) | ‐0,9 (‐1,4 – 0,2) | ‐0,02 (‐0,6 – 0,9) | 0,2 (‐0,6 ‐ 0,5) |
| Escore z do índice de massa corporalb | 0,6 (0,2 – 1,6) | 0,4 (‐0,7 – 2,2) | 1,4 (0,2 – 1,9) | 0,3 (‐0,5 – 1,1) | ‐0,2 (‐0,6 – 0,4) |
BBV, biomassa de banana verde; PEGE, polietilenoglicol 3350 com eletrólitos.
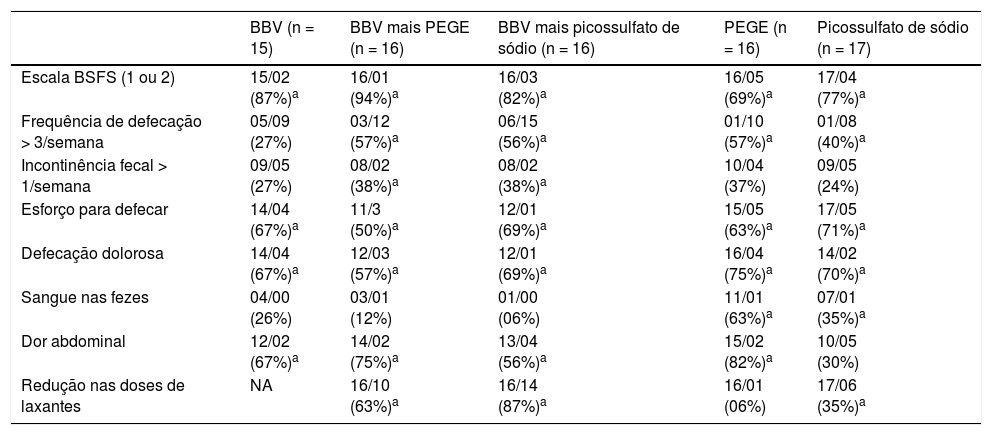
A tabela 2 resume o número e as proporções (%) de crianças antes e depois da intervenção em todos os cinco grupos. Ao término do período de intervenção, houve uma redução estatisticamente significativa na proporção de crianças com classificações 1 ou 2da Escala de Bristol para Consistência de Fezes, esforço na defecação e defecação dolorosa em todos os cinco grupos. Houve um aumento estatisticamente significativo na proporção de crianças e adolescentes com > 3 evacuações/semana em quatro grupos, exceto no grupo somente de biomassa de banana verde. A proporção de crianças com dor abdominal foi reduzida em todos os grupos, exceto em SP. Houve uma redução estatisticamente significativa na proporção de crianças com frequência de incontinência fecal somente nos grupos de biomassa de banana verde + PEGE e biomassa de banana verde + SP. A proporção de crianças com sangue nas fezes foi reduzida nos grupos de PEGE e SP. Durante o período de tratamento de oito semanas, a proporção de crianças que necessitou de redução nas doses de laxantes foi: 87% (BBV + SP); 63% (BBV+PEGE); 35% (SP); 6% (PEGE). A biomassa de banana verde sozinha e associada a laxantes foi bem tolerada e não houve efeitos adversos relatados.
Número de crianças antes e depois de oito semanas de tratamento para diferentes variáveis e proporção de redução ou aumento
| BBV (n = 15) | BBV mais PEGE (n = 16) | BBV mais picossulfato de sódio (n = 16) | PEGE (n = 16) | Picossulfato de sódio (n = 17) | |
|---|---|---|---|---|---|
| Escala BSFS (1 ou 2) | 15/02 (87%)a | 16/01 (94%)a | 16/03 (82%)a | 16/05 (69%)a | 17/04 (77%)a |
| Frequência de defecação > 3/semana | 05/09 (27%) | 03/12 (57%)a | 06/15 (56%)a | 01/10 (57%)a | 01/08 (40%)a |
| Incontinência fecal > 1/semana | 09/05 (27%) | 08/02 (38%)a | 08/02 (38%)a | 10/04 (37%) | 09/05 (24%) |
| Esforço para defecar | 14/04 (67%)a | 11/3 (50%)a | 12/01 (69%)a | 15/05 (63%)a | 17/05 (71%)a |
| Defecação dolorosa | 14/04 (67%)a | 12/03 (57%)a | 12/01 (69%)a | 16/04 (75%)a | 14/02 (70%)a |
| Sangue nas fezes | 04/00 (26%) | 03/01 (12%) | 01/00 (06%) | 11/01 (63%)a | 07/01 (35%)a |
| Dor abdominal | 12/02 (67%)a | 14/02 (75%)a | 13/04 (56%)a | 15/02 (82%)a | 10/05 (30%) |
| Redução nas doses de laxantes | NA | 16/10 (63%)a | 16/14 (87%)a | 16/01 (06%) | 17/06 (35%)a |
BBV, biomassa de banana verde; BSFS, Escala de Bristol para Consistência de Fezes; PEGE, polietilenoglicol 3350 com eletrólitos.
Este estudo intervencional foi destinado a avaliar os efeitos do uso de biomassa de banana verde com diferentes combinações de laxantes no manejo de crianças e adolescentes com constipação funcional. Até onde sabemos, nenhum estudo anterior sobre tratamento da constipação na infância foi feito com biomassa de banana verde como fonte de fibra alimentar e amino resistente. Os resultados primários demonstraram que o consumo somente de biomassa de banana verde por oito semanas (30g/dia) reduziu a proporção de crianças com as classificações 1 ou 2da Escala de Bristol para Consistência de Fezes e esforço e dor na defecção, porém não houve aumento no percentual de crianças com > 3 evacuações/semana.
Uma limitação deste estudo foi que ele foi conduzido em um único centro terciário, no qual há maiores chances de haver crianças com sintomas de constipação mais graves, e o estudo não planejou um acompanhamento de longo prazo. O ponto forte deste estudo inclui o nível de homogeneidade entre os grupos na linha de base e alta adesão ao cronograma de tratamento e o uso da variação na Escala de Bristol para Consistência de Fezes como o desfecho primário. O uso da classificação de Bristol com desfecho primário tornou possível uma análise de tratamento mais objetiva nos cinco grupos estudados. Todos os pacientes e mães/cuidadores foram orientados a observar a classificação de Bristol por meio de treinamentos feitos pelos autores e foram fornecidos panfletos na primeira consulta. A classificação de Bristol é recomendada para uso em crianças com constipação antes do uso dos Critérios de Roma IV.16–18 Assim, a categorização das fezes em sete critérios de acordo com a consistência das fezes é útil para avaliar a eficácia da intervenção na constipação funcional.
O tratamento da constipação na infância é um problema desafiador e os principais objetivos são reestabelecer defecção normal sem incontinência fecal. O papel da fibra no tratamento de constipação crônica é uma questão controversa e ainda é debatida. Um estudo em Hong Kong mostrou que a ingestão de fibra alimentar por crianças com constipação foi menor quando comparadas com crianças não constipadas, correspondeu a 40% da ingestão de fibra alimentar de referência. Dados semelhantes são relatados na Grécia e no Paquistão, onde a constipação funcional foi negativamente correlacionada à ingestão de fibras.19,20 Uma intervenção com aumento da ingestão de fibras por crianças com constipação não resultou na redução do uso de laxantes nem aumento na frequência de evacuações.21 Por outro lado, um estudo clínico constatou que a administração de suplementos de fibra alimentar, além de laxantes, pode ser benéfica em crianças sintomáticas que já tomam laxantes.22 Os resultados deste estudo demonstraram que o uso de polietilenoglicol 3350 com eletrólitos e picossulfato de sódio, quando associados a biomassa de banana verde, reduziu a dose de laxantes em uma maior proporção de crianças, em comparação com os mesmos laxantes usados sozinhos. Assim, os dois laxantes mais úteis recomendados para uso em crianças apresentaram uma associação real com a biomassa de banana verde.
Por outro lado, a ingestão de fibra alimentar é amplamente recomendada como terapia para constipação e tem sido aprovada para tratamento de constipação desde no mínimo o século XVI. As fibras podem afetar o tempo de trânsito gastrointestinal e as evacuações e aumentar o conteúdo de água e a proliferação de bactérias que produzem fezes mais moles e mais frequentes.22,23 A banana verde (Musa sp. AAA) é uma importante fonte de amido resistente com vários efeitos fisiológicos compatíveis com os das fibras alimentares. Os resultados deste estudo mostraram que a biomassa de banana verde tem propriedades terapêuticas e deve ser explorada para aplicações nutricionais em humanos. São necessárias pesquisas adicionais que façam uso de amplos estudos de acompanhamento sobre constipação na infância. São necessários estudos adicionais para elucidar o papel da fermentação do amido resistente e da microbiota intestinal para explicar os resultados positivos da biomassa de banana verde no tratamento de constipação.
Os resultados do estudo mostraram que acrescentar biomassa de banana verde à rotina de tratamento da constipação com laxantes em crianças e adolescentes pode aumentar significativamente a melhoria dos sintomas e, com essa combinação após oito semanas, é possível reduzir a dose de laxantes. De fato, a redução nas doses de laxantes é um resultado muito interessante, considerando os efeitos colaterais e o preço. Como são facilmente encontrados no Brasil, esses resultados mostram o grande potencial para seu uso no tratamento da constipação, com baixo custo, preparo simples e alta reprodutibilidade.
FinanciamentoEste estudo foi apoiado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Cassettari VM, Machado NC, Lourenc¸ão PL, Carvalho MA, Ortolan EV. Combinations of laxatives and green banana biomass on the treatment of functional constipation in children and adolescents: a randomized study. J Pediatr (Rio J). 2019;95:27–33.