To evaluate the validity of clinical and laboratory signs to serious dengue disease in hospitalized children.
MethodsRetrospective cohort of children (<18 years) hospitalized with dengue diagnosis (2007–2008). Serious dengue disease was defined as death or use of advanced life support therapy. Accuracy measures and area under the receiver operating characteristic curve were calculated.
ResultsOf the total (n=145), 53.1% were female, 69% aged 2–11 years, and 15.9% evolved to the worse outcome. Lethargy had the best accuracy (positive likelihood ratio >19 and negative likelihood ratio <0.6). Pleural effusion and abdominal distension had higher sensitivity (82.6%). History of bleeding (epistaxis, gingival or gastrointestinal bleeding) and severe hemorrhage (pulmonary or gastrointestinal bleeding) in physical examination were more frequent in serious dengue disease (p<0.01), but with poor accuracy (positive likelihood ratio=1.89 and 3.89; negative likelihood ratio=0.53 and 0.60, respectively). Serum albumin was lower in serious dengue forms (p<0.01). Despite statistical significance (p<0.05), both groups presented thrombocytopenia. Platelets count, hematocrit, and hemoglobin parameters had area under the curve <0.5.
ConclusionsLethargy, abdominal distension, pleural effusion, and hypoalbuminemia were the best clinical and laboratorial markers of serious dengue disease in hospitalized children, while bleeding, severe hemorrhage, hemoconcentration and thrombocytopenia did not reach adequate diagnostic accuracy. In pediatric referral hospitals, the absence of hemoconcentration does not imply absence of plasma leakage, particularly in children with previous fluid replacement. These findings may contribute to the clinical management of dengue in children at referral hospitals.
Avaliar a validade dos sinais clínicos e laboratoriais para o dengue com evolução grave em crianças hospitalizadas.
MétodosCoorte retrospectivo de crianças (<18 anos) internadas com dengue (2007‐2008). Evolução grave foi definida como óbito ou pelo uso de terapia de suporte avançado de vida. Foram calculadas medidas de acurácia e área sob a curva ROC.
ResultadosDo total (n=145), 53,1% casos eram do sexo feminino, 69% de 2 a 11 anos e 15,9% evoluíram para gravidade. Letargia obteve a melhor acurácia (razão de verossimilhança positiva RVP>19 e RV negativa RVN<0,6). Derrame pleural e distensão abdominal apresentaram maior sensibilidade (se=82,6%). Relato de sangramentos (epistaxe, gengivorragia ou gastrointestinal) e hemorragia grave (pulmonar ou gastrointestinal) presente no exame físico foi mais frequente nos casos com evolução grave (p <0,01), porém com baixa acurácia (RVP=1,89 e 3,89; RVN=0,53 e 0,60, respectivamente). Os níveis de albumina sérica foram mais baixos nas formas graves (p <0,01). Ambos os grupos apresentaram trombocitopenia, apesar da diferença estatística (p <0,05). Contagem de plaquetas, hematócrito e hemoglobina apresentaram área sob a curva ROC<0,5.
ConclusõesLetargia, distensão abdominal, derrame pleural e hipoalbuminemia foram os melhores marcadores clínicos e laboratoriais de dengue com evolução grave em crianças hospitalizadas, enquanto sangramento, hemorragia grave, hemoconcentração e trombocitopenia não tiveram boa acurácia diagnóstica. Em hospitais de referência pediátricos, a ausência de hemoconcentração não implica ausência de extravasamento plasmático, particularmente quando há reposição anterior de volume. Esses resultados podem contribuir para o manejo clínico do dengue em crianças em hospitais de referência.
Dengue é uma doença febril aguda causada por um flavivírus com quatro sorotipos conhecidos (DENV‐1, DENV‐2, DENV‐3 e DENV‐4). Em 2013, a estimativa mundial de infecção por dengue era de 390 milhões de pessoas, 96 milhões das quais eram sintomáticas.1 No Brasil, de 2000 a 2010, houve um aumento na incidência de dengue, acompanhado de um aumento proporcional nos casos graves.2 O dengue afeta principalmente a população adulta no Brasil, porém a epidemia de 2008 apresentou maior incidência em indivíduos menores de 15 anos, com maior proporção de casos graves nessa faixa etária.2
Os quatro sorotipos podem levar a diversos quadros clínicos, que vão de formas assintomáticas a graves. Neonatos e crianças em idade pré‐escolar frequentemente apresentam uma doença febril indiferenciada. Coriza, convulsões, náusea, vômito, exantema e petéquias são mais frequentes em crianças com menos de 2 anos.3 Crianças com dengue podem evoluir para quadros graves mais rapidamente do que adultos, principalmente as com menos de 5 anos.4 Podem aparecer sinais de hipoperfusão, como pele fria, oligúria e enchimento capilar lento, repentinamente após alguns dias da fase febril.5
Em 1997, a Organização Mundial de Saúde (OMS) estabeleceu uma classificação dos casos de dengue em: dengue clássica (DC) e febre hemorrágica da dengue (FHD). A FHD é subdividida em quatro graus de gravidade, os graus III e IV são definidos como síndrome do choque da dengue (SCD). Em 2009, a OMS propôs uma nova classificação, dengue e dengue grave, em que dengue está subdividida de acordo com a presença ou a ausência dos seguintes sinais de alerta: dor abdominal, vômito persistente, edema, sangramento das mucosas, letargia, irritabilidade, hepatomegalia (> 2cm) e aumento no número de hematócritos simultâneo à redução na contagem de plaquetas.6 Essa nova classificação visa a simplificar e mudar o foco da hemorragia para o extravasamento plasmático, principal fator na patogênese das formas graves.7
A OMS e o Ministério da Saúde adotaram o uso de sinais de alerta para a gestão de casos clínicos,6,8 embora sua evidência como preditores de gravidade não seja consistente, principalmente em crianças.9 Os sinais e sintomas mais frequentemente associados à gravidade em crianças eram: sangramento espontâneo, hepatomegalia e sinais de extravasamento plasmático, como ascite, derrame pleural,10,11 dor abdominal,11,12 trombocitopenia13–16 e níveis elevados de plasma da enzima hepática transaminase glutâmico‐oxalacética sérica (TGO).11,15 A maioria dos estudos definiu a contagem de plaquetas abaixo de 50 mil por mm3 como sinal de mau prognóstico.13,14,16 Potts et al.15 descobriram que a contagem de leucócitos e a trombocitopenia são menos significativas para predizer a gravidade, a última é mais importante para o diagnóstico de dengue.
O uso de sinais de alerta no dengue foi proposto para detectar casos possivelmente graves precocemente, possibilitar tratamento imediato e evitar internações desnecessárias, para reduzir a taxa de fatalidade de casos dessa doença.6,8 Contudo, diversos aspectos clínicos e epidemiológicos ainda não foram completamente elucidados, principalmente em crianças. No Brasil, a epidemia de 2008 apresentou mais casos de dengue grave em crianças com infecção primária,2 ao contrário de estudos asiáticos que mostraram uma associação entre infecção secundária e gravidade.17 Embora uma metanálise de 37 estudos internacionais tenha mostrado uma relação inversamente proporcional entre idade e SCD, os estudos eram altamente heterogêneos, devido, provavelmente, à grande variabilidade das faixas etárias nas populações do estudo.17 Neste estudo, embora a hemorragia tenha surgido como preditora de gravidade, o sintoma não era frequente em crianças.13 Por fim, a maioria dos estudos de validação17 sobre os sinais de alerta de dengue usou como padrão de referência os critérios da OMS para FHD,9 que incorporam muitos dos sinais e sintomas testados como preditores. Tiveram, assim, um viés de incorporação de estudos de diagnóstico, com tendência a superestimar as medidas de acurácia.18
Este estudo visou a avaliar a validade dos marcadores clínicos e laboratoriais do dengue grave em uma coorte de crianças internadas durante a epidemia de 2007‐2008 na cidade do Rio de Janeiro, Brasil. Durante essa epidemia, houve mais de cem mil casos de suspeita de dengue relatados ao sistema local de informações de saúde; 38.808 foram confirmados e classificados de acordo com o sistema da OMS de 1997. Desses, 42,3% eram menores de 18 anos. Naquela época, os sorotipos em circulação eram o DENV‐2 e o DENV‐3.
MétodosEste foi um estudo de coorte retrospectivo em um hospital de referência pediátrico na cidade do Rio de Janeiro, Brasil. O estudo incluiu todas as crianças e adolescentes (de 2 meses a 18 anos) internados com dengue durante a epidemia de novembro de 2007 a maio de 2008.
Como pretendíamos estudar os marcadores clínicos e laboratoriais do dengue grave e o choque estava relacionado à variável de resultado, excluímos os casos que apresentaram quadro clínico compatível com choque no dia da internação hospitalar. Choque foi definido como a presença de pulso baixo, hipotensão arterial para a idade associada a cianose, letargia ou coma. Também excluímos casos com falta de informações sobre o prontuário médico do paciente ou com evidências clínicas e/ou laboratoriais de doenças febris agudas como pneumonia, otite média aguda e sinusite. Dois comitês locais de ética em pesquisa aprovaram este estudo.
O diagnóstico de dengue foi definido de acordo com os critérios do Ministério da Saúde.19 Um caso foi considerado confirmado quando atendeu aos seguintes critérios: amostra positiva na detecção de RNA viral por transcriptase reversa seguida de reação em cadeia da polimerase (RT‐PCR); ensaio imunossorvente ligado a enzima (ELISA) para verificar a existência de anticorpos IgM; soroconversão de IgM ou IgG em amostras pareadas por meio do ELISA; ou critério clínico‐epidemiológico: quadro clínico compatível com dengue, relação epidemiológica com o caso de dengue confirmado e ausência de confirmação laboratorial de outros diagnósticos compatíveis com a faixa etária.19 A coleta de dados dos prontuários médicos foi feita por estudantes de medicina ou pediatras treinados para esse fim, com um formulário padronizado para este estudo.
A variável de resultado “dengue grave” foi definida como ocorrência de óbito ou uso de aminas, inotrópicos, coloides, ventilação mecânica, ventilação não invasiva, diálise peritoneal ou hemodiálise, não considerados nas classificações prevalecentes na época.19 As variáveis explicativas incluíram dados sociodemográficos, histórico clínico, exame físico no primeiro dia de internação e os primeiros resultados de ensaios laboratoriais hematológicos e bioquímicos. A hipotensão arterial foi definida de acordo com a faixa etária: pressão sistólica (PAS)<100mmHg para crianças ≥ 12 anos, PAS<95mmHg para crianças ≥ 6 e<12 anos, PAS<90mmHg para crianças ≥ 2 e<6 anos, PAS<85mmHg para crianças ≥ 1 e<2 anos e PAS<70mmHg para crianças ≥ 6 meses e<1 ano.8 Em caso de anamnese, a asma relatada nos prontuários médicos não foi clinicamente classificada; o sangramento foi definido por epistaxe, gengivorragia ou gastrointestinal. No exame físico, a hemorragia grave foi definida como pulmonar ou gastrointestinal; o derrame pleural foi confirmado por raios X ou ultrassom de tórax. A albumina sérica foi avaliada como uma variável contínua e dicotômica. Por fim, usamos o limite de 3,0g/dL e, acima disso, não havia indicação de administração de albumina. A lesão hepática foi avaliada por meio da aspartato aminotransferase (AST>40 UI/L) e da alanina aminotransferase (ALT>56 UI/L).
Os dados foram registrados no EpiData 3.1 (Lauritsen JM [Ed.]. EpiData Data Entry, Data Management and Basic Statistical Analysis System, Denmark) e analisados no Stata 13 (StataCorp. 2013. Stata Statistical Software: Release 13. College Station, EUA). Calculamos frequências e proporções das variáveis e medianas categóricas com os respectivos intervalos interquartis (IIQ) para a idade em anos, tempo de febre até surgimento dos sintomas e parâmetros laboratoriais hematológicos e bioquímicos. O teste exato de Fisher foi calculado para as variáveis categóricas e o teste de Mann‐Whitney, para as variáveis contínuas (distribuição anormal) para avaliar a associação entre essas variáveis e o dengue grave. Quando a associação era estatisticamente significativa (p<0,05), calculamos, para as variáveis categóricas, as seguintes medidas de acurácia com os respectivos intervalos de confiança de 95%: sensibilidade (Se), especificidade (Sp), valores preditivos positivo e negativo (PPV e NPV) e razões de verossimilhança positiva e negativa (RVP e RVN). Valores adequados foram definidos como RVP>5 e RVN ≤ 0,20. Quanto às variáveis contínuas, fizemos a curva característica de operação do receptor (ROC) para estimar a área sob a curva (AUC) com o respectivo intervalo de confiança de 95%.
ResultadosDas 164 crianças internadas com suspeita de dengue, 19 foram excluídas: um diagnóstico de dengue foi descartado pelos resultados laboratoriais, três já apresentaram condição clínica compatível com a síndrome do choque da dengue no dia de internação e 15 foram descartados devido ao diagnóstico de outras doenças ou falta de informações sobre o prontuário do paciente. A amostra final incluiu 145 pacientes, a maioria dos quais era do sexo feminino (53,1%), negro ou pardo (56,6%), residente na cidade do Rio de Janeiro (74,5%) e com pelo menos uma consulta médica anterior (88,3%). A maioria das crianças tinha 2 a 11 anos (69%), 21,4% tinham 12 ou mais anos e 9,2% tinham menos de 2 anos. Somente três pacientes apresentaram histórico anterior de dengue, dos quais nenhum foi classificado como dengue grave. Dos 145 casos, 97 foram confirmados por laboratório e 48 por critérios clínicos‐epidemiológicos, sem diferença estatística entre dengue grave e não (p=0,436).
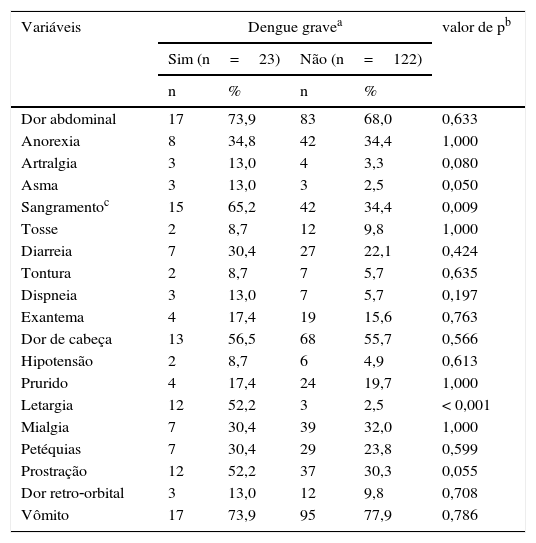
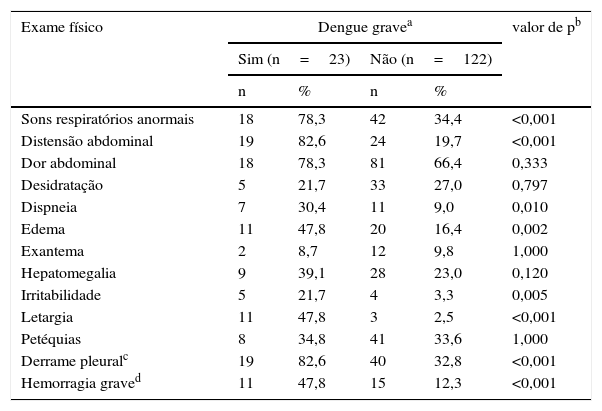
Os pacientes com evolução para dengue grave representavam 15,9% da amostra. Ambos os grupos eram representados majoritariamente por crianças de 2 a 11 anos (Grave=78,3% e Não Grave=67,2%), sem diferença estatística entre as menores de 2 anos e as com entre 12 e 18 anos (valor de p=0,167 do teste exato de Fisher). A duração da febre em dias foi ligeiramente menor nesse subgrupo de pacientes (Grave: Duração média=3,0, IIQ=2,0‐4,5; Não Grave: Duração média=4,0, IIQ=3,0‐5,0; valor de p=0,062). O histórico de asma (p=0,051), o relato de letargia ou sangramento e a identificação de letargia, dispneia, irritabilidade, sangramento, distensão abdominal, edema, sons respiratórios alterados ou derrame pleural no exame físico na internação hospitalar foram mais frequentes em pacientes com resultados graves (tabelas 1 e 2).
Histórico clínico de crianças internadas com dengue
| Variáveis | Dengue gravea | valor de pb | |||
|---|---|---|---|---|---|
| Sim (n=23) | Não (n=122) | ||||
| n | % | n | % | ||
| Dor abdominal | 17 | 73,9 | 83 | 68,0 | 0,633 |
| Anorexia | 8 | 34,8 | 42 | 34,4 | 1,000 |
| Artralgia | 3 | 13,0 | 4 | 3,3 | 0,080 |
| Asma | 3 | 13,0 | 3 | 2,5 | 0,050 |
| Sangramentoc | 15 | 65,2 | 42 | 34,4 | 0,009 |
| Tosse | 2 | 8,7 | 12 | 9,8 | 1,000 |
| Diarreia | 7 | 30,4 | 27 | 22,1 | 0,424 |
| Tontura | 2 | 8,7 | 7 | 5,7 | 0,635 |
| Dispneia | 3 | 13,0 | 7 | 5,7 | 0,197 |
| Exantema | 4 | 17,4 | 19 | 15,6 | 0,763 |
| Dor de cabeça | 13 | 56,5 | 68 | 55,7 | 0,566 |
| Hipotensão | 2 | 8,7 | 6 | 4,9 | 0,613 |
| Prurido | 4 | 17,4 | 24 | 19,7 | 1,000 |
| Letargia | 12 | 52,2 | 3 | 2,5 | < 0,001 |
| Mialgia | 7 | 30,4 | 39 | 32,0 | 1,000 |
| Petéquias | 7 | 30,4 | 29 | 23,8 | 0,599 |
| Prostração | 12 | 52,2 | 37 | 30,3 | 0,055 |
| Dor retro‐orbital | 3 | 13,0 | 12 | 9,8 | 0,708 |
| Vômito | 17 | 73,9 | 95 | 77,9 | 0,786 |
Primeiro exame clínico de crianças internadas com dengue
| Exame físico | Dengue gravea | valor de pb | |||
|---|---|---|---|---|---|
| Sim (n=23) | Não (n=122) | ||||
| n | % | n | % | ||
| Sons respiratórios anormais | 18 | 78,3 | 42 | 34,4 | <0,001 |
| Distensão abdominal | 19 | 82,6 | 24 | 19,7 | <0,001 |
| Dor abdominal | 18 | 78,3 | 81 | 66,4 | 0,333 |
| Desidratação | 5 | 21,7 | 33 | 27,0 | 0,797 |
| Dispneia | 7 | 30,4 | 11 | 9,0 | 0,010 |
| Edema | 11 | 47,8 | 20 | 16,4 | 0,002 |
| Exantema | 2 | 8,7 | 12 | 9,8 | 1,000 |
| Hepatomegalia | 9 | 39,1 | 28 | 23,0 | 0,120 |
| Irritabilidade | 5 | 21,7 | 4 | 3,3 | 0,005 |
| Letargia | 11 | 47,8 | 3 | 2,5 | <0,001 |
| Petéquias | 8 | 34,8 | 41 | 33,6 | 1,000 |
| Derrame pleuralc | 19 | 82,6 | 40 | 32,8 | <0,001 |
| Hemorragia graved | 11 | 47,8 | 15 | 12,3 | <0,001 |
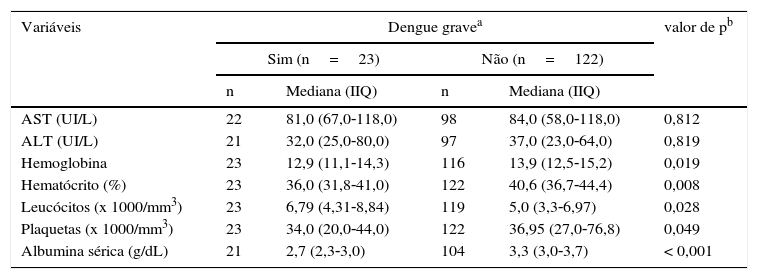
Os casos que evoluíram para dengue grave apresentaram valores mais baixos de hematócritos, hemoglobinas, contagem de plaquetas e albumina sérica do que outras formas, ao passo que a contagem de leucócitos era maior no dengue grave. Em ambos os grupos, os níveis de AST eram elevados, ao passo que a ALT estava abaixo da faixa normal (p>0,05) (tabela 3).
Mediana e intervalo interquartil (IIQ) do primeiro exame laboratorial de crianças internadas com dengue
| Variáveis | Dengue gravea | valor de pb | |||
|---|---|---|---|---|---|
| Sim (n=23) | Não (n=122) | ||||
| n | Mediana (IIQ) | n | Mediana (IIQ) | ||
| AST (UI/L) | 22 | 81,0 (67,0‐118,0) | 98 | 84,0 (58,0‐118,0) | 0,812 |
| ALT (UI/L) | 21 | 32,0 (25,0‐80,0) | 97 | 37,0 (23,0‐64,0) | 0,819 |
| Hemoglobina | 23 | 12,9 (11,1‐14,3) | 116 | 13,9 (12,5‐15,2) | 0,019 |
| Hematócrito (%) | 23 | 36,0 (31,8‐41,0) | 122 | 40,6 (36,7‐44,4) | 0,008 |
| Leucócitos (x 1000/mm3) | 23 | 6,79 (4,31‐8,84) | 119 | 5,0 (3,3‐6,97) | 0,028 |
| Plaquetas (x 1000/mm3) | 23 | 34,0 (20,0‐44,0) | 122 | 36,95 (27,0‐76,8) | 0,049 |
| Albumina sérica (g/dL) | 21 | 2,7 (2,3‐3,0) | 104 | 3,3 (3,0‐3,7) | < 0,001 |
AST, aspartato aminotransferase; ALT, alanina aminotransferase.
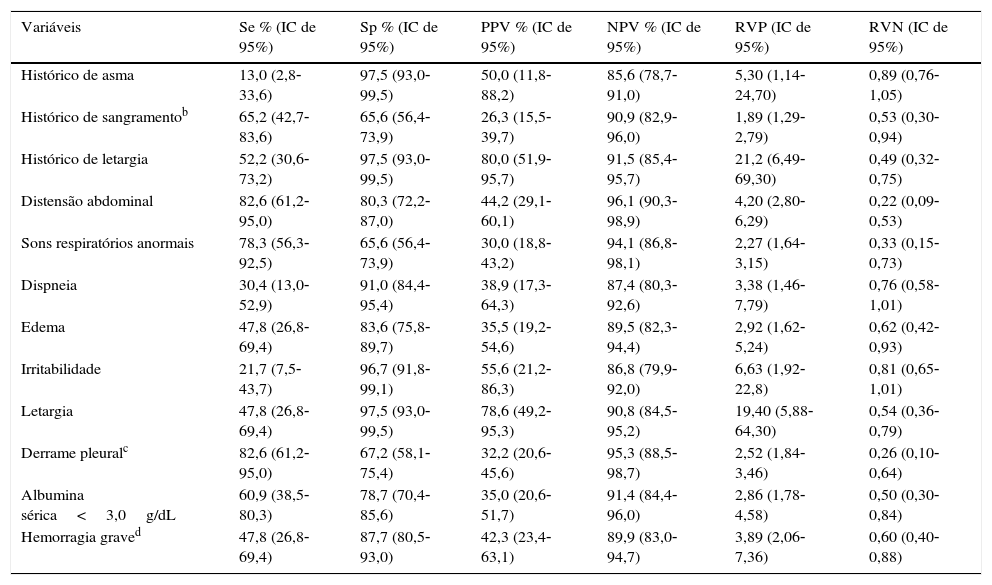
Embora presente em apenas metade dos casos de dengue grave, a letargia, relatada no histórico ou identificada no exame físico inicial, foi o único sinal clínico com as maiores razões de verossimilhança positivas (LR+=21,2 e 19,4, respectivamente) (tabela 4). A presença de irritabilidade e o histórico de asma foram associados a um aumento moderado na probabilidade de evolução para dengue grave (LR+=5,3 e 6,63, respectivamente). O derrame pleural e a distensão abdominal foram os sinais com a maior sensibilidade (82,6%) e o valor preditivo negativo (95,3% e 96,1%), além do menor LR‐ (0,26 e 0,22). A área sob a curva da contagem total de leucócitos foi 0,645 (0,526‐0,765). A duração da febre e outros valores laboratoriais apresentaram AUC ≤ 0,5 (dados não apresentados). A distensão abdominal e o derrame pleural foram os sinais com a maior sensibilidade (Se=82,6%) e valor preditivo negativo (96,1% e 95,3%, respectivamente), além das menores razões de verossimilhança negativas (0,22 e 0,26, respectivamente).
Acurácia dos sinais e sintomas clínicos identificados na anamnese do ou no primeiro exame físico de crianças internadas com dengue gravea
| Variáveis | Se % (IC de 95%) | Sp % (IC de 95%) | PPV % (IC de 95%) | NPV % (IC de 95%) | RVP (IC de 95%) | RVN (IC de 95%) |
|---|---|---|---|---|---|---|
| Histórico de asma | 13,0 (2,8‐33,6) | 97,5 (93,0‐99,5) | 50,0 (11,8‐88,2) | 85,6 (78,7‐91,0) | 5,30 (1,14‐24,70) | 0,89 (0,76‐1,05) |
| Histórico de sangramentob | 65,2 (42,7‐83,6) | 65,6 (56,4‐73,9) | 26,3 (15,5‐39,7) | 90,9 (82,9‐96,0) | 1,89 (1,29‐2,79) | 0,53 (0,30‐0,94) |
| Histórico de letargia | 52,2 (30,6‐73,2) | 97,5 (93,0‐99,5) | 80,0 (51,9‐95,7) | 91,5 (85,4‐95,7) | 21,2 (6,49‐69,30) | 0,49 (0,32‐0,75) |
| Distensão abdominal | 82,6 (61,2‐95,0) | 80,3 (72,2‐87,0) | 44,2 (29,1‐60,1) | 96,1 (90,3‐98,9) | 4,20 (2,80‐6,29) | 0,22 (0,09‐0,53) |
| Sons respiratórios anormais | 78,3 (56,3‐92,5) | 65,6 (56,4‐73,9) | 30,0 (18,8‐43,2) | 94,1 (86,8‐98,1) | 2,27 (1,64‐3,15) | 0,33 (0,15‐0,73) |
| Dispneia | 30,4 (13,0‐52,9) | 91,0 (84,4‐95,4) | 38,9 (17,3‐64,3) | 87,4 (80,3‐92,6) | 3,38 (1,46‐7,79) | 0,76 (0,58‐1,01) |
| Edema | 47,8 (26,8‐69,4) | 83,6 (75,8‐89,7) | 35,5 (19,2‐54,6) | 89,5 (82,3‐94,4) | 2,92 (1,62‐5,24) | 0,62 (0,42‐0,93) |
| Irritabilidade | 21,7 (7,5‐43,7) | 96,7 (91,8‐99,1) | 55,6 (21,2‐86,3) | 86,8 (79,9‐92,0) | 6,63 (1,92‐22,8) | 0,81 (0,65‐1,01) |
| Letargia | 47,8 (26,8‐69,4) | 97,5 (93,0‐99,5) | 78,6 (49,2‐95,3) | 90,8 (84,5‐95,2) | 19,40 (5,88‐64,30) | 0,54 (0,36‐0,79) |
| Derrame pleuralc | 82,6 (61,2‐95,0) | 67,2 (58,1‐75,4) | 32,2 (20,6‐45,6) | 95,3 (88,5‐98,7) | 2,52 (1,84‐3,46) | 0,26 (0,10‐0,64) |
| Albumina sérica<3,0g/dL | 60,9 (38,5‐80,3) | 78,7 (70,4‐85,6) | 35,0 (20,6‐51,7) | 91,4 (84,4‐96,0) | 2,86 (1,78‐4,58) | 0,50 (0,30‐0,84) |
| Hemorragia graved | 47,8 (26,8‐69,4) | 87,7 (80,5‐93,0) | 42,3 (23,4‐63,1) | 89,9 (83,0‐94,7) | 3,89 (2,06‐7,36) | 0,60 (0,40‐0,88) |
Se, sensibilidade; Sp, especificidade; PPV, valor preditivo positivo; NPV, valor preditivo negativo; RVP, razão de verossimilhança positiva; RVN, razão de verossimilhança negativa; IC de 95%, Intervalo de confiança de 95%.
Este estudo mostrou que a letargia, relatada no histórico ou identificada no exame físico, foi o sinal clínico que mais bem discrimina pacientes que evoluem para dengue grave. Asma e irritabilidade apresentaram razões de verossimilhança positivas moderadas, envolveram maior probabilidade de dengue grave quando presentes. O derrame pleural e a distensão abdominal apresentaram as menores razões de verossimilhança negativas, o que significa que os pacientes sem esses sinais na internação hospitalar estavam menos propensos a evoluir para dengue grave. Contudo, a evolução clínica corrobora a importância do diagnóstico precoce, se considerarmos a rápida evolução do dengue, em que o período mais crítico é o da defervescência.20,21 O sangramento era mais frequente em casos de dengue grave, porém não atingiu boa acurácia.
Nossos resultados são semelhantes àqueles de outros estudos que demonstram que a letargia,17,22 irritabilidade,17 distensão abdominal e o derrame pleural10,11 estavam associados a gravidade. Contudo, a contagem de hematócritos era menor em pacientes com dengue grave. Esse achado pode ser explicado pelo fato de que 88,3% de nossos pacientes foram encaminhados por outros serviços de saúde e podem ter recebido reposição de líquidos antes da internação. Um estudo conduzido na República Dominicana constatou que a anemia estava associada ao dengue grave.23
A albumina sérica era menor no grupo com o pior resultado, também encontrado em outro estudo brasileiro.24 Esse resultado está de acordo com a patogênese do dengue, em que a lesão endotelial com extravasamento plasmático resultante é o marcador mais importante da evolução para formas graves, principalmente em crianças.25 Os altos níveis séricos de AST em nossa amostra pediátrica estavam de acordo com outros dois estudos.24,26
Em nosso estudo, embora o sangramento fosse mais frequente em caso graves, ambos os grupos apresentaram trombocitopenia. A ausência de associação entre a trombocitopenia e o sangramento também foi constatada em uma amostra de crianças internadas do Sri Lanka.26 A contagem de leucócitos era maior no dengue grave, associação incompatível com outros dois estudos.26,27
Este estudo tem pontos fortes e limitações. O ponto forte do estudo é a avaliação de um amplo conjunto de sinais e sintomas clínicos, bem como de exames laboratoriais que usam as medidas de acurácia atualmente recomendadas.28 Além disso, o critério adotado neste estudo para o dengue grave foi definido pelo óbito ou por intervenções médicas e minimizou, assim, o viés de incorporação de diagnósticos. A maioria dos estudos11,17,29 estava limitada a avaliar a razão de chance e adotar critérios compostos que consistiam em uma ou mais variáveis preditivas. O tamanho de nossa amostra era semelhante a outros estudos de base hospitalar com crianças.24,26,27 Contudo, também havia algumas limitações, como superestimação da acurácia do diagnóstico de derrame pleural, cuja presença pode determinar o uso de ventilação mecânica. O estudo também foi retrospectivo28 e a generalização dos resultados está limitada a crianças em idade escolar internadas.
Concluindo, este estudo mostrou que a letargia, distensão abdominal e o derrame pleural foram os sinais com maior acurácia diagnóstica; e que sangramento, hemorragia grave, hemoconcentração e trombocitopenia não foram associados à gravidade em nosso ambiente. Assim, em hospitais de referência pediátricos, a ausência de hemoconcentração não implica ausência de extravasamento plasmático, principalmente em pacientes que receberam reposição de líquidos anterior. Nesse cenário, a hipoalbuminemia e o derrame pleural representaram melhores marcadores de dengue grave. Além disso, os resultados relacionados a letargia e derrame pleural foram compatíveis com os sinais de alerta listados na classificação de dengue revisada da OMS de 2009.30
Esses achados podem contribuir para o conhecimento sobre a epidemiologia clínica do dengue em crianças internadas em hospitais de referência pediátricos. Futuros estudos prospectivos devem incluir crianças em estágios iniciais da doença para identificar sinais precoces de gravidade, mais adequados para a gestão de casos no cuidado primário.
FinanciamentoRede Dengue Fiocruz e Fundação de Amparo à Pesquisa do Estado do Rio de Janeiro (Faperj) [bolsa número E‐26/110.964/2013 – APQ1].
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Carlos Augusto Ferreira de Andrade por seus comentários e a Christopher Robert Peterson pela tradução para o inglês.
Como citar este artigo: Pone SM, Hökerberg YH, de Oliveira RV, Daumas RP, Pone TM, Pone MV, et al. Clinical and laboratory signs associated to serious dengue disease in hospitalized children. J Pediatr (Rio J). 2016;92:464–71.