To describe the epidemiology and clinical features of acute pancreatitis and recurrent acute pancreatitis in children.
MethodsObservational and retrospective study with an analytical component. Patients were classified into two groups: Acute pancreatitis and recurrent pancreatitis. The relationship with each parameter obtained was analyzed using the chi‐squared test, Student's t‐test, or the Mann–Whitney U test.
ResultsThere were 130 patients with acute pancreatitis; recurrent pancreatitis was diagnosed in 23.8% of the cases. The most frequent causes were anatomical (29.6%), pharmacological (19.2%), and biliary (14.6%), although in 29.2% etiology was not identified. Fasting lasted 3.5±3.8 days and parenteral nutrition was indicated in 26.9% of the cases for 10.8±11.3 days. A statistical association with anatomical (p=0.02) and pharmacological causes (p=0.01) was found in the recurrent pancreatitis group; no other differences between acute pancreatitis and recurrent pancreatitis groups were observed. The mortality rate was 3.1%, it was not attributable to acute pancreatitis in any cases.
ConclusionAcute pancreatitis is associated with a high frequency of acute recurrent pancreatitis. Severity and complications did not show statistically significant differences in this investigation. Anatomical etiologies were the most relevant cause in this cohort. Fasting time and parenteral nutrition use were relevant. Genetics testing is required in this population.
Descrever a epidemiologia e as características clínicas da pancreatite aguda e da pancreatite aguda recorrente em crianças.
MétodosEstudo observacional e retrospectivo com um componente analítico. Os pacientes foram classificados em dois grupos: pancreatite aguda e pancreatite recorrente. A relação com cada parâmetro obtido foi analisada com o teste de qui‐quadrado, teste t de Student ou teste U de Mann‐Whitney.
ResultadosForam analisados 130 pacientes com pancreatite aguda; pancreatite recorrente foi diagnosticada em 23,8% dos casos. As causas mais frequentes foram anatômicas (29,6%), farmacológicas (19,2%) e biliares (14,6%), embora em 29,2% a etiologia não tenha sido identificada. O jejum durou 3,5±3,8 dias e a nutrição parenteral foi indicada em 26,9% dos casos por 10,8±11,3 dias. Uma associação estatística com causas anatômicas (p=0,02) e farmacológicas (p=0,01) foi encontrada no grupo com pancreatite recorrente; não foram observadas outras diferenças entre os grupos pancreatite aguda e pancreatite recorrente. A taxa de mortalidade foi de 3,1% e nenhum caso foi atribuível à pancreatite aguda.
ConclusãoA pancreatite aguda está associada à alta frequência de pancreatite aguda recorrente. A gravidade e as complicações não apresentaram diferenças estatísticas nesta investigação. Etiologias anatômicas foram a causa mais relevante nesta coorte. O tempo de jejum e o uso de nutrição parenteral foram relevantes. Testes genéticos são necessários em nossas populações.
A pancreatite aguda (PA) em crianças é uma entidade clínica cada vez mais reconhecida;1 em paralelo, o aumento de sua incidência, em todas as idades, tem sido relatado nas duas últimas décadas.2,3 Recentemente, as definições de PA, pancreatite aguda recorrente (PAR) e pancreatite crônica em crianças foram desenvolvidas por consenso para promover a padronização e unificação dos critérios diagnósticos em investigações clínicas e, portanto, para melhorar o nível de conhecimento sobre essas entidades.4
A carga socioeconômica da PA e PAR é significativa diante da presença de sintomas como dor e custos para o sistema de saúde;5,6 consequentemente, o conhecimento sobre essas entidades em crianças tem aumentado nos últimos anos. Dados epidemiológicos, clínicos e etiológicos associados a essas entidades foram explorados em investigações recentes. Pant et al.,6 em um estudo multicêntrico americano, mostraram que as hospitalizações relacionadas à PAR tiveram um aumento da necessidade de cuidados intensivos em comparação com um episódio índice de PA. Recentemente, Kumar et al.5 forneceram uma análise extensiva de PAR em um estudo transversal multinacional; seus dados importantes concluíram que há pelo menos uma mutação genética em genes relacionados à pancreatite, encontrada em 48% dos pacientes com PAR.
Em nossa região, Sánchez‐Ramírez et al.7 fizeram um estudo em crianças mexicanas com PA e PAR e mostraram uma incidência de 34,5% de PAR; na mesma investigação, os cálculos biliares e a história familiar de pancreatite foram as causas mais comuns encontradas. Nenhum outro estudo que incluísse crianças latino‐americanas foi encontrado. O objetivo deste estudo é ter um melhor conhecimento dos aspectos epidemiológicos e clínicos de pacientes com diagnóstico de PA e PAR em um hospital pediátrico de referência na Colômbia, um país sul‐americano.
Material e métodosUm estudo transversal e retrospectivo foi feito. Foi feita uma revisão de todos os registros médicos com diagnósticos da International Disease Classification‐10 relacionados à PA entre janeiro de 2010 e dezembro de 2015 em uma instituição pediátrica colombiana; não há IDC‐10 para PAR, então os casos foram analisados com base nos códigos de PA e os casos foram selecionados de acordo com as definições de PAR.
Indivíduos com menos de 18 anos foram incluídos. PA foi definida de acordo com a presença de dois dos seguintes critérios: (a) dor abdominal compatível com PA, (b) valores de amilase e/ou lipase sérica ≥ 3 vezes os limites superiores do normal, (c) achados de imagem da PA. A PAR foi definida como: ≥ 2 episódios distintos de PA com retorno da intervenção à linha basal, de acordo com as definições fornecidas pela Insppire (International Study Group of Pediatric Pancreatitis: in Search for a Cure).4 Variáveis demográficas e clínicas, bem como parâmetros laboratoriais, etiologia, comorbidades, tipo de imagens e interpretações, estratégias de tratamento e desfechos, foram registradas com base em prontuários clínicos. A análise do estado nutricional foi feita com a ferramenta WHO Anthro (versão 3.2.2, Janeiro 2011, Organização Mundial da Saúde [OMS])8 e foi interpretada de acordo com os parâmetros da OMS.9
Variáveis obtidas dos exames laboratoriais feitos nas primeiras 24 horas do início dos sintomas foram incluídas. No caso de amilase e lipase séricas, o valor de seguimento de cada uma foi registrado e as imagens diagnósticas de cada paciente foram revisadas. O relato radiológico registrado na anamnese foi usado para descrever parâmetros compatíveis com PA: edema pancreático, necrose pancreática ou peripancreática, inflamação peripancreática, coleções únicas ou múltiplas, hemorragia pancreática, abscesso pancreático e pseudocisto. Achados associados com alterações do trato biliar ou outras anormalidades abdominais também foram considerados.
Em relação ao tratamento, foram avaliados o jejum, o tempo de jejum, o uso e a duração da nutrição enteral e parenteral. O tempo de permanência no hospital e a internação e tempo de internação na unidade de terapia intensiva pediátrica (UTIP) foram incluídos como variáveis. Casos com permanência prolongada e internação na UTIP não relacionada à PA ou PAR foram excluídos. A permanência na UTIP ou na unidade de cuidados intermediários foi considerada como variável única.
Gravidade e complicações foram classificadas de acordo com os critérios de Atlanta,10 em que um episódio é definido como grave se houver evidência de falência de órgãos (pressão arterial sistêmica < p5 para a idade ou necessidade de vasopressores, PaO2 < 60mmHg, doença renal aguda ou sangramento gastrintestinal) ou complicações locais (pseudocisto, necrose, abscesso, necessidade de cirurgia pancreática ou morte).
A análise estatística foi feita com o programa Microsoft Excel (Microsoft Corporation, Versão 2014, WA, EUA) e o SPSS (IBM SPSS Estatística para Windows, Versão 22.0, NY, EUA) e uma análise descritiva de todos os casos é apresentada abaixo. Variáveis quantitativas são relatadas em termos de média com desvio‐padrão (DP) ou mediana e intervalos interquartis (IIQ) de acordo com sua distribuição. Variáveis nominais são expressas em frequências absolutas e relativas. Além disso, a análise descritiva de cada variável foi feita independentemente para os grupos PA e PAR e seus resultados foram comparados pelo teste do qui‐quadrado e teste exato de Fisher para variáveis categóricas e teste t de Student ou Mann‐Whitney para variáveis quantitativas. Os resultados foram interpretados com base em um nível de significância estatística de 0,05. Este estudo foi aprovado pelo comitê de ética institucional.
ResultadosForam revisados 366 registros, dos quais 236 casos foram excluídos devido a registros médicos incompletos e outros diagnósticos que não PA ou PAR. Então, apenas 130 (35,5%) preencheram os critérios Insppire para o diagnóstico de PA e PAR. Desse último grupo, 81 pacientes (62,3%) eram do sexo feminino. A média de idade foi de 11,4 ± 3,8 anos e três pacientes (2,3%) tinham menos de dois anos no momento do diagnóstico. Foram diagnosticadas com PAR 31 crianças (23,8%).
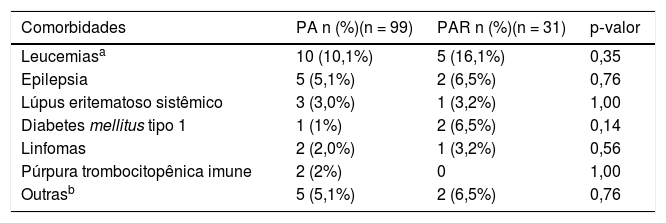
Os achados clínicos mais comuns foram dor abdominal, encontrada em 119 pacientes (91,5%); náusea ou vômito, em 93 (71,5%); hiporexia, em 66 (50,8%); febre, em 18 (13,8%); oligúria, em nove (6,9%); icterícia, em oito (6,2%) e angústia respiratória, em um (0,8%). Ao exame físico, observou‐se dor à palpação do epigástrio em 93 casos (71,5%), motilidade gastrointestinal aumentada em seis (4,6%), sinais de irritação peritoneal em quatro (3,1%), massas abdominais em dois (1,5%) e ascite em um (1,5%). Comorbidades foram observadas em 31,5% dos pacientes, as mais importantes foram a leucemia (11,5%) e a epilepsia (5,4%) (tabela 1).
Comorbidades associadas
| Comorbidades | PA n (%)(n = 99) | PAR n (%)(n = 31) | p‐valor |
|---|---|---|---|
| Leucemiasa | 10 (10,1%) | 5 (16,1%) | 0,35 |
| Epilepsia | 5 (5,1%) | 2 (6,5%) | 0,76 |
| Lúpus eritematoso sistêmico | 3 (3,0%) | 1 (3,2%) | 1,00 |
| Diabetes mellitus tipo 1 | 1 (1%) | 2 (6,5%) | 0,14 |
| Linfomas | 2 (2,0%) | 1 (3,2%) | 0,56 |
| Púrpura trombocitopênica imune | 2 (2%) | 0 | 1,00 |
| Outrasb | 5 (5,1%) | 2 (6,5%) | 0,76 |
PA, pancreatite aguda; PAR, pancreatite aguda recorrente.
Em relação às enzimas pancreáticas, amilase e lipase, seus níveis estavam três vezes acima ao limite superior em 90% e 89,5% dos casos, respectivamente. Nos casos com enzimas pancreáticas, o diagnóstico foi feito com base nos sintomas e critérios radiológicos. Tiveram análises dos níveis de amilase e lipase feitas simultaneamente no início do quadro clínico 76 casos (58,4%); deles, 65 mostraram um aumento de ambas as enzimas de acordo com o limite definido para o diagnóstico. Para a amilase, a média entre a primeira e a segunda amostras foi de 3,5 ± 3,1 dias e para a lipase, de 5,7 ± 6,5 dias. Devido ao grande lapso de tempo no qual os valores de acompanhamento das enzimas foram obtidos, nenhuma associação estatística foi explorada. Os estudos imunológicos foram feitos em 18 (13,8%) pacientes e os seguintes parâmetros laboratoriais foram obtidos: anticorpos antinucleares, anticorpos contra antígenos nucleares extraíveis, níveis de complementos e anticorpos citoplasmáticos antineutrófilos; entretanto, cada paciente teve diferentes grupos de ensaios imunológicos. Nenhum histórico médico de causas genéticas ou metabólicas foi encontrado. Nenhum ensaio genético ou metabólico foi feito neste grupo.
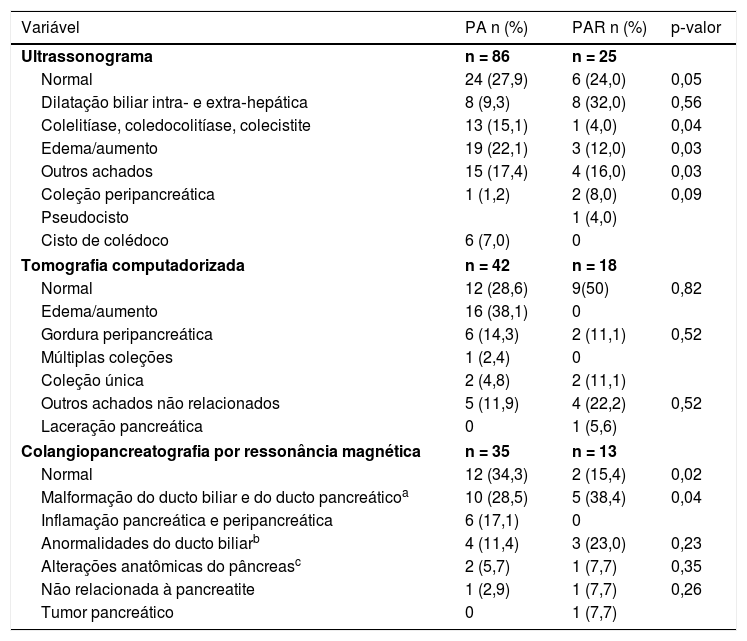
O exame de imagem mais usado foi a ultrassonografia abdominal total (em 111 casos), seguida de tomografia com contraste (59 casos), colangiopancreatografia por ressonância magnética (em 48 casos) e colangiografia retrógrada endoscópica (em 17 casos). O jejum foi considerado como parte do tratamento em 108 casos (83,1%), com uma duração mediana de dois dias (IIQ: 1‐4). A alimentação enteral com sonda jejunal não foi usada, enquanto que em 35 pacientes (26,9%) a nutrição parenteral foi usada com uma mediana por oito dias (IIQ: 3‐12).
Em conclusão, 38 pacientes (29,2%) preencheram pelo menos um critério para PA grave. As complicações documentadas foram doença renal aguda em 11 (8,5%), hipotensão ou necessidade de agentes vasoativos em 12 (9,2%), PaO2 < 60mmHg em sete casos (5,4%), hemorragia gastrointestinal em seis (4,6%), pseudocisto pancreático em seis (4,6%) e necrose pancreática em cinco (3,8%). A taxa de mortalidade foi de 3,1% (as causas foram: complicações abdominais após trauma fechado, laceração hepática secundária à correção laparoscópica, laceração hepática secundária à correção laparoscópica da junção do ducto biliar e ducto pancreático e dois casos de sepse), mas nenhum caso foi atribuível à pancreatite aguda.
Análise comparativa dos casos de PA e PARForam incluídos 99 casos (76,2%) casos no grupo PA e 31 (23,8%) no grupo PAR. Não foram encontradas diferenças em relação à distribuição por sexo (p = 0,771) e idade (p = 0,439) entre os casos de PA e PAR. Sobrepeso e obesidade foram encontrados em 30 e 35% dos casos com PAR e PA, respectivamente, e 46% dos casos de PA e 70% de PAR eram eutróficos. Não foi encontrada associação entre PAR e estado nutricional (p = 0,35). Além disso, não houve diferenças estatísticas em relação aos sintomas e achados clínicos. Em relação às comorbidades, não foi documentada relação entre elas e PAR (tabela 1).
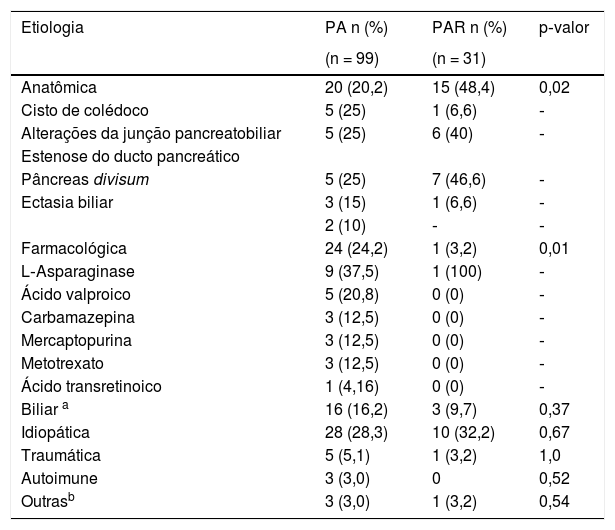
Por outro lado, encontrou‐se uma associação estatisticamente significativa entre PAR e as etiologias farmacológicas e anatômicas (tabela 2 para as etiologias de PA e PAR). Entretanto, não foram encontradas diferenças estatísticas em relação aos níveis enzimáticos, nem foi observada associação com os perfis lipídicos ou complicações locais encontradas nas imagens. O resumo dos achados dos testes diagnósticos de imagem é apresentado na tabela 3.
Etiologia
| Etiologia | PA n (%) | PAR n (%) | p‐valor |
|---|---|---|---|
| (n = 99) | (n = 31) | ||
| Anatômica | 20 (20,2) | 15 (48,4) | 0,02 |
| Cisto de colédoco | 5 (25) | 1 (6,6) | ‐ |
| Alterações da junção pancreatobiliar | 5 (25) | 6 (40) | ‐ |
| Estenose do ducto pancreático | |||
| Pâncreas divisum | 5 (25) | 7 (46,6) | ‐ |
| Ectasia biliar | 3 (15) | 1 (6,6) | ‐ |
| 2 (10) | ‐ | ‐ | |
| Farmacológica | 24 (24,2) | 1 (3,2) | 0,01 |
| L‐Asparaginase | 9 (37,5) | 1 (100) | ‐ |
| Ácido valproico | 5 (20,8) | 0 (0) | ‐ |
| Carbamazepina | 3 (12,5) | 0 (0) | ‐ |
| Mercaptopurina | 3 (12,5) | 0 (0) | ‐ |
| Metotrexato | 3 (12,5) | 0 (0) | ‐ |
| Ácido transretinoico | 1 (4,16) | 0 (0) | ‐ |
| Biliar a | 16 (16,2) | 3 (9,7) | 0,37 |
| Idiopática | 28 (28,3) | 10 (32,2) | 0,67 |
| Traumática | 5 (5,1) | 1 (3,2) | 1,0 |
| Autoimune | 3 (3,0) | 0 | 0,52 |
| Outrasb | 3 (3,0) | 1 (3,2) | 0,54 |
PA, pancreatite aguda; PAR, pancreatite aguda recorrente.
Achados em imagens diagnósticas
| Variável | PA n (%) | PAR n (%) | p‐valor |
|---|---|---|---|
| Ultrassonograma | n = 86 | n = 25 | |
| Normal | 24 (27,9) | 6 (24,0) | 0,05 |
| Dilatação biliar intra‐ e extra‐hepática | 8 (9,3) | 8 (32,0) | 0,56 |
| Colelitíase, coledocolitíase, colecistite | 13 (15,1) | 1 (4,0) | 0,04 |
| Edema/aumento | 19 (22,1) | 3 (12,0) | 0,03 |
| Outros achados | 15 (17,4) | 4 (16,0) | 0,03 |
| Coleção peripancreática | 1 (1,2) | 2 (8,0) | 0,09 |
| Pseudocisto | 1 (4,0) | ||
| Cisto de colédoco | 6 (7,0) | 0 | |
| Tomografia computadorizada | n = 42 | n = 18 | |
| Normal | 12 (28,6) | 9(50) | 0,82 |
| Edema/aumento | 16 (38,1) | 0 | |
| Gordura peripancreática | 6 (14,3) | 2 (11,1) | 0,52 |
| Múltiplas coleções | 1 (2,4) | 0 | |
| Coleção única | 2 (4,8) | 2 (11,1) | |
| Outros achados não relacionados | 5 (11,9) | 4 (22,2) | 0,52 |
| Laceração pancreática | 0 | 1 (5,6) | |
| Colangiopancreatografia por ressonância magnética | n = 35 | n = 13 | |
| Normal | 12 (34,3) | 2 (15,4) | 0,02 |
| Malformação do ducto biliar e do ducto pancreáticoa | 10 (28,5) | 5 (38,4) | 0,04 |
| Inflamação pancreática e peripancreática | 6 (17,1) | 0 | |
| Anormalidades do ducto biliarb | 4 (11,4) | 3 (23,0) | 0,23 |
| Alterações anatômicas do pâncreasc | 2 (5,7) | 1 (7,7) | 0,35 |
| Não relacionada à pancreatite | 1 (2,9) | 1 (7,7) | 0,26 |
| Tumor pancreático | 0 | 1 (7,7) | |
PA, pancreatite aguda; PAR, pancreatite aguda recorrente.
O tempo de jejum foi maior nos casos de PA (p = 0,01), assim como a duração da nutrição parenteral (p = 0,043). Nenhuma evidência foi encontrada em relação à associação com o jejum como terapia, nem a necessidade de nutrição parenteral. Finalmente, quatro pacientes (3,1%) morreram, mas nenhum dos casos foi atribuível à PA ou à PAR. A tabela 4 resume os achados de tratamento e desfechos em cada grupo.
Tratamento e desfechos clínicos
| Variável | PA | PAR | p‐valor |
|---|---|---|---|
| Tempo de jejum(dias) | 3 (IIQ 2‐5)(n = 79) | 2 (IIQ 1‐2,5)(n = 29) | 0,01 |
| Tempo de nutrição parenteral(dias) | 9 (IIQ 5,5 ‐15,3)(n = 30) | 3 (IIQ 1,5‐8)(n = 5) | 0,043 |
| Tempo de hospitalização(dias) | 9 (IIQ 6‐13,5)(n = 85) | 10 (IIQ 6,5‐17,7)(n = 26) | 0,44 |
| Internação na UTI pediátrican (%) | 34 (36,2) | 14 (48,3) | 0,24 |
| Tempo de hospitalização na UTI pediátrica(dias) | 5 (IIQ 3‐10)(n = 34) | 6,5 (IIQ 3,8 ‐10,3)(n = 29) | 0,37 |
PA, pancreatite aguda; PAR, pancreatite aguda recorrente.
Este estudo contém informações, anteriormente não disponíveis na Colômbia, que descrevem PA e PAR e nenhuma investigação semelhante havia sido publicada em nosso país. Anteriormente, apenas Sánchez‐Ramírez et al.,7 em uma coorte com 55 pacientes, descreveram PAR em crianças latino‐americanas e seu grupo mostrou proporções semelhantes, com etiologia idiopática de 33,3% de PA e 36,8% de PAR vs. 28,3% e 32,2% em nosso estudo, respectivamente; entretanto, ele difere nas outras causas mais prevalentes.
A etiologia farmacológica foi uma causa importante de PA, que é semelhante à informada em outras coortes.11,12 Bai et al.13 mostraram em sua investigação o ácido valproico, L‐asparaginase, 6‐mercaptopurina entre as causas mais frequentes, como identificamos nesta coorte, e está relacionado com as comorbidades mais importantes: leucemias e epilepsia, o que coincide em ambos os estudos. Comorbidades não foram associadas com PAR. Nosso hospital é um importante centro de referência para o controle do câncer e epilepsia na infância e isso pode estar relacionado com alguns achados.
Em relação à PAR em crianças, sua frequência neste estudo coincide com a faixa relatada em estudos semelhantes1 e, então, um número importante de casos de PA está relacionado com um episódio de PAR. Sobre as etiologias da PAR, as causas anatômicas representam nesta coorte o fator mais importante relacionado com essa doença, concordante com o mais recente e maior estudo sobre a PAR,5 no qual etiologias anatômicas semelhantes foram descritas pelos autores.
O número de registros (366) revisados nos quais este estudo é baseado foi consideravelmente maior, talvez por causa da intenção geral inicial de descartar PA nos pacientes. Dor abdominal e vômitos são os sintomas mais frequentemente encontrados em concordância com outras séries.13,14 Um diagnóstico diferencial criterioso é importante para o tratamento oportuno de crianças com PA, em vez de tratar desnecessariamente outras doenças.15 Os sintomas foram semelhantes na apresentação de PA e PAR e não foram estabelecidas diferenças significativas. Então, seu diagnóstico inicial permanece clinicamente respaldado por enzimas pancreáticas séricas (com grandes variações) e estudos de imagem.
Com relação à amilasemia, os relatos indicam que ela aumenta entre 40% e 60%,14,16 ao contrário do que aconteceu nesta série de casos, na qual foi observado um aumento de 90% dos casos, o que pode ser explicado pela diferença de idade dos pacientes, pois a expressão da amilase e lipase aumentam após o nascimento, com uma taxa mais lenta de aumento da expressão da amilase.17 Não foram encontradas diferenças entre os níveis enzimáticos e o perfil lipídico nas duas formas de pancreatite.
Os testes diagnósticos de imagem foram usados essencialmente para identificar alterações anatômicas e complicações. Da mesma forma, uma notável falta de padronização foi observada ao se usarem os padrões de leitura e as escalas de gravidade, como o índice de escore de TC ou a classificação de Atlanta, que leva a resultados diversos. Na revisão das imagens dos registros radiológicos do presente estudo não havia um padrão único para interpretá‐los, mas estamos trabalhando para avaliar os escores de TC e sua utilidade em pacientes pediátricos.18
Portanto, o esquema de manejo de crianças com PA e PAR permanece conservador, é principalmente clínico. A nutrição merece atenção especial. Nesta coorte, o jejum continua a prevalecer, enquanto a nutrição enteral precoce com sonda avançada é inexistente, o que é consistente com relatos que mostram uma frequência de uso de apenas 3% em crianças.19
Além disso, a frequência de nutrição parenteral é semelhante à relatada em outros estudos,7 em que um número significativo de pacientes recebeu essa alternativa terapêutica como tratamento, embora não essa preferência seja clara na revisão retrospectiva. Limitações e necessidades nutricionais devem ser estabelecidas para evitar complicações, encurtar os períodos de hospitalização e reduzir custos. Recentemente, um novo consenso foi publicado sobre o manejo nutricional na pancreatite pediátrica,20 porém suas recomendações não foram aplicadas em nossa coorte.
Escalas para predizer a gravidade da PA em crianças não foram validadas nas diferentes populações estudadas,21 nem a necessidade de transferência de rotina para a UTIP. Nesta série de casos, o comportamento das entidades avaliadas foi o mesmo: não foram encontradas diferenças na gravidade, complicações locais e internação na UTIP. A mortalidade foi baixa e não houve casos em que a PA foi a principal causa de morte.
Nosso estudo tem várias limitações. O desenho retrospectivo não permitiu o seguimento dos pacientes e nossos dados foram obtidos de registros clínicos. Não há um protocolo para avaliação de pacientes com PAR no fim desse estudo no hospital, então não foram feitos os mesmos testes (imunológicos, virais, genéticos) em todos os pacientes. Outros autores mostraram causas genéticas,5,22 especialmente: gene regulador de condutância transmembrana da fibrose cística e outros: tripsinogênio catiônico, inibidor da tripsina secretora pancreática, quimotripsina C e carboxipeptidase 1 (CPA1); entretanto, nenhum estudo genético foi feito nesta população, até o momento, e nenhum estudo foi feito na população colombiana para identificar mutações associadas à PAR;5 sua frequência e utilidade deveriam ser avaliadas neste subgrupo de crianças, mas o custo dos estudos genéticos para o sistema de saúde poderia ser uma limitação em nosso país. A PA em crianças está associada com alta frequência de PAR e as manifestações clínicas são semelhantes em ambas as entidades. A gravidade e as complicações não apresentaram diferenças estatísticas nesta investigação. Etiologias anatômicas foram a causa mais relevante nesta coorte de PAR e os estudos de imagem foram fundamentais na abordagem. Precisamos avaliar o uso de nutrição parenteral e, de acordo com cada paciente, considerar o uso da nutrição naso‐jejunal como uma alternativa. O uso de um consenso na abordagem da PAR permitirá uma padronização na avaliação desse grupo de pacientes, são necessários testes genéticos em nossas populações.
Esta pesquisa foi feita em um centro de referência nacional; portanto, seus resultados podem ser aplicáveis à população em geral de nosso país, mas estudos multicêntricos são necessários para confirmar essa hipótese.
FinanciamentoUniversidade Nacional da Colômbia. Central Nacional de Projetos para Fortalecer Pesquisa, Criação e Inovação na Universidade Nacional da Colômbia 2016‐2018.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Fonseca Sepúlveda EV, Guerrero‐Lozano R. Acute pancreatitis and recurrent acute pancreatitis: an exploration of clinical and etiologic factors and outcomes. J Pediatr (Rio J). 2019;95:713–9.
Estudo vinculado a Universidad Nacional de Colombia, Bogotá, Colômbia.